이산화탄소
Carbon dioxide
 | |||
| |||
| 이름들 | |||
|---|---|---|---|
| IUPAC이름 이산화탄소 | |||
| 기타이름 | |||
| 식별자 | |||
3D 모델(JSMO) | |||
| 3D Met | |||
| 1900390 | |||
| ChEBI | |||
| 쳄블 | |||
| 켐스파이더 | |||
| ECHA 인포카드 | 100.004.271 | ||
| EC 번호 |
| ||
| E번 | E290(보존료) | ||
| 989 | |||
| 케그 | |||
| MeSH | 이산화탄소 | ||
펍켐 CID | |||
| RTECS 번호 |
| ||
| 유니아이 | |||
| UN번호 | 1013 (가스), 1845 (고체) | ||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| CO2 | |||
| 어금니 질량 | 44.009g·mol−1 | ||
| 외모 | 무색기체 | ||
| 냄새 |
| ||
| 밀도 |
| ||
| 임계점(T, P) | 304.128(15) K[2](30.978(15)°C), 7.3773(30) MPa[2](72.808(30) atm) | ||
| 1 atm(0.101325 MPa)에서 194.6855(30) K(-78.4645(30)°C) | |||
| 25 °C(77 °F), 100 kPa(0.99 atm)에서 1.45 g/L | |||
| 증기압 | 5.7292(30) MPa, 56.54(30) atm(20°C(293.15 K)) | ||
| 산도(pKa) | 6.35, 10.33 | ||
| -20.5·10cm−63/mol | |||
| 열전도율 | 0.01662 W·m−1·K−1 (300K (27°C; 80°F))[3] | ||
굴절률(nD) | 1.00045 | ||
| 점도 |
| ||
| 0 D | |||
| 구조. | |||
| 삼각형 | |||
| 선형 | |||
| 열화학 | |||
열용량 (C) | 37.135 J/(K·mol) | ||
어금니 엔트로피 (S⦵298) | 214 J·mol−1·K−1 | ||
스덴탈피 형성 (δ) | −393.5 kJ·mol−1 | ||
| 약리학 | |||
| V03AN02 (WHO) | |||
| 유해성 | |||
| NFPA 704 (파이어다이아몬드) | |||
| 치사량 또는 농도(LD, LC): | |||
LCLo (최저 발행) | 90,000ppm(162,000mg/m3)(사람, 5분)[6] | ||
| NIOSH(미국 건강 노출 한도): | |||
PEL(허용) | TWA 5000ppm (9000mg/m3)[5] | ||
REL (권장) | TWA 5000ppm (9000mg/m3), ST 30,000ppm (54,000mg/m3)[5] | ||
IDLH(즉각 위험) | 40,000 ppm (72,000 mg/m3)[5] | ||
| 안전자료(SDS) | 시그마-알드리치 | ||
| 관련화합물 | |||
기타 음이온 | |||
기타 양이온 | |||
관련화합물 | |||
| 부가자료페이지 | |||
| 이산화탄소(자료페이지) | |||
별도의 언급이 없는 경우를 제외하고, 표준 상태(25 °C [77 °F], 100 kPa에서)의 재료에 대한 데이터가 제공됩니다. | |||
이산화탄소는 화학식이 CO인2 화합물입니다.그것은 각각 하나의 탄소 원자가 두 개의 산소 원자와 공유 결합된 두 개의 분자로 이루어져 있습니다.그것은 상온의 가스 상태에서 발견되며, 탄소 순환에서 사용 가능한 탄소의 원천으로서 대기 중의2 CO는 지구상의 생명체의 주요한 탄소 원천입니다.공기 중에서 이산화탄소는 가시광선에는 투명하지만 적외선을 흡수해 온실가스 역할을 합니다.이산화탄소는 물에 용해되며 지하수, 호수, 만년설, 바닷물에서 발견됩니다.이산화탄소가 물에 녹으면 탄산염과 주로 중탄산염(HCO-3)을 형성하는데, 이는 대기 중 CO2 수치가 증가함에 따라 해양 산성화의 원인이 됩니다.[9]
지구 대기의 미량 가스로, 산업화 이전 수준인 280ppm 또는 0.025%[11][12]보다 증가한 421ppm(ppm), 즉 약 0.04%([note 1]2022년 5월 기준)입니다.화석 연료를 태우는 것은 이러한 CO2 농도 증가의 주요 원인이며 기후 변화의 주요 원인이기도 합니다.[13]
선캄브리아기 후기부터 지구의 산업화 이전 대기 중에 그것의 농도는 유기체와 지질 현상에 의해 조절되었습니다.식물, 해조류, 시아노박테리아는 햇빛의 에너지를 이용하여 이산화탄소와 물로부터 탄수화물을 합성하는데, 이 과정은 폐기물로서 산소를 생산하는 광합성이라고 불립니다.[14]결국 산소는 소비되고 CO는2 호흡에 의해 에너지를 생산하기 위해 유기 화합물을 대사할 때 모든 호기성 생물에 의해 폐기물로 배출됩니다.[15]CO는2 산불과 같이 유기물이 부패하거나 연소할 때 방출됩니다.식물은 광합성을 위해2 CO를 필요로 하고, 인간과 동물은 음식을 위해 식물에 의존하기 때문에 CO는2 지구상의 생명체의 생존을 위해 필요합니다.
이산화탄소는 건조한 공기보다 53% 더 밀도가 높지만 오래 살고 철저히 대기 중에서 섞입니다.대기에 대한 초과 이산화탄소2 배출량의 약 절반은 육지와 바다의 탄소 흡수원에 의해 흡수됩니다.[16]이러한 싱크대는 부패와 산불로 인해 이산화탄소가2 대기 중으로 다시 방출되기 때문에 포화 상태가 될 수 있고 휘발성이 있습니다.[17]CO는2 결국 암석 및 석탄, 석유 및 천연 가스와 같은 유기 퇴적물에 격리(장기 보관)됩니다.격리된 CO는2 화석 연료를 태우는 것을 통해 또는 화산, 온천, 간헐천, 탄산염 암석이 물에 녹거나 산과 반응할 때 자연적으로 대기로 방출됩니다.
CO는2 다용도의 산업 재료로, 예를 들어 용접 및 소화기에서 불활성 가스로, 에어 건 및 오일 회수에서 가압 가스로, 커피의 디카페인 및 초임계 건조에서 초임계 유체 용매로 사용됩니다.[18]빵, 맥주, 와인 제조에서 설탕이 발효되는 부산물이며, 셀처나 맥주와 같은 탄산 음료에 거품을 내기 위해 첨가됩니다.날카롭고 산성의 냄새가 나며 입안에서 탄산수 맛이 나지만 평소 접하게 되는 농도에서는 냄새가 나지 않습니다.[1]
화학적 및 물리적 특성
구조, 접합 및 분자 진동
이산화탄소 분자의 대칭은 평형 기하학에서 선형대칭이고 중심대칭입니다.이산화탄소에서 탄소-산소 결합의 길이는 116.3 pm으로 일반적인 단일 C-O 결합의 약 140 pm 길이보다 눈에 띄게 짧으며, 카보닐과 같은 대부분의 다른 C-O 다중 결합 작용기보다 짧습니다.[19]중심대칭이기 때문에 분자는 전기 쌍극자 모멘트가 없습니다.

선형2 3원자 분자로서 CO는 그림에 나타난 바와 같이 4개의 진동 모드를 가지고 있습니다.대칭적인 신장 모드와 대칭적인 신장 모드에서, 원자들은 분자의 축을 따라 움직입니다.두 가지 굽힘 모드가 있는데, 이것은 분자의 대칭성 때문에 같은 주파수와 같은 에너지를 갖는다는 것을 의미합니다.분자가 표면을 만지거나 다른 분자를 만질 때, 두 벤딩 모드는 두 모드에 대해 상호작용이 다르기 때문에 빈도가 다를 수 있습니다.적외선(IR) 스펙트럼에서 일부 진동 모드가 관찰됩니다. 즉, 파장 2349cm−1(파장 4.25μm)에서 대칭적인 스트레칭 모드와 667cm−1(파장 15μm)에서 축퇴된 한 쌍의 벤딩 모드입니다.대칭 스트레칭 모드는 전기 쌍극자가 생성되지 않아 IR 분광에서는 관찰되지 않지만 라만 분광법에서는 1388cm−1(파장 7.2μm)에서 검출됩니다.[20]
기체 상태에서 이산화탄소 분자는 상당한 진동 운동을 하며 고정된 구조를 유지하지 않습니다.그러나 쿨롱 폭발 영상 실험에서는 분자 구조의 순간 이미지를 추론할 수 있습니다.그러한 실험은[21] 이산화탄소에 대해 행해졌습니다.이 실험의 결과와 분자의 초기 위치 에너지 표면에 기초한 이론적[22] 계산의 결론은 기체 상태에 있는 분자들 중 어떤 것도 정확하게 선형적이지 않다는 것입니다.이러한 반직관적인 결과는 선형 기하학에서 핵운동량 요소가 사라지기 때문입니다.[22]이것은 모든 분자에 해당합니다. (다이아토믹스를 제외하고!)
수용액중에
이산화탄소는 물에 녹는데, 물에서 이온화가 불완전하기 때문에 약한 산인 HCO23(탄산)를 가역적으로 형성합니다.
- CO2 + H2O ⇌ H2CO3
탄산의 수화 평형 상수는 25 °C입니다.
따라서 이산화탄소의 대부분은 탄산으로 전환되지 않고 CO2 분자로 남아 pH에 영향을 주지 않습니다.
상대적인 농도인 CO2, HCO23 및 탈양성자화된 형태인 HCO-3(중탄산염) 및 CO2-3(탄산염)은 pH에 따라 달라집니다.Bjerum 플롯에서 볼 수 있듯이, 중성 또는 약간 알칼리성 물(pH > 6.5)에서 중탄산염 형태가 우세(>50%)하여 해수의 pH에서 가장 우세(>95%)합니다.매우 알칼리성인 물(pH > 10.4)에서 우세한 형태(>50%)는 탄산염입니다.전형적인 pH = 8.2–8.5의 약한 알칼리성 해양은 리터당 약 120 mg의 중탄산염을 함유하고 있습니다.
쌍양성자인 탄산은 중탄산염(탄산수소라고도 함) 이온(HCO-3)으로의 해리를 위한 첫 번째 산 해리 상수인 두 개의 산 해리 상수는 다음과 같습니다.
- H2CO3 ⇌ HCO−3 + H+
- 25 °C에서 K = 2.5 × 10 mol/L; pK = 3.6.
이것은 진정한 첫번째 산 해리 상수이며, 다음과 같이 정의됩니다.
여기서 분모는 공유결합된 HCO만23 포함하고 수화된 CO2(aq)는 포함하지 않습니다.4.16 × 10에−7 가까운 훨씬 작고 종종 인용되는 값은 용해된 모든 CO가2 탄산으로 존재한다는 (잘못된) 가정에서 계산된 명백한 값입니다.
용해된 CO의2 대부분이 CO2 분자로 남아 있기 때문에 Ka1(분명히)는 실제 K보다a1 훨씬 더 큰 분모와 훨씬 더 작은 값을 가지고 있습니다.[23]
중탄산염 이온은 용액의 pH에 따라 산 또는 염기로 작용할 수 있는 양성자 종입니다.높은 pH에서는 탄산 이온(CO2-3)으로 크게 해리됩니다.
- HCO−3 ⇌ CO2−3 + H+
- K = 4.69 × 10 mol/L; pK = 10.329
생물체에서 탄산 생성은 탄산 무수효소로 알려진 효소에 의해 촉매됩니다.
CO의2 화학반응
CO는2 벤즈알데히드 또는 강한 α,β-불포화 카보닐 화합물에 필적하는 친전자 반응성을 갖는 강력한 전기 물질입니다.그러나, 유사한 반응성을 가진 전기영동체와 달리, CO와2 친핵체의 반응은 열역학적으로 덜 선호되며 종종 매우 가역적인 것으로 발견됩니다.[24]이산화탄소와2 아민의 가역적인 반응은 CO 스크러버에 사용되며, 아민 가스 처리에 의한 탄소 포집 및 저장의 가능한 출발점으로 제시되어 왔습니다.그리너드 시약 및 유기 리튬 화합물이 제공하는 탄소 음이온과 같은 매우 강한 친핵체만이 CO와2 반응하여 카르복실레이트를 생성합니다.
금속 이산화탄소 복합체에서 CO는2 리간드 역할을 하여 CO가2 다른 화학물질로 전환되는 것을 촉진할 수 있습니다.[25]
CO에서2 CO로의 환원은 일반적으로 어렵고 느린 반응입니다.
- CO + 2e + 2H → CO + HO
광자동영양생물(즉, 식물과 시아노박테리아)은 햇빛에 포함된 에너지를 이용하여 공기와 물로부터 흡수된 CO로부터2 단당을 광합성합니다.
- n CO + n HO → (CHO) + O
pH 7 부근에서 이 반응의 산화 환원 전위는 표준 수소 전극에 비해 약 -0.53 V입니다.니켈을 함유한 효소인 일산화탄소 탈수소효소는 이 과정을 촉매합니다.[26]
물리적 특성

이산화탄소는 무색입니다.낮은 농도에서는 가스가 냄새가 나지 않지만 충분히 높은 농도에서는 날카롭고 산성의 냄새가 납니다.[1]표준 온도와 압력에서 이산화탄소의 밀도는 공기의 약 1.53배인 약 1.98kg/m입니다3.[27]
이산화탄소는 0.51795(10) MPa[2](5.11177(99) atm) 미만의 압력에서 액체 상태가 없습니다.1atm(0.101325MPa)의 압력에서 기체는 194.6855(30)K[2](-78.4645(30)°C) 미만의 온도에서 고체에 직접 침전되고 고체는 이 온도 이상의 기체에 직접 승합합니다.고체 상태에서 이산화탄소는 흔히 드라이아이스라고 불립니다.

액체 이산화탄소는 0.51795(10) MPa[2](5.11177(99) atm) 이상의 압력에서만 형성되며, 이산화탄소의 삼중점은 0.51795(10) MPa[2](5.11177(99) atm)에서 216.592(3) K[2](-56.558(3) °C)입니다(위상도 참조).임계점은 7.3773(30) MPa[2](72.808(30) atm에서 304.128(15) K(30[2].978(15) °C)입니다.고압에서 관찰되는 고체 이산화탄소의 또 다른 형태는 비정질 유리와 같은 고체입니다.[28]카르보니아라고 불리는 이 형태의 유리는 다이아몬드 모루 안에서 가열된 CO를2 극단적인 압력(40–48 GPa 또는 약 400,000 기압)으로 과냉각함으로써 생성됩니다.이 발견은 이산화탄소가 이산화규소(실리카 유리)와 이산화 게르마늄과 같은 원소군의 다른 구성원들과 유사한 유리 상태로 존재할 수 있다는 이론을 확인시켜 주었습니다.그러나 실리카나 게르마니아 유리와는 달리 카르보니아 유리는 정상 압력에서는 안정적이지 못하고 압력이 방출되면 기체로 되돌아갑니다.
이산화탄소는 임계점 이상의 온도와 압력에서 초임계 이산화탄소로 알려진 초임계 유체로 작용합니다.
포화 액체 이산화탄소의 열 및 물리적 특성 표:[29][30]
| 온도(°C) | 밀도(kg/m3) | 비열(kJ/(kg ⋅K)) | 운동학적 점도(m2/s) | 열전도율(W/(m ⋅K)) | 열확산율(m2/s) | 프란틀 번호 | 벌크 모듈러스 (K^-1)[clarification needed] |
| −50 | 1156.34 | 1.84 | 1.19 x 10−7 | 0.0855 | 4.02 x 10−8 | 2.96 | |
| −40 | 1117.77 | 1.88 | 1.18 x 10−7 | 0.1011 | 4.81 x 10−8 | 2.46 | |
| −30 | 1076.76 | 1.97 | 1.17 x 10−7 | 0.1116 | 5.27 x 10−8 | 2.22 | |
| −20 | 1032.39 | 2.05 | 1.15 x 10−7 | 0.1151 | 5.45 x 10−8 | 2.12 | |
| −10 | 983.38 | 2.18 | 1.13 x 10−7 | 0.1099 | 5.13 x 10−8 | 2.2 | |
| 0 | 926.99 | 2.47 | 1.08 x 10−7 | 0.1045 | 4.58 x 10−8 | 2.38 | |
| 10 | 860.03 | 3.14 | 1.01 x 10−7 | 0.0971 | 3.61 x 10−8 | 2.8 | |
| 20 | 772.57 | 5 | 9.10 x 10−8 | 0.0872 | 2.22 x 10−8 | 4.1 | 1.40 x 10−2[clarification needed] |
| 30 | 597.81 | 36.4 | 8.00 x 10−8 | 0.0703 | 0.279 x 10−8 | 28.7 |
대기압에서 이산화탄소(CO2)의 열 및 물리적 특성 표:[29][30]
| 온도(K) | 밀도(kg/m3) | 비열(kJ/(kg ⋅°C)) | 동적점도(kg/(m ⋅)) | 운동학적 점도(m2/s) | 열전도율(W/(m ⋅°C)) | 열확산율(m2/s) | 프란틀 번호 |
| 220 | 2.4733 | 0.783 | 1.11 x 10−5 | 4.49 x 10−6 | 0.010805 | 5.92 x 10−6 | 0.818 |
| 250 | 2.1657 | 0.804 | 1.26 x 10−5 | 5.81 x 10−6 | 0.012884 | 7.40 x 10−6 | 0.793 |
| 300 | 1.7973 | 0.871 | 1.50 x 10−5 | 8.32 x 10−6 | 0.016572 | 1.06 x 10−5 | 0.77 |
| 350 | 1.5362 | 0.9 | 1.72 x 10−5 | 1.12 x 10−5 | 0.02047 | 1.48 x 10−5 | 0.755 |
| 400 | 1.3424 | 0.942 | 1.93 x 10−5 | 1.44 x 10−5 | 0.02461 | 1.95 x 10−5 | 0.738 |
| 450 | 1.1918 | 0.98 | 2.13 x 10−5 | 1.79 × 10−5 | 0.02897 | 2.48 x 10−5 | 0.721 |
| 500 | 1.0732 | 1.013 | 2.33 x 10−5 | 2.17 x 10−5 | 0.03352 | 3.08 x 10−5 | 0.702 |
| 550 | 0.9739 | 1.047 | 2.51 x 10−5 | 2.57 x 10−5 | 0.03821 | 3.75 x 10−5 | 0.685 |
| 600 | 0.8938 | 1.076 | 2.68 x 10−5 | 3.00 x 10−5 | 0.04311 | 4.48 x 10−5 | 0.668 |
| 650 | 0.8143 | 1.1 | 2.88 x 10−5 | 3.54 × 10−5 | 0.0445 | 4.97 x 10−5 | 0.712 |
| 700 | 0.7564 | 1.13 | 3.05 x 10−5 | 4.03 x 10−5 | 0.0481 | 5.63 x 10−5 | 0.717 |
| 750 | 0.7057 | 1.15 | 3.21 x 10−5 | 4.55 x 10−5 | 0.0517 | 6.37 x 10−5 | 0.714 |
| 800 | 0.6614 | 1.17 | 3.37 x 10−5 | 5.10 x 10−5 | 0.0551 | 7.12 x 10−5 | 0.716 |
생물학적 역할
이산화탄소는 당, 지방, 아미노산을 대사의 일부로 산소와 함께 분해함으로써 에너지를 얻는 유기체의 세포 호흡의 최종 산물입니다.여기에는 모든 식물, 조류 및 동물, 호기성 곰팡이 및 박테리아가 포함됩니다.척추동물에서 이산화탄소는 몸의 조직에서 피부(양서류)나 아가미(어류)로, 물에 녹은 곳에서, 또는 숨을 내쉬는 곳에서 폐로 혈액 속으로 이동합니다.활발한 광합성을 하는 동안, 식물들은 호흡할 때 방출하는 이산화탄소보다 대기로부터 더 많은 이산화탄소를 흡수할 수 있습니다.
광합성 및 탄소고정

탄소 고정은 식물, 조류 및 (시아노박테리아)에 의해 대기 중의 이산화탄소가 포도당과 같은 에너지가 풍부한 유기 분자에 포함되어 광합성에 의해 자체 식품을 생성하는 생화학적 과정입니다.광합성은 이산화탄소와 물을 사용하여 다른 유기 화합물이 만들어질 수 있는 당을 생산하고, 산소는 부산물로 생산됩니다.
일반적으로 RuBisCO로 약칭되는 리불로스-1,5-이중인산 카르복실화효소 산소화효소는 탄소 고정의 첫 번째 주요 단계인 CO와2 리불로스 이중인산으로부터 2개의 3-포스포글리세르산 분자의 생성에 관여하는 효소입니다.
루비스코는 지구상에서 가장 풍부한 단 하나의 단백질로 여겨지고 있습니다.[31]
광영양소는 광합성의 산물을 내부 식량원으로 사용하고 다당류, 핵산, 단백질과 같은 더 복잡한 유기 분자의 생합성을 위한 원료로 사용합니다.이것들은 그들 자신의 성장을 위해 사용되며, 또한 우리와 같은 동물들을 포함한 다른 생물체들을 먹이는 먹이사슬과 거미줄의 기초로 사용됩니다.일부 중요한 광영양소인 코코리토포어는 단단한 탄산칼슘 비늘을 합성합니다.[32]세계적으로 중요한 코코콜리토포어 종은 에밀리아니아 헉슬리이인데, 석회암 비늘은 석회암과 같은 많은 퇴적암의 기초를 형성하고 있는데, 이전에 대기 중의 탄소는 지질학적인 시간 척도로 고정되어 있을 수 있습니다.

식물은 주변 조건과 비교할 때 CO 12,000ppm의 농도에서 50%까지 빠르게 성장할 수 있지만, 기후 변화와 다른 영양소에 대한 제한은 없습니다.[33][clarification needed]CO2 수치 상승은 농작물의 수확 가능한 수확량에 반영되는 증가를 야기하며, 밀, 쌀, 콩 모두 FACE 실험에서 CO2 수치 상승 하에서 12-14%의 수확량 증가를 보여줍니다.[34][35]
대기 중 CO2 농도가 증가하면 식물에[36] 기공이 적게 생겨 물 사용량이 감소하고 물 사용 효율성이 높아집니다.[37]FACE를 사용한 연구는 CO2 농축이 작물 식물의 미세영양소 농도 감소로 이어진다는 것을 보여주었습니다.[38]초식동물이 같은 양의 단백질을 얻기 위해 더 많은 음식을 먹어야 하기 때문에 이것은 생태계의 다른 부분에 연쇄적인 영향을 미칠 수 있습니다.[39]
페닐프로파노이드 및 플라보노이드와 같은 2차 대사 물질의 농도는 또한 고농도의2 CO에 노출된 식물에서 변경될 수 있습니다.[40][41]
식물은 또한 호흡 중에2 CO를 배출하므로 C3 광합성을 사용하는 대부분의 식물과 조류는 낮 동안에는 순수 흡수체에 불과합니다.성장하는 숲은 매년 많은 톤의 CO를2 흡수할 것이지만, 성숙한 숲은 식물의 광합성에 사용되는 것만큼 죽은 표본(예: 떨어진 가지)의 호흡과 분해로부터 많은 CO를2 생산할 것입니다.[42]탄소 중립이라는 오랜 관점과는 달리, 성숙한 숲은 탄소를[43] 계속 축적하고 귀중한 탄소 흡수원으로 남아 지구 대기의 탄소 균형을 유지하는 데 도움을 줄 수 있습니다.게다가, 그리고 지구상의 생명체들에게 결정적으로, 식물성 플랑크톤에 의한 광합성은 대양의 용해된 CO를2 소비하고, 그에 따라 대기로부터의 CO의2 흡수를 촉진합니다.[44]
독성

신선한 공기 중의 이산화탄소 함량(해수면에서 10kPa 사이의 평균, 즉 약 30km(19mi) 고도)은 위치에 따라 0.036%(360ppm)에서 0.041%(412ppm) 사이에서 다릅니다.[46][clarification needed]
CO는2 질식성 가스이며 OECD 화학물질 시험 지침을 사용하여 유럽에 대한 유엔 경제 위원회의 화학물질 분류 및 라벨링의 세계적 조화 시스템에 따라 독성 또는 유해성으로 분류되지 않습니다.1%(1만ppm)[45]까지 농도가 높아지면 일부 사람들은 나른함을 느끼고 폐에 답답함을 느끼게 됩니다.7~10%(70,000~100,000ppm)의 농도는 충분한 산소가 있는 상태에서도 질식을 유발할 수 있으며, 몇 분에서 한 시간 이내에 어지러움, 두통, 시각 및 청각 장애, 의식 불명 등으로 나타날 수 있습니다.[47][clarification needed]급성 이산화탄소 노출의 생리학적 영향은 질식의 부분집합인 하이퍼캡니아라는 용어로 함께 분류됩니다.
공기보다 무겁기 때문에 가스가 지면에서 (지열 또는 화산 지하 활동으로 인해) 상대적으로 고농도로 스며드는 위치에서는 바람의 분산 효과 없이 평균 지면 아래의 보호/포켓 위치에 모일 수 있어 그 안에 위치한 동물들이 질식할 수 있습니다.시체에 끌린 시체 공급원들도 죽임을 당합니다.인근 니라곤고 화산에서 배출된 이산화탄소2 때문에 고마시 인근에서도 어린이들이 같은 방식으로 목숨을 잃었습니다.[48]이 현상을 스와힐리어로 mazuku라고 합니다쿠)입니다.

혈액 산성화(산증)의 효과의 균형을 맞추기 위해 변형 호흡 및 신장 중탄산염 생성을 포함하여 증가된 CO2 농도에 대한 적응이 인간에서 발생합니다.여러 연구에서 성능 저하 또는 정상적인 신체 활동이 5일 동안 이 수준의 노출에서 발생하지 않기 때문에 적응이 생리적이고 가역적이기 때문에 2.0%의 영감을 받은 농도가 폐쇄된 공기 공간(예: 잠수함)에 사용될 수 있다고 제안했습니다.[49][50]그러나, 다른 연구들은 훨씬 낮은 수준에서도 인지 기능의 감소를 보여줍니다.[51][52]또한 진행 중인 호흡기 산증으로 인해 적응 또는 보상 메커니즘은 이러한 상태를 되돌릴 수 없습니다.
1%미만
1% 미만의 수준에서 CO 장기 지속 노출이 인간과 동물에2 미치는 건강 영향에 대한 연구는 거의 없습니다.미국에서는 8시간 동안 직업적 CO2 노출 한도를 0.5%(5000ppm)로 설정했습니다.[53]이러한 CO2 농도에서, 국제 우주 정거장 승무원들은 두통, 무기력, 정신적인 느림, 정서적인 짜증, 그리고 수면 장애를 경험했습니다.[54]CO의2 0.5%에서 동물을 대상으로 한 연구에서 신장 석회화와 노출 8주 후의 뼈 손실이 입증되었습니다.[55]2.5시간 동안 노출된 사람들을 대상으로 한 연구에서 CO로2 인한 뇌 혈류의 증가로 인해 CO가2 0.1%(1000ppm) 정도로 낮은 농도에서 인지 능력에 상당한 부정적인 영향을 미치는 것으로 나타났습니다.[51]또 다른 연구에서는 기본 활동 수준과 정보 사용량이 500 ppm에 비해 1000 ppm에서 감소하는 것을 관찰했습니다.[52][clarification needed]그러나 문헌을 검토한 결과 이산화탄소 현상에 대한 대부분의 연구는 높은 수준의 의사 결정에 작은 영향을 미치도록 인지 장애를 유도했으며 대부분의 연구는 부적절한 연구 설계, 환경적 편안함, 노출 선량의 불확실성 및 사용된 상이한 인지 평가로 인해 혼란을 겪었습니다.[56]마찬가지로 오토바이 헬멧의 CO2 농도의 영향에 대한 연구는 오토바이 탑승자들의 자기 보고에 주목하지 않고 마네킹을 사용하여 측정을 하는 데 의심스러운 방법론을 가지고 있다는 비판을 받아 왔습니다.또한 정상적인 오토바이 상태(고속도로나 시내 속도 등)를 달성하거나 바이저를 높이면 CO2 농도가 안전 수준(0.2%)[57][58]으로 떨어졌습니다.
| 집중력[clarification needed] | 메모 |
|---|---|
| 280ppm | 산업화 이전 수준 |
| 421 ppm | 현재(2022년 5월) 수준 |
| 700ppm | ASHRAE 추천[59] |
| 1000ppm | 인지장애, 캐나다의 장기 노출 한도[60] |
| 1000-2000ppm | 졸음[61] |
| 2000-5000ppm | 두통, 졸림, 집중력 저하, 주의력 저하, 약간의 메스꺼움도 있을[61] 수 있음 |
| 5000ppm | USA 8시간 노출 제한[53] |
환기

환기 불량은 밀폐된 공간에서 CO2 농도가 과도하게 높아져 실내 공기의 질이 떨어지는 주요 원인 중 하나입니다.정상 상태 조건(CO2 농도가 안정화될 정도로 점유 및 환기 시스템 작동이 충분히 긴 경우)에서 실외 농도 이상의 이산화탄소 차이는 때때로 1인당 환기율을 추정하는 데 사용됩니다.[citation needed]CO2 농도가 높을수록 승객의 건강, 편안함 및 성능 저하와 관련이 있습니다.[62][63]ASHRAE Standard 62.1–2007 환기 속도는 실내 농도를 주변 실외 조건보다 최대 2,100ppm까지 높일 수 있습니다.따라서 실외 농도가 400ppm이면 실내 농도가 2,500ppm에 이를 수 있으며, 환기 속도는 업계 합의 기준을 충족합니다.환기가 잘 되지 않는 공간의 농도는 이보다 더 높을 수 있습니다(3,000 또는 4,000ppm 범위).[clarification needed]
환기가 충분하지 않아 가스 노출에 특히 취약한 광부들은 이산화탄소와 질소의 혼합물을 "블랙댐", "초크댐" 또는 "스티테"라고 불렀습니다.더 효과적인 기술이 개발되기 전에, 광부들은 작업할 때 우리에 갇힌 카나리아를 가지고 와서 광산 갱도에 있는 블랙댐과 다른 가스의 위험한 수준을 자주 감시하곤 했습니다.카나리아는 사람보다 질식 가스에 더 민감하고 의식이 없어지면 노래를 멈추고 횃대에서 떨어집니다.데이비 램프는 또한 덜 밝게 연소함으로써 높은 수준의 블랙댐 (바닥 근처에 가라앉고 모이는)을 감지할 수 있었고, 또 다른 질식 가스와 폭발 위험인 메탄은 램프가 더 밝게 연소되도록 할 것입니다.
2020년 2월, 모스크바의 한 파티에서 드라이아이스(냉동 CO2)를 수영장에 넣어 식히다가 질식으로 3명이 사망했습니다.[64]2018년에도 한 여성이 자신의 차에 싣고 가던 다량의 드라이아이스에서 뿜어져 나오는 CO2 매연으로 사망하는 사고가 있었습니다.[65]
실내공기
인간은 점점 더 많은 시간을 한정된 대기에서 보냅니다. (건물이나 차량에서 보내는 시간의 약 80-90%)프랑스 식품환경산업보건안전청(ANSES)과 프랑스의 여러 행위자들에 따르면, 공기 갱신에 의해 가중치가 부여된 건물의 실내 공기에서의 CO율은2 "보통 약 350에서 2,500 ppm 사이"입니다.[66][clarification needed]
가정, 학교, 보육원 및 사무실에서는 CO2 수준과 기타 오염 물질 간에 체계적인 관계가 없으며, 실내 CO는2 통계적으로 실외 도로(또는 공기 등) 교통과 관련된 오염 물질에 대한 좋은 예측 변수가 아닙니다.[67]CO는2 사람이나 동물이 밀폐되어 있거나 환기가 잘 되지 않는 방에 모여 있을 때 습도 측정 및 산소 농도와 함께 가장 빠르게 변화하는 파라미터입니다.가난한 나라에서, 많은 노천은 생활 환경으로 직접 배출되는 CO와2 CO의 원천입니다.[68]
농도가 상승된 실외지역
이산화탄소의 국소 농도는 강력한 공급원, 특히 주변 지형에 의해 고립된 공급원 근처에서 높은 값에 도달할 수 있습니다.지름이 약 100m(330피트)인 그릇 모양의 움푹 들어간 곳에 위치한 이탈리아 토스카나 라폴라노 테르메 근처의 보솔레토 온천에서는 밤새 CO2 농도가 75% 이상으로 높아져 곤충과 작은 동물들을 죽일 수 있을 정도입니다.해가 뜬 후 기체는 대류에 의해 분산됩니다.[69]CO로2 포화된 깊은 호수 물의 교란에 의해 생성된 고농도의2 CO는 1984년 카메룬 모눈 호수에서 37명의 사망자를 냈고 1986년 카메룬 니오스 호수에서 1700명의 사망자를 낸 것으로 생각됩니다.[70]
인체생리학
내용
| 혈액구획 | (kPa) | (mmHg) | |
|---|---|---|---|
| 정맥혈 이산화탄소 | 5.5–6.8 | 41–51[71] | 41–51[71] |
| 폐포 폐가스 압력 | 4.8 | 36 | 36 |
| 동맥혈 이산화탄소 | 4.7–6.0 | 35–45[71] | 35–45[71] |
몸은 1인당 매일 약 2.3 파운드(1.0 kg)의 이산화탄소를 생산하며, [72]이는 0.63 파운드(290 g)의 탄소를 포함합니다. 인간의 경우, 이 이산화탄소는 정맥계를 통해 운반되고 폐를 통해 배출되어 동맥 내의 농도가 낮아집니다.혈액의 이산화탄소 함량은 종종 이산화탄소가 부피를 차지했다면 가졌을 압력인 분압으로 주어집니다.[73]사람의 경우 혈중 이산화탄소 함량은 옆의 표에 나와 있습니다.
혈액내 수송
CO는2 세 가지 다른 방식으로 혈액 내에 운반됩니다. (정확한 백분율은 동맥혈과 정맥혈에 따라 다릅니다.)
- CO + HO → HCO → H + HCO-3
적혈구에서 산소를 운반하는 주요 분자인 헤모글로빈은 산소와 이산화탄소를 운반합니다.그러나 헤모글로빈에 결합된 CO는2 산소와 같은 부위에 결합하지 않습니다.대신, 그것은 4개의 글로빈 사슬 상의 N 말단 그룹과 결합합니다.그러나, 헤모글로빈 분자에 대한 알로스테릭 효과 때문에, CO의2 결합은 산소의 주어진 분압에 결합되는 산소의 양을 감소시킵니다.이것은 할데인 효과로 알려져 있으며, 이산화탄소를 조직에서 폐로 운반하는 데 중요합니다.반대로, CO의2 분압이 상승하거나 pH가 낮아지면 헤모글로빈으로부터 산소가 오프로딩되는 현상이 발생하며, 이를 보어 효과(Bohr effect)라고 합니다.
호흡조절
이산화탄소는 혈액 공급의 국소적인 자동 조절의 매개체 중 하나입니다.농도가 높으면 모세혈관이 확장되어 해당 조직으로 더 많은 혈액이 흐를 수 있습니다.[75]
중탄산 이온은 혈중 pH를 조절하는데 중요합니다.사람의 호흡수는 혈액 속의 CO2 농도에 영향을 미칩니다.호흡이 너무 느리거나 얕으면 호흡성 산증이 발생하고, 너무 빠른 호흡은 과호흡으로 이어져 호흡성 알칼리증을 유발할 수 있습니다.[76]
신체는 신진대사를 위해 산소를 필요로 하지만, 낮은 산소 수치는 보통 호흡을 자극하지 않습니다.오히려, 호흡은 더 높은 이산화탄소 수치에 의해 자극을 받습니다.결과적으로 낮은 압력의 공기 또는 산소가 전혀 없는 혼합 가스(순수 질소 등)를 호흡하면 공기 기아를 겪지 않고 의식을 잃을 수 있습니다.이것은 특히 고고도 전투기 조종사들에게 위험합니다.이것은 또한 승무원들이 객실 압력을 잃을 경우 승객들에게 다른 사람들을 돕기 전에 먼저 산소 마스크를 바르라고 지시하는 이유이기도 합니다. 그렇지 않으면 의식을 잃을 위험이 있습니다.[74]
호흡기 센터에서는 동맥 CO2 압력이 40 mmHg로 유지되도록 노력합니다.의도적인 과호흡으로 동맥혈의 CO2 함량이 10–20mmHg로 낮아질 수 있습니다(혈액의 산소 함량은 거의 영향을 받지 않음). 그리고 호흡기 구동력이 저하됩니다.이것이 과호흡을 한 후에 숨을 참는 시간이 과호흡을 하지 않고 숨을 참는 시간보다 긴 이유입니다.이것은 호흡의 필요성이 압도적이 되기 전에 무의식이 초래할 수 있는 위험을 수반하며, 이것이 프리 다이빙 전에 과호흡이 특히 위험한 이유입니다.[77]
환경에서의 집중도 및 역할
대기.

지구 대기에서 이산화탄소는 온실 효과, 탄소 순환, 광합성, 해양 탄소 순환에 필수적인 역할을 하는 미량 가스입니다.그것은 지구 대기 중의 여러 온실가스 중 하나입니다.2022년 5월 현재 전 세계 평균 대기 중 CO2 농도는 421ppm(0.04%)[80]입니다.이는 산업혁명이 시작된 이후 50% 증가한 것으로 18세기 중반 이전 1만 년 동안 280ppm보다 증가한 수치입니다.[81][80][82]그 증가는 인간의 활동 때문입니다.[83]화석 연료를 태우는 것은 이러한 이산화탄소2 농도 증가의 주요 원인이며 기후 변화의 주요 원인이기도 합니다.[84]시멘트 생산, 삼림 벌채, 바이오매스 연소 등의 다른 대규모 인위적 공급원들도 있습니다.
가시광선에는 투명하지만 이산화탄소는 온실가스로서 적외선을 흡수하여 두 개의 적외선 활성 진동 주파수로 방출합니다.CO는2 4.26μm(2,347cm−1)(비대칭 스트레칭 진동모드)와 14.99μm(667cm−1)(벤딩 진동모드)의 파장에서 적외선을 흡수하여 방출합니다.그것은 온실 효과를 통해 지구의 표면 온도에 영향을 미치는데 중요한 역할을 합니다.[85]지구 표면에서의 빛 방출은 적외선 영역에서 200에서 2500 cm−1 사이에서 가장 강렬하며,[86] 가시 영역에서 가장 강렬한 태양의 빛 방출과는 대조적입니다.대기 중 CO의2 진동 주파수에서 적외선의 흡수는 표면 근처에 에너지를 가두어 표면과 대기 하부를 따뜻하게 합니다.대기 상층부에 도달하는 에너지가 줄어들기 때문에 이 흡수 때문에 더 시원합니다.[87]
이산화탄소와2 메탄, 아산화질소, 오존과 같은 다른 오래 지속되는 온실가스의 대기 농도 증가는 대기에 의한 적외선 복사의 흡수와 방출을 증가시키며, 관측된 지구 평균 온도와 해양 산성화의 증가를 야기합니다.또 다른 직접적인 효과는 CO2 수정 효과입니다.이러한 변화는 기후 변화가 물리적 환경, 생태계, 인간 사회에 미치는 간접적인 영향의 범위를 야기합니다.이산화탄소는 다른 모든 온실가스를 합친 것보다 더 큰 전체적인 온난화 영향을 줍니다.[82]이 활동이 지구의 빠른 탄소 순환에 부과하는 불균형 때문에 화석 탄소를 추출하고 연소하는 누적 양에 따라 증가하는 대기 수명을 가지고 있습니다.[88]이는 지금까지 전달된 화석 탄소의 일부 분율(예상 20-35%)이 이러한 탄소 전달 활동이 가라앉기 시작한 후 수천 년 동안 CO 수치가2 상승함에 따라 대기 중에 유지된다는 것을 의미합니다.[89][90][91]탄소 순환은 지구의 해양, 토양, 암석 그리고 생물권 사이에서 탄소가 교환되는 생물 지구화학적 순환입니다.식물과 다른 광자생동물들은 광합성에 의해 대기 중의 이산화탄소와 물로부터 탄수화물을 생산하기 위해 태양 에너지를 사용합니다.거의 모든 다른 생물체들은 광합성에서 나온 탄수화물을 그들의 주요 에너지원과 탄소 화합물로 의존합니다.
현재 대기 중 CO2 농도는 1,400만 년 동안 가장 높습니다.[92]대기 중 CO2 농도는 약 5억 년 전 캄브리아기에 4,000 ppm까지 높았으며, 지난 2백만 년 동안 4차 빙하기에는 180 ppm까지 낮았습니다.[81]지난 4억 2천만 년 동안의 재구성된 온도 기록은 대기 중 CO2 농도가 데본기(400 Ma) 기간 동안 약 2,000ppm, 트라이아스기(220-200 Ma) 기간에 다시 정점을 찍었고 쥐라기(201-145 Ma) 기간 동안 현재 수준의 4배에 달했음을 나타냅니다.[93][94]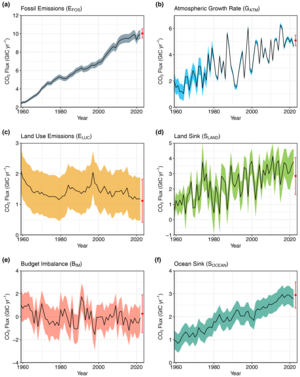
오션스
해양 산성화
이산화탄소는 바다에서 용해되어 탄산(HCO23), 중탄산(HCO-3), 탄산(CO2-3)을 형성합니다.대기 중에 존재하는 이산화탄소보다 바다에 용해된 이산화탄소의 양이 약 50배나 많습니다.바다는 거대한 탄소흡수원의 역할을 하며, 인간의 활동에 의해 배출되는 이산화탄소의2 약 3분의 1을 차지합니다.[96]
해양 산성화는 지구 해양의 pH가 감소하는 것입니다.1950년과 2020년 사이에, 해수면의 평균 pH는 약 8.15에서 8.05로 떨어졌습니다.[97]대기 중 이산화탄소(CO2) 수치가 410ppm(2020년)을 초과하는 등 인간 활동으로 인한 이산화탄소 배출은 해양 산성화의 주요 원인입니다.대기중의 CO는2 바다에 흡수됩니다.이것은 중탄산 이온(HCO-3)과 수소 이온(H+)으로 해리되는 탄산(HCO23)을 생성합니다.유리 수소 이온(H+)의 존재는 바다의 pH를 낮추어 산성도를 증가시킵니다(이것은 해수가 아직 산성이라는 것을 의미하지 않습니다; pH가 8보다 높은 상태에서 여전히 알칼리성입니다).연체동물이나 산호와 같은 해양 석회화 생물은 껍질과 골격을 만들기 위해 탄산칼슘에 의존하기 때문에 특히 취약합니다.[98]
pH 0.1의 변화는 전 세계 해양에서 수소 이온 농도가 26% 증가한 것을 나타냅니다(pH 스케일은 로그이므로 pH 단위의 1 변화는 수소 이온 농도의 10배 변화에 해당함).해수면 pH와 탄산염 포화 상태는 해수면 깊이와 위치에 따라 다릅니다.더 차갑고 위도가 높은 물은 더 많은 이산화탄소를2 흡수할 수 있습니다.이는 산성도를 상승시켜 이들 지역의 pH와 탄산염 포화도를 낮출 수 있습니다.대기-해양 CO2 교환, 그리고 따라서 지역 해양 산성화에 영향을 미치는 다른 요인들은 해류와 융기 지역, 큰 대륙 강과의 근접성, 해빙 범위, 화석 연료 연소와 농업에서 나오는 질소와 황과의 대기 교환을 포함합니다.[99][100][101]
해양 화학의 변화는 생물체와 그들의 서식지에 광범위한 직간접적인 영향을 미칠 수 있습니다.해양 산성도를 증가시키는 가장 중요한 영향 중 하나는 탄산칼슘(CaCO3)에서 조개껍질을 생성하는 것과 관련이 있습니다.[98]이 과정은 석회화라고 불리며 다양한 해양 생물의 생물학과 생존에 중요합니다.석회화는 녹은 이온을 고체 CaCO3 구조로 침전시키는 것을 포함하며, 코코콜리토포어, 포라미니페라, 갑각류, 연체동물 등과 같은 많은 해양 생물의 구조입니다.이러한 CaCO3 구조는 형성된 후 주변 해수에 포화 농도의 탄산염 이온(CO2-3)이 포함되지 않는 한 용해에 취약합니다.
바다에 첨가되는 여분의 이산화탄소 중 용해된 이산화탄소로 남아있는 것은 않습니다.대다수는 추가적인 중탄산염과 유리수소 이온으로 해리됩니다.수소의 증가는 중탄산염의 증가보다 [102]더 커서 반응에 불균형을 일으킵니다.
- HCO−3 ⇌ CO2−3 + H+
화학적 평형을 유지하기 위해 이미 바다에 있는 탄산염 이온 중 일부는 수소 이온 중 일부와 결합하여 더 많은 중탄산염을 만듭니다.따라서 해양의 탄산 이온 농도가 감소하여 해양 생물이 껍질을 만들거나 석회화하는 데 필수적인 구성 요소가 제거됩니다.
- Ca2+ + CO2−3 ⇌ CaCO3
열수구
이산화탄소는 열수 분출구를 통해 바다로 유입되기도 합니다.마리아나 해구에 있는 북서 에이후쿠 화산에서 발견된 샴페인 열수 분출구는 거의 순수한 액체 이산화탄소를 생산하는데, 2004년 현재 세계에서 단 두 곳만이 알려진 장소 중 하나이며, 다른 하나는 오키나와 트로프에 있습니다.[103]오키나와 트로프에서 액체 이산화탄소로 이루어진 해저 호수가 발견된 것은 2006년에 보고되었습니다.[104]
생산.
생물학적 과정
이산화탄소는 맥주, 위스키 및 기타 알코올 음료 양조 및 바이오 에탄올 생산에서 설탕이 발효되는 부산물입니다.효모는 다음과 같이 설탕을 대사시켜 CO와2 알코올로도 알려진 에탄올을 생산합니다.
- CHO → CO 2 + CHCHOH 2개
모든 호기성 생물은 탄수화물, 지방산, 단백질을 산화시킬 때 CO를2 생성합니다.관련된 많은 반응은 매우 복잡하고 쉽게 설명되지 않습니다.(세포 호흡, 혐기성 호흡 및 광합성)을 참조합니다.포도당과 다른 단당류의 호흡에 대한 방정식은 다음과 같습니다.
- CHO + 6 O → 6 CO + 6 HO
혐기성 생물은 다른 화합물의 흔적과 함께 메탄과 이산화탄소를 생성하는 유기물을 분해합니다.[105]유기 물질의 종류와 상관없이 가스의 생성은 잘 정의된 운동 패턴을 따릅니다.이산화탄소는 매립지에서 발생하는 분해 가스의 약 40-45%를 차지합니다("매립지 가스"라고 함).나머지 50-55%의 대부분은 메탄입니다.[106]
산업공정
이산화탄소는 공기에서 증류하면 얻을 수 있지만 그 방법은 비효율적입니다.산업적으로 이산화탄소는 주로 회수되지 않은 폐기물이며, 다양한 규모로 실행될 수 있는 여러 가지 방법으로 생성됩니다.[107]
연소
메탄(천연가스), 석유 증류물(가솔린, 디젤, 등유, 프로판), 석탄, 목재 및 일반 유기물과 같은 모든 탄소 기반 연료의 연소는 이산화탄소를 생성하며, 순수한 탄소의 경우를 제외하고는 물을 생성합니다.예를 들어, 메탄과 산소 사이의 화학적 반응:
- CH + 2 O → CO + 2 HO
고로에서 코크스를 사용하여 산화물에서 철이 환원되어 선철과 이산화탄소가 생성됩니다.[108]
- FeO + 3 CO → 3 CO + 2 Fe
수소생산 부산물
이산화탄소는 증기 개질에 의한 수소 산업 생산과 암모니아 생산에서의 수성 가스 전환 반응의 부산물입니다.이러한 과정은 물과 천연 가스(주로 메탄)의 반응으로 시작됩니다.[109]이것은 맥주와 청량 음료의 탄산화에 사용되는 식품 등급 이산화탄소의 주요 공급원이며 가금류와 같은 놀라운 동물에도 사용됩니다.2018년 여름, 유럽에서는 유지보수를 위해 몇몇 암모니아 공장의 일시적인 폐쇄로 인해 이러한 목적의 이산화탄소 부족이 발생했습니다.[110]
석회석의 열분해
산업적 용도가 많은 생석회(산화칼슘, CaO)를 제조할 때 약 850°C(1,560°F)에서 가열(석회)하여 석회석, CaCO를3 열분해하여 생산합니다.
- CaCO → CaO + CO
산은 대부분의 금속 탄산염으로부터 CO를2 방출합니다.따라서 천연 이산화탄소 스프링에서 직접 얻을 수 있으며, 석회암이나 돌로마이트에 산성화된 물이 작용하여 생성됩니다.염산과 탄산칼슘(석회석 또는 분필)의 반응은 다음과 같습니다.
- CaCO + 2 HCl → CaCl + HCO
탄산(HCO23)은 물과 CO로2 분해됩니다.
- HCO → CO + HO
이러한 반응은 가스가 방출될 때 거품이나 거품, 또는 둘 다를 동반합니다.폐산 스트림을 중화하는 데 사용될 수 있기 때문에 산업계에서 널리 사용되고 있습니다.
상업용
이산화탄소는 식품 산업, 석유 산업, 화학 산업에서 사용됩니다.[107]이 화합물은 다양한 상업적 용도를 가지고 있지만, 화학 물질로서 가장 큰 용도 중 하나는 탄산 음료 제조입니다. 탄산수, 맥주 및 스파클링 와인과 같은 탄산 음료에서 반짝임을 제공합니다.
화학물질의 전구체(precursor)
화학 산업에서 이산화탄소는 주로 요소 생산의 성분으로 소비되며, 더 작은 분획은 메탄올 및 다양한 다른 제품을 생산하는 데 사용됩니다.[111]살리실산 나트륨과 같은 카르복실산 유도체는 콜베-슈미트 반응에 의해 CO를2 사용하여 제조됩니다.[112]
화학적 생산을 위해 CO를2 사용하는 종래의 공정 이외에도 전기화학적 방법도 연구 수준에서 연구되고 있습니다.특히, CO2(메탄올과 같은)로부터 연료를 생산하기 위한 재생 에너지의 사용은 기존의 연소 기술 내에서 쉽게 운송되고 사용될 수 있지만 순 CO 배출량이2 없는 연료를 생성할 수 있기 때문에 매력적입니다.[113]
농업
식물은 광합성을 하기 위해서 이산화탄소를 필요로 합니다.온실의 대기는 식물 생장 속도를 유지하고 증가시키기 위해 추가적인 이산화탄소로2 농축될 수 있습니다.[114][115]매우 높은 농도(대기농도의 100배 이상)에서는 이산화탄소가 동물의 생명에 독성을 나타낼 수 있어 몇 시간 동안 농도를 1만ppm(1%) 이상으로 올리면 온실 내 흰파리, 거미진드기 등 해충을 없앨 수 있습니다.[116][clarification needed]
음식을

이산화탄소는 식품 산업에서 추진제와 산도 조절제로 사용되는 식품 첨가제입니다.EU[117](E 번호 E290으로 표시), 미국[118] 및 호주[119], 뉴질랜드(INS 번호 290으로 표시)에서 사용할 수 있도록 승인되었습니다.
팝 락스(Pop Rocks)라고[120] 불리는 사탕은 이산화탄소 가스로 약 4,000 kPa (40 bar; 580 psi)의 압력을 받습니다.입 안에 넣으면, 다른 딱딱한 사탕과 마찬가지로 용해되어 소리가 나는 소리와 함께 기포를 내보냅니다.
발효제는 이산화탄소를 생성함으로써 반죽을 상승시킵니다.[121]베이커의 효모는 반죽 안에 있는 설탕의 발효에 의해 이산화탄소를 생산하는 반면 베이킹 파우더와 베이킹 소다와 같은 화학적인 발효제는 가열될 때 또는 산에 노출될 때 이산화탄소를 방출합니다.
음료
이산화탄소는 탄산음료와 탄산수를 만드는 데 사용됩니다.전통적으로 맥주와 스파클링 와인의 탄산화는 자연 발효를 통해 이루어졌지만, 많은 제조업체들은 발효 과정에서 회수된 이산화탄소로 이 음료들을 탄산화시킵니다.병맥주와 케그맥주의 경우 가장 일반적으로 사용되는 방법은 이산화탄소를 재활용하여 탄산화하는 것입니다.영국 리얼 에일을 제외하고, 생맥주는 보통 차가운 방이나 지하실의 통에서 가압 이산화탄소를 사용하여 바에 수도꼭지를 틀기 위해 옮겨지고, 때로는 질소와 혼합됩니다.
탄산수의 맛(및 다른 탄산음료의 관련 미각)은 가스의 거품이 터지는 것보다 용해된 이산화탄소의 효과입니다.탄산무수화효소 4는 탄산으로 전환되어 신맛이 나고, 용해된 이산화탄소는 체성감각반응을 유도합니다.[122]
와인만들기

드라이아이스 형태의 이산화탄소는 야생 효모에 의한 자연발효를 방지하기 위해 따기 후 포도송이를 빨리 식히기 위해 포도주 제조 시 저온 담금기에 자주 사용됩니다.드라이아이스를 워터아이스보다 사용하는 것의 가장 큰 장점은 포도의 설탕 농도를 감소시킬 수 있는 추가적인 물을 첨가하지 않고 포도를 식힌다는 것이고, 따라서 완성된 와인의 알코올 농도를 감소시킬 수 있습니다.이산화탄소는 또한 보졸레 와인을 생산하는 데 사용되는 과정인 저산소 환경을 만들기 위해 사용됩니다.
이산화탄소는 때때로 산화를 방지하기 위해 와인병이나 배럴과 같은 다른 저장 용기를 보충하는 데 사용되지만, 와인에 녹아서 이전에 아직도 와인이 약간 곪아버릴 수 있다는 문제점이 있습니다.이러한 이유로, 전문적인 와인 제조사들은 질소나 아르곤과 같은 다른 가스를 이 공정에 선호합니다.
놀라운 동물들
이산화탄소는 종종 도살 전에 동물들을 "놀라게" 하는데 사용됩니다.[123]동물들이 즉시 기절하지 않고 고통을 겪을 수 있기 때문에 "놀라다"는 잘못된 이름일 수도 있습니다.[124][125]
불활성 가스
이산화탄소는 휴대용 압력 공구에서 공압(가압 가스) 시스템에 가장 일반적으로 사용되는 압축 가스 중 하나입니다.이산화탄소는 용접을 위한 대기로도 사용되지만 용접 아크에서는 대부분의 금속을 산화시키기 위해 반응합니다.이산화탄소 용접이 불활성 분위기에서 용접된 용접보다 더 취약하다는 중요한 증거가 있음에도 불구하고 자동차 산업에서 사용되는 것은 일반적입니다.[citation needed]MIG 용접에 사용할 경우 CO가22 이러한 고온에서 반응할 수 있기 때문에 CO 사용을 MAG 용접이라고 부르기도 합니다.실제 불활성 분위기보다 뜨거운 웅덩이를 생성하는 경향이 있어 유동 특성이 개선됩니다.하지만 이는 웅덩이 현장에서 발생하는 대기 반응 때문일 수 있습니다.이는 용접 시 원하는 효과와 반대되는 것이 일반적이며, 이는 현장을 취화하는 경향이 있기 때문입니다. 하지만 궁극적인 연성이 주요 관심사가 아닌 일반적인 연강 용접의 경우에는 문제가 되지 않습니다.
이산화탄소는 값싸고 불연성이기 때문에, 그리고 대략 60 bar (870 psi; 59 atm)의 도달 가능한 압력에서 상온에서 가스로부터 액체로의 상전이를 겪기 때문에, 가압 가스를 필요로 하는 많은 소비자 제품에 사용됩니다.다른 방법보다 훨씬 더 많은 이산화탄소가 주어진 용기에 들어갈 수 있도록 하는 것.구명조끼에는 급속한 팽창을 위해 가압된 이산화탄소 통이 들어있는 경우가 많습니다.CO의2 알루미늄 캡슐은 에어 건, 페인트볼 마커/건, 팽창 자전거 타이어, 탄산수 제조를 위한 압축 가스 공급으로도 판매됩니다.고농도의 이산화탄소는 해충을 죽이는 데도 사용될 수 있습니다.액체 이산화탄소는 일부 식품 및 기술 재료의 초임계 건조, 전자 현미경[126] 스캔을 위한 검체 준비 및 원두의 디카페인에 사용됩니다.
소화기

이산화탄소는 가스로 화염 주위의 환경을 침수시킴으로써 화염을 진화하는 데 사용될 수 있습니다.그 자체가 불꽃을 끄는데 반응하는 것이 아니라, 그것을 대체함으로써 산소의 불꽃을 굶게 됩니다.일부 소화기, 특히 전기 화재를 위해 설계된 소화기에는 압력을 받는 액체 이산화탄소가 들어 있습니다.이산화탄소 소화기는 작은 가연성 액체나 전기 화재에는 잘 작동하지만, 일반 가연성 화재에는 잘 작동하지 않는데, 연소 물질을 크게 냉각시키지 못하고, 이산화탄소가 분산되면 대기 산소에 노출되면 불이 붙을 수 있기 때문입니다.그것들은 주로 서버실에서 사용됩니다.[127]
이산화탄소는 고정식 방화 시스템에서 특정 위험 요소의 국소 적용과 보호 공간의 전체 침수를 위한 소화제로도 널리 사용되어 왔습니다.[128]국제해사기구 표준은 선박실과 기관실의 화재 보호를 위해 이산화탄소 시스템을 인정하고 있습니다.이산화탄소 기반의 방화 시스템은 충분히 높은 농도에서 질식을 유발할 수 있기 때문에 여러 명의 사망자와 관련이 있습니다.CO2 시스템을 검토한 결과 1975년부터 보고서 작성일(2000년)까지 51건의 사건이 발생하여 72명의 사망자와 145명의 부상자가 발생한 것으로 확인되었습니다.[129]
용매로서의 초임계 이산화탄소2
액체 이산화탄소는 많은 친유성 유기 화합물에 좋은 용매이며 커피에서 카페인을 제거하는데 사용됩니다.[18]이산화탄소는 유기염소화물과 같은 더 전통적인 용매에 대한 덜 독성적인 대안으로서 제약 및 기타 화학 가공 산업에서 주목을 받아 왔습니다.이런 이유로 일부 세탁소에서도 사용하고 있습니다.초임계 이산화탄소의 특성 때문에 일부 에어로겔 제조에 사용됩니다.
의학 및 약리학적 용도
의학에서는 무호흡 후 호흡을 자극하고 혈액 내 O2/CO2 균형을 안정시키기 위해 산소에 최대 5%의 이산화탄소(대기 농도의 130배)를 첨가합니다.
이산화탄소는 최대 50%의 산소와 혼합되어 흡입 가능한 가스를 형성할 수 있습니다. 이 가스는 Carbogen으로 알려져 있으며 다양한 의료 및 연구 용도를 가지고 있습니다.
또 다른 의학적 용도는 화산 후 배출된 이산화탄소를 치료 목적으로 사용하는 모페트 건조 스파입니다.
에너지
초임계 CO는2 Allam 동력 사이클 엔진의 작동 유체로 사용됩니다.
화석연료회수
이산화탄소는 오일과 혼화성이 되었을 때 보통 초임계 상태에서 유정에 주입되거나 인접한 곳에 주입되는 향상된 오일 회수에 사용됩니다.이 방법을 사용하면 1차 추출 시 잔류 오일 포화도를 7-23% 추가로 감소시켜 원래 오일 회수율을 높일 수 있습니다.[130]이는 가압제 역할을 하며, 지하 원유에 용해되면 점도가 현저히 떨어지고, 표면 화학을 변화시켜 오일이 저장소를 통해 제거 유정으로 더 빠르게 흐를 수 있습니다.[131]성숙한 유전에서는 이산화탄소를 주입 지점까지 운반하기 위해 광범위한 파이프 네트워크가 사용됩니다.
향상된 석탄층 메탄 회수에서 이산화탄소는 석탄층이 갇힌 메탄을 방출하도록 하기 위해 물을 제거하는 것에 주로 의존하는 현재의 방법과는 달리 메탄을 대체하기 위해 석탄층으로 펌핑될 것입니다.[132]
생물이 연료로 전환
발전에서 나오는 이산화탄소를2 거품을 내어 연못으로 만들어 조류의 성장을 자극하여 바이오 디젤 연료로 전환할 수 있다고 제안되었습니다.[133]광합성을 이용하여 CO로부터2 이소부티랄알데히드와 이소부탄올 연료를 생산하기 위해 시아노박테리움 시네코코커스 엘롱가투스 균주가 유전적으로 조작되었습니다.[134]
연구원들은 박테리아로부터 분리된 효소를 이용하여 이산화탄소를2 연료로 바꾸는 화학 반응을 작동시키는 전기 분해라고 불리는 과정을 개발했습니다.[135][136][137]
냉매

액체 및 고체 이산화탄소는 특히 식품 산업에서 중요한 냉매이며, 아이스크림 및 기타 냉동 식품의 운송 및 보관 시에 사용됩니다.고체 이산화탄소는 "드라이 아이스"라고 불리며 냉동 장비가 실용적이지 않은 소규모 운송에 사용됩니다.고체 이산화탄소는 대기 온도에 관계없이 일정한 대기압에서 항상 -78.5 °C(-109.3 °F) 이하입니다.
디클로로디플루오로메탄(R12, 클로로플루오로카본(CFC))을 사용하기 전에는[citation needed] 액체 이산화탄소(산업명 R744 또는 R-744)를 냉매로 사용하였습니다.CO는2 CFC의 주요 대체 물질 중 하나인 1,1,1,2-테트라플루오로에탄(R134a, 수소 플루오로카본)이 CO보다2 기후 변화에 더 많이 기여하기 때문에 르네상스를 누릴 수 있습니다.CO2 물성은 냉각, 냉동, 가열에 매우 유리하여 체적 냉각 능력이 높습니다.최대 130bar(1,900psi; 13,000kPa)의 압력에서 작동해야 하기 때문에 CO2 시스템에는 기계적으로 저항성이 높은 저장소와 이미 많은 부문에서 대량 생산을 위해 개발된 부품이 필요합니다.자동차 공조 장치에서, 50° 이상의 위도에서 전체 주행 조건의 90% 이상에서 CO2(R744)는 HFC(예: R134a)를 사용하는 시스템보다 더 효율적으로 작동합니다.환경적 이점(GWP 1, 비오존 고갈, 무독성, 불연성)은 자동차, 슈퍼마켓, 히트펌프 온수기 등에서 현재의 HFC를 대체할 미래의 작동 유체로 만들 수 있습니다.코카콜라는 CO 기반2 음료 냉각기를 생산했고 미군은 CO2 냉동 및 가열 기술에 관심이 있습니다.[138][139]
사소한 용도

이산화탄소는 초기 형태의 레이저 중 하나인 이산화탄소 레이저의 레이저 매체입니다.
이산화탄소는 물에 가스를 지속적으로 첨가함으로써 [140]pH가 상승하지 않도록 수영장의 pH를 조절하는 수단으로 사용될 수 있습니다.이것의 장점 중 하나는 취급(더 위험한) 산을 피할 수 있다는 것입니다.마찬가지로, 탄산칼슘이 물에 더 자유롭게 녹도록 하기 위해 탄산칼슘 위를 통과하는 물의 pH를 일시적으로 낮추기 위해 칼슘 원자로에서 사용되는 암초 수족관에서도 사용됩니다. 일부 산호가 골격을 형성하기 위해 탄산칼슘을 사용합니다.
원자력발전용 영국 첨단 가스냉각로에서 1차 냉각재로 사용
이산화탄소 유도는 일반적으로 실험실 연구용 동물의 안락사에 사용됩니다.CO를2 투여하는 방법은 동물을 CO를2 포함하는 밀폐된 미리 채워진 챔버에 직접 넣는 것 또는 점차적으로 증가하는 CO2 농도에 노출시키는 것을 포함합니다.미국 수의학 협회의 2020년 이산화탄소 유도 가이드라인에 따르면 분당 챔버 또는 케이지 부피의 30~70%의 변위율은 작은 설치류의 인도적 안락사에 최적이라고 합니다.[141]: 5, 31 CO의2 백분율은 고통을 최소화하기 위해 확인된 최적의 백분율에 따라 종에 따라 달라집니다.[141]: 22
이산화탄소는 또한 여러 관련 세척 및 표면 준비 기술에 사용됩니다.
발견이력

이산화탄소는 이산 물질로 묘사된 최초의 가스였습니다.약 1640년,[142] 플랑드르의 화학자 얀 밥티스트 반 헬몬트는 그가 밀폐된 그릇에서 숯을 태웠을 때, 생성된 재의 질량이 원래 숯의 질량보다 훨씬 적음을 관찰했습니다.그의 해석은 숯의 나머지 부분이 그가 "가스"(그리스어 "혼돈"에서 유래) 또는 "야생의 영혼"(스피리투스 실베스트리스)이라고 부르는 보이지 않는 물질로 변환되었다는 것이었습니다.[143]
이산화탄소의 특성은 1750년대에 스코틀랜드 의사 조셉 블랙에 의해 더 연구되었습니다.그는 석회석 (탄산칼슘)을 가열하거나 산으로 처리하여 그가 "고정 공기"라고 부르는 가스를 생산할 수 있다는 것을 발견했습니다.그는 고정된 공기가 공기보다 밀도가 높고 불꽃이나 동물의 생명을 지탱하지 못한다는 것을 관찰했습니다.블랙은 또한 석회수(수산화칼슘의 포화 수용액)를 통해 거품을 내면 탄산칼슘을 침전시킨다는 것을 발견했습니다.그는 이 현상을 동물의 호흡과 미생물의 발효에 의해 이산화탄소가 생성된다는 것을 설명하기 위해 사용했습니다.1772년, 영국의 화학자 조셉 프리스틀리는 "고정된 공기로 물을 스며들게 한다"라는 제목의 논문을 발표했는데, 그는 이산화탄소를 생산하기 위해 분필에 황산(또는 프리스틀리가 알고 있던 독설의 기름)을 떨어뜨리고, 그 가스와 접촉하는 물 그릇을 교반함으로써 그 가스를 강제로 녹이는 과정을 묘사했습니다.[144]
이산화탄소는 1823년 험프리 데이비와 마이클 패러데이에 의해 처음으로 액화되었습니다.[145]고체 이산화탄소(건빙)에 대한 최초의 설명은 1835년 액체 이산화탄소가 담긴 가압 용기를 열었지만 액체의 급속한 증발에 의해 생성된 냉각으로 고체2 이산화탄소가 "눈"으로 생성되었음을 프랑스 발명가 Adrien-Jean-Pierre Thilorier가 1835년에 발표했습니다.[146][147]
이산화탄소는 질소와 결합하여 이전부터 블랙댐(Blackdamp), 스티더(styther) 또는 초크댐(choke damp)으로 알려져 있었으며,[148] 다른 유형의 댐과 함께 광산 작업과 우물 침하에서 발견되었습니다.석탄의 느린 산화와 생물학적 과정이 산소를 대체하여 질소와 이산화탄소의 숨막히는 혼합물을 만들었습니다.[149]
참고 항목
- 동맥혈 가스 검사 – 특정 용해 가스의 양을 측정하는 동맥에서 채취한 혈액 검사
- Bosch 반응 – 금속 촉매를 사용하여 CO2와 수소로부터 원소 탄소를 생성합니다. 한 페이지
- 이산화탄소 제거 – 사람의 활동(대기 중)을 통한 대기 중 이산화탄소 제거
- 탄소효율이 낮은 발전소 목록
- 이산화탄소 배출량에 따른 나라 목록
- 메로믹 호수 – 물이 섞이지 않는 층층이 있는 영구적으로 성층화된 호수
- 길버트 플라스 – 캐나다 물리학자 (1920–2004) (CO와2 기후 변화에 대한 초기 연구)
- 사바티에 반응 – 이산화탄소와 수소의 메탄화 과정
- NASA의 궤도 탄소 관측소 2 – NASA 위성 를 폴백(한 페이지
- 온실가스 관측 위성 – 지구 관측 위성
- 토양 가스 – 토양 - 식물 뿌리와 대기 사이의 가스 교환 (fallback)으로하는 페이지
메모들
참고문헌
- ^ a b c "Carbon Dioxide" (PDF). Air Products. Archived from the original (PDF) on 29 July 2020. Retrieved 28 April 2017.
- ^ a b c d e f g h i Span R, Wagner W (1 November 1996). "A New Equation of State for Carbon Dioxide Covering the Fluid Region from the Triple‐Point Temperature to 1100 K at Pressures up to 800 MPa". Journal of Physical and Chemical Reference Data. 25 (6): 1519. Bibcode:1996JPCRD..25.1509S. doi:10.1063/1.555991.
- ^ Touloukian YS, Liley PE, Saxena SC (1970). "Thermophysical properties of matter - the TPRC data series". Thermal Conductivity - Nonmetallic Liquids and Gases. Data book. 3.
- ^ Schäfer M, Richter M, Span R (2015). "Measurements of the viscosity of carbon dioxide at temperatures from (253.15 to 473.15) K with pressures up to 1.2 MPa". The Journal of Chemical Thermodynamics. 89: 7–15. doi:10.1016/j.jct.2015.04.015.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0103". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Carbon dioxide". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Safety Data Sheet – Carbon Dioxide Gas – version 0.03 11/11" (PDF). AirGas.com. 12 February 2018. Archived (PDF) from the original on 4 August 2018. Retrieved 4 August 2018.
- ^ "Carbon dioxide, refrigerated liquid" (PDF). Praxair. p. 9. Archived from the original (PDF) on 29 July 2018. Retrieved 26 July 2018.
- ^ Ocean Acidification: A National Strategy to Meet the Challenges of a Changing Ocean. Washington, DC: National Academies Press. 22 April 2010. pp. 23–24. doi:10.17226/12904. ISBN 978-0-309-15359-1. Archived from the original on 5 February 2016. Retrieved 29 February 2016.
- ^ "CO2 Gas Concentration Defined". CO2 Meter. 18 November 2022. Retrieved 5 September 2023.
- ^ Eggleton T (2013). A Short Introduction to Climate Change. Cambridge University Press. p. 52. ISBN 9781107618763. Archived from the original on 23 July 2021. Retrieved 9 November 2020.
- ^ "Carbon dioxide now more than 50% higher than pre-industrial levels National Oceanic and Atmospheric Administration". www.noaa.gov. 3 June 2022. Retrieved 14 June 2022.
- ^ IPCC(2022) 기후변화 정책결정자를 위한 요약 2022: 기후변화 완화 영국 케임브리지와 미국 뉴욕의 정부간 기후변화에 관한 패널의 제6차 평가보고서에 대한 워킹그룹 III의 기여
- ^ Kaufman DG, Franz CM (1996). Biosphere 2000: protecting our global environment. Kendall/Hunt Pub. Co. ISBN 978-0-7872-0460-0.
- ^ "Food Factories". www.legacyproject.org. Archived from the original on 12 August 2017. Retrieved 10 October 2011.
- ^ IPCC (2021). "Summary for Policymakers" (PDF). Climate Change 2021: The Physical Science Basis. p. 20. Archived (PDF) from the original on 10 October 2022.
- ^ Myles, Allen (September 2020). "The Oxford Principles for Net Zero Aligned Carbon Offsetting" (PDF). Archived (PDF) from the original on 2 October 2020. Retrieved 10 December 2021.
- ^ a b Tsotsas E, Mujumdar AS (2011). Modern drying technology. Vol. 3: Product quality and formulation. John Wiley & Sons. ISBN 978-3-527-31558-1. Archived from the original on 21 March 2020. Retrieved 3 December 2019.
- ^ a b Greenwood NN, Earnshaw A (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 305–314. ISBN 978-0-08-037941-8.
- ^ Atkins P, de Paula J (2006). Physical Chemistry (8th ed.). W.H. Freeman. pp. 461, 464. ISBN 978-0-7167-8759-4.
- ^ Siegmann B, Werner U, Lutz HO, Mann R (2002). "Complete Coulomb fragmentation of CO2 in collisions with 5.9 MeV u−1 Xe18+ and Xe43+". J Phys B Atom Mol Opt Phys. 35 (17): 3755. Bibcode:2002JPhB...35.3755S. doi:10.1088/0953-4075/35/17/311. S2CID 250782825.
- ^ a b Jensen P, Spanner M, Bunker PR (2020). "The CO2 molecule is never linear−". J Mol Struct. 1212: 128087. Bibcode:2020JMoSt121228087J. doi:10.1016/j.molstruc.2020.128087. hdl:2142/107329. S2CID 216318907.
- ^ Jolly WL (1984). Modern Inorganic Chemistry. McGraw-Hill. p. 196. ISBN 978-0-07-032760-3.
- ^ Li Z, Mayer RJ, Ofial AR, Mayr H (May 2020). "From Carbodiimides to Carbon Dioxide: Quantification of the Electrophilic Reactivities of Heteroallenes". Journal of the American Chemical Society. 142 (18): 8383–8402. doi:10.1021/jacs.0c01960. PMID 32338511. S2CID 216557447.
- ^ Aresta M, ed. (2010). Carbon Dioxide as a Chemical Feedstock. Weinheim: Wiley-VCH. ISBN 978-3-527-32475-0.
- ^ Finn C, Schnittger S, Yellowlees LJ, Love JB (February 2012). "Molecular approaches to the electrochemical reduction of carbon dioxide" (PDF). Chemical Communications. 48 (10): 1392–1399. doi:10.1039/c1cc15393e. hdl:20.500.11820/b530915d-451c-493c-8251-da2ea2f50912. PMID 22116300. S2CID 14356014. Archived (PDF) from the original on 19 April 2021. Retrieved 6 December 2019.
- ^ "Gases – Densities". Engineering Toolbox. Archived from the original on 2 March 2006. Retrieved 21 November 2020.
- ^ Santoro M, Gorelli FA, Bini R, Ruocco G, Scandolo S, Crichton WA (June 2006). "Amorphous silica-like carbon dioxide". Nature. 441 (7095): 857–860. Bibcode:2006Natur.441..857S. doi:10.1038/nature04879. PMID 16778885. S2CID 4363092.
- ^ a b Holman, Jack P. (2002). Heat Transfer (9th ed.). New York, NY: McGraw-Hill Companies, Inc. pp. 600–606. ISBN 9780072406559.
- ^ a b Incropera, Frank P.; Dewitt, David P.; Bergman, Theodore L.; Lavigne, Adrienne S. (2007). Fundamentals of Heat and Mass Transfer (6th ed.). Hoboken, NJ: John Wiley and Sons, Inc. pp. 941–950. ISBN 9780471457282.
- ^ Dhingra A, Portis AR, Daniell H (April 2004). "Enhanced translation of a chloroplast-expressed RbcS gene restores small subunit levels and photosynthesis in nuclear RbcS antisense plants". Proceedings of the National Academy of Sciences of the United States of America. 101 (16): 6315–6320. Bibcode:2004PNAS..101.6315D. doi:10.1073/pnas.0400981101. PMC 395966. PMID 15067115.
(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast
- ^ Falkowski P, Knoll AH (1 January 2007). Evolution of primary producers in the sea. Elsevier, Academic Press. ISBN 978-0-12-370518-1. OCLC 845654016.
- ^ Blom TJ, Straver WA, Ingratta FJ, Khosla S, Brown W (December 2002). "Carbon Dioxide In Greenhouses". Archived from the original on 29 April 2019. Retrieved 12 June 2007.
- ^ Ainsworth EA (2008). "Rice production in a changing climate: a meta-analysis of responses to elevated carbon dioxide and elevated ozone concentration" (PDF). Global Change Biology. 14 (7): 1642–1650. Bibcode:2008GCBio..14.1642A. doi:10.1111/j.1365-2486.2008.01594.x. S2CID 19200429. Archived from the original (PDF) on 19 July 2011.
- ^ Long SP, Ainsworth EA, Leakey AD, Nösberger J, Ort DR (June 2006). "Food for thought: lower-than-expected crop yield stimulation with rising CO2 concentrations" (PDF). Science. 312 (5782): 1918–1921. Bibcode:2006Sci...312.1918L. CiteSeerX 10.1.1.542.5784. doi:10.1126/science.1114722. PMID 16809532. S2CID 2232629. Archived (PDF) from the original on 20 October 2016. Retrieved 27 October 2017.
- ^ Woodward F, Kelly C (1995). "The influence of CO2 concentration on stomatal density". New Phytologist. 131 (3): 311–327. doi:10.1111/j.1469-8137.1995.tb03067.x.
- ^ Drake BG, Gonzalez-Meler MA, Long SP (June 1997). "More Efficient Plants: A Consequence of Rising Atmospheric CO2?". Annual Review of Plant Physiology and Plant Molecular Biology. 48 (1): 609–639. doi:10.1146/annurev.arplant.48.1.609. PMID 15012276. S2CID 33415877.
- ^ Loladze I (2002). "Rising atmospheric CO2 and human nutrition: toward globally imbalanced plant stoichiometry?". Trends in Ecology & Evolution. 17 (10): 457–461. doi:10.1016/S0169-5347(02)02587-9. S2CID 16074723.
- ^ Coviella CE, Trumble JT (1999). "Effects of Elevated Atmospheric Carbon Dioxide on Insect-Plant Interactions". Conservation Biology. 13 (4): 700–712. doi:10.1046/j.1523-1739.1999.98267.x. JSTOR 2641685. S2CID 52262618.
- ^ Davey MP, Harmens H, Ashenden TW, Edwards R, Baxter R (2007). "Species-specific effects of elevated CO2 on resource allocation in Plantago maritima and Armeria maritima". Biochemical Systematics and Ecology. 35 (3): 121–129. doi:10.1016/j.bse.2006.09.004.
- ^ Davey MP, Bryant DN, Cummins I, Ashenden TW, Gates P, Baxter R, Edwards R (August 2004). "Effects of elevated CO2 on the vasculature and phenolic secondary metabolism of Plantago maritima". Phytochemistry. 65 (15): 2197–2204. Bibcode:2004PChem..65.2197D. doi:10.1016/j.phytochem.2004.06.016. PMID 15587703.
- ^ "Global Environment Division Greenhouse Gas Assessment Handbook – A Practical Guidance Document for the Assessment of Project-level Greenhouse Gas Emissions". World Bank. Archived from the original on 3 June 2016. Retrieved 10 November 2007.
- ^ Luyssaert S, Schulze ED, Börner A, Knohl A, Hessenmöller D, Law BE, et al. (September 2008). "Old-growth forests as global carbon sinks" (PDF). Nature. 455 (7210): 213–215. Bibcode:2008Natur.455..213L. doi:10.1038/nature07276. PMID 18784722. S2CID 4424430.
- ^ Falkowski P, Scholes RJ, Boyle E, Canadell J, Canfield D, Elser J, et al. (October 2000). "The global carbon cycle: a test of our knowledge of earth as a system". Science. 290 (5490): 291–296. Bibcode:2000Sci...290..291F. doi:10.1126/science.290.5490.291. PMID 11030643. S2CID 1779934.
- ^ a b Friedman D. "Toxicity of Carbon Dioxide Gas Exposure, CO2 Poisoning Symptoms, Carbon Dioxide Exposure Limits, and Links to Toxic Gas Testing Procedures". InspectAPedia. Archived from the original on 28 September 2009.
- ^ "CarbonTracker CT2011_oi (Graphical map of CO2)". esrl.noaa.gov. Archived from the original on 13 February 2021. Retrieved 20 April 2007.
- ^ "Carbon Dioxide as a Fire Suppressant: Examining the Risks". U.S. Environmental Protection Agency. Archived from the original on 2 October 2015.
- ^ "Volcano Under the City". A NOVA Production by Bonne Pioche and Greenspace for WGBH/Boston. Public Broadcasting System. 1 November 2005. Archived from the original on 5 April 2011..
- ^ Glatte Jr HA, Motsay GJ, Welch BE (1967). Carbon Dioxide Tolerance Studies (Report). Brooks AFB, TX School of Aerospace Medicine Technical Report. SAM-TR-67-77. Archived from the original on 9 May 2008. Retrieved 2 May 2008.
{{cite report}}: CS1 maint : URL(링크) 부적합 - ^ Lambertsen CJ (1971). Carbon Dioxide Tolerance and Toxicity (Report). IFEM Report. Environmental Biomedical Stress Data Center, Institute for Environmental Medicine, University of Pennsylvania Medical Center. No. 2-71. Archived from the original on 24 July 2011. Retrieved 2 May 2008.
{{cite report}}: CS1 maint : URL(링크) 부적합 - ^ a b Satish U, Mendell MJ, Shekhar K, Hotchi T, Sullivan D, Streufert S, Fisk WJ (December 2012). "Is CO2 an indoor pollutant? Direct effects of low-to-moderate CO2 concentrations on human decision-making performance" (PDF). Environmental Health Perspectives. 120 (12): 1671–1677. doi:10.1289/ehp.1104789. PMC 3548274. PMID 23008272. Archived from the original (PDF) on 5 March 2016. Retrieved 11 December 2014.
- ^ a b Allen JG, MacNaughton P, Satish U, Santanam S, Vallarino J, Spengler JD (June 2016). "Associations of Cognitive Function Scores with Carbon Dioxide, Ventilation, and Volatile Organic Compound Exposures in Office Workers: A Controlled Exposure Study of Green and Conventional Office Environments". Environmental Health Perspectives. 124 (6): 805–812. doi:10.1289/ehp.1510037. PMC 4892924. PMID 26502459.
- ^ a b "Exposure Limits for Carbon Dioxide Gas – CO2 Limits". InspectAPedia.com. Archived from the original on 16 September 2018. Retrieved 19 October 2014.
- ^ Law J, Watkins S, Alexander D (2010). In-Flight Carbon Dioxide Exposures and Related Symptoms: Associations, Susceptibility and Operational Implications (PDF) (Report). NASA Technical Report. TP–2010–216126. Archived from the original (PDF) on 27 June 2011. Retrieved 26 August 2014.
- ^ Schaefer KE, Douglas WH, Messier AA, Shea ML, Gohman PA (1979). "Effect of prolonged exposure to 0.5% CO2 on kidney calcification and ultrastructure of lungs". Undersea Biomedical Research. 6 (Suppl): S155–S161. PMID 505623. Archived from the original on 19 October 2014. Retrieved 19 October 2014.
- ^ Du B, Tandoc MC, Mack ML, Siegel JA (November 2020). "Indoor CO2 concentrations and cognitive function: A critical review". Indoor Air. 30 (6): 1067–1082. doi:10.1111/ina.12706. PMID 32557862. S2CID 219915861.
- ^ Kaplan L (4 June 2019). "Ask the doc: Does my helmet make me stupid? - RevZilla". www.revzilla.com. Archived from the original on 22 May 2021. Retrieved 22 May 2021.
- ^ Brühwiler PA, Stämpfli R, Huber R, Camenzind M (September 2005). "CO2 and O2 concentrations in integral motorcycle helmets". Applied Ergonomics. 36 (5): 625–633. doi:10.1016/j.apergo.2005.01.018. PMID 15893291.
- ^ "Ventilation for Acceptable Indoor Air Quality" (PDF). 2018. ISSN 1041-2336. Archived (PDF) from the original on 26 October 2022. Retrieved 10 August 2023.
- ^ Canada, Health (19 March 2021). "Carbon dioxide in your home". www.canada.ca. Retrieved 10 August 2023.
- ^ a b "Typical CO2 Levels at Home Tester". CO2 Meter. 8 August 2023. Retrieved 10 August 2023.
- ^ Allen JG, MacNaughton P, Satish U, Santanam S, Vallarino J, Spengler JD (June 2016). "Associations of Cognitive Function Scores with Carbon Dioxide, Ventilation, and Volatile Organic Compound Exposures in Office Workers: A Controlled Exposure Study of Green and Conventional Office Environments". Environmental Health Perspectives. 124 (6): 805–812. doi:10.1289/ehp.1510037. PMC 4892924. PMID 26502459.
- ^ Romm J (26 October 2015). "Exclusive: Elevated CO2 Levels Directly Affect Human Cognition, New Harvard Study Shows". ThinkProgress. Archived from the original on 9 October 2019. Retrieved 14 October 2019.
- ^ "Three die in dry-ice incident at Moscow pool party". BBC News. 29 February 2020. Archived from the original on 29 February 2020.
The victims were connected to Instagram influencer Yekaterina Didenko.
- ^ Rettner R (2 August 2018). "A Woman Died from Dry Ice Fumes. Here's How It Can Happen". livescience.com. Archived from the original on 22 May 2021. Retrieved 22 May 2021.
- ^ Concentrations de CO2 dans l'air intérieur et effets sur la santé (PDF) (Report) (in French). ANSES. July 2013. p. 294.
- ^ Chatzidiakou, Lia; Mumovic, Dejan; Summerfield, Alex (March 2015). "Is CO 2 a good proxy for indoor air quality in classrooms? Part 1: The interrelationships between thermal conditions, CO 2 levels, ventilation rates and selected indoor pollutants". Building Services Engineering Research and Technology. 36 (2): 129–161. doi:10.1177/0143624414566244. ISSN 0143-6244. S2CID 111182451.
- ^ Cetin, Mehmet; Sevik, Hakan (2016). "INDOOR QUALITY ANALYSIS OF CO2 FOR KASTAMONU UNIVERSITY" (PDF). Conference of the International Journal of Arts & Sciences. 9 (3): 71.
- ^ van Gardingen PR, Grace J, Jeffree CE, Byari SH, Miglietta F, Raschi A, Bettarini I (1997). "Long-term effects of enhanced CO2 concentrations on leaf gas exchange: research opportunities using CO2 springs". In Raschi A, Miglietta F, Tognetti R, van Gardingen PR (eds.). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. pp. 69–86. ISBN 978-0-521-58203-2.
- ^ Martini M (1997). "CO2 emissions in volcanic areas: case histories and hazards". In Raschi A, Miglietta F, Tognetti R, van Gardingen PR (eds.). Plant responses to elevated CO2: Evidence from natural springs. Cambridge: Cambridge University Press. pp. 69–86. ISBN 978-0-521-58203-2.
- ^ a b c d "ABG (Arterial Blood Gas)". Brookside Associates. Archived from the original on 12 August 2017. Retrieved 2 January 2017.
- ^ "How much carbon dioxide do humans contribute through breathing?". EPA.gov. Archived from the original on 2 February 2011. Retrieved 30 April 2009.
- ^ Henrickson C (2005). Chemistry. Cliffs Notes. ISBN 978-0-7645-7419-1.
- ^ Battisti-Charbonney, A.; Fisher, J.; Duffin, J. (15 June 2011). "The cerebrovascular response to carbon dioxide in humans". J. Physiol. 589 (12): 3039–3048. doi:10.1113/jphysiol.2011.206052. PMC 3139085. PMID 21521758.
- ^ Patel, S.; Miao, J.H.; Yetiskul, E.; Anokhin, A.; Majmunder, S.H. (2022). "Physiology, Carbon Dioxide Retention". National Library of Medicine. National Center for Biotechnology Information, NIH. PMID 29494063. Retrieved 20 August 2022.
- ^ Wilmshurst, Peter (1998). "ABC of oxygen". BMJ. 317 (7164): 996–999. doi:10.1136/bmj.317.7164.996. PMC 1114047. PMID 9765173.
- ^ Showstack, Randy (2013). "Carbon dioxide tops 400 ppm at Mauna Loa, Hawaii". Eos, Transactions American Geophysical Union. 94 (21): 192. Bibcode:2013EOSTr..94Q.192S. doi:10.1002/2013eo210004. ISSN 0096-3941.
- ^ Montaigne, Fen. "Son of Climate Science Pioneer Ponders A Sobering Milestone". Yale Environment 360. Yale School of Forestry & Environmental Studies. Archived from the original on 8 June 2013. Retrieved 14 May 2013.
- ^ a b "Carbon dioxide now more than 50% higher than pre-industrial levels National Oceanic and Atmospheric Administration". www.noaa.gov. 3 June 2022. Archived from the original on 5 June 2022. Retrieved 14 June 2022.
- ^ a b Eggleton, Tony (2013). A Short Introduction to Climate Change. Cambridge University Press. p. 52. ISBN 9781107618763. Archived from the original on 14 March 2023. Retrieved 14 March 2023.
- ^ a b "The NOAA Annual Greenhouse Gas Index (AGGI) – An Introduction". NOAA Global Monitoring Laboratory/Earth System Research Laboratories. Archived from the original on 27 November 2020. Retrieved 18 December 2020.
- ^ Etheridge, D.M.; L.P. Steele; R.L. Langenfelds; R.J. Francey; J.-M. Barnola; V.I. Morgan (1996). "Natural and anthropogenic changes in atmospheric CO2 over the last 1000 years from air in Antarctic ice and firn". Journal of Geophysical Research. 101 (D2): 4115–28. Bibcode:1996JGR...101.4115E. doi:10.1029/95JD03410. ISSN 0148-0227. S2CID 19674607.
- ^ IPCC (2022) 정책 입안자를 위한 요약 2023년 3월 12일 기후 변화의 웨이백 머신 2022에서 보관: 기후 변화 완화 2022년 8월 2일 영국 케임브리지 및 미국 뉴욕, 뉴욕, 뉴욕에서 보관된 기후 변화에 관한 정부간 패널의 제6차 평가 보고서에 대한 워킹 그룹 III의 기여
- ^ Petty, G.W. (2004). "A First Course in Atmospheric Radiation". Eos Transactions. 85 (36): 229–51. Bibcode:2004EOSTr..85..341P. doi:10.1029/2004EO360007.
- ^ Atkins P, de Paula J (2006). Atkins' Physical Chemistry (8th ed.). W. H. Freeman. p. 462. ISBN 978-0-7167-8759-4.
- ^ "Carbon Dioxide Absorbs and Re-emits Infrared Radiation". UCAR Center for Science Education. 2012. Archived from the original on 21 September 2017. Retrieved 9 September 2017.
- ^ Archer D (15 March 2005). "How long will global warming last?". RealClimate. Archived from the original on 4 March 2021. Retrieved 5 March 2021.
- ^ Archer D (2009). "Atmospheric lifetime of fossil fuel carbon dioxide". Annual Review of Earth and Planetary Sciences. 37 (1): 117–34. Bibcode:2009AREPS..37..117A. doi:10.1146/annurev.earth.031208.100206. hdl:2268/12933. Archived from the original on 24 February 2021. Retrieved 7 March 2021.
- ^ Joos F, Roth R, Fuglestvedt JS, Peters GP, Enting IG, Von Bloh W, et al. (2013). "Carbon dioxide and climate impulse response functions for the computation of greenhouse gas metrics: A multi-model analysis". Atmospheric Chemistry and Physics. 13 (5): 2793–2825. doi:10.5194/acpd-12-19799-2012. Archived from the original on 22 July 2020. Retrieved 7 March 2021.
- ^ "Figure 8.SM.4" (PDF). Intergovernmental Panel on Climate Change Fifth Assessment Report. p. 8SM-16. Archived (PDF) from the original on 24 March 2021. Retrieved 7 March 2021.
- ^ Zhang, Yi Ge; et al. (28 October 2013). "A 40-million-year history of atmospheric CO2". Philosophical Transactions of the Royal Society A. 371 (2001): 20130096. Bibcode:2013RSPTA.37130096Z. doi:10.1098/rsta.2013.0096. PMID 24043869.
- ^ "Climate and CO2 in the Atmosphere". Archived from the original on 6 October 2018. Retrieved 10 October 2007.
- ^ Berner RA, Kothavala Z (2001). "GEOCARB III: A revised model of atmospheric CO2 over Phanerozoic Time" (PDF). American Journal of Science. 301 (2): 182–204. Bibcode:2001AmJS..301..182B. CiteSeerX 10.1.1.393.582. doi:10.2475/ajs.301.2.182. Archived (PDF) from the original on 4 September 2011. Retrieved 15 February 2008.
- ^ Friedlingstein P, Jones MW, O'sullivan M, Andrew RM, Hauck J, Peters GP, et al. (2019). "Global Carbon Budget 2019". Earth System Science Data. 11 (4): 1783–1838. Bibcode:2019ESSD...11.1783F. doi:10.5194/essd-11-1783-2019..
- ^ Doney SC, Levine NM (29 November 2006). "How Long Can the Ocean Slow Global Warming?". Oceanus. Archived from the original on 4 January 2008. Retrieved 21 November 2007.
- ^ Terhaar, Jens; Frölicher, Thomas L.; Joos, Fortunat (2023). "Ocean acidification in emission-driven temperature stabilization scenarios: the role of TCRE and non-CO2 greenhouse gases". Environmental Research Letters. 18 (2): 024033. Bibcode:2023ERL....18b4033T. doi:10.1088/1748-9326/acaf91. ISSN 1748-9326. S2CID 255431338.
Figure 1f
- ^ a b Ocean acidification due to increasing atmospheric carbon dioxide (PDF). 2005. ISBN 0-85403-617-2.
{{cite book}}:website=무시됨(도움말) - ^ Jiang, Li-Qing; Carter, Brendan R.; Feely, Richard A.; Lauvset, Siv K.; Olsen, Are (2019). "Surface ocean pH and buffer capacity: past, present and future". Scientific Reports. 9 (1): 18624. Bibcode:2019NatSR...918624J. doi:10.1038/s41598-019-55039-4. PMC 6901524. PMID 31819102.
 텍스트가 이 소스에서 복사되었으며 크리에이티브 커먼즈 속성 4.0 국제 라이센스 2017년 10월 16일 웨이백 머신에서 보관됨
텍스트가 이 소스에서 복사되었으며 크리에이티브 커먼즈 속성 4.0 국제 라이센스 2017년 10월 16일 웨이백 머신에서 보관됨 - ^ Zhang, Y.; Yamamoto‐Kawai, M.; Williams, W.J. (16 February 2020). "Two Decades of Ocean Acidification in the Surface Waters of the Beaufort Gyre, Arctic Ocean: Effects of Sea Ice Melt and Retreat From 1997–2016". Geophysical Research Letters. 47 (3). doi:10.1029/2019GL086421. S2CID 214271838.
- ^ Beaupré-Laperrière, Alexis; Mucci, Alfonso; Thomas, Helmuth (31 July 2020). "The recent state and variability of the carbonate system of the Canadian Arctic Archipelago and adjacent basins in the context of ocean acidification". Biogeosciences. 17 (14): 3923–3942. Bibcode:2020BGeo...17.3923B. doi:10.5194/bg-17-3923-2020. S2CID 221369828.
- ^ Mitchell, Mark J.; Jensen, Oliver E.; Cliffe, K. Andrew; Maroto-Valer, M. Mercedes (8 May 2010). "A model of carbon dioxide dissolution and mineral carbonation kinetics". Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 466 (2117): 1265–1290. Bibcode:2010RSPSA.466.1265M. doi:10.1098/rspa.2009.0349.
- ^ Lupton J, Lilley M, Butterfield D, Evans L, Embley R, Olson E, et al. (2004). "Liquid Carbon Dioxide Venting at the Champagne Hydrothermal Site, NW Eifuku Volcano, Mariana Arc". American Geophysical Union. 2004 (Fall Meeting). V43F–08. Bibcode:2004AGUFM.V43F..08L.
- ^ Inagaki F, Kuypers MM, Tsunogai U, Ishibashi J, Nakamura K, Treude T, et al. (September 2006). "Microbial community in a sediment-hosted CO2 lake of the southern Okinawa Trough hydrothermal system". Proceedings of the National Academy of Sciences of the United States of America. 103 (38): 14164–14169. Bibcode:2006PNAS..10314164I. doi:10.1073/pnas.0606083103. PMC 1599929. PMID 16959888. 비디오는 다음 사이트에서 다운로드할 수 있습니다.
- ^ "Collecting and using biogas from landfills". U.S. Energy Information Administration. 11 January 2017. Archived from the original on 11 July 2018. Retrieved 22 November 2015.
- ^ "Facts About Landfill Gas" (PDF). U.S. Environmental Protection Agency. January 2000. Archived (PDF) from the original on 23 September 2015. Retrieved 4 September 2015.
- ^ a b Pierantozzi R (2001). "Carbon Dioxide". Kirk-Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.0301180216090518.a01.pub2. ISBN 978-0-471-23896-6.
- ^ Strassburger J (1969). Blast Furnace Theory and Practice. New York: American Institute of Mining, Metallurgical, and Petroleum Engineers. ISBN 978-0-677-10420-1.
- ^ Topham S (2000). "Carbon Dioxide". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a05_165. ISBN 3527306730.
- ^ "CO2 shortage: Food industry calls for government action". BBC. 21 June 2018. Archived from the original on 23 May 2021. Retrieved 24 June 2018.
- ^ "IPCC Special Report on Carbon dioxide Capture and Storage" (PDF). The Intergovernmental Panel on Climate Change. Archived from the original (PDF) on 24 September 2015. Retrieved 4 September 2015.
- ^ Morrison RT, Boyd RN (1983). Organic Chemistry (4th ed.). Allyn and Bacon. pp. 976–977. ISBN 978-0-205-05838-9.
- ^ Badwal SP, Giddey SS, Munnings C, Bhatt AI, Hollenkamp AF (24 September 2014). "Emerging electrochemical energy conversion and storage technologies". Frontiers in Chemistry. 2: 79. Bibcode:2014FrCh....2...79B. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
- ^ Whiting D, Roll M, Vickerman L (August 2010). "Plant Growth Factors: Photosynthesis, Respiration, and Transpiration". CMG GardenNotes. Colorado Master Gardener Program. Archived from the original on 2 September 2014. Retrieved 10 October 2011.
- ^ Waggoner PE (February 1994). "Carbon dioxide". How Much Land Can Ten Billion People Spare for Nature?. Archived from the original on 12 October 2011. Retrieved 10 October 2011.
- ^ Stafford N (August 2007). "Future crops: the other greenhouse effect". Nature. 448 (7153): 526–528. Bibcode:2007Natur.448..526S. doi:10.1038/448526a. PMID 17671477. S2CID 9845813.
- ^ 영국 식품 표준청:
- ^ 미국 식품의약국:
- ^ 오스트레일리아 뉴질랜드 식품 표준 코드"Standard 1.2.4 – Labelling of ingredients". Archived from the original on 19 January 2012. Retrieved 27 October 2011.
- ^ Futurific Leading Indicators Magazine. Vol. 1. CRAES LLC. ISBN 978-0-9847670-1-4. Archived from the original on 15 August 2021. Retrieved 9 November 2020.
- ^ Vijay GP (25 September 2015). Indian Breads: A Comprehensive Guide to Traditional and Innovative Indian Breads. Westland. ISBN 978-93-85724-46-6.[영구 데드링크]
- ^ "Scientists Discover Protein Receptor For Carbonation Taste". ScienceDaily. 16 October 2009. Archived from the original on 29 March 2020. Retrieved 29 March 2020.
- ^ Coghlan A (3 February 2018). "A more humane way of slaughtering chickens might get EU approval". New Scientist. Archived from the original on 24 June 2018. Retrieved 24 June 2018.
- ^ "What is CO2 stunning?". RSPCA. Archived from the original on 9 April 2014.
- ^ Campbell A (10 March 2018). "Humane execution and the fear of the tumbril". New Scientist. Archived from the original on 24 June 2018. Retrieved 24 June 2018.
- ^ Nordestgaard BG, Rostgaard J (February 1985). "Critical-point drying versus freeze drying for scanning electron microscopy: a quantitative and qualitative study on isolated hepatocytes". Journal of Microscopy. 137 (Pt 2): 189–207. doi:10.1111/j.1365-2818.1985.tb02577.x. PMID 3989858. S2CID 32065173.
- ^ "Types of Fire Extinguishers". The Fire Safety Advice Centre. Archived from the original on 28 June 2021. Retrieved 28 June 2021.
- ^ 미국방화협회 규약 12.
- ^ 화재억제제로서의 이산화탄소: 위험성 검토, US EPA. 2000
- ^ "Appendix A: CO2 for use in enhanced oil recovery (EOR)". Accelerating the uptake of CCS: industrial use of captured carbon dioxide. 20 December 2011. Archived from the original on 28 April 2017. Retrieved 2 January 2017.
{{cite book}}:website=무시됨(도움말) - ^ Austell JM (2005). "CO2 for Enhanced Oil Recovery Needs – Enhanced Fiscal Incentives". Exploration & Production: The Oil & Gas Review. Archived from the original on 7 February 2012. Retrieved 28 September 2007.
- ^ "Enhanced coal bed methane recovery". ETH Zurich. 31 August 2006. Archived from the original on 6 July 2011.
- ^ Clayton M (11 January 2006). "Algae – like a breath mint for smokestacks". The Christian Science Monitor. Archived from the original on 14 September 2008. Retrieved 11 October 2007.
- ^ Atsumi S, Higashide W, Liao JC (December 2009). "Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde". Nature Biotechnology. 27 (12): 1177–1180. doi:10.1038/nbt.1586. PMID 19915552. S2CID 1492698.
- ^ Cobb S, Badiani V, Dharani A, Wagner A, Zacarias S, Oliveira AR, et al. (28 February 2022). "Fast CO2 hydration kinetics impair heterogeneous but improve enzymatic CO2 reduction catalysis". Nature Chemistry. 14 (4): 417–424. Bibcode:2022NatCh..14..417C. doi:10.1038/s41557-021-00880-2. ISSN 1755-4349. PMC 7612589. PMID 35228690. S2CID 247160910.
- ^ Edwardes Moore E, Cobb SJ, Coito AM, Oliveira AR, Pereira IA, Reisner E (January 2022). "Understanding the local chemical environment of bioelectrocatalysis". Proceedings of the National Academy of Sciences of the United States of America. 119 (4): e2114097119. Bibcode:2022PNAS..11914097E. doi:10.1073/pnas.2114097119. PMC 8795565. PMID 35058361.
- ^ "Clean Way To Turn CO2 Into Fuel Inspired by Nature". Applied Sciences from Technology Networks. 1 March 2022. Retrieved 2 March 2022.
- ^ "The Coca-Cola Company Announces Adoption of HFC-Free Insulation in Refrigeration Units to Combat Global Warming". The Coca-Cola Company. 5 June 2006. Archived from the original on 1 November 2013. Retrieved 11 October 2007.
- ^ "Modine reinforces its CO2 research efforts". R744.com. 28 June 2007. Archived from the original on 10 February 2008.
- ^ TCE, the Chemical Engineer. Institution of Chemical Engineers. 1990. Archived from the original on 17 August 2021. Retrieved 2 June 2020.
- ^ a b "AVMA guidelines for the euthanasia of animals: 2020 Edition" (PDF). American Veterinary Medical Association. 2020. Archived (PDF) from the original on 1 February 2014. Retrieved 13 August 2021.
- ^ Harris D (September 1910). "The Pioneer in the Hygiene of Ventilation". The Lancet. 176 (4542): 906–908. doi:10.1016/S0140-6736(00)52420-9. Archived from the original on 17 March 2020. Retrieved 6 December 2019.
- ^ Almqvist E (2003). History of industrial gases. Springer. p. 93. ISBN 978-0-306-47277-0.
- ^ Priestley J, Hey W (1772). "Observations on Different Kinds of Air". Philosophical Transactions. 62: 147–264. doi:10.1098/rstl.1772.0021. S2CID 186210131. Archived from the original on 7 June 2010. Retrieved 11 October 2007.
- ^ Davy H (1823). "On the Application of Liquids Formed by the Condensation of Gases as Mechanical Agents". Philosophical Transactions. 113: 199–205. doi:10.1098/rstl.1823.0020. JSTOR 107649.
- ^ Thilorier AJ (1835). "Solidification de l'Acide carbonique". Comptes Rendus. 1: 194–196. Archived from the original on 2 September 2017. Retrieved 1 September 2017.
- ^ Thilorier AJ (1836). "Solidification of carbonic acid". The London and Edinburgh Philosophical Magazine. 8 (48): 446–447. doi:10.1080/14786443608648911. Archived from the original on 2 May 2016. Retrieved 15 November 2015.
- ^ 가끔 19번째 C 텍스트에서 "초악-담프"를 쓰곤 합니다.
- ^ Haldane, John (1894). "Notes of an Enquiry into the Nature and Physiological Action of Black-Damp, as Met with in Podmore Colliery, Staffordshire, and Lilleshall Colliery, Shropshire". Proceedings of the Royal Society of London. 57: 249–257. Bibcode:1894RSPS...57..249H. JSTOR 115391.
외부 링크
| 라이브러리 리소스정보 이산화탄소 |



![{\displaystyle K_{\mathrm {h} }={\frac {{\ce {[H2CO3]}}}{{\ce {[CO2_{(aq)}]}}}}=1.70\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b01be634ec0c3d83cbf3aa2c71bbd51b9ce0e26)
![{\displaystyle K_{\mathrm {a1} }={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6013fac05dba06751345e4d824c525ed2c43b12)
![{\displaystyle K_{\mathrm {a1} }{\rm {(apparent)}}={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3] + [CO2_{(aq)}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ae2fa07440c037d6054ce4e7ef95c15c59264e7)


