위상도
Phase diagram물리화학, 공학, 광물학 및 재료과학의 위상도는 열역학적으로 다른 위상(예: 고체, 액체 또는 기체 상태)이 평형 상태에서 발생하고 공존하는 조건(압력, 온도, 부피 등)을 보여주는 데 사용되는 차트의 일종이다.
개요
위상 다이어그램의 공통 구성요소는 평형선 또는 위상 경계선이며, 이는 평형에서 여러 위상이 공존할 수 있는 조건을 표시하는 선이다.위상 전이는 평형선을 따라 발생합니다.준안정 위상은 일반적으로 발생하지만 평형 위상이 아니므로 위상 다이어그램에 표시되지 않는다.
트리플 포인트는 위상 다이어그램에서 평형선이 교차하는 지점입니다.트리플 포인트는 3개의 다른 위상이 공존할 수 있는 조건을 나타냅니다.예를 들어 수상도에는 고형수, 액체수 및 기체수가 안정된 평형(273.16K, 부분증기압 611.657Pa)으로 공존할 수 있는 단일 온도 및 압력에 대응하는 3중점이 있다.
솔리더스는 물질이 고체 상태에서 안정적인 온도입니다.액상온도는 액상상태에서 물질이 안정되어 있는 온도이다.솔리더스와 리퀴드투스 사이에는 틈이 있을 수 있습니다. 틈새 내에서 물질은 결정과 액체의 혼합물로 구성됩니다('슬러리'[1]처럼).
작동 유체는 종종 위상 다이어그램의 모양에 따라 분류됩니다.
종류들
이차원도
압력 대 온도

가장 간단한 위상도는 물과 같은 단일 단순한 물질의 압력-온도 다이어그램입니다.축은 압력과 온도에 대응합니다.위상 다이어그램은 압력-온도 공간에서 고체, 액체 및 기체의 3상 사이의 평형선 또는 위상 경계를 보여줍니다.
위상 다이어그램의 곡선은 자유 에너지(및 기타 파생 특성)가 비분석적으로 변하는 점을 나타냅니다. 좌표(이 예에서는 온도 및 압력)에 대한 도함수가 불연속적으로(급작스럽게 변화합니다.예를 들어, 얼음으로 채워진 용기의 열 용량은 용기의 용융점을 지나 가열됨에 따라 급격히 변화합니다.자유 에너지가 분석되는 열린 공간은 단상 영역에 해당합니다.단상 영역은 비분석적 동작의 라인에 의해 분리되며, 여기서 위상 천이가 발생하고 이를 위상 경계라고 합니다.
오른쪽 그림에서는 액체와 기체의 위상경계가 무한히 계속되지 않습니다.대신 임계점이라고 불리는 위상 다이어그램의 한 지점에서 끝납니다.이는 극도로 높은 온도와 압력에서 초임계 유체라고 알려진 액상과 기체상이 구별되지 [2]않는다는 사실을 반영합니다.물에서 임계점은 약 Tc = 647.096K(373.946°C), pc = 22.064MPa(217.75atm), θc = 356kg/[3]m에서3 발생한다.
액체-가스 임계점의 존재는 단상 영역의 라벨 표시에 약간의 모호성을 드러낸다.액상에서 기체상으로 갈 때는 보통 위상경계를 넘지만 임계점의 오른쪽으로 가면 절대 경계를 넘지 않는 경로를 선택할 수 있다.따라서 액상과 기체상은 서로 연속적으로 혼합될 수 있습니다.고체-액상 경계는 고체와 액체상의 대칭 그룹이 [4]동일한 경우에만 임계점으로 끝날 수 있습니다.
대부분의 물질의 경우, 위상 다이어그램의 고액상 경계(또는 융접 곡선)는 압력에 따라 녹는점이 증가하도록 양의 기울기를 가진다.이것은 고체상이 [5]액체상보다 밀도가 높을 때 항상 해당됩니다.특정 물질에 가해지는 압력이 클수록 물질의 분자가 서로 밀착되어 물질의 분자간 힘의 영향이 커진다.따라서 고체의 고정된 패턴에서 벗어나 액상으로 진입할 수 있는 충분한 에너지를 분자가 가질 수 있도록 더 높은 온도를 필요로 한다.액체-가스 위상 [6]변화에도 유사한 개념이 적용된다.
물은 압력에 따라 녹는점이 감소하도록 음의 기울기와 함께 고체-액체 경계를 갖는 예외이다.이것은 얼음(고체 물)이 액체 물보다 밀도가 낮기 때문에 발생하는데, 이는 얼음이 물에 뜬다는 사실에서 알 수 있다.분자 수준에서, 얼음은 물 [5]분자의 분리가 더 필요한 수소 결합의 더 광범위한 네트워크를 가지고 있기 때문에 밀도가 낮다.다른 예외로는 안티몬과 비스무트가 [7][8]있다.
50GPa(500,000atm) 이상의 매우 높은 압력에서 액체 질소는 고분자 형태로 액상 전이를 거치고 동일한 압력에서 고체 질소보다 밀도가 높아집니다.따라서 이러한 조건 하에서 고체 질소는 [9]액체에도 떠다닌다.
기울기 dP/dT 값은 융해(융해)[10]에 대한 Clausius-Clapeyron 방정식으로 구한다.
여기서 δH는fus 항상 양인 융해열이며, δV는fus 융해 부피 변화이다.대부분의 물질에서 δV는fus 양수이므로 기울기가 양수이다.그러나 물과 기타 예외의 경우 δV가fus 음수이므로 기울기가 음수입니다.
기타 열역학 특성
온도 및 압력 외에 다른 열역학 특성을 위상 다이어그램에 그래프로 표시할 수 있습니다.이러한 열역학 특성에는 특정 부피, 특정 엔탈피 또는 특정 엔트로피가 포함된다.예를 들어, 물/증기 또는 냉매에 대한 온도 대 특정 엔트로피(T 대 s)의 단일 성분 그래프는 카르노 사이클, 랭킨 사이클 또는 증기 압축 냉동 사이클과 같은 열역학 사이클을 설명하기 위해 일반적으로 사용됩니다.
2차원 다이어그램의 수평축과 수직축에 2개의 열역학적 양을 표시할 수 있다.추가 열역학적 양은 각각 곡선, 직선 또는 곡선 및 직선 조합의 일련의 선으로 증분하여 설명할 수 있습니다.각 Iso-line은 일정한 값에서의 열역학적 양을 나타냅니다.
| 증기에 대한 엔탈피-황도(h-s) | 증기 압력-엔탈피(p-h) 다이어그램 | 증기의 온도 엔트로피(T–s)도 |
3차원 도표
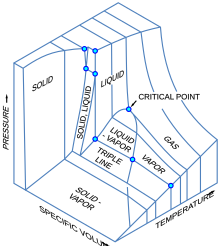
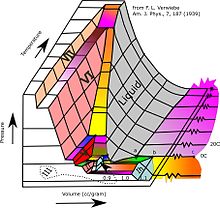
3개의 [11][12]열역학적 양을 보여주는 3차원(3D) 그래프를 상상할 수 있습니다.예를 들어 단일 구성요소의 경우 3D 데카르트 좌표 유형 그래프는 한 축에 온도(T), 두 번째 축에 압력(p), 세 번째 축에 특정 볼륨(v)을 표시할 수 있습니다.이러한 3D 그래프를 p-v-T 다이어그램이라고 부르기도 합니다.평형상태는 3D로 곡면에 곡선으로 나타나며, 고체와 액체, 고체와 증기, 또는 액체와 증기가 평형상태로 공존하는 영역이다.삼중선이라고 불리는 표면의 선은 고체, 액체, 그리고 증기가 모두 평형으로 공존할 수 있는 곳입니다.임계점은 3D 위상 다이어그램에서도 지표면에 한 점으로 남아 있습니다.
3D p–v–T 그래프는 수직 및 수평 축의 압력과 온도를 나타내는 직교 투영으로 3D 그림을 표준 2D 압력-온도 다이어그램으로 축소합니다.이렇게 하면 고체-증기, 고체-액체 및 액체-증기 표면은 삼중점에서 만나는 세 개의 해당 곡선으로 붕괴됩니다. 즉, 삼중선의 접힌 직각 투영입니다.
이원 혼합물
특히 둘 이상의 순수한 구성요소가 존재하는 경우 훨씬 더 복잡한 유형의 위상도를 구성할 수 있습니다.이 경우 집중력이 중요한 변수가 됩니다.물질의 위상에 대한 3개 이상의 변수의 영향을 보여주는 2차원 이상의 위상도를 구성할 수 있다.위상 다이어그램은 온도, 압력 및 조성 외에 다른 변수(예: 인가된 전기장 또는 자기장 강도)를 사용할 수 있으며, 세 가지 이상의 물질 상태를 갖는 물질도 포함할 수 있습니다.

위상도의 한 가지 유형은 오른쪽에 표시된 것처럼 이진 위상도라고 하는 2진 혼합물의 두 물질의 상대 농도에 대한 온도를 표시합니다.이러한 혼합물은 고체용액, 공정용액 또는 건축용액 중 하나가 될 수 있습니다.이 두 유형의 혼합물은 매우 다른 그래프를 생성합니다.또 다른 형태의 이진 위상도는 두 가지 성분, 즉 화학 화합물의 혼합물에 대한 끓는점 도표이다.대기압과 같은 특정 압력의 두 특정 휘발성 성분의 경우, 끓는점 다이어그램은 온도에 따라 주어진 액체 조성과 평형 상태에 있는 증기(가스) 조성을 보여줍니다.전형적인 바이너리 비등점도에서는 온도는 수직축에, 혼합조성은 수평축에 각각 플롯되어 있다.
성분 A와 성분 B를 "이상적" 용액에 포함하는 두 가지 성분도를 나타냅니다.액상기상도의 구성은 라울트의 법칙을 따르는 이상적인 액체 용액과 달튼의 부분압 법칙을 따르는 이상적인 기체 혼합물을 가정한다.액체에서 기체로 일정한 압력으로 연결되는 연결선은 각각 [13]액체와 기체의 두 가지 구성을 나타냅니다.
오른쪽에는 비공생성 혼합물 중 가상 성분 1, 2를 가진 간단한 예도가 나타나 있다.순수한 성분의 끓는점에 합류하는 두 개의 별도의 곡선이 있다는 것은 보통 증기가 평형 상태에 있는 액체 성분과 같지 않다는 것을 의미합니다.자세한 내용은 증기-액체 평형을 참조하십시오.
상술한 유형의 위상도 외에 많은 조합이 있습니다.위상 다이어그램의 주요 특징 중 일부는 고체가 액체로 직접 변환되는 합동점을 포함합니다.또한 냉각 중에 두 개의 고체상이 하나의 고체상으로 결합되는 지점인 peritectoid도 있습니다.냉각 중에 하나의 고체상이 2개의 고체상으로 변하는 것을 공정상이라고 합니다.
기술적으로 매우 중요한 복잡한 위상도는 7% 미만의 탄소에 대한 철-탄소 시스템의 위상도이다(강철 참조).
이러한 다이어그램의 x축은 혼합물의 농도 변수를 나타냅니다.혼합물은 일반적으로 희석과는 거리가 멀고 온도의 함수로써 밀도가 알려져 있지 않기 때문에 바람직한 농도 측정은 몰 분율이다.몰 농도 같은 부피 기반 측정은 권장할 수 없을 것이다.
삼원 위상도
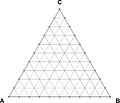
3개의 구성요소가 있는 시스템을 삼원계라고 합니다.일정한 압력에서 독립 변수의 최대 수는 온도와 두 개의 농도 값 등 3개입니다.3차 평형을 표현하기 위해서는 3차원 위상도가 필요하다.종종 이러한 다이어그램은 수평면과 이 평면에 수직인 축의 온도를 사용하여 그려집니다.삼원계에서 구성을 표현하기 위해 깁스 삼각형이라고 불리는 등변 삼각형이 사용된다.
온도 척도는 합성 삼각형에 수직인 축에 표시됩니다.따라서 3원 위상도의 공간 모델은 직각-삼각 프리즘이다.프리즘 변은 대응하는 바이너리 시스템 A-B, B-C, A-C를 나타냅니다.
그러나 삼원계에서 위상 평형을 나타내는 가장 일반적인 방법은 1) 액상, 솔리더스, 용매 표면의 농도 삼각형 ABC에 투영, 2) 등온 단면, 3) 수직 [14]단면이다.
크리스탈
다형성 및 다형성 물질은 다결정상 또는 비정질상을 가지며, 고체상, 액체상, 기체상과 유사한 방식으로 그래프로 나타낼 수 있다.
메소페이즈
어떤 유기물들은 고체와 액체 사이의 중간 상태를 통과한다; 이러한 상태를 중수소라고 한다.디스플레이 소자를 가능하게 하고, 이른바 액정 기술을 통해 상업적으로 중요해진 메소페이즈에 관심이 쏠리고 있다.위상도는 메소포스의 [16]발생을 설명하는 데 사용됩니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Predel, Bruno; Hoch, Michael J. R.; Pool, Monte (2004). Phase Diagrams and Heterogeneous Equilibria: A Practical Introduction. Springer. ISBN 978-3-540-14011-5.
- ^ Papon, P.; Leblond, J.; Meijer, P. H. E. (2002). The Physics of Phase Transition : Concepts and Applications. Berlin: Springer. ISBN 978-3-540-43236-4.
- ^ 국제수증기물성협회, 2001년, 5페이지 "물리기본상수 사용지침"
- ^ Landau, Lev D.; Lifshitz, Evgeny M. (1980). Statistical Physics. Vol. 5 (3rd ed.). Butterworth-Heinemann. ISBN 978-0-7506-3372-7.
- ^ a b Whitten, Kenneth W.; Galley, Kenneth D.; Davis, Raymond E. (1992). General Chemistry (4th ed.). Saunders College Publishing. p. 477. ISBN 9780030751561.
- ^ Dorin, Henry; Demmin, Peter E.; Gabel, Dorothy L. (1992). Chemistry : The Study of Matter Prentice (Fourth ed.). Prentice Hall. pp. 266–273. ISBN 978-0-13-127333-7.
- ^ Averill, Bruce A.; Eldredge, Patricia (2012). "11.7 Phase Diagrams". Principles of General Chemistry. Creative Commons.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry. Principles and Modern Applications (8th ed.). Prentice Hall. p. 495. ISBN 0-13-014329-4.
- ^ Mukherjee, Goutam Dev; Boehler, Reinhard (30 November 2007). "High-Pressure Melting Curve of Nitrogen and the Liquid-Liquid Phase Transition". Physical Review Letters. 99 (22): 225701. Bibcode:2007PhRvL..99v5701M. doi:10.1103/PhysRevLett.99.225701. PMID 18233298.
- ^ Laidler, Keith J.; Meiser, John H. (1982). Physical Chemistry. Benjamin/Cummings. pp. 173–74.
- ^ Zemansky, Mark W.; Dittman, Richard H. (1981). Heat and Thermodynamics (6th ed.). McGraw-Hill. Figs. 2-3, 2-4, 2-5, 10-10, P10-1. ISBN 978-0-07-072808-0.
- ^ 웹 애플릿: 물, 이산화탄소 및 암모니아에 대한 3D 위상도.에 기재되어 있습니다.
- ^ David, Carl W. (2022). "The phase diagram of a non-ideal mixture's p − v − x 2-component gas=liquid representation, including azeotropes". Chemistry Education Materials. University of Connecticut. Retrieved 9 April 2022.
- ^ Alan Prince, "Alloy Phase Equalria", Elsevier, 290pp (1966) ISBN 978-0444404626
- ^ 유사한 도표는 현장의 물 구조와 과학에서 찾을 수 있다.마틴 채플린이 2015년 7월 2일에 접속한 '물 구조와 과학 사이트'
- ^ Chandrasekhar, Sivaramakrishna (1992). Liquid Crystals (2nd ed.). Cambridge University Press. pp. 27–29, 356. ISBN 978-0-521-41747-1.
외부 링크
- 탄화철 위상도의 예
- 단계도 작성 방법
- 단계 변경:단계도: 파트 1
- 평형 Fe-C 위상도
- 무연 납땜 단계도
- DoITPoMS 단계도 라이브러리
- DoITPoMS 교육 및 학습 패키지– "단계도 및 확정"
- 단계도:지혜의 시작 – 오픈 액세스 저널 기사
- 바이노달 곡선, 타이 라인, 레버 규칙 및 불변점 – 위상도를 읽는 방법(TIB AV-Portal에서 SciFox의 비디오)
- 합금 위상도 국제위원회(APDIC)