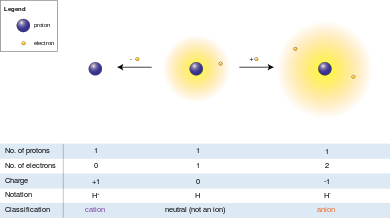
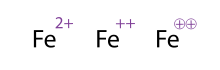이온
Ion이온(/aaɪ.nn, -nn/)[1]은 순전하를 가진 원자 또는 분자이다.
전자의 전하는 관례상 음으로 간주되며, 이 전하는 관례상 양으로 간주되는 양성자의 전하와 동일하고 반대이다.이온의 총 전자 수가 양성자 수와 동일하지 않기 때문에 이온의 순 전하가 0이 아니다.
양이온은 양성자보다 적은[2] 전자를 가진 양전하 이온인 반면 음이온은 양성자보다 [3]더 많은 전자를 가진 음전하 이온입니다.반대되는 전하가 정전기력에 의해 서로 끌어당겨지기 때문에 양이온과 음이온이 서로 끌어당겨 쉽게 이온 화합물을 형성한다.
하나의 원자만으로 이루어진 이온은 원자이온 또는 단원자이온이라고 불리며, 두 개 이상의 원자는 분자이온 또는 다원자이온을 형성한다.유체(가스 또는 액체)의 물리적 이온화의 경우, "이온 쌍"은 생성된 각 쌍이 자유 전자와 [4]양이온으로 구성된 자발적인 분자 충돌에 의해 생성됩니다.이온은 또한 액체 중의 소금 용해와 같은 화학적 상호작용이나 전도성 용액을 통해 직류 전류를 통과시키고 이온화를 통해 양극을 용해시키는 다른 수단에 의해 생성된다.
발견 이력
이온이라는 단어는 "가자"라는 뜻의 그리스 중성자 현재 분사형(그리스어: έια),)에서 유래되었다.A cation is something that moves down (Greek: κάτω pronounced kato, meaning "down") and an anion is something that moves up (Greek: ano ἄνω, meaning "up").이온이 반대 전하의 전극을 향해 움직이기 때문에 그렇게 불립니다.이 용어는 영국의 물리학자이자 화학자인 마이클 패러데이에 [5]의해 1834년 한 전극에서 수성 매체를 통해 [6][7]다른 전극으로 이동하는 알려지지 않은 종을 위해 도입되었습니다.패러데이는 이 종들의 성질을 몰랐지만, 금속이 한 전극에서 용액으로 용해되고 들어간 이후 다른 전극의 용액에서 새로운 금속이 나왔기 때문에 어떤 종류의 물질이 용액에서 전류로 이동했다는 것을 알았다.이것은 물질을 한 곳에서 다른 곳으로 운반한다.패러데이에 대응하여, 휴웰은 양극과 음극뿐만 아니라 음이온과 양이온이라는 단어를 각각의 [5]전극에 끌어당기는 이온으로 만들었다.
스반테 아레니우스는 1884년 논문에서 고체 결정성 소금이 용해되면 한 쌍의 하전 입자로 분리된다는 사실을 설명했고, 이로 인해 1903년 노벨 [8]화학상을 수상하게 되었다.아레니우스의 설명은 용액을 형성할 때 소금이 패러데이의 이온으로 분해된다는 것인데, 그는 전류가 [9][10][11]없어도 이온이 형성된다는 것이었다.
특성.
가스 상태의 이온은 반응성이 매우 높으며 반대 전하의 이온과 빠르게 상호작용하여 중성 분자 또는 이온 염을 생성합니다.이온은 또한 액체 또는 고체 상태에서 생성되는데, 이온은 용해된 이온(예를 들어 물)과 상호작용을 하기 위해 서로 멀어질 때 에너지와 엔트로피의 조합을 수반하는 이유로 더 안정적인 용해된 이온은 액체 또는 고체 상태에서 생성됩니다.이 안정된 종들은 낮은 온도에서 환경에서 더 흔하게 발견된다.일반적인 예로는 바닷물에 존재하는 이온이 있는데, 이 이온들은 용해된 소금에서 유래한다.
하전물체로서 이온은 반대되는 전하(양전하에서 음전하로, 그 반대)에 끌리고, 같은 전하로 반발한다.그들이 움직일 때, 그들의 궤적은 자기장에 의해 꺾일 수 있다.
전자는 물질 파동처럼 질량이 작아 공간을 채우는 특성이 크기 때문에 전자를 가진 원자와 분자의 크기를 결정합니다.따라서 음이온(음전하 이온)은 전자 구름에 의해 크기가 결정되기 때문에 과잉 전자가 서로 밀어내고 이온의 물리적 크기를 더하기 때문에 모 분자 또는 원자보다 크다.양이온은 전자 구름의 크기가 작기 때문에 대응하는 부모 원자 또는 분자보다 작습니다.하나의 특정 양이온(수소의 양이온)은 전자를 포함하지 않으므로, 부모 수소 원자보다 훨씬 작은 단일 양성자로 구성된다.
음이온과 양이온
양성자 위의 전하가 전자 위의 전하와 크기가 같기 때문에, 이온 위의 순 전하는 이온의 양성자 수에서 전자 수를 뺀 것과 같습니다.
안 음이온(-) (/synn'a)δn/ANN-eye-δn은 그리스어 [12]δα(αno)에서 양성자보다 더 많은 전자를 가진 이온으로, (전자가 음전하되고 양성자가 [13]양전하되기 때문에) 순 음전하를 준다.
양이온(+) (/'케트'a')δn/ KAT-eye-δn은 그리스어 δδδ([14]kato)에서 양성자보다 적은 전자를 가진 이온으로,[15] 양전하를 부여한다.
여러 전하를 가진 이온에 사용되는 추가 이름이 있습니다.예를 들어 -2 전하의 이온을 다이온이라고 하고 +2 전하의 이온을 디온이라고 한다.zwitterion은 분자 [16]내의 다른 위치에 양전하와 음전하를 가진 중성 분자입니다.
양이온과 음이온은 이온 반지름으로 측정되며 상대적인 크기가 다릅니다. " 양이온은 대부분 반지름이 10m(10cm−8) 미만입니다−10.하지만 대부분의 음이온은 크고 지구의 음이온도 가장 흔합니다. 산소입니다.이 사실로 볼 때 결정의 공간의 대부분은 음이온이 차지하고 있으며 양이온이 [17]음이온과 음이온 사이의 공간에 들어맞는다는 것이 명백합니다.
음이온과 양이온이라는 용어는 1834년 마이클 패러데이가 윌리엄 휴웰과 상의한 후 도입했다.
자연발생
이온은 자연[citation needed] 어디에나 존재하며 태양의 발광에서 지구 전리층의 존재까지 다양한 현상을 일으킨다.이온 상태의 원자는 중성 원자와 다른 색을 띠기 때문에 금속 이온에 의한 빛 흡수는 원석의 색을 나타낸다.무기화학 및 유기화학(생화학 포함)에서 물과 이온의 상호작용은 매우 중요합니다[citation needed]. 예를 들어, 아데노신 삼인산(ATP)[clarification needed]의 분해를 촉진하는 에너지입니다.다음 섹션에서는 이온이 현저하게 특징지어지는 상황에 대해 설명합니다. 이온은 천문학에서 현미경에 이르기까지 물리적 길이 축척이 감소하는 형태로 배열됩니다.
관련 기술
이온은 다양한 이온원을 사용하여 화학적으로 준비될 수 있으며, 일반적으로 고전압 또는 온도를 수반합니다.이것들은 질량 분석기, 광학 발광 분광기, 입자 가속기, 이온 주입기, 이온 엔진과 같은 다양한 장치에 사용됩니다.
반응성 하전 입자로서, 그것들은 미생물을 교란시켜 공기 정화 및 연기 감지기와 같은 가정 용품에도 사용된다.
유기체에서의 신호 전달과 대사가 막을 가로지르는 정밀한 이온 구배에 의해 제어되기 때문에, 이 구배의 교란은 세포 사멸에 기여한다.이것은 이온 채널 그라미시딘과 암포테리신(진균제)을 포함한 자연 및 인공 바이오시드에 의해 이용되는 일반적인 메커니즘입니다.
무기 용해 이온은 수질 지표로 널리 알려진 총 용해 고형물의 성분입니다.
이온화 방사선 검출
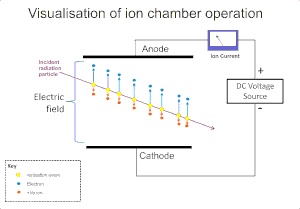
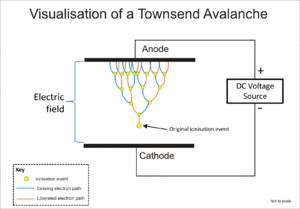
가스에 대한 방사선의 이온화 효과는 알파, 베타, 감마, X선과 같은 방사선의 검출에 광범위하게 사용된다.이러한 기기의 원래 이온화 이벤트는 가스 분자에 대한 방사선에 의한 이온 충격에 의해 "이온 쌍" 즉, 양이온과 자유 전자를 형성합니다.이온화 챔버는 이러한 검출기 중 가장 단순하며,[4] 전계 적용을 통해 기체 내에서 직접 이온화에 의해 생성된 모든 전하를 수집합니다.
가이거-뮐러 튜브와 비례 카운터는 모두 타운센드 눈사태로 알려진 현상을 사용하여 자유 전자가 이온 충격에 의해 더 많은 전자를 방출할 수 있는 충분한 에너지를 전기장에 의해 공급되는 캐스케이드 효과를 통해 원래의 이온화 이벤트의 효과를 곱한다.
화학
충전 상태 표시
이온의 화학식을 쓸 때, 이온의 순 전하를 분자/원자 화학 구조 바로 뒤에 윗첨자로 표기한다.순전하는 기호 앞의 크기로 작성됩니다. 즉, 이중으로 충전된 양이온은 +2가 아닌 2+로 표시됩니다.단, 단일 하전 분자/atom의 경우 전하 크기는 생략된다. 예를 들어 나트륨 양이온은 Na로 표시되고+ Na는 표시되지1+ 않는다.
여러 전하를 가진 분자/원자를 보여주는 대안(그리고 허용 가능한) 방법은 여러 번 부호를 끌어내는 것인데, 이는 전이 금속에서 종종 볼 수 있다.화학자들은 가끔 표지판에 동그라미를 친다; 이것은 단지 장식적인 것일 뿐 화학적 의미를 바꾸지 않는다.그림에서 나타내는 Fe, Fe++, Fe의⊕⊕ 3가지2+
표현은 모두 동일합니다.

단원자 이온은 특히 분광학에서 로마 숫자로 표시되기도 한다. 예를 들어 위에서 본 Fe2+
예는 Fe(II) 또는II Fe라고 한다.로마 숫자는 원소의 공식 산화 상태를 나타내며, 위 첨자로 표시된 인도-아랍 숫자는 순 전하를 나타냅니다.따라서 두 표기법은 단원자 이온과 교환할 수 있지만 로마 숫자는 다원자 이온에 적용할 수 없습니다.그러나, 개별 금속 중심에 대한 표기법을 다원자 복합체와 혼합할 수 있다(우라닐 이온 예에서 볼 수 있음).
서브클래스
만약 이온이 짝을 이루지 않은 전자를 포함한다면, 그것은 라디칼 이온이라고 불립니다.전하를 띠지 않은 라디칼처럼 라디칼 이온은 매우 반응적입니다.탄산염과 황산염과 같은 산소를 포함하는 다원자 이온은 옥시 음이온이라고 불립니다.적어도 하나의 탄소와 수소 결합을 포함하는 분자 이온은 유기 이온이라고 불립니다.유기 이온의 전하가 공식적으로 탄소에 집중되는 경우, 이를 카르보케이션(양전하인 경우) 또는 카르보니온(음전하인 경우)이라고 한다.
형성
단원자 이온 생성
단원자 이온은 원자의 원자가 껍질(가장 바깥쪽 전자 껍질)에 대한 전자의 득실에 의해 형성됩니다.원자의 내부 껍질은 양전하를 띤 원자핵에 단단히 결합되어 있는 전자들로 채워져 있어서, 이러한 종류의 화학적 상호작용에 참여하지 않는다.중성 원자 또는 분자로부터 전자를 얻거나 잃는 과정을 이온화라고 합니다.
원자는 방사선에 의한 충격에 의해 이온화될 수 있지만, 화학에서 마주치는 보다 일반적인 이온화 과정은 원자 또는 분자 간의 전자 이동이다.이러한 전송은 보통 안정적인("닫힌 셸") 전자 구성을 통해 이루어집니다.원자는 어떤 작용이 에너지를 가장 적게 소비하느냐에 따라 전자를 얻거나 잃는다.
예를 들어 나트륨 원자 Na는 원자가 껍질에 단일 전자를 가지고 있으며, 2개의 안정적이고 채워진 2개의 전자와 8개의 전자로 이루어진 내부 껍질을 둘러싸고 있다.이렇게 채워진 껍데기는 매우 안정적이기 때문에 나트륨 원자는 여분의 전자를 잃고 이 안정적인 구성을 이루는 경향이 있으며, 그 과정에서 나트륨 양이온이 된다.
- Na → Na+
+ e−
반면 염소원자 Cl은 8개의 전자로 채워진 안정적인 껍질보다 1개 부족한 7개의 전자를 가지고 있다.따라서 염소 원자는 여분의 전자를 얻고 안정적인 8전자 구성을 이루는 경향이 있으며, 이 과정에서 염화 음이온이 됩니다.
- Cl + e−
→ Cl−
이 원동력은 나트륨과 염소가 화학반응을 일으키게 하고, 여기서 "여분의" 전자는 나트륨에서 염소로 전달되어 나트륨 양이온과 염화 음이온을 형성합니다.반대 방향으로 대전되면, 이 양이온과 음이온은 이온 결합을 형성하고, 결합해서 염화나트륨, NaCl을 형성하고, 더 일반적으로 식탁 소금으로 알려져 있습니다.
- Na+
+ Cl−
→ NaCl
다원자 및 분자 이온 생성
다원자 및 분자 이온은 중성 분자에서 양성자 H와+
같은 원소 이온의 득실에 의해 종종 형성된다.예를 들어, 암모니아인
3 NH가 양성자를+
받아들이면, H(양성자화라고 하는 과정)는 암모늄 이온을 형성하고+
4, NH. 암모니아와 암모늄은 본질적으로 동일한 전자 구성에서 같은 수의 전자를 가지지만, 암모늄에는 순 양전하를 주는 추가적인 양성자가 있다.
암모니아는 양전하를 얻기 위해 전자를 잃어 이온 NH를+
3 형성할 수 있다. 그러나 이 이온은 질소 원자 주위에 불완전한 원자가 껍질이 있어 매우 반응성이 높은 라디칼 이온이 되기 때문에 불안정하다.
라디칼 이온의 불안정성으로 인해 다원자 및 분자 이온은 전자를 얻거나 잃는 대신 H와 같은+
원소 이온을 얻거나 잃음으로써 형성된다.이를 통해 분자는 전하를 획득하면서 안정된 전자 구성을 유지할 수 있습니다.
이온화 퍼텐셜
가장 낮은 에너지 상태에 있는 전자를 더 적은 전하를 가진 가스의 원자 또는 분자로부터 분리하는 데 필요한 에너지는 이온화 전위 또는 이온화 에너지라고 불립니다.원자의 n번째 이온화 에너지는 첫 번째 n-1 전자가 이미 분리된 후 n번째 전자를 분리하는 데 필요한 에너지이다.
각각의 연속적인 이온화 에너지는 지난 번보다 현저하게 커집니다.특히 원자 궤도의 특정 블록이 전자로 소진된 후에 큰 증가가 발생합니다.이러한 이유로 이온은 완전한 궤도 블록을 남기는 방식으로 형성되는 경향이 있습니다.예를 들어 나트륨은 가장 바깥쪽 껍질에 하나의 원자가 전자를 가지고 있기 때문에 이온화된 형태에서는 Na와 같이 하나의+
잃어버린 전자와 함께 흔히 발견된다.주기율표의 다른 쪽에는 염소가 7개의 원자가 전자를 가지고 있기 때문에 이온화된 형태에서는 Cl과 같이−
얻은 전자와 함께 흔히 발견된다.세슘은 모든 원소 중에서 이온화 에너지가 가장 낮고 헬륨은 가장 [18]크다.일반적으로 금속의 이온화 에너지는 비금속 이온화 에너지보다 훨씬 낮으며, 이는 일반적으로 금속이 전자를 잃어 양전하를 형성하고, 비금속은 전자를 얻어 음전하를 형성하기 때문입니다.
이온 결합
이온 결합은 반대 방향으로 대전된 이온의 상호 흡인으로부터 발생하는 화학 결합의 일종입니다.같은 전하의 이온은 서로 밀어내고, 반대 전하의 이온은 서로 끌어당긴다.따라서 이온은 보통 자체적으로 존재하는 것이 아니라 반대 전하의 이온과 결합하여 결정 격자를 형성합니다.생성된 화합물은 이온 화합물이라고 불리며 이온 결합에 의해 함께 유지된다고 한다.이온 화합물에서는 이온 이웃들 사이에 개별 이온의 공간적 확장과 이온 반지름이 도출될 수 있는 특징적인 거리가 발생한다.
이온 결합의 가장 일반적인 유형은 금속과 비금속 화합물(화학 화합물을 거의 형성하지 않는 귀한 가스 제외)에서 볼 수 있습니다.금속은 안정적이고 닫힌 껍질의 전자 구성을 초과하는 소수의 전자를 갖는 것이 특징이다.이와 같이, 그들은 안정된 구성을 얻기 위해 여분의 전자를 잃는 경향이 있다.이 성질은 일렉트로포시티브라고 불립니다.반면 비금속은 안정적인 구성에 몇 개의 전자에 미치지 못하는 전자 구성을 갖는 것이 특징입니다.따라서 안정적인 구성을 달성하기 위해 더 많은 전자를 얻는 경향이 있습니다.이러한 경향은 전기 음성도라고 알려져 있다.높은 전기음성 금속이 높은 전기음성 비금속과 결합될 때, 금속 원자의 여분의 전자는 전자 결핍 비금속 원자로 옮겨집니다.이 반응은 금속 양이온과 비금속 음이온을 생성하는데, 이 음이온은 서로 끌어당겨 소금을 형성합니다.
공통 이온
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
「 」를 참조해 주세요.
레퍼런스
- ^ 콜린스 영어 사전의 Wayback Machine 항목에 "Ion" 2013-12-24가 아카이브되었습니다.
- ^ "Definition of CATION". www.merriam-webster.com. Archived from the original on 2021-10-06. Retrieved 2021-10-06.
- ^ "Definition of ANION". www.merriam-webster.com. Archived from the original on 2021-10-06. Retrieved 2021-10-06.
- ^ a b c Knoll, Glenn F (1999). Radiation detection and measurement (3rd ed.). New York: Wiley. ISBN 978-0-471-07338-3.
- ^ a b Frank A. J. L. James, ed. (1991). The Correspondence of Michael Faraday, Vol. 2: 1832-1840. p. 183. ISBN 9780863412493. Archived from the original on 2021-04-14. Retrieved 2020-10-16.
- ^ Michael Faraday (1791-1867). UK: BBC.
- ^ "Online etymology dictionary". Archived from the original on 2011-05-14. Retrieved 2011-01-07.
- ^ "The Nobel Prize in Chemistry 1903". www.nobelprize.org. Archived from the original on 2018-07-08. Retrieved 2017-06-13.
- ^ Harris, William; Levey, Judith, eds. (1976). The New Columbia Encyclopedia (4th ed.). New York City: Columbia University. p. 155. ISBN 978-0-231-03572-9.
- ^ Goetz, Philip W. (1992). McHenry, Charles (ed.). The New Encyclopædia Britannica. Chicago: Encyclopaedia Britannica Inc. Vol. 1 (15 ed.). Chicago: Encyclopædia Britannica, Inc. p. 587. Bibcode:1991neb..book.....G. ISBN 978-0-85229-553-3.
- ^ Cillispie, Charles, ed. (1970). Dictionary of Scientific Biography (1 ed.). New York City: Charles Scribner's Sons. pp. 296–302. ISBN 978-0-684-10112-5.
- ^ Oxford University Press (2013). "Oxford Reference: OVERVIEW anion". oxfordreference.com. Archived from the original on 2017-01-18. Retrieved 2017-01-15.
- ^ University of Colorado Boulder (November 21, 2013). "Atoms and Elements, Isotopes and Ions". colorado.edu. Archived from the original on February 2, 2015. Retrieved November 22, 2013.
- ^ Oxford University Press (2013). "Oxford Reference: OVERVIEW cation". oxfordreference.com. Archived from the original on 2017-01-18. Retrieved 2017-01-15.
- ^ Douglas W. Haywick, Ph.D.; University of South Alabama (2007–2008). "Elemental Chemistry" (PDF). usouthal.edu. Archived (PDF) from the original on 2011-12-04. Retrieved 2013-11-22.
- ^ Purdue University (November 21, 2013). "Amino Acids". purdue.edu. Archived from the original on July 13, 2011. Retrieved November 22, 2013.
- ^ Press, Frank; Siever, Raymond (1986). Earth (14th ed.). New York: W. H. Freeman and Company. p. 63. ISBN 0-7167-1743-3. OCLC 12556840.
- ^ 이온화 에너지별로 나열된 화학 원소 2009-03-30 웨이백 머신에 보관되어 있습니다.Lenntech.com
- ^ a b c "Common Ions and Their Charges" (PDF). Science Geek. Archived (PDF) from the original on 2018-02-18. Retrieved 2018-05-11.