큐륨
Curium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 큐륨 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 발음 | /ˈkjʊəriəm/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 외관 | 은빛 금속성, 어둠 속에서 자주색으로 빛나다. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 질량수 | [247] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표의 큐륨 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자번호 (Z) | 96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그룹 | 그룹 n/a | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기간 | 7주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 블록 | f-블록 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 구성 | [Rn] 5f7 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 셸당 전자 | 2, 8, 18, 32, 25, 9, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 위상 STP서 | 실체가 있는 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | 1613K(1340°C, 2444°F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 비등점 | 3383K(310°C, 5630°F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (근처 ) | 13.51 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | 13.85 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
증기압
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자성 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | +3, +4, +5, [1]+6[2](암포테릭 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기성 | 폴링 척도: 1.3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 체험: 174시 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공동 반지름 | 오후 169±3시 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 큐륨의 스펙트럼 라인 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기타 속성 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자연발생 | 인조의 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정구조 | 이중 육각형 근위축(dhcpdhcp) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기저항도 | 1.25 µΩ⋅m[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자기순서 | 52K에서[3] 반자성-모수성 전이 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7440-51-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 역사 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이름 지정 | 마리 스콜도프스카 퀴리와 피에르 퀴리의 이름을 따서 명명되었다. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 디스커버리 | 글렌 T. 시보그, 랄프 A. 제임스, 알버트 기오르소 (1944년) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 큐륨의 주요 동위 원소 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
쿠륨은 Cm 기호와 원자 번호 96을 가진 초우라늄 방사성 화학 원소다.액티나이드 시리즈의 이 요소는 방사능에 대한 연구로 유명한 저명한 과학자 마리와 피에르 퀴리의 이름을 따서 명명되었다.쿠리움은 처음에 글렌 T의 팀에 의해 의도적으로 만들어졌다. 1944년 시보르그, 랄프 A. 제임스, 알버트 기오르소 등이 버클리에서 사이클로트론을 이용했다.그들은 새로 발견된 원소 플루토늄(이소토프 239)의 한 조각에 알파 입자를 퍼부었다.이것은 시카고 대학의 금속 연구소로 보내졌고, 거기서 작은 큐륨 샘플이 결국 분리되어 확인되었다.이 발견은 제2차 세계대전이 끝날 때까지 비밀에 부쳐졌다.이 뉴스는 1947년 11월에 대중에게 공개되었다.대부분의 큐륨은 원자로에서 중성자로 우라늄이나 플루토늄을 폭격하여 생산된다. 사용후 핵연료 1톤은 약 20그램의 큐륨을 함유하고 있다.
큐륨은 액티나이드의 용융점과 비등점이 상대적으로 높은 단단하고 밀도가 높은 은빛 금속이다.주변 조건에서는 파라마그네틱인 반면, 냉각 시 반소자성이 되며, 다른 자기 전환도 많은 큐륨 화합물에 대해 관찰된다.화합물에서 큐륨은 보통 용액 +3과 때로는 +4를 나타내며, 용액에서 +3 용액이 우세하다.큐륨은 쉽게 산화하며, 그 산화물들은 이 원소의 지배적인 형태다.각종 유기화합물을 가지고 강한 형광 콤플렉스를 형성하고 있지만, 박테리아와 고고학에 접목된 증거는 없다.인체에 유입되면 골격과 폐, 간 등에 큐륨이 축적되어 암을 촉진시킨다.
알려진 큐륨의 모든 동위원소는 방사능이며 지속적인 핵 연쇄 반응을 위한 작은 임계 질량을 가지고 있다.이들은 주로 α 입자를 방출하며, 이 과정에서 방출되는 열은 방사성 이소토프 열전 발전기의 열원으로서 역할을 할 수 있지만, 이 용도는 큐륨 동위원소의 희소성과 높은 비용으로 인해 장애가 된다.큐륨은 인공 심장 박동기의 전원과 우주선용 RTG의 전원에 대해 무거운 액티니드와 푸 방사성핵종의 생산에 사용된다.소저너, 스피릿, 오퍼튜니티, 큐리오시티 마스 탐사선, 67P/추류모프–제라시멘코 혜성의 필래 착륙선 등 여러 우주 탐사선에 설치된 알파 입자 X선 분광기의 α-소스 역할을 했다.
역사
이전의 핵 실험에서 큐륨이 생산되었을 가능성이 높았지만, 그것은 글렌 T에 의해 1944년 버클리 캘리포니아 대학에서 의도적으로 합성, 격리, 식별되었다. 시보그, 랄프 A. 제임스, 그리고 알버트 기오르소.그들의 실험에서, 그들은 60인치(150cm)의 사이클로트론을 사용했다.[4]
큐륨은 시카고 대학의 메탈릭 연구소(현재의 아르곤네 국립 연구소)에서 화학적으로 확인되었다.이 원소는 시리즈 중 네 번째임에도 불구하고 발견된 세 번째 트랜스우라늄 원소로, 당시는 더 가벼운 원소 아메리슘을 알 수 없었다.[5][6]
샘플은 다음과 같이 준비되었다: 최초의 플루토늄 질산염 용액은 약 0.5 cm2 면적의 백금 호일에 코팅되었고, 용액은 증발되었고 잔여물은 플루토늄으로 변환되었다().IV) 어닐링에 의한 산화물(PuO2)산화물에 대한 사이클로트론 조사 후에 코팅은 질산으로 용해되었다가 농축 수용성 암모니아 용액을 사용하여 수산화물로 침전되었다.잔류물은 과염소산에 용해되었고, 이온 교환에 의해 더 이상의 분리가 진행되어 일정한 큐륨 동위원소가 산출되었다.큐륨과 아메리슘의 분리는 매우 고통스러웠기 때문에 버클리 그룹은 처음에 그러한 원소들을 대혼란(모든 악마나 지옥을 위해 그리스어에서 온 것)과 망상증(광기를 위해 라틴어에서 온 것)이라고 불렀다.[7][8]
큐륨-242 동위원소는 7월에 생산되었다.1944년 8월 Pu에게 중성자 방출로 큐륨을 생산하기 위해 α 입자를 퍼부음으로써:
큐륨-242는 붕괴 시 방출되는 α 입자의 특성 에너지로 명확하게 식별되었다.
이 알파 붕괴의 반감기는 처음에는 150일로 측정되었다가 162.8일로 정정되었다.[9]
또 다른 동위원소 Cm은 1945년 3월에 유사한 반응으로 생성되었다.
Cm α-decay의 반감기는 26.7일로 정확하게 결정되었다.[9]
1944년 아메리슘뿐만 아니라 큐륨의 발견은 맨해튼 프로젝트와 밀접한 관련이 있었기 때문에 그 결과는 비밀이었고 1945년에야 기밀 해제되었다.시보그는 1945년 11월 11일 미국 화학 학회에서 공식 발표하기 5일 전 미국의 어린이용 라디오 쇼인 퀴즈 키즈에서 95, 96 원소 합성을 유출했는데, 청취자 중 한 명이 전쟁 중에 플루토늄과 넵투늄 외에 새로운 트랜스우라늄 원소가 발견되었는지를 물었다.[7]큐륨(242Cm과 Cm)의 발견과 그것의 생산, 그리고 그 화합물들은 나중에 특허를 받아 시보그만 발명자로 등재되었다.[10]
이 새로운 원소는 라듐을 발견하고 방사능에 대한 연구로 유명한 마리 퀴리와 그녀의 남편 피에르 퀴리의 이름을 따서 명명되었다.주기율표에서 큐륨 위의 란타늄 원소인 가돌리늄의 예를 따랐는데, 이 원소는 희토류 원소 요한 가돌린의 탐험가의 이름을 따서 명명되었다.[11]
- "원자 번호 96의 원소의 이름으로서 우리는 Cm 기호를 가진 "쿠리움"을 제안하고 싶다.그 증거는 96 원소가 7개의 5f 전자를 포함하고 있으며 따라서 정규 희토류 시리즈에서 7개의 4f 전자를 가진 가돌리늄 원소와 유사하다는 것을 나타낸다.이 염기 원소 96은 화학자 가돌리늄의 명칭과 유사한 방식으로 퀴리족의 이름을 따서 명명되는데, 그 안에서 화학자 가돌리늄이 존칭되었다."[5]
첫 번째 큐륨 샘플은 거의 보이지 않았고, 방사능으로 확인되었다.루이 베르너와 이사도어 펄먼은 1947년 미국 버클리 캘리포니아 대학교에서 아메리슘-241에 중성자를 퍼부어 30µg의 수산화물 중 처음으로 상당한 양의 표본을 만들었다.[12][13][14]거시적으로 볼 수 있는 큐륨 양().III) 불소는 1950년에 W. W. T. 크레인, J. C. 월만, B. 커닝햄에 의해 획득되었다.그것의 자기 감수성은 그것의 화합물에서 큐륨의 +3 용기에 대한 최초의 실험 증거를 제공하는 GdF의3 그것과 매우 가까웠다.[12]큐륨 금속은 1951년에야 바륨으로 CmF를3 줄여서 생산되었다.[15][16]
특성.
물리적인

합성 방사성 원소인 큐륨은 은백색의 외관과 가돌리늄과 유사한 물리적 화학적 성질을 가진 단단하고 밀도가 높은 금속이다.그것의 1344 °C의 녹는점은 이전의 초우라늄 원소 넵투늄(637 °C), 플루토늄(639 °C), 아메리슘(1173 °C)보다 상당히 높다.이에 비해 가돌리늄은 1312℃에서 녹는다.큐륨의 비등점은 3556 °C이다.13.52g/cm의3 밀도로 큐륨은 넵투늄(20.45g/cm3), 플루토늄(19.8g/cm)에3 비해 상당히 가볍지만 대부분의 다른 금속보다 무겁다.두 가지 결정 형태의 큐륨 사이에서 α-Cm은 주변 조건에서 더 안정적이다.육각대칭, 공간군 P63/mmc, 격자 매개변수 a = 365pm, c = 1182pm, 단위 셀당 4개의 공식 단위를 가진다.[17]결정체는 층열 ABAC와 함께 이중 헥스각형 근접 패킹으로 구성되며, 따라서 α-란타넘과 함께 이소형이다.23 GPA 이상의 압력에서 상온에서 α-Cm은 얼굴 중심의 입방 대칭인 β-Cm, 공간 그룹 Fm3m, 격자 상수 a = 493pm으로 변한다.[17]43 GPA로 추가 압축하면 큐륨이 α-우라늄과 유사한 직교옴 γ-Cm 구조로 변환되며, 최대 52 GPA까지 더 이상의 전환이 관찰되지 않는다.이 세 가지 큐륨 단계는 Cm I, II, III라고도 한다.[18][19]
큐륨은 독특한 자성을 가지고 있다.인접 원소 아메리슘이 전체 온도 범위에서 퀴리-와이즈 파라마그네틱스로부터 편차를 보이지 않는 반면, α-Cm은 65–52 K로 냉각 시 반소자성 상태로 변환되며,[20][21] β-Cm은 약 205 K에서 강자성 전환을 보인다.한편, 큐륨 피닉티드는 냉각 시 강자성 변화를 나타낸다: CmN과 CmAs는 109K, CmP는 73K, CmSb는 162K.큐륨, 가돌리늄의 란타니드 아날로그뿐만 아니라 그 피니티드도 냉각 시 자기 전환이 나타나지만 Gd와 GdN은 강자성(강자성)이 되고 GdP, GdAs, GdSb는 반자성(antiphermatic) 순서가 나타나는 등 전환 캐릭터가 다소 다르다.[22]
자기 데이터에 따르면 큐륨의 전기 저항성은 온도에 따라 (4~60K) 증가하며, 상온까지 거의 일정하게 유지된다.알파 방사선에 의한 결정 격자의 자기 손상으로 인해 시간 경과에 따른 저항성(약 10µΩ·cm/h)이 크게 증가한다.이것은 큐륨에 대한 절대 저항값(약 125µΩ·cm)을 불확실하게 만든다.큐륨의 저항성은 가돌리늄과 액티니이드 플루토늄과 넵투늄과 유사하지만 아메리슘, 우라늄, 폴로늄, 토륨에 비해 현저하게 높다.[3][23]
자외선 조명 아래, 큐륨(III)[24] 이온은 환경에 따라 최대 590~640nm의 범위에서 강하고 안정적인 황색 형광을 보인다.형광은 첫 번째 흥분 상태 D와7/2 지상 상태 S로부터의7/2 전환에서 발생한다.이 형광 분석은 유기체와 무기체 복합체에서 Cm(III) 이온 간의 상호작용을 모니터링할 수 있다.[25]
케미컬
용액의 큐륨 이온은 거의 독점적으로 큐륨의 가장 안정적인 산화상태인 +3의 산화상태를 가정한다.[26]+4 산화 상태는 주로 CmO와2 CmF와4 같은 몇 가지 고체상들에서 관찰된다.[27][28]수성 큐륨(Aquous curium)IV)는 페르황산칼륨과 같은 강한 산화제가 존재하는 경우에만 알려져 있으며, 쉽게 큐륨(curium)으로 환원된다.III) 무선 분해에 의해 그리고 심지어 물 자체로도.[29]큐륨의 화학적 작용은 액티니이드 토륨과 우라늄과는 다르며 아메리슘과 비슷하고 란타니드가 많다.수용액에서 Cm3+ 이온은 무색에서 연녹색,[30] Cm4+ 이온은 연황색이다.[31]cm3+ 이온의 광학흡수는 375.4, 381.2, 396.5나노미터의 세 개의 뾰족한 봉우리들을 포함하고 있으며 그 강도는 이온의 농도로 직접 변환될 수 있다.[32]+6 산화 상태는 1978년 용액에서 단 한 번 보고된 적이 있는데, CMO2+
2: 이것은 아메리슘(V) 이온 AmO에서+
2 아메리슘-242의 베타 붕괴로부터 준비되었다.[2]Cm(III)과 Cm(IV)의 산화로부터 Cm(VI)을 얻지 못하는 것은 높은 Cm4+/Cm3+ 이온화 잠재력과 Cm(V)의 불안정성 때문일 수 있다.[29]
큐륨 이온은 단단한 루이스 산이기 때문에 단단한 베이스로 가장 안정된 콤플렉스를 형성한다.[33]접합은 대부분 이온성이며, 작은 공밸런스 성분이 있다.[34]그것의 복합체들의 큐륨은 3중 프리즘 기하학 안에서 9배의 조정 환경을 나타낸다.[35]
동위 원소
약 19개의 방사성 동위원소와 Cm과 Cm 사이의 7개의 핵 이성계는 큐륨으로 알려져 있는데, 이 중 어느 것도 안정적이지 않다.가장 긴 반감기는 cm(1560만년)과 cm(34만8000년)으로 나타났다.기타 장수 동위원소로는 Cm(반감기 8500년), Cm(8300년), Cm(4760년)이 있다.큐륨-250은 주로 (약 86%) 자발적 핵분열을 통해 분해된다는 점에서 이례적이다.가장 많이 사용되는 큐륨 동위원소는 Cm과 Cm으로 반감기가 각각 162.8일, 18.1년이다.[9]
| 열 중성자 단면(창)[36] | ||||||
|---|---|---|---|---|---|---|
| 242CM | 243CM | 244CM | 245CM | 246CM | 247CM | |
| 핵분열 | 5 | 617 | 1.04 | 2145 | 0.14 | 81.90 |
| 캡처 | 16 | 130 | 15.20 | 369 | 1.22 | 57 |
| C/F 비율 | 3.20 | 0.21 | 14.62 | 0.17 | 8.71 | 0.70 |
| LEU는 53 MWd/kg 연소[37] 후 20년 만에 핵연료를 사용하였다. | ||||||
| 공통 동위 원소 3개 | 51 | 3700 | 390 | |||
| 고속 중성자 원자로 MOX 연료(5개 표본, 연소 66–120 GWd/t)[38] | ||||||
| 총 큐륨 3.09×10−3% | 27.64% | 70.16% | 2.166% | 0.0376% | 0.000928% | |
| 동위원소 | 242CM | 243CM | 244CM | 245CM | 246CM | 247CM | 248CM | 250CM |
| 임계 질량, kg | 25 | 7.5 | 33 | 6.8 | 39 | 7 | 40.4 | 23.5 |
Cm뿐만 아니라 Cm과 Cm 사이의 모든 동위원소는 자급자족하는 핵사슬 반응을 겪기 때문에 원칙적으로 원자로에서 핵연료 역할을 할 수 있다.대부분의 초우라늄 원소에서와 같이 핵분열 단면은 특히 홀수 질량 큐륨 동위원소 Cm, Cm, Cm의 경우 높다.이는 열중성 원자로에서 사용될 수 있는 반면, 큐륨 동위원소의 혼합물은 고른 질량 동위원소가 열로에서 핵분열이 되지 않고 연소량이 증가함에 따라 축적되기 때문에 고속 증식 원자로에만 적합하다.[39]Cm의 중성자 활성화가 캘리포늄을 생성하기 때문에 원자로에 사용될 혼합산화물(MOX) 연료는 큐륨을 거의 또는 전혀 포함하지 않아야 한다.캘리포늄은 강력한 중성자 방출체로 연료 주기의 후단을 오염시키고 원자로 인력에 대한 선량을 증가시킬 것이다.따라서 경미한 액티니드를 열 중성자 원자로에서 연료로 사용하려는 경우 큐리움을 연료에서 제외하거나 유일한 액티니이드인 특수 연료봉에 넣어야 한다.[40]
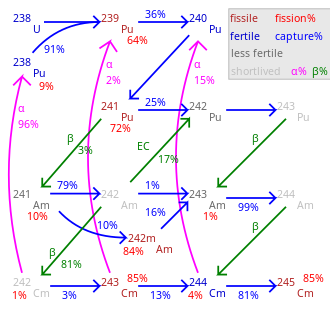
핵분열 비율은 100에서 표시된 백분율을 뺀 값이다.
총 투과율은 핵종에 따라 크게 다르다.
245Cm-Cm은 수명이 길고 부패가 거의 없다.248
인접한 표에는 감속재와 반사체가 없는 구의 큐륨 동위원소에 대한 임계 질량이 나열되어 있다.금속 반사체(철강 30 cm)로 홀수 동위원소의 임계 질량은 약 3-4 kg이다.반사체로 물(두꺼움 ~20~30cm)을 사용할 때 임계 질량은 Cm의 경우 59g, Cm의 경우 155g, Cm의 경우 1550g 정도로 작을 수 있다.이러한 임계 질량 값에는 상당한 불확실성이 있다.보통 20%의 순서로 되어 있는 반면, Cm과 Cm의 값은 일부 연구 그룹에 의해 각각 371 kg과 70.1 kg으로 나열되었다.[39][42]
쿠리움은 현재 가용성이 낮고 가격이 비싸 핵연료로 사용되지 않고 있다.[43]245cm과 cm은 임계 질량이 매우 작아 전술핵에 사용될 수 있지만 생산한 것은 없는 것으로 알려졌다.큐륨-243은 반감기가 짧고 α 방출이 강해 과도한 열이 발생하기 때문에 이 목적에 적합하지 않다.[44]큐륨-247은 플루토늄-239(기존 핵무기에 많이 사용되는)보다 647배 긴 반감기가 있어 적합성이 높을 것이다.
발생

큐륨의 최장수 동위원소 Cm은 반감기가 1560만 년이다.그러므로, 지구 형성 중에 지구에 존재하는 큐륨인 어떤 원시적 큐륨도 지금쯤은 썩었어야 했다.멸종된 방사성핵종으로서의 그것의 과거 존재는 원시적이고 장수하는 딸 U.의 초과로서 검출될 수 있다. 비록 이것이 확인되지는 않았지만 중성자 포획과 베타 붕괴 시퀀스의 결과로서 우라늄 광물에서 자연적으로 발생하는 큐륨의 미량일 가능성이 있다.[45][46]Cm의 미량도 우주 광선을 타고 지구로 유입될 가능성이 있지만, 다시 한번 이것은 확인되지 않았다.[47]
큐륨은 연구 목적으로 소량으로 인공적으로 생산된다.게다가, 그것은 사용후 핵연료에서 발생한다.큐륨은 핵무기 실험에 사용되는 특정 영역에 자연적으로 존재한다.[48]아인슈타인륨, 페르뮴, 플루토늄, 아메리슘 외에 미국 최초의 열핵무기인 아이비 마이크 (1952년 11월 1일, 에누에탁크 환초)의 시험장 잔해를 분석한 결과 베켈륨, 캘리포늄, 큐륨의 동위원소, 특히 Cm, Cm, Cm의 소량도 밝혀졌다.[49]
대기 중 퀴륨 화합물은 일반 용매에 잘 녹지 않으며 대부분 토양 입자에 붙는다.토양 분석 결과 모래 토양 입자의 큐륨 농도가 토양 모공에 존재하는 물보다 약 4000배 높은 것으로 나타났다.약 18,000의 훨씬 더 높은 비율이 암토에서 측정되었다.[50]
큐륨을 포함한 아메리슘에서 페르뮴에 이르는 트랜스우라늄 원소는 오클로의 자연 핵분열 원자로에서 자연적으로 발생했지만, 더 이상 그렇게 하지 않는다.[51]
큐륨은 다른 비원발성 액티니드와 함께 프지빌스키 별의 스펙트럼에서도 검출되었다.[52]
합성
동위원소 준비
큐륨은 원자로에서 소량으로 생산되고 있으며, 현재까지는 Cm과 Cm의 경우 킬로그램만이 축적되어 있고, 더 무거운 동위원소의 경우 그램이나 심지어 밀리그램도 축적되어 있다.이것은 cm의 경우 US$2000/g,[12] Cm의 경우 US$170/g로 견적된 curium의 높은 가격을 설명한다.[53]원자로에서는 일련의 핵반응에서 U로부터 큐륨이 형성된다.첫 번째 체인에서 U는 중성자를 포착하여 U로 변환하는데, β− 붕괴를 통해 Np와 Pu로 변환된다.
-
(1)
β-decay에− 따른 추가적인 중성자 포획은 아메리슘의 Am 동위원소를 생성하여 Cm:
- 플루토늄 94239→ 2(n, γ)94241플루토늄 → 14.35yr β − 오전 95241→(n, γ)95242개구 → 16.02 hβ − 96242Cm{\displaystyle{\ce{^{239}_{94}Pu->,[{{2(n,\gamma)}\ce}]_{94}^{241}Pu->,[\beta ^{-}][14.35\{\ce{1년 구독}}]{^{241}_{95}Am}->,[{\ce{(n,\gamma)}}]_{95}^{242}.Am-96
(2)
연구 목적상, 큐륨은 우라늄이 아닌 플루토늄을 조사하여 얻는데, 사용후핵연료에서 다량으로 구할 수 있다.다른 반응 체인과 Cm 형성을 초래하는 조사에 훨씬 더 높은 중성자 유속이 사용된다.[6]
-
(3)
큐륨-244는 알파 입자 방출로 Pu로 분해되지만 중성자를 흡수해 소량의 무거운 큐륨 동위원소가 발생한다.그중에서도 cm과 cm은 반쪽 리브가 길어서 과학 연구에서 인기가 많다.그러나 열 중성자 원자로에서 Cm의 생산률은 열 중성자에 의해 유도된 핵분열을 겪기 쉽기 때문에 상대적으로 낮다.[54]중성자 흡수를 통한 Cm의 합성도 β− 붕괴에 의해 베르켈륨 동위원소 Bk로 변환되는 중간 산출물 Cm(64분)의 짧은 반감기 때문에 다소 가능성이 낮다.[54]
-
(4)
위의 계단식 (n,cs) 반응은 서로 다른 큐륨 동위원소의 혼합물을 생성한다.그들의 합성 후 분리는 번거롭고, 따라서 선택적인 합성이 필요하다.큐륨-248은 반감기가 길기 때문에 연구 목적으로 선호된다.이 동위원소의 가장 효율적인 준비 방법은 캘리포늄 동위원소 Cf의 α-decay를 통한 것으로, 반감기(2.65년)가 길기 때문에 비교적 대량으로 이용할 수 있다.Cm 약 35–50 mg이 매년 이 방법으로 생산되고 있다.관련 반응은 동위원소 순도가 97%[54]인 Cm을 생성한다.
-
(5)
또 다른 연구용 동위원소 Cm은 Cf의 α-decay에서 얻을 수 있으며, 후자 동위원소는 베르켈륨 동위원소 Bk의 β-decay에서− 미세한 양으로 생산된다.
-
(6)
금속제제제
대부분의 합성 루틴은 산화물로 서로 다른 액티나이드 동위원소의 혼합물을 생산하는데, 여기서부터 큐륨의 특정 동위원소를 분리해야 한다.예를 들어, 사용후 원자로 연료(예: MOX 연료)를 질산에 용해하고, 탄화수소 내 트리뷰틸 인산염과 함께 PUREX(Plutonium – URanium EXtraction) 유형 추출을 사용하여 우라늄과 플루토늄의 대부분을 제거하는 것이 그 예일 수 있다.그런 다음, 란타니드와 나머지 액티니드는 직경 기반 추출에 의해 수성 잔류물(레퍼레이트)에서 분리되어 3가액 액티니드와 란타니이드의 혼합물을 제공한다.그런 다음 큐륨 화합물을 적절한 시약으로 다단계 크로마토그래피 및 원심분리 기법을 사용하여 선택적으로 추출한다.[55]최근 큐륨 선택성이 높은 시약으로 비스 트라이아즈비닐 비피리딘 단지가 제안됐다.[56]화학적으로 매우 유사한 아메리슘으로부터 큐륨의 분리는 또한 높은 온도에서 오존과 함께 수용성 중탄산나트륨에 있는 수산화물의 슬러리를 처리함으로써 달성될 수 있다.아메리슘과 큐륨은 대부분 +3 발란스 상태로 용액에 존재한다. 아메리슘은 용해성 암(IV) 복합체로 산화되는 반면, 큐륨은 변하지 않으며 따라서 반복 원심분리하여 격리할 수 있다.[57]
금속 큐륨은 화합물의 감소로 얻는다.초기에는 큐륨(curium)을 사용하였다.III) 이를 위해 불소를 사용하였다.반응은 물과 산소가 없는 환경, 탄탈룸과 텅스텐으로 만들어진 기구에서 원소 바륨이나 리튬을 환원제로 사용하여 수행되었다.[6][15][58][59][60]
또 다른 가능성은 큐륨의 감소다.IV)[61] 염화 마그네슘과 불소 마그네슘 용해에서 마그네슘-진크 합금을 사용한 산화물.
화합물 및 반응
산화제
큐륨은 대부분 CmO와23 CmO2 산화물을 형성하는 산소와 쉽게 반응하지만,[48] 이분산화물 CmO도 알려져 있다.[62]블랙 CmO는2 순수 산소에서 질산염(Cm
2(CO
2
4),
3 질산염(Cm(NO
3))
3 또는 수산화물을 연소시켜 얻을 수 있다.[28][63]진공 상태(약 0.01Pa)에서 600–650 °C까지 가열하면 희끄무레한 CmO로23 변한다.[28][64]
- 2→ 2 2 + +
또는 분자 수소로 CmO를2 감소시킴으로써 CmO를23 얻을 수 있다.[65]
또한 M(II)CmO형3 3차 산화물이 다수 알려져 있으며, 여기서 M은 바륨과 같은 2차 금속을 의미한다.[66]
CmH2–3(Curium Hydride) 미량의 열 산화는 매우 희귀한 +6 상태의 알려진 두 가지 예 중 하나인 휘발성 삼산화 CmO와2 휘발성 삼산화 CmO를3 생성하는 것으로 보고되었다.[2]또 다른 관찰된 종은 플루토늄 테트록사이드와 유사하게 작용하는 것으로 보고되었고, CmO로4 잠정적으로 특징지어졌으며, 매우 희귀한 +8 상태에 큐륨이 있었다.[67] 그러나, 새로운 실험은 CmO가4 존재하지 않는다는 것을 보여주는 것으로 보이며, PuO의4 존재에 대해서도 의문을 제기하고 있다.[68]
할리데스
무색 큐륨().III) 불소이온을 큐륨(III) 함유 용액에 주입하여 불소이온(CmF3)을 생성할 수 있다.갈색 사분면 큐륨(curium)IV) 반면에 불소(CmF4)는 큐륨(curium)을 반응하여 얻어야 한다.III) 분자 플루오린을 사용한 플루오르화:[6]
일련의 3차 불소는 ACMF 형태로7631 알려져 있으며, 여기서 A는 알칼리 금속을 의미한다.[69]
무색 큐륨().III) 염화물(CmCl3)은 무수 수소 염화 가스와 수산화 퀴륨(Cm(OH)3의 반응으로 생성된다.더 나아가 큐륨(curium)과 같은 다른 할로겐화물로 전환할 수 있다.III) 브로마이드(무색에서 연한 녹색까지) 및 큐륨(curium)은III) 약 400–450°C의 상승 온도에서 해당 할로겐의 암모니아 소금과 반응하여 요오드화(무색):[70]
대안으로 산화물 큐륨을 해당 산으로 약 600 °C까지 가열(예: 브로미드 큐륨용 하이드로롬)하는 절차가 있다.[71][72]큐륨의 증기상 가수 분해(III) 염화물로 인해 옥시염소화물이 생성됨:[73]
샬코제니데스 및 닐티데스
황화물, 셀레니드, 큐륨 텔루리드는 높은 온도에서 진공상태에서 기체황, 셀레늄 또는 텔루륨으로 큐륨을 처리함으로써 얻어졌다.[74][75]CmX형 큐륨의 질소는 질소, 인, 비소, 안티몬 원소로 알려져 있다.[6]그들은 어느 하나의 큐륨을 반응시킴으로써 준비될 수 있다.III) 높은 온도에서 이러한 원소가 있는 수화물(CmH3) 또는 금속 큐륨.[76]
유기암호화합물 및 생물학적 측면
천왕성과 유사한 유기농 복합체들은 토륨, 프로토티늄, 넵투늄, 플루토늄, 아메리슘과 같은 다른 액티니이드로도 알려져 있다.분자 궤도이론은 안정적인 '큐로센' 콤플렉스(--CH888)2Cm을 예측하지만 아직 실험적으로 보고되지는 않았다.[77][78]
N-CH-BTP와37 Cm3+ 이온을 함유한 용액에서 BTP가 2,6-di(1,2,4-triazin-3-yl)pyridine을 나타내는
3Cm(n-CH-BTP
3
7) 유형의 복합체 형성은 EXAFS에 의해 확인되었다.이러한 BTP형 복합체 중 일부는 선택적으로 큐륨과 상호작용하므로 란타니드 및 또 다른 액티니드로부터 선택적으로 분리하는 데 유용하다.[24][79]용해된 Cm3+ 이온은 수산화산,[80] 요소,[81] 형광체[82], 아데노신 삼인산 등과 같은 많은 유기 화합물과 결합한다.[83]이 화합물들 중 많은 것들이 다양한 미생물의 생물학적 활동과 관련이 있다.결과 복합체들은 자외선을 쬐면 강한 황색-오렌지 방출이 나타나는데, 이는 검출 뿐만 아니라 반감기(순서 ~ 0.1ms)와 형광 스펙트럼의 변화를 통한 Cm3+ 이온과 리간드 사이의 상호작용을 연구하는데도 편리하다.[25][80][81][82][83]
큐륨은 생물학적 의미가 없다.[84]박테리아와 고고학에 의한 Cm의3+ 생물학 착취에 관한 몇 가지 보고가 있지만, 그것들에 큐륨이 통합되었다는 증거는 없다.[85][86]
적용들
방사성핵종
큐륨은 가장 방사능이 많은 격리성 원소 중 하나이다.가장 흔한 동위원소 Cm과 Cm은 강력한 알파 방출체(에너지 6 MeV)로, 비교적 짧은 반감기 162.8일, 18.1년이며 각각 120W/g와 3W/g의 열 에너지를 생산한다.[12][87][88]따라서 큐륨은 우주선에 있는 것과 같은 방사성 이소토프 열전 발전기에서 일반적인 산화제 형태로 사용될 수 있다.이 응용 프로그램은 Cm 동위원소에 대해 연구되어 왔으며, Cm은 약 2000 USD/g의 금지된 가격으로 인해 폐기되었고, Cm은 반감기가 약 30년이고 에너지 수율이 약 1.6W/g에 달하면 적절한 연료를 만들 수 있지만, 방사성 붕괴 제품에서 상당한 양의 유해 감마선과 베타 방사선을 생산한다.α-이미터로서 Cm은 훨씬 얇은 방사선방호차폐를 필요로 하지만, 자발적 핵분열률이 높아 중성자 및 감마선 방사선량이 상대적으로 강하다.Pu와 같은 경쟁 열전 발생기 동위원소와 비교했을 때, Cm은 500배 더 큰 중성자를 방출하고, 감마선 방출량이 더 높은 경우 Pu의 0.1에 비해 1kW 선원에 약 2인치인 20배 두꺼운 실드가 필요하다.따라서 이러한 큐륨의 적용은 현재 비실용적인 것으로 간주되고 있다.[53]
Cm의 더 유망한 적용 분야는 심장박동기와 같은 열전 발생기에 더 적합한 방사성 동위원소인 Pu를 생산하는 것이다.Pu에 대한 대체 루트는 Np의 (n,csu) 반응 또는 우라늄의 중수소 폭격을 사용한다. Np는 항상 원하지 않는 부산물로 Pu를 생산한다. 왜냐하면 Pu는 강력한 감마 방출로 U로 소멸하기 때문이다.[89]큐륨은 또한 더 높은 트랜스우라늄 원소와 초헤비 원소의 생산을 위한 일반적인 시작 재료다.따라서 Cm에 네온(22Ne), 마그네슘(26Mg) 또는 칼슘(48Ca)을 투하하면 해저지움(265Sg), 해시움(269Hs and Hs), 간모륨(292Lv, Lv, 가능성이 있음)의 특정 동위원소가 생성되었다.[90]캘리포늄은 버클리에서 150cm의 60인치 사이클로트론을 사용하여 35 MeV 알파 입자로 마이크로그램 크기의 큐륨-242를 조사했을 때 발견되었다.
- 242
96Cm
+ 4
2He
→ 245
98Cf
+ 1
0n
이 실험에서 약 5,000개의 캘리포니아 원자들만이 생산되었다.[91]
홀수 질량 큐륨 동위 원소 Cm, Cm은 모두 핵분열성이 높으며 열 스펙트럼 원자로에서 추가 에너지를 생성하는 데 사용될 수 있으며, Cm 동위 원소는 모두 고속 중성자 스펙트럼 원자로에서 핵분열 가능하다.이것은 핵연료 주기에서 사소한 행동의 분리 및 전달에 대한 동기 중 하나로, 사용된 또는 사용후 핵연료의 장기적 방사선독성을 감소시키는데 도움이 된다.
X선 분광계
Cm의 가장 실용적인 적용은 (총 부피는 다소 제한되지만) 알파 입자 X선 스펙트럼 분석계(APXS)에서 α 입자 선원으로서 적용된다.이들 기구는 [92]소저너, 화성, 화성 96, 화성탐사로버, 필래 혜성 착륙선 등에 설치돼 화성 과학실험실을 비롯해 화성 표면에 있는 암석의 구성과 구조를 분석했다.[93]APXS는 또한 평가관 5-7 달 탐침에도 사용되었지만 Cm 선원과 함께 사용되었다.[50][94][95]
정교한 APXS 설정에는 총 방사능 붕괴율이 수십 밀리터리인 6개의 큐륨 선원이 포함된 센서 헤드가 장착되어 있다(거의 기가베큐렐).선원은 샘플에서 시준되며, 샘플에서 산란된 알파 입자와 양성자의 에너지 스펙트럼을 분석한다(양자 분석은 일부 분광계에서만 구현된다).이러한 스펙트럼에는 수소, 헬륨 및 리튬을 제외한 샘플의 모든 주요 원소에 대한 정량적 정보가 포함되어 있다.[96]
안전
높은 방사능 때문에 큐륨과 그 화합물은 특별한 준비 하에 적절한 실험실에서 취급되어야 한다.큐륨 자체는 주로 α 입자를 방출하는데 반해, 그 붕괴 산물의 일부는 베타 및 감마선의 상당한 분수를 방출하는데, 이것은 좀 더 정교한 보호가 필요하다.[48]섭취하면 며칠 안에 큐륨이 배설되고 0.05%만 혈액에 흡수된다.거기서 약 45%는 간으로, 45%는 뼈로, 나머지 10%는 배설된다.골수에서, 큐륨은 골수와의 접점 안쪽에 축적되고 시간이 지남에 따라 현저하게 재분배되지 않는다; 그것의 방사선은 골수를 파괴하고 따라서 적혈구 생성을 막는다.큐륨의 생물학적 반감기는 간에서 약 20년, 뼈에서 50년이다.[48][50]큐륨은 흡입으로 훨씬 더 강하게 체내에 흡수되며 수용성 형태의 Cm의 허용 총 선량은 0.3μC이다.[12]쥐에 대한 용액이 포함된 Cm과 Cm의 정맥주사는 골종양 발생률을 높였고, 흡입은 폐암과 간암을 촉진시켰다.[48]
큐륨 동위원소는 약 20 g/tonne 농도의 사용후핵연료에 존재할 수밖에 없다.[97]이 중 Cm-Cm 248동위원소는 붕괴시간이 수천 년으로, 폐기용 연료를 중화시키기 위해 제거해야 한다.[98]관련 절차에는 몇 가지 단계가 포함되는데, 여기서 큐륨은 먼저 분리되었다가 특수 원자로에서 중성자 폭격에 의해 단명 핵종으로 전환된다.이 절차, 핵 변환은 다른 요소들에 대해 잘 문서화 되었지만, 여전히 큐륨을 위해 개발되고 있다.[24]
참조
- ^ Kovács, Attila; Dau, Phuong D.; Marçalo, Joaquim; Gibson, John K. (2018). "Pentavalent Curium, Berkelium, and Californium in Nitrate Complexes: Extending Actinide Chemistry and Oxidation States". Inorg. Chem. American Chemical Society. 57 (15): 9453–9467. doi:10.1021/acs.inorgchem.8b01450. OSTI 1631597. PMID 30040397. S2CID 51717837.
- ^ a b c Domanov, V. P.; Lobanov, Yu. V. (October 2011). "Formation of volatile curium(VI) trioxide CmO3". Radiochemistry. SP MAIK Nauka/Interperiodica. 53 (5): 453–6. doi:10.1134/S1066362211050018. S2CID 98052484.
- ^ a b c Schenkel, R. (1977). "The electrical resistivity of 244Cm metal". Solid State Communications. 23 (6): 389. Bibcode:1977SSCom..23..389S. doi:10.1016/0038-1098(77)90239-3.
- ^ Hall, Nina (2000). The New Chemistry: A Showcase for Modern Chemistry and Its Applications. Cambridge University Press. pp. 8–9. ISBN 978-0-521-45224-3.
- ^ a b Seaborg, Glenn T.; James, R. A.; Ghiorso, A. (1949). "The New Element Curium (Atomic Number 96)" (PDF). NNES PPR (National Nuclear Energy Series, Plutonium Project Record). The Transuranium Elements: Research Papers, Paper No. 22.2. 14 B. OSTI 4421946. Archived from the original (PDF) on 12 October 2007.
- ^ a b c d e Mors, L. R., Edelstein, N. M. 및 Fugere, J. (eds):Actinide 요소와 transactinides의 화학, 제3권, Springer-Verlag, Dordrecht 2006, ISBN 1-4020-3555-1.
- ^ a b Pepling, Rachel Sheremeta (2003). "Chemical & Engineering News: It's Elemental: The Periodic Table – Americium". Retrieved 2008-12-07.
- ^ 크렙스, 로버트 E.우리 지구 화학 원소의 역사와 사용: 참조 가이드, 그린우드 출판 그룹, 2006, ISBN 0-313-33438-2 페이지 322
- ^ a b c Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (1997). "The NUBASE evaluation of nuclear and decay properties" (PDF). Nuclear Physics A. 624 (1): 1–124. Bibcode:1997NuPhA.624....1A. doi:10.1016/S0375-9474(97)00482-X. Archived from the original (PDF) on 2008-09-23.
- ^ Seaborg, G. T. U.S. 특허 3,161,462 "Element", 출원일: 1949년 2월 7일, 발행일:1964년 12월
- ^ 그린우드, 페이지 1252
- ^ a b c d e Hammond C. R. "원소" 의
- ^ L. B. Werner, I. Perlman: "Curium의 분리", NNES PPR(National Nuclear Energy Series, 플루토늄 프로젝트 기록), Vol. 14 B, Transuranium 요소: 1949년 뉴욕 McGraw-Hill Book, Inc.의 22.5호 연구 논문.
- ^ "National Academy of Sciences. Isadore Perlman 1915–1991". Nap.edu. Retrieved 2011-03-25.
- ^ a b Wallmann, J. C.; Crane, W. W. T.; Cunningham, B. B. (1951). "The Preparation and Some Properties of Curium Metal" (PDF). Journal of the American Chemical Society. 73 (1): 493–494. doi:10.1021/ja01145a537. hdl:2027/mdp.39015086479790.
- ^ Werner, L. B.; Perlman, I. (1951). "First Isolation of Curium". Journal of the American Chemical Society. 73 (1): 5215–5217. doi:10.1021/ja01155a063.
- ^ a b Milman, V.; Winkler, B.; Pickard, C. J. (2003). "Crystal structures of curium compounds: an ab initio study". Journal of Nuclear Materials. 322 (2–3): 165. Bibcode:2003JNuM..322..165M. doi:10.1016/S0022-3115(03)00321-0.
- ^ 영, D.A. 요소의 위상 도표, 캘리포니아 대학교 출판부, 1991년 ISBN 0-520-07483-1, 페이지 227
- ^ Haire, R.; Peterson, J.; Benedict, U.; Dufour, C.; Itie, J. (1985). "X-ray diffraction of curium-248 metal under pressures of up to 52 GPa". Journal of the Less Common Metals. 109 (1): 71. doi:10.1016/0022-5088(85)90108-0.
- ^ Kanellakopulos, B.; Blaise, A.; Fournier, J. M.; Müller, W. (1975). "The magnetic susceptibility of Americium and curium metal". Solid State Communications. 17 (6): 713. Bibcode:1975SSCom..17..713K. doi:10.1016/0038-1098(75)90392-0.
- ^ Fournier, J.; Blaise, A.; Muller, W.; Spirlet, J.-C. (1977). "Curium: A new magnetic element". Physica B+C. 86–88: 30. Bibcode:1977PhyBC..86...30F. doi:10.1016/0378-4363(77)90214-5.
- ^ Nave, S. E.; Huray, P. G.; 피터슨, J. R. 및 데미안, D. A. Curium pnicides의 자기 감수성, Oak Ridge 국립 연구소
- ^ Schenkel, R. (1977). "The electrical resistivity of 244Cm metal". Solid State Communications. 23 (6): 389. Bibcode:1977SSCom..23..389S. doi:10.1016/0038-1098(77)90239-3.
- ^ a b c Denecke, Melissa A.; Rossberg, André; Panak, Petra J.; Weigl, Michael; Schimmelpfennig, Bernd; Geist, Andreas (2005). "Characterization and Comparison of Cm(III) and Eu(III) Complexed with 2,6-Di(5,6-dipropyl-1,2,4-triazin-3-yl)pyridine Using EXAFS, TRFLS, and Quantum-Chemical Methods". Inorganic Chemistry. 44 (23): 8418–8425. doi:10.1021/ic0511726. PMID 16270980.
- ^ a b Bünzli, J.-C. G. G. Lantanide 탐사선, 생명, 화학, 지구 과학: 이론과 실습, 암스테르담, 1989 ISBN 0-444-88199-9
- ^ 페네만, 페이지 24
- ^ Keenan, Thomas K. (1961). "First Observation of Aqueous Tetravalent Curium". Journal of the American Chemical Society. 83 (17): 3719. doi:10.1021/ja01478a039.
- ^ a b c Asprey, L. B.; Ellinger, F. H.; Fried, S.; Zachariasen, W. H. (1955). "Evidence for Quadrivalent Curium: X-Ray Data on Curium Oxides1". Journal of the American Chemical Society. 77 (6): 1707. doi:10.1021/ja01611a108.
- ^ a b Gregg J., Lumetta; Thompson, Major C.; Penneman, Robert A.; Eller, P. Gary (2006). "Curium". In Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean (eds.). The Chemistry of the Actinide and Transactinide Elements (PDF). Vol. 3 (3rd ed.). Dordrecht, the Netherlands: Springer. pp. 1397–1443. doi:10.1007/1-4020-3598-5_9. ISBN 978-1-4020-3555-5.
- ^ 그린우드, 페이지 1265
- ^ 홀레만, 1956 페이지
- ^ 페네만, 25-26페이지
- ^ Jensen, Mark P.; Bond, Andrew H. (2002). "Comparison of Covalency in the Complexes of Trivalent Actinide and Lanthanide Cations". Journal of the American Chemical Society. 124 (33): 9870–9877. doi:10.1021/ja0178620. PMID 12175247.
- ^ Seaborg, Glenn T. (1993). "Overview of the Actinide and Lanthanide (the f) Elements". Radiochimica Acta. 61 (3–4): 115–122. doi:10.1524/ract.1993.61.34.115. S2CID 99634366.
- ^ 그린우드, 페이지 1267
- ^ Pfennig, G.; Klewe-Nebenius, H. and Seelmann Eggebert, W. (Eds.): Karlsruhe nucleid, 1998년 6월 6일.
- ^ Kang, Jungmin; Von Hippel, Frank (2005). "Limited Proliferation-Resistance Benefits from Recycling Unseparated Transuranics and Lanthanides from Light-Water Reactor Spent Fuel" (PDF). Science and Global Security. 13 (3): 169. Bibcode:2005S&GS...13..169K. doi:10.1080/08929880500357682. S2CID 123552796.
- ^ Osaka, M.; et al. (2001). "Analysis of Curium Isotopes in Mixed Oxide Fuel Irradiated in Fast Reactor". Journal of Nuclear Science and Technology. 38 (10): 912–914. doi:10.3327/jnst.38.912.
- ^ a b 방사선방사선방사선방사선방사선방사선방사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선사선
- ^ National Research Council (U.S.). Committee on Separations Technology and Transmutation Systems (1996). Nuclear wastes: technologies for separations and transmutation. National Academies Press. pp. 231–. ISBN 978-0-309-05226-9. Retrieved 19 April 2011.
- ^ Sasahara, Akihiro; Matsumura, Tetsuo; Nicolaou, Giorgos; Papaioannou, Dimitri (2004). "Neutron and Gamma Ray Source Evaluation of LWR High Burn-up UO2 and MOX Spent Fuels" (PDF). Journal of Nuclear Science and Technology. 41 (4): 448–456. doi:10.3327/jnst.41.448.
- ^ Okundo, H. & Kawasaki, H. (2002). "Critical and Subcritical Mass Calculations of Curium-243 to −247 Based on JENDL-3.2 for Revision of ANSI/ANS-8.15". Journal of Nuclear Science and Technology. 39 (10): 1072–1085. doi:10.3327/jnst.39.1072.
- ^ § 2 Begriffsbestimungen (원자력에너지법)(독일어)
- ^ Jukka Lehto; Xiaolin Hou (2 February 2011). Chemistry and Analysis of Radionuclides: Laboratory Techniques and Methodology. Wiley-VCH. pp. 303–. ISBN 978-3-527-32658-7. Retrieved 19 April 2011.
- ^ Earth, Live Science Staff 2013-09-24T21:44:13Z Planet (24 September 2013). "Facts About Curium". livescience.com. Retrieved 2019-08-10.
- ^ "Curium - Element information, properties and uses Periodic Table". www.rsc.org. Retrieved 2019-08-10.
- ^ Thornton, Brett F.; Burdette, Shawn C. (2019). "Neutron stardust and the elements of Earth". Nature Chemistry. 11: 4–10. doi:10.1038/s41557-018-0190-9. Retrieved 19 February 2022.
- ^ a b c d e 큐륨(독일어)
- ^ Fields, P. R.; Studier, M. H.; Diamond, H.; et al. (1956). "Transplutonium Elements in Thermonuclear Test Debris". Physical Review. 102 (1): 180–182. Bibcode:1956PhRv..102..180F. doi:10.1103/PhysRev.102.180.
- ^ a b c Los Alamos 국립 연구소의 웨이백 머신에 보관된 2006-02-18 쿠리움 인간 건강 현황표
- ^ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ Gopka, V. F.; Yushchenko, A. V.; Yushchenko, V. A.; Panov, I. V.; Kim, Ch. (15 May 2008). "Identification of absorption lines of short half-life actinides in the spectrum of Przybylski's star (HD 101065)". Kinematics and Physics of Celestial Bodies. 24 (2): 89–98. Bibcode:2008KPCB...24...89G. doi:10.3103/S0884591308020049. S2CID 120526363.
- ^ a b 정적 RTG의 기본 요소 2013-02-15 Wayback Machine, G.L. Kulcinski, NEEP 602 코스 노트(2000년 봄), University of Wisconsin Fusion Technology Institute (마지막 페이지 참조)
- ^ a b c Lumetta, Gregg J.; Thompson, Major C.; Penneman, Robert A.; Eller, P. Gary (2006). "Curium" (PDF). In Morss; Edelstein, Norman M.; Fuger, Jean (eds.). The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Dordrecht, The Netherlands: Springer Science+Business Media. p. 1401. ISBN 978-1-4020-3555-5. Archived from the original (PDF) on 2010-07-17.
- ^ 페네만, 34-48페이지
- ^ Magnusson D; Christiansen B; Foreman MRS; Geist A; Glatz JP; Malmbeck R; Modolo G; Serrano-Purroy D & Sorel C (2009). "Demonstration of a SANEX Process in Centrifugal Contactors using the CyMe4-BTBP Molecule on a Genuine Fuel Solution". Solvent Extraction and Ion Exchange. 27 (2): 97. doi:10.1080/07366290802672204. S2CID 94720457.
- ^ 페네만, 페이지 25
- ^ Cunningham, B. B.; Wallmann, J. C. (1964). "Crystal structure and melting point of curium metal". Journal of Inorganic and Nuclear Chemistry. 26 (2): 271. doi:10.1016/0022-1902(64)80069-5. OSTI 4667421.
- ^ Stevenson, J.; Peterson, J. (1979). "Preparation and structural studies of elemental curium-248 and the nitrides of curium-248 and berkelium-249". Journal of the Less Common Metals. 66 (2): 201. doi:10.1016/0022-5088(79)90229-7.
- ^ 무기화학 Gmelin Handbook, 시스템 No. 71, 7권 a, 트랜스우라닉, 파트 B 1, 페이지 67–68.
- ^ Eubanks, I.; Thompson, M. C. (1969). "Preparation of curium metal". Inorganic and Nuclear Chemistry Letters. 5 (3): 187. doi:10.1016/0020-1650(69)80221-7.
- ^ 홀레만, 페이지 1972
- ^ 그린우드, 페이지 1268
- ^ Noe, M.; Fuger, J. (1971). "Self-radiation effects on the lattice parameter of 244CmO2". Inorganic and Nuclear Chemistry Letters. 7 (5): 421. doi:10.1016/0020-1650(71)80177-0.
- ^ Haug, H. (1967). "Curium sesquioxide Cm2O3". Journal of Inorganic and Nuclear Chemistry. 29 (11): 2753. doi:10.1016/0022-1902(67)80014-9.
- ^ Fuger, J.; Haire, R.; Peterson, J. (1993). "Molar enthalpies of formation of BaCmO3 and BaCfO3". Journal of Alloys and Compounds. 200 (1–2): 181. doi:10.1016/0925-8388(93)90491-5.
- ^ Domanov, V. P. (January 2013). "Possibility of generation of octavalent curium in the gas phase in the form of volatile tetraoxide CmO4". Radiochemistry. 55 (1): 46–51. doi:10.1134/S1066362213010098. S2CID 98076989.
- ^ Zaitsevskii, Andréi; Schwarz, W. H. Eugen (April 2014). "Structures and stability of AnO4 isomers, An = Pu, Am, and Cm: a relativistic density functional study". Physical Chemistry Chemical Physics. 2014 (16): 8997–9001. Bibcode:2014PCCP...16.8997Z. doi:10.1039/c4cp00235k. PMID 24695756.
- ^ Keenan, T. (1967). "Lattice constants of K7Cm6F31 trends in the 1:1 and 7:6 alkali metal-actinide(IV) series". Inorganic and Nuclear Chemistry Letters. 3 (10): 391. doi:10.1016/0020-1650(67)80092-8.
- ^ Asprey, L. B.; Keenan, T. K.; Kruse, F. H. (1965). "Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium". Inorganic Chemistry. 4 (7): 985. doi:10.1021/ic50029a013.
- ^ Burns, J.; Peterson, J. R.; Stevenson, J. N. (1975). "Crystallographic studies of some transuranic trihalides: 239PuCl3, 244CmBr3, 249BkBr3 and 249CfBr3". Journal of Inorganic and Nuclear Chemistry. 37 (3): 743. doi:10.1016/0022-1902(75)80532-X.
- ^ Wallmann, J.; Fuger, J.; Peterson, J. R.; Green, J. L. (1967). "Crystal structure and lattice parameters of curium trichloride". Journal of Inorganic and Nuclear Chemistry. 29 (11): 2745. doi:10.1016/0022-1902(67)80013-7.
- ^ Weigel, F.; Wishnevsky, V.; Hauske, H. (1977). "The vapor phase hydrolysis of PuCl3 and CmCl3: heats of formation of PuOC1 and CmOCl". Journal of the Less Common Metals. 56 (1): 113. doi:10.1016/0022-5088(77)90224-7.
- ^ 트로크, R.Actinide Monochalcogenides, Volume 27, Springer, 2009 ISBN 3-540-29177-6, 페이지 4
- ^ Damien, D.; Charvillat, J. P.; Müller, W. (1975). "Preparation and lattice parameters of curium sulfides and selenides". Inorganic and Nuclear Chemistry Letters. 11 (7–8): 451. doi:10.1016/0020-1650(75)80017-1.
- ^ Lumetta, G. J.; Tompson, Penneman, R. A.; Eller, P. G. Curium 2010-07-17 웨이백머신, Springer, 2004, 페이지 1420–1421에 보관.ISBN 0387341226, ISBN 978-0387 341224
- ^ Elschenbroich, Ch. Organometalic Chemistry, 제6판, Wiesbaden 2008, ISBN 978-3-8351-0167-8, 페이지 589
- ^ Kerridge, Andrew; Kaltsoyannis, Nikolas (2009). "Are the Ground States of the Later Actinocenes Multiconfigurational? All-Electron Spin−Orbit Coupled CASPT2 Calculations on An(η8-C8H8)2(An = Th, U, Pu, Cm)". The Journal of Physical Chemistry A. 113 (30): 8737–8745. Bibcode:2009JPCA..113.8737K. doi:10.1021/jp903912q. PMID 19719318.
- ^ Girnt, Denise; Roesky, Peter W.; Geist, Andreas; Ruff, Christian M.; Panak, Petra J.; Denecke, Melissa A. (2010). "6-(3,5-Dimethyl-1H-pyrazol-1-yl)-2,2′-bipyridine as Ligand for Actinide(III)/Lanthanide(III) Separation". Inorganic Chemistry. 49 (20): 9627–9635. doi:10.1021/ic101309j. PMID 20849125. S2CID 978265.
- ^ a b Glorius, M.; Moll, H.; Bernhard, G. (2008). "Complexation of curium(III) with hydroxamic acids investigated by time-resolved laser-induced fluorescence spectroscopy". Polyhedron. 27 (9–10): 2113. doi:10.1016/j.poly.2008.04.002.
- ^ a b Heller, Anne; Barkleit, Astrid; Bernhard, Gert; Ackermann, Jörg-Uwe (2009). "Complexation study of europium(III) and curium(III) with urea in aqueous solution investigated by time-resolved laser-induced fluorescence spectroscopy". Inorganica Chimica Acta. 362 (4): 1215. doi:10.1016/j.ica.2008.06.016.
- ^ a b Moll, Henry; Johnsson, Anna; Schäfer, Mathias; Pedersen, Karsten; Budzikiewicz, Herbert; Bernhard, Gert (2007). "Curium(III) complexation with pyoverdins secreted by a groundwater strain of Pseudomonas fluorescens". BioMetals. 21 (2): 219–228. doi:10.1007/s10534-007-9111-x. PMID 17653625. S2CID 24565144.
- ^ a b Moll, Henry; Geipel, Gerhard; Bernhard, Gert (2005). "Complexation of curium(III) by adenosine 5′-triphosphate (ATP): A time-resolved laser-induced fluorescence spectroscopy (TRLFS) study". Inorganica Chimica Acta. 358 (7): 2275. doi:10.1016/j.ica.2004.12.055.
- ^ "Biochemical Periodic Table – Curium". UMBBD. 2007-06-08. Retrieved 2011-03-25.
- ^ Moll, H.; Stumpf, T.; Merroun, M.; Rossberg, A.; Selenska-Pobell, S.; Bernhard, G. (2004). "Time-resolved laser fluorescence spectroscopy study on the interaction of curium(III) with Desulfovibrio äspöensis DSM 10631T". Environmental Science & Technology. 38 (5): 1455–1459. Bibcode:2004EnST...38.1455M. doi:10.1021/es0301166. PMID 15046347.
- ^ Ozaki, T.; et al. (2002). "Association of Eu(III) and Cm(III) with Bacillus subtilis and Halobacterium salinarium". Journal of Nuclear Science and Technology. Suppl. 3: 950–953. doi:10.1080/00223131.2002.10875626. S2CID 98319565. Archived from the original on 2009-02-25.
- ^ 바인더, Harry H.:Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3, 페이지 174–178.
- ^ 무기화학 Gmelin Handbook, 시스템 No.71, 7a, 트랜스우라늄, 파트 A2, 페이지 289
- ^ Kronberg, Andreas, 플루토늄-Batterien Archived 2013-12-26 Wayback Machine (독일어) "Archived copy". Archived from the original on February 21, 2011. Retrieved April 28, 2011.
{{cite web}}: CS1 maint: 타이틀 (링크) CS1 maint: bott: 원본 URL 상태 알 수 없음 (링크) - ^ 홀레만, 1980-1981페이지.
- ^ Seaborg, Glenn T. (1996). Adloff, J. P. (ed.). One Hundred Years after the Discovery of Radioactivity. Oldenbourg Wissenschaftsverlag. p. 82. ISBN 978-3-486-64252-0.
- ^ "Der Rosetta Lander Philae". Bernd-leitenberger.de. 2003-07-01. Retrieved 2011-03-25.
- ^ Rieder, R.; Wanke, H.; Economou, T. (September 1996). "An Alpha Proton X-Ray Spectrometer for Mars-96 and Mars Pathfinder". Bulletin of the American Astronomical Society. 28: 1062. Bibcode:1996DPS....28.0221R.
- ^ 라이텐버거, 베른드 다이 서베이 라움슨덴(독일어)
- ^ Nicks, Oran (1985). "Ch. 9. Essentials for Surveyor". SP-480 Far Travelers: The Exploring Machines. NASA.
- ^ 알파 입자 X선 분광계(APXS), 코넬 대학교
- ^ 호프만, Kann Man Gold machen? 가우너, 고클러 앤 겔레르테 아우스 데르 게시히테 데르 케미셴 엘리멘테 (금을 만들 수 있는가?사기꾼, 광대, 학자.화학 원소의 역사로부터), 우라니아-베를라크, 라이프치히, 제나, 1979년 베를린, ISBN 없음, 페이지 233
- ^ Baetslé, L. H. 방사성 폐기물 관리에서의 방사성 물질의 분할/전송의 응용 벨기에 Sk/Cen, Mol, 2001년 9월, 벨기에의 Wayback Machine, 원자력 연구 센터에 2005-04-26 보관.
참고 문헌 목록
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- 홀레만, 아놀드 F.와 위버그, 닐 르르부흐 데르 아노간시첸 케미, 102 에디션, 드 그루이터, 2007 베를린, ISBN 978-3-11-017770-1.
- 페네만, R. A., 키넌 T. K.1960년 캘리포니아 로스앨러모스 캘리포니아 대학교 아메리슘과 큐륨의 방사화학
외부 링크
| 위키미디어 커먼스는 퀴리움 관련 매체를 보유하고 있다. |
| 무료 사전인 Wiktionary에서 큐리움을 찾아보십시오. |
- 주기율표 비디오의 큐륨 (노팅엄 대학교)
- NLM 위험 물질 데이터 뱅크 - 큐륨, 방사능









![{\displaystyle {\ce {^{238}_{92}U->[{\ce {(n,\gamma )}}]{^{239}_{92}U}->[\beta ^{-}][23.5\ {\ce {min}}]_{93}^{239}Np->[\beta ^{-}][2.3565\ {\ce {d}}]_{94}^{239}Pu}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c30c60d3b829e92822267f24b94337ce0d267d38)
![{\displaystyle {\ce {^{239}_{94}Pu->[{\ce {2(n,\gamma )}}]_{94}^{241}Pu->[\beta ^{-}][14.35\ {\ce {yr}}]{^{241}_{95}Am}->[{\ce {(n,\gamma )}}]_{95}^{242}Am->[\beta ^{-}][16.02{\ce {h}}]_{96}^{242}Cm}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee8c743c87eab605b6f80f80388eeb9f462b4086)
![{\displaystyle {\ce {^{239}_{94}Pu->[{\ce {4(n,\gamma )}}]_{94}^{243}Pu->[\beta ^{-}][4.956\ {\ce {h}}]_{95}^{243}Am->[({\ce {n}},\gamma )]_{95}^{244}Am->[\beta ^{-}][10.1{\ce {h}}]_{96}^{244}Cm->[\alpha ][18.11\ {\ce {yr}}]_{94}^{240}Pu}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e202c162172b717f887b5f0bd06d3e01057ae924)

![{\displaystyle {\begin{matrix}{}\\{\ce {^{252}_{98}Cf ->[\alpha][2.645\ {\ce {yr}}] ^{248}_{96}Cm}}\\{}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6cc4394eb604706a66a7112cda30cf38f857380)
![{\displaystyle {\ce {^{249}_{97}Bk ->[\beta^-][330\ {\ce {d}}] ^{249}_{98}Cf ->[\alpha][351\ {\ce {yr}}] ^{245}_{96}Cm}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7ccddd548852fda4a6af794bec61eda1293ebdd8)


![{\displaystyle {\ce {4CmO2 ->[\Delta T] 2Cm2O3 + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d347ad5669ad313e0453be3c15f15e400c2d5ef8)










