철
Iron | |||||||||||||||||||||||||||||||||||||||||
| 철 | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 동소체 | 철분 동소체 참조 | ||||||||||||||||||||||||||||||||||||||||
| 외모 | 회색빛을 띤 광택이 나는 금속 | ||||||||||||||||||||||||||||||||||||||||
| 표준 원자량Ar°(Fe) |
| ||||||||||||||||||||||||||||||||||||||||
| 주기율표의 철 | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 26 | ||||||||||||||||||||||||||||||||||||||||
| 그룹. | 그룹 8 | ||||||||||||||||||||||||||||||||||||||||
| 기간 | 4주기 | ||||||||||||||||||||||||||||||||||||||||
| 블록 | d블록 | ||||||||||||||||||||||||||||||||||||||||
| 전자 구성 | [Ar] 3d6 4s2 | ||||||||||||||||||||||||||||||||||||||||
| 셸당 전자 수 | 2, 8, 14, 2 | ||||||||||||||||||||||||||||||||||||||||
| 물리 속성 | |||||||||||||||||||||||||||||||||||||||||
| 단계 STP에서 | 단단한 | ||||||||||||||||||||||||||||||||||||||||
| 녹는점 | 1811 K (1538 °C, 2800 °F) | ||||||||||||||||||||||||||||||||||||||||
| 비등점 | 3134 K (2862 °C, 5182 °F) | ||||||||||||||||||||||||||||||||||||||||
| 밀도 (근처) | 7.874 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| 액상일 때(로) | 6.98 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| 융해열 | 13.81 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| 기화열 | 340 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| 몰 열용량 | 25.10 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||
증기압
| |||||||||||||||||||||||||||||||||||||||||
| 원자 특성 | |||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | -4, -2, -1, 0, +1, [2]+2, +3, +4, +5, [3]+6, +7[4](양성 산화물) | ||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 | 폴링 스케일: 1.83 | ||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| ||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 경험적: 126 pm | ||||||||||||||||||||||||||||||||||||||||
| 공유 반지름 | 저회전: 132±3pm 고회전: 152±6pm | ||||||||||||||||||||||||||||||||||||||||
| 반데르발스 반지름 | 194 [1] pm | ||||||||||||||||||||||||||||||||||||||||
| 철의 스펙트럼 라인 | |||||||||||||||||||||||||||||||||||||||||
| 기타 속성 | |||||||||||||||||||||||||||||||||||||||||
| 자연발생 | 원시적인 | ||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 체심입방체(BCC) a=오후 286.65 | ||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 면중심입방체(표준) 1185-1667K, a=364.680pm | ||||||||||||||||||||||||||||||||||||||||
| 음속 얇은 막대기 | 5120 m/s(시) (시) (시) | ||||||||||||||||||||||||||||||||||||||||
| 열팽창 | 11.8 µm/(mkK) (25 °C에서) | ||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 80.4 W/(mµK) | ||||||||||||||||||||||||||||||||||||||||
| 전기 저항률 | 96.1 NΩm (20 °C에서) | ||||||||||||||||||||||||||||||||||||||||
| 퀴리점 | 1043 K | ||||||||||||||||||||||||||||||||||||||||
| 자기 순서 | 강자성의 | ||||||||||||||||||||||||||||||||||||||||
| 영률 | 211 GPa | ||||||||||||||||||||||||||||||||||||||||
| 전단 계수 | 82 GPa | ||||||||||||||||||||||||||||||||||||||||
| 벌크 계수 | 170 GPa | ||||||||||||||||||||||||||||||||||||||||
| 포아송비 | 0.29 | ||||||||||||||||||||||||||||||||||||||||
| 모스 경도 | 4 | ||||||||||||||||||||||||||||||||||||||||
| 비커스 경도 | 608 MPa | ||||||||||||||||||||||||||||||||||||||||
| 브리넬 경도 | 200 ~ 1180 MPa | ||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||
| 역사 | |||||||||||||||||||||||||||||||||||||||||
| 검출 | 기원전 5000년 이전 | ||||||||||||||||||||||||||||||||||||||||
| 기호. | 'Fe' : 라틴어 페럼에서 | ||||||||||||||||||||||||||||||||||||||||
| 철의 주요 동위원소 | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
철(/aaərn/)은 화학 원소로 기호는 Fe(라틴어: ferrum), 원자 번호는 26입니다.이것은 주기율표의 첫 번째 전이계열과 8족에 속하는 금속이다.그것은 질량으로 따지면 지구상에서 가장 흔한 원소이며, 산소 바로 앞(각각 32.1%, 30.1%)에서 지구의 외핵과 내핵의 대부분을 형성하고 있다.그것은 지구 지각에서 네 번째로 흔한 원소이다.
금속 상태에서는, 철은 지구의 지각에서 희귀하며, 주로 운석에 의한 퇴적에만 한정된다.반면 철광석은 지각에 가장 많이 존재하지만, 철광석에서 사용 가능한 금속을 추출하려면 구리 제련에 필요한 것보다 약 500°C(932°F) 높은 1,500°C(2,730°F) 이상의 가마나 용광로가 필요합니다.인간은 기원전 2천 년 동안 유라시아에서 그 과정을 마스터하기 시작했고, 기원전 1200년경 일부 지역에서 철 도구와 무기의 사용이 구리 합금을 대체하기 시작했다.그 사건은 청동기 시대에서 철기 시대로의 이행으로 여겨진다.현대 세계에서 철 합금은 기계적 특성과 낮은 비용 때문에 단연코 가장 일반적인 산업용 금속입니다.따라서 철과 철강 산업은 경제적으로 매우 중요하며, 철은 가장 저렴한 금속으로 kg당 또는 파운드당 가격이 몇 달러입니다(금속 #uses 참조).
깨끗하고 매끄러운 순철 표면은 거울처럼 은회색을 띠고 있습니다.하지만, 철은 산소와 물과 쉽게 반응하여 갈색에서 검은색의 수화 철산화물, 흔히 녹이라고 알려져 있습니다.부식층을 형성하는 다른 금속의 산화물과 달리, 녹은 금속보다 더 많은 부피를 차지하기 때문에 부식이 발생하기 때문에 새로운 표면이 노출됩니다.철은 쉽게 반응하지만 전해철이라 불리는 고순도 철은 내식성이 더 우수합니다.
성인 인간의 몸에는 주로 헤모글로빈과 미오글로빈에 약 4그램(0.005%)의 철분이 포함되어 있습니다.이 두 단백질은 각각 혈액에 의한 산소 운반과 근육에 있는 산소 저장에 의해 척추 동물 대사에 필수적인 역할을 합니다.필요한 수치를 유지하기 위해, 인간의 철분 신진대사는 식단에서 최소한의 철분을 필요로 한다.철분은 또한 세포 호흡과 산화 그리고 식물과 [5]동물의 감소를 다루는 많은 중요한 산화 환원 효소의 활성 부위에 있는 금속입니다.
화학적으로 철의 가장 일반적인 산화 상태는 철이다.II) 및 철(III)입니다.철은 다른 8족 원소인 루테늄과 오스뮴을 포함한 다른 전이 금속의 많은 성질을 공유합니다.철은 -2에서 +7의 광범위한 산화 상태에서 화합물을 형성합니다.철은 또한 많은 배위 화합물을 형성합니다; 페로센, 철옥살산철, 프러시아 블루와 같은 일부 화합물은 상당한 산업, 의학 또는 연구 용도를 가지고 있습니다.
특성.
동소체
적어도 4개의 철 동소체(고체 중의 확산 원자 배열)가 알려져 있으며, 통상은 α, β, β 및 β로 표기되어 있다.

처음 세 가지 형태는 일반적인 압력에서 관찰됩니다.용융철은 응고점인 1538°C를 지나 냉각되면 체심입방체(BCC) 결정구조를 가진 γ 동소체로프 형태로 결정된다.1394°C까지 냉각되면 γ-철 동소체, 면중심입방체(FCC) 결정구조 또는 오스테나이트로 변화한다.912°C 이하에서는 결정구조가 다시 BCCα-철 [6]동소체가 된다.
매우 높은 압력과 온도에서 철의 물리적 특성 또한 광범위하게 [7][8]연구되어 왔는데, 이는 철이 지구와 다른 행성들의 핵에 대한 이론과 관련이 있기 때문이다.약 10GPa 이상 및 수백 켈빈 이하의 온도에서 α-철은 또 다른 육각형 밀착(hcp) 구조로 변화하며, β-철이라고도 합니다.고온의 δ상도 δ-Iron으로 변화하지만 높은 압력에서는 변화합니다.
50 GPa 이상의 압력과 최소 1500K의 온도에서 안정적인 β 단계에 대해 논란이 되는 실험 증거가 존재한다.이것은 오르토롬 또는 이중 hcp [9]구조를 가지고 있을 것으로 추정됩니다.([6]혼란하게도 결정 구조가 변하지 않았음에도 강자성에서 상사성으로 변할 때 퀴리점 위의 α-철을 가리킬 때도 "β-iron"이라는 용어가 사용됩니다.)
지구의 내부 코어는 일반적으로 β([10]또는 β) 구조의 철-니켈 합금으로 구성되어 있는 것으로 추정됩니다.
녹는점과 끓는점
철 발생의 엔탈피의 녹는점과 끓는점이, 그러한 스칸듐 크롬에서 이전의 3D요소가 움직임이 없는 그 핵심과 점점 더 핵에 의해서 매력을 느낍니다 3일부 귀 서한에 따라서 전자의 금속 결합에 놓여 공헌을 보여 주기 보다;[11] 하지만, 그들은 값보다 높다 낮다. 그이전의 원소 망간은 원소가 반쯤 채워진 3d 서브셸을 가지고 있기 때문에 결과적으로 그 d-metagnes는 쉽게 비국재화되지 않는다.루테늄에도 같은 추세가 나타나지만 [12]오스뮴에는 나타나지 않는다.
50 GPa 미만의 압력에 대해 철의 녹는점이 실험적으로 잘 정의되어 있습니다.더 큰 압력으로 인해 발표된 데이터(2007년 기준)는 여전히 수십 기가파스칼과 1,000 켈빈 [13]이상 차이가 납니다.
자기 특성
퀴리점 770°C(1,420°F; 1,040K) 이하에서는 α-철은 상사성에서 강자성으로 변화한다. 각 원자에서 쌍으로 구성되지 않은 두 전자의 스핀은 일반적으로 인접 전자의 스핀과 일치하여 전체 자기장을 [15]생성한다.이것은 두 전자(d와x2 − y2 d)의z2 궤도가 격자의 인접 원자를 가리키지 않기 때문에 금속 [6]결합에 관여하지 않기 때문에 발생합니다.
자기장의 외부 원천이 없을 때, 원자들은 각 영역의 원자들이 평행 스핀을 가지도록,[16] 약 10 마이크로미터의 자기 영역으로 자발적으로 분할됩니다. 그러나 일부 영역은 다른 방향을 가집니다.따라서 거시적인 철 조각은 전체 자기장이 거의 0에 가까울 것입니다.
외부 자기장을 적용하면 동일한 일반 방향으로 자화된 도메인이 다른 방향을 가리키는 인접 도메인을 희생하여 커지며 외부 자기장이 강화됩니다.이 효과는 변압기, 자기 기록 헤드, 전기 모터와 같이 설계 기능을 수행하기 위해 자기장을 통해야 하는 장치에서 활용됩니다.불순물, 격자 결점 또는 입자와 입자 경계는 새로운 위치에 도메인을 "고정"할 수 있으므로 외부 필드가 제거된 후에도 효과가 지속되므로 철 물체는 (영구적인) [15]자석이 됩니다.
혼합 철의 결정 형태인 미네랄 마그네타이트를 포함한 페라이트 등 일부 철 화합물에서도 유사한 거동이 나타난다(II,III) 산화물FeO34(원자 스케일 메커니즘인 페리마그네틱은 다소 다르지만).자연 영구 자화(지석)가 있는 마그네타이트 조각은 항해를 위한 최초의 나침반을 제공했습니다.마그네타이트 입자는 코어 메모리, 자기 테이프, 플로피, 디스크 등의 자기 기록 매체에 광범위하게 사용되어 코발트계 물질로 대체되었다.
동위원소
철은 Fe (천연 철의 5.845%), Fe (91.754%), Fe (2.119%), Fe (0.282%)의 4가지 안정 동위원소를 가지고 있다.인공 동위원소도 20~30개가 만들어졌다.이러한 안정 동위원소 중 Fe만이 핵 스핀(-)을 갖는다. 122) 이론상으로는54 Cr에 대해 2배의 전자포착을 할 수 있으나 그 과정이 관찰된 적은 없으며 3.1×10년의22 반감기 하한만 설정되었다.[17]
60Fe는 긴 반감기(260만년)[18]의 멸종 방사성핵종이다.지구에서는 발견되지 않지만, 그것의 궁극적인 붕괴 산물은 손녀인 안정된 핵종 [17]Ni이다.철의 동위원소 조성에 대한 과거 연구의 대부분은 운석과 광석 형성에 대한 연구를 통해 Fe의 핵합성에 초점을 맞추었다.지난 10년 동안 질량 분석의 발전으로 안정적인 철 동위원소 비율에서 자연적으로 발생하는 미세한 변화를 검출하고 정량화할 수 있었다.생물 및 산업 시스템에 대한 응용이 대두되고 있지만,[19] 이 작업의 대부분은 지구와 행성 과학 공동체가 주도하고 있습니다.
운석 Semarkona와 Chervony Kut의 상에서는 Fe의 손녀인 Ni의 농도와 안정적인 철 동위원소의 풍부함과의 상관관계를 통해 태양계 형성 당시 Fe의 존재를 알 수 있었다.Fe의 붕괴로 방출된 에너지와 Al이 방출한 에너지는 46억 년 전 소행성이 형성된 후 소행성이 재용해되고 분화하는 데 기여했을 가능성이 있다.외계 물질에 존재하는 Ni의 풍부함은 태양계의 [20]기원과 초기 역사에 대한 더 많은 통찰력을 가져다 줄 수 있다.
가장 풍부한 철 동위원소 Fe는 핵합성의 [21]가장 일반적인 끝점을 나타내기 때문에 핵 과학자들에게 특히 관심이 많다.Ni(14개의 알파 입자)는 초신성의 핵반응에서 알파 과정(실리콘 연소 과정 참조)의 가벼운 핵에서 쉽게 생성되기 때문에, 다른 알파 입자를 추가하여 Zn을 생성하는 것은 엄청난 에너지를 필요로 하기 때문에 매우 질량이 큰 별 내부의 핵융합 사슬의 끝점이다.반감기가 약 6일인 이 Ni는 이들 별에서 대량으로 생성되지만, 초신성 잔류 가스 구름의 초신성 붕괴 생성물 내에서 처음에는 방사성 Co, 그리고 그 다음에는 안정적인 Fe로 두 개의 연속적인 양전자 방출에 의해 곧 붕괴된다.이처럼 철은 적색거성의 핵에서 가장 풍부한 원소이며 철 운석과 [22]지구와 같은 행성의 고밀도 금속핵에서 가장 풍부한 금속이다.그것은 또한 우주에서 매우 흔하며, 거의 같은 원자량을 [22][23]가진 다른 안정된 금속들과 비교된다.철은 우주에서 여섯 번째로 풍부한 원소이며 가장 흔한 내화 [24]원소이다.
결합 에너지가 Fe보다 약간 높은 Ni를 합성함으로써 더 작은 에너지 이득을 추출할 수 있지만, 별의 조건은 이 과정에 적합하지 않습니다.초신성에서의 원소 생성과 지구에서의 분포는 니켈보다 철을 선호하며, 어떤 경우에도 Fe는 가벼운 양성자의 비율이 [25]높기 때문에 여전히 Ni보다 핵자당 질량이 낮습니다.따라서 철보다 무거운 원소는 Fe [22]원자핵을 시작함으로써 빠른 중성자 포획을 수반하는 초신성을 필요로 한다.
우주의 먼 미래에서 양성자 붕괴가 일어나지 않는다고 가정할 때, 양자 터널링을 통해 발생하는 냉융합을 통해 일반 물질의 빛 핵이 Fe 핵으로 융합될 것이다.핵분열과 알파 입자 방출은 무거운 핵을 철로 붕괴시켜 모든 별 질량의 물체를 차가운 철의 [26]구로 바꿀 것이다.
자연에서의 기원과 발생
우주형성
지구와 같은 암석 행성에서 철이 풍부한 것은 철을 [27][28]우주로 흩뿌리는 Ia형 초신성의 폭주하는 핵융합과 폭발 동안 철이 풍부하게 생성되었기 때문이다.
금속 철

금속이나 토종 철은 산화되는 경향이 있기 때문에 지구 표면에서 거의 발견되지 않는다.하지만, 지구 전체 질량의 35%를 차지하는 지구의 내부와 외부 핵은 대부분 철 합금으로 구성되어 있으며, 아마도 니켈로 구성되어 있을 것으로 생각된다.액체 외핵의 전류는 지구 자기장의 근원으로 여겨진다.달뿐만 아니라 다른 지구 행성들(수성, 금성, 화성)은 대부분 철로 이루어진 금속 핵을 가지고 있는 것으로 여겨진다.M형 소행성들은 또한 부분적으로 또는 대부분 금속 철 합금으로 만들어진 것으로 여겨진다.
희귀한 철 운석은 지구 표면에 있는 천연 금속 철의 주요 형태이다.냉간 가공된 운석 철로 만들어진 물품들은 철 제련이 아직 개발되지 않은 시대로 거슬러 올라가는 다양한 고고학 유적지에서 발견되었고 그린란드의 이누이트인들은 도구와 사냥 [29]무기로 케이프 요크 운석의 철을 사용했다고 보고되었다.운석 20개 중 1개는 독특한 철-니켈 광물 태나이트(35~80% 철)와 카마사이트(90~95% 철)[30]로 구성됩니다.천연 철분은 또한 탄소가 풍부한 퇴적암과 접촉한 마그마로 형성된 현무암에서 거의 발견되지 않는데, 이것은 철이 결정화될 수 있을 만큼 산소 공급량을 감소시켰다.이것은 텔루르 철로 알려져 있으며, 서그린란드의 디스코 섬, 러시아의 야쿠티아, 독일의 [31]뵐과 같은 몇몇 지역에서 유래되었다.
맨틀 광물
페리클라아제(MgO)와 뷔스타이트(FeO)의 고체 용액인 페로페리클라아제(Mg,Fe)O는 지구 하부 맨틀의 부피의 약 20%를 차지하는데, 이는 규산염 페로브스카이트(Mg,Fe3) SiO에 이어 그 지역에서 두 번째로 풍부한 광물상입니다. 또한 철의 숙주의 주요 물질입니다.맨틀의 전이대 하부에서 반응 γ-(Mg,Fe)[2SiO4]↔(Mg,Fe)[SiO3]+(Mg,Fe)O에 의해 γ-아미딘이 규산페로브스카이트와 페로페리클라아제의 혼합물로 변환되고 그 반대도 마찬가지이다.문헌에서, 하부 맨틀의 이 광물상은 종종 마그네슘 [33]위스타이트라고도 불립니다.규산페로브스카이트는 하부 [34]맨틀의 93%까지 형성될 수 있으며, 마그네슘 철 형태인 (Mg,Fe)SiO는3 부피의 [35]38%를 차지하는 지구상에서 가장 풍부한 광물로 여겨진다.

철이 지구상에서 가장 풍부한 원소인 반면, 이 철의 대부분은 안쪽과 바깥쪽 [36][37]코어에 집중되어 있습니다.지각에 있는 철의 비율은 지각 전체 질량의 약 5%에 불과하며, 따라서 이 층에서 산소, 실리콘, [38]알루미늄 다음으로 네 번째로 풍부한 원소입니다.
지각에 있는 대부분의 철분은 많은 철광물을 형성하기 위해 다양한 다른 원소들과 결합됩니다.철의 주요 광석인 헤마타이트(FeO23), 마그네타이트(FeO34), 사이더라이트(FeCO3)와 같은 산화철 광물이 중요한 종류입니다.많은 화성암들은 또한 황화물 광물인 피로사이트와 펜틀랜다이트를 [39][40]함유하고 있다.풍화 중에 철은 황산염의 황화물 퇴적물과 중탄산염의 규산염 퇴적물에서 침출되는 경향이 있습니다.둘 다 수용액에서 산화되어 약간 높은 pH에서도 산화철(III)[41]로서 침전된다.
철의 많은 퇴적물은 철이 부족한 셰일 및 셰트 띠와 번갈아 반복되는 산화철의 얇은 층으로 이루어진 암석의 일종인 띠철 형성물입니다.띠 모양의 철제 층은 37억 년 전에서 18억 년 [42][43]전 사이에 놓여졌다.
황토와 같은 미세 분쇄된 산화철(III) 또는 산화수소화물을 포함하는 물질은 역사 이전부터 황색, 적색 및 갈색 색소로 사용되어 왔다.오레곤의 페인트 힐과 번트산드스타인(Buntsandstein, 영국식 [44]분터)과 같은 지질층 전체를 포함한 다양한 암석과 점토의 색깔에도 기여합니다.Eisensandstein (예를 들어 독일의 [45]Donzdorf에서 온 쥐라기 '철 사암')과 영국의 Bath 돌을 통해, 철 화합물은 많은 역사적 건물과 [46]조각의 노란 빛깔의 원인이 된다.화성 표면의 유명한 붉은 색은 산화철이 풍부한 레골리스에서 유래되었다.[47]
황화철 광물 황철광(FeS2)에는 상당한 양의 철이 존재하지만 철을 추출하기 어렵기 때문에 이용되지 않는다.사실, 철은 매우 흔하기 때문에 생산은 일반적으로 매우 많은 양의 철을 가진 광석에만 집중됩니다.
국제자원 패널의 사회 금속 재고 보고서에 따르면, 사회에서 사용되는 철의 전 세계 재고는 1인당 2,200 kg이다.이러한 점에서 선진국은 저개발국과 다르다([48]1인당 2,000kg 대비 7,000–14,000).
해양과학은 고대 바다에서 해양 생물군과 [49]기후 모두에서 철의 역할을 증명했다.
및
| 화 oxidation 표시 | 화합물 |
|---|---|
| - 2 (d10) | 테트라카르보닐페레인산나트륨(콜만 시약) |
| - 1 (d9) | Fe 2(CO)2− 8 |
| 0 (d8) | |
| 1 (d7) | 사이클로펜타디에닐아이론디카르보닐이합체('Fp2') |
| 2 (d6) | 황산철, 페로센 |
| 3 (d5) | 염화철, 테트라플루오로붕산페로세늄 |
| 4 (d4) | Fe(diars) 2Cl2+ 2, 4불화붕산페릴 |
| 5 (d3) | FeO3− 4 |
| 6 (d2) | |
| 7 (d1) | [FeO4]– (매트릭스 분리, 4K) |
철은 전이 금속의 특징적인 화학적 특성, 즉 1단계와 매우 큰 배위 및 유기 금속 화학에 의해 다른 다양한 산화 상태를 형성하는 능력을 보여줍니다: 사실, 1950년대에 [50]후자의 분야를 혁신시킨 것은 철 화합물인 페로센의 발견이었습니다.철은 풍부하고 인류의 [51]기술적 진보에 큰 역할을 했기 때문에 때때로 전이 금속의 전체 블록의 원형으로 여겨집니다.그것의 26개의 전자는 [Ar]3d4s로62 배열되어 있고, 그 중 3d와 4s의 전자는 상대적으로 에너지가 가깝기 때문에 가변적인 수의 전자를 잃을 수 있으며, 더 이상의 이온화가 이득이 [12]되지 않는 명확한 지점이 없다.
철은 주로 산화 상태 +2(철(II), "철")와 +3(철(III, "철")에서 화합물을 형성합니다.철은 또한 높은 산화 상태에서도 발생합니다. 예를 들어 +6 산화 상태의 철을 포함하는 보라색 칼륨 페레이트(KFeO24)입니다.철(VII)산화물(FeO4)은 주장되어 왔지만, 보고서는 재현할 수 없으며, (적어도 철이 +8산화상태일 경우) 앞의 불활성 가스 구성을 넘어 원소의 모든 전자를 제거하는 것은 계산상 [52]불가능하다는 것이 밝혀졌다.단, O/[53]Ar 혼합물에2 레이저 압출된 Fe 원자를 응축시킨 후 철(V)-페록소 이성질체와 함께 +7 산화 상태의 음이온(FeO4)–의 1종을 4K에서 적외선 분광법으로 검출했다.철(IV)은 많은 생화학적 산화 [54][55]반응의 일반적인 중간체이다.수많은 유기 철 화합물은 +1, 0, -1, 또는 -2의 공식 산화 상태를 포함합니다.산화 상태와 기타 결합 특성은 종종 뫼스바우어 [56]분광법을 사용하여 평가된다.많은 혼합 원자가 화합물은 철분을 모두 함유하고 있다.II) 및 철(II) 중심(예: 마그네타이트 및 프러시아 블루(Fe4(Fe[CN]))63[55]후자는 [57]청사진에서 전통적인 "청색"으로 사용됩니다.
철은 무거운 착향료인 루테늄과 오스뮴이 오스뮴보다 [6]난이도가 더 높지만 +8의 그룹 산화 상태에 도달할 수 없는 첫 번째 전이 금속입니다.루테늄은 철과 비슷한 낮은 산화 상태에서 수성 양이온 화학을 보이지만 오스뮴은 그렇지 않아 음이온 [6]복합체를 형성하는 높은 산화 상태를 선호한다.3D 전이 시리즈의 후반부에서, 그룹 하단의 수직 유사성은 주기율표의 이웃 코발트 및 니켈과 철의 수평 유사성과 경쟁합니다. 또한 상온에서 강자성을 띠며 유사한 화학 작용을 공유합니다.이와 같이 철, 코발트, 니켈은 철 [51]삼합체로 분류되기도 한다.
다른 많은 금속들과 달리, 철은 수은과 아말감을 형성하지 않는다.그 결과 수은은 [58]철로 만들어진 표준 76파운드 플라스크(34kg)로 거래됩니다.
철은 그 그룹에서 단연 가장 반응성이 높은 원소이다. 철은 미세하게 나눌 때 발열성이며 묽은 산에 쉽게 용해되어 Fe를2+ 얻는다.그러나 염산과 반응할 수 있는 불침투성 산화층이 형성되기 때문에 농축 질산 [6]및 다른 산화산과는 반응하지 않는다.전해철이라고 불리는 고순도 철은 산화층 때문에 녹에 강한 것으로 여겨진다.
과
철은 다양한 산화물과 수산화합물을 형성한다; 가장 흔한 것은 철(II,III)산화물(FeO34) 및 철(III)산화물(FeO23).상온에서는 불안정하지만 산화철(II)도 존재합니다.이름에도 불구하고, 그것들은 모두 구성이 [59]다를 수 있는 비-스토이코메트리 화합물입니다.이러한 산화물은 철 생산을 위한 주요 광석입니다(블루머리와 용광로 참조).그것들은 또한 페라이트, 컴퓨터의 유용한 자기 저장 매체, 색소의 생산에도 사용된다.가장 잘 알려진 황화철은 황금빛 [55]광택 때문에 바보의 금으로도 알려진 철 황철광이다2.이것은 철(IV) 화합물은 아니지만 실제로는 철이다.II) Fe 및 S2−
2 이온을 왜곡된2+ 염화나트륨 구조로 [59]함유하는 폴리황화물.
이원성 할로겐화 제철과 제철은 잘 알려져 있습니다.할로겐화 제철은 일반적으로 해당 하이드로할산으로 철금속을 처리하여 해당 수화염을 [55]생성하는 과정에서 발생합니다.
- Fe + 2 HX → FeX2 + H2 (X = F, Cl, Br, I)
철은 불소, 염소 및 브롬과 반응하여 해당 할로겐화 제철을 생성하며 염화 제철이 가장 일반적입니다.[60]
- 2 Fe + 3 X2 → 2 FeX3 (X = F, Cl, Br)
요오드화 철은 예외로, Fe의 산화력과3+ [60]I의 높은− 환원력으로 인해 열역학적으로 불안정하다.
- 2− I + 23+ Fe → I2 + 22+ Fe (E0 = +0.23 V)
흑색 고체인 요오드화철은 일반 조건에서는 안정적이지 않지만, 산소와 물을 [60]제외하고 -20°C의 온도에서 헥산과 빛이 존재하는 상태에서 철 펜타카르보닐과 요오드 및 일산화탄소의 반응을 통해 제조할 수 있다.요오드화철과 일부 연질 염기의 복합체는 안정적인 [61][62]화합물로 알려져 있다.

일부 일반적인 철 이온에 대한 산성 수용액의 표준 환원 전위는 [6]다음과 같습니다.
| Fe2+ + 2 e− | 】페 | E0 = -0.447 V |
| Fe3+ + 3 e− | 】페 | E0 = -0.037 V |
| FeO2− 4 + 8 H+ + 3 e− | § Fe3+ + 42 HO | E0 = +2.20 V |
붉은 보라색 사면체 페레이트(VI) 음이온은 매우 강한 산화제이므로 상온에서 질소와 암모니아를 산화시키고 산성 또는 중성 [60]용액에서 물 자체를 산화시킵니다.
- 42−
4 FeO + 10
2 HO → 43+
Fe + 20−
OH + 32 O
Fe 이온은 다음과3+ 같이 [63]pH가 0 이상 증가하면 옅은 자줏빛의 헥사코 이온 [Fe2(63+HO)]이 매우 쉽게 가수분해되지만, 양이온 화학은 크다.
| [Fe(H2O)6]3+ | 【Fe2(HO)(5OH+)】+2+H | K = 10−3.05 mol−3 dm |
| [Fe(H2O)5(OH)]2+ | 【Fe2(HO)(4OH+)】+2+H | K = 10−3.26 mol−3 dm |
| 2 [Fe(HO2)]63+ | § [Fe2(HO)(4OH)]4+2+ + 2H2 + 2HO | K = 10−2.91 mol−3 dm |
pH가 0 이상으로 상승하면 위의 황색 가수분해종이 형성되고, 2-3 이상으로 상승하면 적갈색 수성 철(II) 산화물이 용액 밖으로 침전됩니다.Fe는 d 구성을5 가지고 있지만, 흡수3+ 스펙트럼은 약한 스핀 금지 d-d 밴드를 가진 Mn의 흡수2+ 스펙트럼과 같지 않다. 왜냐하면 Fe는 더 높은 양의 전하를 가지고 더 분극이 심하기 때문에 배위자 대 금속 전하 전달 흡수의 에너지를 낮추기 때문이다3+.따라서 헥사쿠오 이온을 제외하고 위의 모든 복합체는 다소 강한 색상으로 나타나며, 그마저도 가까운 자외선 [63]영역에서 전하 전달에 의해 지배되는 스펙트럼을 가지고 있다.반면 옅은 녹색 철은II) 헥사쿠이온 [Fe(HO2)]62+은 현저한 가수분해를 받지 않는다.탄산 음이온이 첨가될 때 이산화탄소는 진화하지 않고, 대신 백색 철분이 된다.II) 탄산염이 침전되는 것.과도한 이산화탄소는 지하수에서 흔히 발생하는 약간 용해성 중탄산염을 형성하지만, 상당한 수의 [64]하천에 존재하는 갈색 퇴적물을 설명하는 산화철(II)을 형성하기 위해 공기 중에 빠르게 산화됩니다.
철의 전자 구조 때문에, 철은 매우 큰 배위와 유기 금속 화학을 가지고 있습니다.

철의 많은 배위 화합물이 알려져 있다.대표적인 6좌표 음이온은 혼합염 테트라키스(메틸암모늄) [65][66]헥사클로로페레이트(II) 중 헥사클로로페레이트(II) [FeCl]3−이다6.여러 개의 이원배위자를 가진 복합체는 기하학적 이성질체를 가진다.예를 들어 트랜스클로로히드리도비스(bis-1,2-(디페닐포스피노)에탄) 철(II) 착체를 Fe(dppe)2[67][68] 단위가 있는 화합물의 시작재로 사용한다.3개의 옥살산염 배위자(오른쪽 그림)를 가진 철산화물 이온은 IUPAC [63]규칙에 따라 왼쪽 나사 축의 경우 δ(lambda) 및 오른쪽 나사 축의 경우 δ(delta)라는 라벨이 붙은 2개의 비초과성 기하학적 구조를 사용하여 헬리컬 키랄성을 나타낸다.페리오실산칼륨은 화학작용측정법에 사용되며 나트륨염과 함께 구식 사진공정에서 광호흡을 한다.철분의 이수화물(II) 옥살산염은 아래 [69]그림과 같이 각 8면체의 캡을 형성하는 결정의 물과 철의 중심 사이에 동평면 옥살산염 이온이 가교하는 중합체 구조를 가진다.
철(III) 복합체는 N-공여 리간드 대신 O-공여자를 선호하는 철(III)을 제외하고는 크롬(III) 복합체와 상당히 유사하다.후자는 철보다 불안정한 경향이 있다.II) 물속에서 복합적으로 분리되는 경우가 많다.많은 Fe-O 복합체는 강렬한 색상을 나타내며 페놀 또는 에놀 테스트로 사용됩니다.예를 들어 페놀의 존재 여부를 확인하는 데 사용되는 염화철 테스트에서 염화철(II)은 페놀과 반응하여 딥 바이올렛 [63]복합체를 형성합니다.
- 3 ArOH + FeCl3 → Fe(OAr)3 + 3 HCl (Ar = 아릴)
할로겐화물 및 의사할라이드 복합체 중 철(II)의 불소 착체가 가장 안정적이며, 수용액 중 무색[FeF(2−HO2)]이5 가장 안정적이다.클로로 착체는 [FeCl4]−과 같이 안정성이 떨어지고 사면체 배위성이 좋아 [FeBr4]−와 [FeI4]−는 쉽게 철(II)로 환원된다.티오시아네이트는 혈중 적색(Fe(SCN)(HO)52+을2 형성하기 때문에 철(II)의 존재에 대한 일반적인 검사이다.망간 같은 거II) 대부분의 철(III) 복합체는 고스핀이지만 시안화물 등의 분광화학 계열에서 높은 리간드를 가진 복합체는 예외이다.저회전 철(III) 복합체의 예는 [Fe(CN)]63−입니다.시안화물 배위자는 [Fe(CN)]63−에서 쉽게 분리될 수 있으며, 따라서 이 복합체는 철과 달리 독성이 있다.II) 프러시아 [63]블루에서 발견되는 복합체 [Fe(CN)]64− 묽은 산을 [64]첨가하는 경우를 제외하고는 시안화수소를 방출하지 않는다.철은 0(반자성)에서 5⁄2(5쌍이 아닌 전자)까지의 d-블록 원소에 대해 가능한 모든 스핀 양자수 값을 포함하여 매우 다양한 전자 스핀 상태를 보여줍니다.이 값은 항상 짝이 없는 전자 수의 절반입니다.0에서 2개의 짝이 없는 전자를 가진 복합체는 저회전, 4개 또는 5개의 전자를 가진 복합체는 [59]고회전이라고 간주된다.
철(II) 착체는 철(II) 착체에 비해 안정성은 떨어지지만, O-공여 리간드에 대한 선호도는 덜 표시되므로 예를 들어 [Fe3(62+NH)]는 알려진 반면 [Fe(NH3)]63+는 알려지지 않았다.이들은 철(III)로 산화되는 경향이 있지만 낮은 pH와 사용되는 [64]특정 리간드에 의해 완화될 수 있다.
금속
유기 철 화학은 탄소 원자가 금속 원자에 공유 결합되어 있는 철의 유기 금속 화합물에 대한 연구입니다.시안화물 복합체, 카르보닐 복합체, 샌드위치 및 하프샌드위치 화합물 등 다양합니다.
프러시아 블루 또는 "제철 페로시아니드"인4 Fe[Fe(63CN)]는 오래되고 잘 알려진 철-시아니드 복합체로 안료 및 여러 다른 용도로 널리 사용됩니다.Fe와 Fe3+ 수용액이2+ (각각) 펠리시안화칼륨과 반응하여 프러시아 [55]블루를 형성하기 때문에 Fe와 Fe 수용액을 구별하는 간단한 습식 화학 실험으로 사용할 수 있다.
유기철 화합물의 또 다른 오래된 예는 5개의 일산화탄소 분자의 탄소 원자에 중성 철 원자가 결합되어 있는 철 펜타카르보닐, Fe(CO)5이다.이 화합물은 금속 철의 반응성이 높은 형태인 카르보닐 철 분말을 만드는 데 사용될 수 있습니다.철 펜타카르보닐의 열분해는 3개의 철 원자의 군집이 중심에 있는 복합체인 트라이아이론 도데카카르보닐, Fe3(CO)12를 생성한다.콜만의 시약인 테트라카르보닐페레이트 이나트륨은 유기화학에 유용한 시약으로 -2 산화상태의 철분을 함유하고 있다.사이클로펜타디에닐아이론 디카르보닐 이합체는 희소한 +1 [70]산화상태의 철분을 함유하고 있다.
이 분야의 획기적인 점은 1951년 파우슨과 킬리에[71] 의해 그리고 밀러와 [72]동료들에 의해 독립적으로 현저하게 안정된 샌드위치 화합물 페로센 Fe(CH)2를55 발견한 것이다. 밀러와 동료들은 불과 1년 후에 우드워드, 윌킨슨[73], [74]피셔에 의해 놀라운 분자 구조를 결정했다.페로센은 여전히 이 [75]클래스에서 가장 중요한 도구와 모델 중 하나입니다.
촉매로는 철심 유기금속종을 이용한다.예를 들어 Knölker 복합체는 케톤의 [76]수소화 전달 촉매이다.
업계에서 가장 큰 규모로 생산되는 철화합물은 철이다.II) 황산염(FeSO4·7)HO2) 및 염화철(III)(FeCl3).전자는 가장 쉽게 구할 수 있는 철(II) 공급원 중 하나이지만, Mohr의 소금(NH4)2Fe(SO4)·26보다 공기 산화에 덜 안정적이다.HO2. 아이언(II) 화합물은 공기 [55]중에 철(II) 화합물로 산화되는 경향이 있다.
★★★
야금의
철은 의심할 [77]여지 없이 고대 세계에 알려진 원소 중 하나이다.그것은 수천 년 동안이나 계속되어 왔다.그러나 오래 된 철제 물체는 [78]쉽게 부식되기 때문에 금이나 은으로 만든 물건보다 훨씬 희귀하다.기술은 천천히 발전했고, 제련의 발견 이후에도 철이 도구와 무기의 금속으로 선택된 청동을 대체하는데 수 세기가 걸렸다.
기원전 3500년 이전에 운석철로 만들어진 구슬은 이집트 게르제에서 G.A.[79] 웨인라이트에 의해 발견되었다.이 구슬들은 7.5%의 니켈을 함유하고 있는데, 이것은 지구의 지각에서 발견되는 철분이 일반적으로 아주 작은 니켈 불순물만을 가지고 있기 때문에 운석 기원의 상징이다.
운석철은 하늘에서 유래한 것으로 높이 평가되었고 무기와 도구를 [79]위조하는 데 자주 사용되었습니다.예를 들어,[80][81][82] 투탕카멘의 무덤에서는 고대 유성우에 의해 퇴적된 이 지역에서 발견된 운석과 비슷한 비율의 철, 코발트, 니켈이 들어 있는 운석으로 만들어진 단검이 발견되었다.이집트인들이 철로 만든 것으로 보이는 물건들은 [78]기원전 3000년에서 2500년까지 거슬러 올라간다.
운석 철은 비교적 부드럽고 연성이 있으며 냉간 단조가 용이하지만 니켈 [83]함량 때문에 가열되면 부서질 수 있습니다.

최초의 철 생산은 중세 청동기 시대에 시작되었지만, 철이 청동을 대체하기까지는 수 세기가 걸렸다.아스마르, 메소포타미아, 시리아 북부의 톨 차가르 바자에서 제련된 철의 샘플은 [84]기원전 3000년에서 2700년 사이에 만들어졌다.히타이트인들은 기원전 1600년경 중앙 아나톨리아에 제국을 세웠다.그들은 광석에서 철의 생산을 이해하고 그들의 사회에서 [85]철을 높이 평가하는 최초의 사람들인 것으로 보인다.히타이트인들은 기원전 1500년에서 1200년 사이에 철을 제련하기 시작했고 기원전 [84]1180년에 그들의 제국이 멸망한 후 그 관습은 근동의 나머지 지역으로 퍼져나갔다.그 이후의 시기는 철기 시대라고 불린다.
제련된 철의 유물은 [86]기원전 1800년부터 1200년까지의 인도와 기원전 1500년 [87][88]경의 레반트에서 발견된다.인도 베다의 철에 대한 언급(남아시아의 야금 역사 비교)은 인도에서 철이 매우 일찍 사용되었다는 주장으로 사용되었고, 지금까지도 이와 같은 내용의 문헌이 있다.리그베다 용어(금속)는 구리를 지칭하는 반면, 문자 그대로 "검은 구리"인 야마 아야스라고 불리는 철은 후기 강성 아타르바베다에서 [89]먼저 언급된다.
몇몇 고고학적 증거들은 철이 기원전 [90]8세기 짐바브웨와 아프리카 남동부에서 제련되었다는 것을 암시한다.제철은 기원전 11세기 후반에 그리스에 도입되었고,[91] 그리스에서 유럽 전역으로 빠르게 퍼져나갔다.
중앙유럽과 서유럽에서의 철공의 확산은 켈트족의 확장과 관련이 있다.대 플리니우스에 따르면, 철의 사용은 로마 [79]시대에 흔했다.현재 중국이라고 생각되는 땅에서 철은 [92]대략 기원전 700~500년에 나타난다.철제련은 중앙아시아를 [93]통해 중국으로 유입되었을 수 있다.중국에서 용광로를 사용한 최초의 증거는 서기 [94]1세기이며, 큐폴라로는 전국시대(기원전 [95]403-221년)부터 사용되었다.송나라와 [96]당나라에는 송풍로와 큐폴라가 널리 사용되었습니다.
영국의 산업 혁명 동안, 헨리 코트는 혁신적인 생산 시스템을 사용하여 선철에서 연철로 철을 정제하기 시작했습니다.1783년에 그는 철광석을 정제하기 위한 웅덩이 공정의 특허를 취득했다.그것은 나중에 조셉 [97]홀을 포함한 다른 사람들에 의해 개선되었다.
철철
주철은 기원전 [98]5세기 중국에서 처음 생산되었지만 중세까지는 [99][100]유럽에서 거의 생산되지 않았다.최초의 주철 유물은 고고학자들에 의해 현재 중국 장쑤성 루허현에서 발견되었다.고대 중국에서 주철은 전쟁, 농업, [101]건축에 사용되었다.중세 동안, 유럽에서 정교한 단조물을 사용하여 주철(이 문맥에서는 선철로 알려진)에서 연철을 생산하는 수단이 발견되었다.이 모든 과정을 위해 숯이 [102]연료로 필요했습니다.
중세의 용광로는 높이가 약 3m였고 내화 벽돌로 제작되었습니다. 강제 공기는 보통 손으로 작동하는 [100]풀무로 제공되었습니다.현대식 용광로는 직경 14미터의 난로가 있어 규모가 훨씬 커졌고, 매일 수천 톤의 철을 생산할 수 있지만, 기본적으로는 중세 [102]시대와 거의 같은 방식으로 작동합니다.
1709년 아브라함 다비 1세는 코크스 연소식 용광로를 설립하여 숯을 대체하는 주철을 생산하였으나 용광로는 계속 사용하였습니다.그에 따른 값싼 철의 가용성은 산업혁명을 이끈 요인 중 하나였다.18세기 말, 주철은 연철을 대체하기 시작했는데, 그 이유는 연철이 더 저렴했기 때문이다.철의 탄소 함량은 18세기까지 [84]연철, 주철, 강철의 특성 차이에 대한 이유로 언급되지 않았다.
철은 값이 싸고 양이 많아지면서 1778년 혁신적인 최초의 철교가 건설된 이후 주요 구조 재료가 되었다.이 다리는 오늘날에도 여전히 산업 혁명에서 철의 역할을 한 기념물로 서 있다.그 후, 철은 철도, 보트, 선박, 수도관, 건물뿐만 아니라 증기기관의 [102]철제 실린더에 사용되었다.철도는 근대성과 진보의 개념을[103] 형성하는 데 중심적 역할을 해왔고 다양한 언어 (예: 프랑스어, 스페인어, 이탈리아어, 독일어)는 철도를 철길이라고 부릅니다.
★★★
선철보다 탄소 함량이 적지만 연철보다 많은 강철은 고대에 블루머리를 사용하여 처음 생산되었습니다.페르시아 서부의 루리스탄에 있는 [84]대장장이들은 기원전 1000년까지 좋은 강철을 만들고 있었다.그 후 개량된 인도의 우츠강과 다마스쿠스강이 각각 기원전 300년 경과 서기 500년 경에 개발되었다.이 방법들은 전문화되었고, 그래서 강철은 [104]1850년대까지 주요 상품이 되지 못했다.
철봉을 석출 공정에서 침탄시켜 제조하는 새로운 방법은 17세기에 고안되었다.산업혁명에서는 숯을 사용하지 않고 철을 생산하는 새로운 방법이 고안되어 나중에 강철을 생산하는 데 사용되었다.1850년대 후반, 헨리 베세머는 녹은 선철을 통해 공기를 내뿜는 새로운 제강 공정을 발명하여 연강을 생산하였다.이것은 강철을 훨씬 더 경제적으로 만들었고, 그 결과 더 이상 많은 양의 [105]단철이 생산되지 않게 되었다.
1774년, 앙투안 라부아지에는 백열철관 안에서 수증기와 금속철의 반응을 이용해 수소를 생산했고, 이는 질량의 보존을 증명하는 데 기여했는데, 이는 화학을 질적 과학에서 양적 [106]과학으로 바꾸는데 중요한 역할을 했다.
롤

철은 신화에서 일정한 역할을 하며 은유와 민속에서 다양한 용도를 발견해 왔다.그리스 시인 헤시오드의 작품과 날들 (109-201행)은 [107]인류의 다음 시대를 설명하기 위해 금, 은, 청동, 철과 같은 금속의 이름을 딴 다양한 나이를 열거하고 있습니다.철기시대는 로마와 밀접하게 관련되어 있으며, 오비드의 변태기에서는
미덕은 절망에 빠져 세상을 떠나고, 인간의 타락은 보편적이고 완전한 것이 된다.그때 하드 스틸이 성공했어요.
--
철의 상징적인 역할의 중요성의 예는 1813년의 독일 전역에서 찾을 수 있다.프레데릭 윌리엄 3세는 당시 최초의 철십자 훈장을 수여했다.베를린의 철 장신구는 1813년에서 1815년 사이에 생산량이 최고조에 달했는데, 이때 프러시아 왕실은 시민들에게 군사 자금을 위해 금과 은 장신구를 기부하라고 촉구했습니다.Gold Gabich für Eisen(철을 위해 금을 주었다)이라는 글귀는 이후의 [108]전쟁에도 사용되었다.
금속 철의 제조
실험실 루트
몇 가지 제한적인 목적을 위해 순수 산화물 또는 수산화물을 수소로 환원하거나 철 펜타카르보닐을 형성하여 250°C로 가열하여 소량의 순수 [41]철분을 실험실에서 생산한다.또 다른 방법은 염화철을 [109]철음극에 전기분해하는 것이다.
주요 산업 루트
| 나라 | 철광석 | 선철 | 다이렉트 아이언 | 강철 |
|---|---|---|---|---|
| 1,114.9 | 549.4 | 573.6 | ||
| 393.9 | 4.4 | 5.2 | ||
| 305.0 | 25.1 | 0.011 | 26.5 | |
| 66.9 | 87.5 | |||
| 257.4 | 38.2 | 23.4 | 63.5 | |
| 92.1 | 43.9 | 4.7 | 60.0 | |
| 65.8 | 25.7 | 29.9 | ||
| 0.1 | 27.3 | 48.6 | ||
| 0.4 | 20.1 | 0.38 | 32.7 | |
| 세계 | 1,594.9 | 914.0 | 64.5 | 1,232.4 |
오늘날, 철이나 강철의 산업 생산은 두 가지 주요 단계로 구성되어 있다.제1공정에서는 고로 내의 코크스에 의해 철광석을 환원하고 규산염 광물 등의 총불순물에서 용융금속을 분리한다.이 단계는 비교적 많은 양의 탄소를 포함하는 합금인 선철을 생산합니다.제2단계에서는 산화에 의해 선철의 탄소량을 저감하여 연철, 강철 또는 [111]주철을 얻는다.이 단계에서 다른 금속을 첨가하여 합금강을 형성할 수 있습니다.

고로 가공
고로에는 코크스(휘발성 성분을 제거하기 위해 별도로 구운 석탄) 및 플럭스(석회석 또는 돌로마이트)와 함께 철광석(일반적으로 헤마타이트23 FeO 또는 마그네타이트34 FeO)이 적재됩니다.900°C(가끔 산소 농축을 통해)로 예열된 공기의 "블라스트"가 혼합물을 통해 배출되며, 탄소를 [111]일산화탄소로 바꿀 수 있습니다.
이 반응에 의해 온도가 약 2000°C까지 상승합니다.일산화탄소는 철광석을 금속[111] 철로 환원시킨다.
용해로의 고온 하부 영역에 있는 일부 철은 [111]코크스와 직접 반응합니다.
이 플럭스는 광석의 규소 광물을 제거하며, 그렇지 않으면 용해로가 막힐 수 있습니다.용해로의 열은 탄산염을 산화칼슘으로 분해하고, 산화칼슘은 여분의 실리카와 반응하여 규산칼슘 CaSiO3 또는 기타 제품으로 구성된 슬래그를 형성합니다.용해로 온도에서 금속과 슬래그는 모두 용해됩니다.그리고 아래쪽에 두 개의 불용성 액체 층(슬래그가 위에 있음)이 모여 쉽게 [111]분리됩니다.슬래그는 도로 건설의 재료로 사용하거나 [100]농업용 미네랄 부족 토양을 개선하는 데 사용될 수 있습니다.
따라서 제강은 세계에서 [113]가장 큰 CO2 배출원 중 하나로 남아 있습니다.
제강
고로 공정에서 생성되는 선철은 최대 4~5%의 탄소(질량 기준)를 함유하고 있으며, 황, 마그네슘, 인, 망간 등의 기타 불순물도 소량 함유되어 있습니다.이 높은 수준의 탄소는 상대적으로 약하고 부서지기 쉽습니다.탄소의 양을 0.002–2.1%로 줄이면 강철이 생성되며, 강철은 순수 철보다 최대 1000배 더 단단해질 수 있습니다.그 후 냉간 가공, 열간 압연, 단조, 가공 등을 통해 다양한 강철 제품을 만들 수 있다.선철에서 불순물을 제거하되 탄소를 2-4% 남길 경우 주조 공장에서 주철을 사용하여 스토브, 파이프, 라디에이터, 가로등 기둥, [111]레일 등의 물품을 주조할 수 있습니다.
강철 제품은 성형 후 다양한 열처리를 거치는 경우가 많습니다.아닐은 700–800°C로 몇 시간 동안 가열하고 나서 점차적으로 냉각하는 것으로 구성됩니다.그것은 강철을 더 부드럽고 더 [114]잘 작동하게 만듭니다.
직접 철 환원
환경 문제 때문에 철을 처리하는 대체 방법이 개발되었습니다."직접 철 환원"은 철광석을 "스펀지" 철 또는 "직접" 철이라고 불리는 철 덩어리로 강철 [100]제조에 적합합니다.직접적인 감소 프로세스를 구성하는 두 가지 주요 반응은 다음과 같습니다.
천연 가스는 부분적으로 산화됩니다(열과 촉매로).[100]
그런 다음 철광석을 용해로에서 다음과 같은 가스로 처리하여 고체 스펀지 [100]철을 생성합니다.
실리카는 [100]위와 같이 석회석 플럭스를 첨가하여 제거한다.
테르마이트법
알루미늄 분말과 산화철 혼합물이 점화되면 테르마이트 반응을 통해 금속 철이 생성됩니다.
또는 선철을 강철(최대 2%의 탄소함유) 또는 연철(상업상 순수한 철)로 만들 수 있다.이를 위해 정밀 단로, 웅덩이로, 베세머 컨버터, 노천로, 기본 산소 용해로, 전기 아크로 등 다양한 프로세스가 사용되었습니다.모든 경우, 목적은 탄소의 일부 또는 전부를 다른 불순물과 함께 산화시키는 것입니다.한편, 합금강을 만들기 위해 [102]다른 금속을 첨가해도 된다.
적용들
구조 재료로서
철은 전 세계 금속 생산의 90% 이상을 차지하며 모든 금속 중에서 가장 널리 사용됩니다.저렴한 비용과 높은 강도로 인해 기계 및 공작기계, 레일, 자동차, 선체, 콘크리트 철근, 건물의 하중 전달 프레임워크 등의 건설과 같은 스트레스를 견디거나 힘을 전달하기 위한 재료로서 선택되는 경우가 많습니다.순철은 매우 부드러우므로,[115] 가장 일반적으로 합금 원소와 결합하여 강철을 만듭니다.
기계적 특성
| 재료. | TS (MPa) | BH (브라이넬) |
|---|---|---|
| 쇠수염 | 11000 | |
| Ausformed(강화) 강철로 만든 | 2930 | 850–1200 |
| 마르텐사이트강 | 2070 | 600 |
| 베이나이트강 | 1380 | 400 |
| 펄라이트강 | 1200 | 350 |
| 냉간 가공된 다리미 | 690 | 200 |
| 소립자 철 | 340 | 100 |
| 탄소 함유 철 | 140 | 40 |
| 순수 단결정 철 | 10 | 3 |
철과 그 합금의 기계적 특성은 구조 용도와 매우 관련이 있습니다.이러한 특성은 Brinell 테스트, Rockwell 테스트 및 Vickers 경도 테스트를 포함하여 다양한 방법으로 평가할 수 있습니다.
순철의 특성은 종종 측정값을 보정하거나 [117][118]테스트를 비교하는 데 사용됩니다.그러나 철의 기계적 특성은 샘플의 순도에 크게 영향을 받습니다. 순수한 철의 단결정은 [116]실제로 알루미늄보다 부드러우며, 산업적으로 생산된 가장 순수한 철(99.99%)의 경도는 20~30브리넬입니다.[119]순수철(99.9%~99.999%)은 전해철이라고 불리며 산업적으로 전해정련에 의해 생산된다.
탄소 함량이 증가하면 철의 경도와 인장 강도가 크게 증가합니다.최대 경도는 65R이지만c 탄소 함량이 0.6%인 합금은 인장 강도가 [120]낮습니다.철의 부드러움 때문에, 철은 무거운 착향료인 루테늄과 [12]오스뮴보다 작업하기 훨씬 쉽습니다.
강철 및 합금의 종류
α-Iron is a fairly soft metal that can dissolve only a small concentration of carbon (no more than 0.021% by mass at 910 °C).[121] Austenite (γ-iron) is similarly soft and metallic but can dissolve considerably more carbon (as much as 2.04% by mass at 1146 °C). This form of iron is used in the type of stainless steel used for making cutlery, and hospital and food-service equipment.[16]
Commercially available iron is classified based on purity and the abundance of additives. Pig iron has 3.5–4.5% carbon[122] and contains varying amounts of contaminants such as sulfur, silicon and phosphorus. Pig iron is not a saleable product, but rather an intermediate step in the production of cast iron and steel. The reduction of contaminants in pig iron that negatively affect material properties, such as sulfur and phosphorus, yields cast iron containing 2–4% carbon, 1–6% silicon, and small amounts of manganese.[111] Pig iron has a melting point in the range of 1420–1470 K, which is lower than either of its two main components, and makes it the first product to be melted when carbon and iron are heated together.[6] Its mechanical properties vary greatly and depend on the form the carbon takes in the alloy.[12]
"White" cast irons contain their carbon in the form of cementite, or iron carbide (Fe3C).[12] This hard, brittle compound dominates the mechanical properties of white cast irons, rendering them hard, but unresistant to shock. The broken surface of a white cast iron is full of fine facets of the broken iron carbide, a very pale, silvery, shiny material, hence the appellation. Cooling a mixture of iron with 0.8% carbon slowly below 723 °C to room temperature results in separate, alternating layers of cementite and α-iron, which is soft and malleable and is called pearlite for its appearance. Rapid cooling, on the other hand, does not allow time for this separation and creates hard and brittle martensite. The steel can then be tempered by reheating to a temperature in between, changing the proportions of pearlite and martensite. The end product below 0.8% carbon content is a pearlite-αFe mixture, and that above 0.8% carbon content is a pearlite-cementite mixture.[12]
In gray iron the carbon exists as separate, fine flakes of graphite, and also renders the material brittle due to the sharp edged flakes of graphite that produce stress concentration sites within the material.[123] A newer variant of gray iron, referred to as ductile iron, is specially treated with trace amounts of magnesium to alter the shape of graphite to spheroids, or nodules, reducing the stress concentrations and vastly increasing the toughness and strength of the material.[123]
Wrought iron contains less than 0.25% carbon but large amounts of slag that give it a fibrous characteristic.[122] It is a tough, malleable product, but not as fusible as pig iron. If honed to an edge, it loses it quickly. Wrought iron is characterized by the presence of fine fibers of slag entrapped within the metal. Wrought iron is more corrosion resistant than steel. It has been almost completely replaced by mild steel for traditional "wrought iron" products and blacksmithing.
Mild steel corrodes more readily than wrought iron, but is cheaper and more widely available. Carbon steel contains 2.0% carbon or less,[124] with small amounts of manganese, sulfur, phosphorus, and silicon. Alloy steels contain varying amounts of carbon as well as other metals, such as chromium, vanadium, molybdenum, nickel, tungsten, etc. Their alloy content raises their cost, and so they are usually only employed for specialist uses. One common alloy steel, though, is stainless steel. Recent developments in ferrous metallurgy have produced a growing range of microalloyed steels, also termed 'HSLA' or high-strength, low alloy steels, containing tiny additions to produce high strengths and often spectacular toughness at minimal cost.[124][125][126]
Alloys with high purity elemental makeups (such as alloys of electrolytic iron) have specifically enhanced properties such as ductility, tensile strength, toughness, fatigue strength, heat resistance, and corrosion resistance.
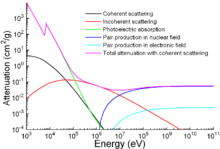
Apart from traditional applications, iron is also used for protection from ionizing radiation. Although it is lighter than another traditional protection material, lead, it is much stronger mechanically. The attenuation of radiation as a function of energy is shown in the graph.[127]
The main disadvantage of iron and steel is that pure iron, and most of its alloys, suffer badly from rust if not protected in some way, a cost amounting to over 1% of the world's economy.[128] Painting, galvanization, passivation, plastic coating and bluing are all used to protect iron from rust by excluding water and oxygen or by cathodic protection. The mechanism of the rusting of iron is as follows:[128]
- Cathode: 3 O2 + 6 H2O + 12 e− → 12 OH−
- Anode: 4 Fe → 4 Fe2+ + 8 e−; 4 Fe2+ → 4 Fe3+ + 4 e−
- Overall: 4 Fe + 3 O2 + 6 H2O → 4 Fe3+ + 12 OH− → 4 Fe(OH)3 or 4 FeO(OH) + 4 H2O
The electrolyte is usually iron(II) sulfate in urban areas (formed when atmospheric sulfur dioxide attacks iron), and salt particles in the atmosphere in seaside areas.[128]
Iron compounds
Although the dominant use of iron is in metallurgy, iron compounds are also pervasive in industry. Iron catalysts are traditionally used in the Haber–Bosch process for the production of ammonia and the Fischer–Tropsch process for conversion of carbon monoxide to hydrocarbons for fuels and lubricants.[129] Powdered iron in an acidic solvent was used in the Bechamp reduction the reduction of nitrobenzene to aniline.[130] Iron based catalysts play a crucial role in converting biobased raw materials into valuable bulk[131]- and fine chemicals,[132][133] in fuel cells[134] as well as in removal of hazardous chemicals.[135][136][137][138]
Iron(III) oxide mixed with aluminium powder can be ignited to create a thermite reaction, used in welding large iron parts (like rails) and purifying ores. Iron(III) oxide and oxyhydroxide are used as reddish and ocher pigments.
Iron(III) chloride finds use in water purification and sewage treatment, in the dyeing of cloth, as a coloring agent in paints, as an additive in animal feed, and as an etchant for copper in the manufacture of printed circuit boards.[139] It can also be dissolved in alcohol to form tincture of iron, which is used as a medicine to stop bleeding in canaries.[140]
Iron(II) sulfate is used as a precursor to other iron compounds. It is also used to reduce chromate in cement. It is used to fortify foods and treat iron deficiency anemia. Iron(III) sulfate is used in settling minute sewage particles in tank water. Iron(II) chloride is used as a reducing flocculating agent, in the formation of iron complexes and magnetic iron oxides, and as a reducing agent in organic synthesis.[139]
Biological and pathological role
Iron is required for life.[5][141][142] The iron–sulfur clusters are pervasive and include nitrogenase, the enzymes responsible for biological nitrogen fixation. Iron-containing proteins participate in transport, storage and used of oxygen.[5] Iron proteins are involved in electron transfer.[143]
Examples of iron-containing proteins in higher organisms include hemoglobin, cytochrome (see high-valent iron), and catalase.[5][144] The average adult human contains about 0.005% body weight of iron, or about four grams, of which three quarters is in hemoglobin – a level that remains constant despite only about one milligram of iron being absorbed each day,[143] because the human body recycles its hemoglobin for the iron content.[145]
Microbial growth may be assisted by oxidation of iron(II) or by reduction of iron (III).[146]
Biochemistry
Iron acquisition poses a problem for aerobic organisms because ferric iron is poorly soluble near neutral pH. Thus, these organisms have developed means to absorb iron as complexes, sometimes taking up ferrous iron before oxidising it back to ferric iron.[5] In particular, bacteria have evolved very high-affinity sequestering agents called siderophores.[147][148][149]
After uptake in human cells, iron storage is precisely regulated.[5][150] A major component of this regulation is the protein transferrin, which binds iron ions absorbed from the duodenum and carries it in the blood to cells.[5][151] Transferrin contains Fe3+ in the middle of a distorted octahedron, bonded to one nitrogen, three oxygens and a chelating carbonate anion that traps the Fe3+ ion: it has such a high stability constant that it is very effective at taking up Fe3+ ions even from the most stable complexes. At the bone marrow, transferrin is reduced from Fe3+ and Fe2+ and stored as ferritin to be incorporated into hemoglobin.[143]
The most commonly known and studied bioinorganic iron compounds (biological iron molecules) are the heme proteins: examples are hemoglobin, myoglobin, and cytochrome P450.[5] These compounds participate in transporting gases, building enzymes, and transferring electrons.[143] Metalloproteins are a group of proteins with metal ion cofactors. Some examples of iron metalloproteins are ferritin and rubredoxin.[143] Many enzymes vital to life contain iron, such as catalase,[152] lipoxygenases,[153] and IRE-BP.[154]
Hemoglobin is an oxygen carrier that occurs in red blood cells and contributes their color, transporting oxygen in the arteries from the lungs to the muscles where it is transferred to myoglobin, which stores it until it is needed for the metabolic oxidation of glucose, generating energy.[5] Here the hemoglobin binds to carbon dioxide, produced when glucose is oxidized, which is transported through the veins by hemoglobin (predominantly as bicarbonate anions) back to the lungs where it is exhaled.[143] In hemoglobin, the iron is in one of four heme groups and has six possible coordination sites; four are occupied by nitrogen atoms in a porphyrin ring, the fifth by an imidazole nitrogen in a histidine residue of one of the protein chains attached to the heme group, and the sixth is reserved for the oxygen molecule it can reversibly bind to.[143] When hemoglobin is not attached to oxygen (and is then called deoxyhemoglobin), the Fe2+ ion at the center of the heme group (in the hydrophobic protein interior) is in a high-spin configuration. It is thus too large to fit inside the porphyrin ring, which bends instead into a dome with the Fe2+ ion about 55 picometers above it. In this configuration, the sixth coordination site reserved for the oxygen is blocked by another histidine residue.[143]
When deoxyhemoglobin picks up an oxygen molecule, this histidine residue moves away and returns once the oxygen is securely attached to form a hydrogen bond with it. This results in the Fe2+ ion switching to a low-spin configuration, resulting in a 20% decrease in ionic radius so that now it can fit into the porphyrin ring, which becomes planar.[143] (Additionally, this hydrogen bonding results in the tilting of the oxygen molecule, resulting in a Fe–O–O bond angle of around 120° that avoids the formation of Fe–O–Fe or Fe–O2–Fe bridges that would lead to electron transfer, the oxidation of Fe2+ to Fe3+, and the destruction of hemoglobin.) This results in a movement of all the protein chains that leads to the other subunits of hemoglobin changing shape to a form with larger oxygen affinity. Thus, when deoxyhemoglobin takes up oxygen, its affinity for more oxygen increases, and vice versa.[143] Myoglobin, on the other hand, contains only one heme group and hence this cooperative effect cannot occur. Thus, while hemoglobin is almost saturated with oxygen in the high partial pressures of oxygen found in the lungs, its affinity for oxygen is much lower than that of myoglobin, which oxygenates even at low partial pressures of oxygen found in muscle tissue.[143] As described by the Bohr effect (named after Christian Bohr, the father of Niels Bohr), the oxygen affinity of hemoglobin diminishes in the presence of carbon dioxide.[143]

Carbon monoxide and phosphorus trifluoride are poisonous to humans because they bind to hemoglobin similarly to oxygen, but with much more strength, so that oxygen can no longer be transported throughout the body. Hemoglobin bound to carbon monoxide is known as carboxyhemoglobin. This effect also plays a minor role in the toxicity of cyanide, but there the major effect is by far its interference with the proper functioning of the electron transport protein cytochrome a.[143] The cytochrome proteins also involve heme groups and are involved in the metabolic oxidation of glucose by oxygen. The sixth coordination site is then occupied by either another imidazole nitrogen or a methionine sulfur, so that these proteins are largely inert to oxygen – with the exception of cytochrome a, which bonds directly to oxygen and thus is very easily poisoned by cyanide.[143] Here, the electron transfer takes place as the iron remains in low spin but changes between the +2 and +3 oxidation states. Since the reduction potential of each step is slightly greater than the previous one, the energy is released step-by-step and can thus be stored in adenosine triphosphate. Cytochrome a is slightly distinct, as it occurs at the mitochondrial membrane, binds directly to oxygen, and transports protons as well as electrons, as follows:[143]
- 4 Cytc2+ + O2 + 8H+
inside → 4 Cytc3+ + 2 H2O + 4H+
outside
Although the heme proteins are the most important class of iron-containing proteins, the iron–sulfur proteins are also very important, being involved in electron transfer, which is possible since iron can exist stably in either the +2 or +3 oxidation states. These have one, two, four, or eight iron atoms that are each approximately tetrahedrally coordinated to four sulfur atoms; because of this tetrahedral coordination, they always have high-spin iron. The simplest of such compounds is rubredoxin, which has only one iron atom coordinated to four sulfur atoms from cysteine residues in the surrounding peptide chains. Another important class of iron–sulfur proteins is the ferredoxins, which have multiple iron atoms. Transferrin does not belong to either of these classes.[143]
The ability of sea mussels to maintain their grip on rocks in the ocean is facilitated by their use of organometallic iron-based bonds in their protein-rich cuticles. Based on synthetic replicas, the presence of iron in these structures increased elastic modulus 770 times, tensile strength 58 times, and toughness 92 times. The amount of stress required to permanently damage them increased 76 times.[156]
Nutrition
Diet
Iron is pervasive, but particularly rich sources of dietary iron include red meat, oysters, lentils, beans, poultry, fish, leaf vegetables, watercress, tofu, chickpeas, black-eyed peas, and blackstrap molasses.[5] Bread and breakfast cereals are sometimes specifically fortified with iron.[5][157]
Iron provided by dietary supplements is often found as iron(II) fumarate, although iron(II) sulfate is cheaper and is absorbed equally well.[139] Elemental iron, or reduced iron, despite being absorbed at only one-third to two-thirds the efficiency (relative to iron sulfate),[158] is often added to foods such as breakfast cereals or enriched wheat flour. Iron is most available to the body when chelated to amino acids[159] and is also available for use as a common iron supplement. Glycine, the least expensive amino acid, is most often used to produce iron glycinate supplements.[160]
Dietary recommendations
The U.S. Institute of Medicine (IOM) updated Estimated Average Requirements (EARs) and Recommended Dietary Allowances (RDAs) for iron in 2001.[5] The current EAR for iron for women ages 14–18 is 7.9 mg/day, 8.1 for ages 19–50 and 5.0 thereafter (post menopause). For men the EAR is 6.0 mg/day for ages 19 and up. The RDA is 15.0 mg/day for women ages 15–18, 18.0 for 19–50 and 8.0 thereafter. For men, 8.0 mg/day for ages 19 and up. RDAs are higher than EARs so as to identify amounts that will cover people with higher than average requirements. RDA for pregnancy is 27 mg/day and, for lactation, 9 mg/day.[5] For children ages 1–3 years 7 mg/day, 10 for ages 4–8 and 8 for ages 9–13. As for safety, the IOM also sets Tolerable upper intake levels (ULs) for vitamins and minerals when evidence is sufficient. In the case of iron the UL is set at 45 mg/day. Collectively the EARs, RDAs and ULs are referred to as Dietary Reference Intakes.[161]
The European Food Safety Authority (EFSA) refers to the collective set of information as Dietary Reference Values, with Population Reference Intake (PRI) instead of RDA, and Average Requirement instead of EAR. AI and UL defined the same as in United States. For women the PRI is 13 mg/day ages 15–17 years, 16 mg/day for women ages 18 and up who are premenopausal and 11 mg/day postmenopausal. For pregnancy and lactation, 16 mg/day. For men the PRI is 11 mg/day ages 15 and older. For children ages 1 to 14 the PRI increases from 7 to 11 mg/day. The PRIs are higher than the U.S. RDAs, with the exception of pregnancy.[162] The EFSA reviewed the same safety question did not establish a UL.[163]
Infants may require iron supplements if they are bottle-fed cow's milk.[164] Frequent blood donors are at risk of low iron levels and are often advised to supplement their iron intake.[165]
For U.S. food and dietary supplement labeling purposes the amount in a serving is expressed as a percent of Daily Value (%DV). For iron labeling purposes 100% of the Daily Value was 18 mg, and as of May 27, 2016[update] remained unchanged at 18 mg.[166][167] A table of the old and new adult daily values is provided at Reference Daily Intake.
Deficiency
Iron deficiency is the most common nutritional deficiency in the world.[5][168][169][170] When loss of iron is not adequately compensated by adequate dietary iron intake, a state of latent iron deficiency occurs, which over time leads to iron-deficiency anemia if left untreated, which is characterised by an insufficient number of red blood cells and an insufficient amount of hemoglobin.[171] Children, pre-menopausal women (women of child-bearing age), and people with poor diet are most susceptible to the disease. Most cases of iron-deficiency anemia are mild, but if not treated can cause problems like fast or irregular heartbeat, complications during pregnancy, and delayed growth in infants and children.[172]
Excess
Iron uptake is tightly regulated by the human body, which has no regulated physiological means of excreting iron. Only small amounts of iron are lost daily due to mucosal and skin epithelial cell sloughing, so control of iron levels is primarily accomplished by regulating uptake.[173] Regulation of iron uptake is impaired in some people as a result of a genetic defect that maps to the HLA-H gene region on chromosome 6 and leads to abnormally low levels of hepcidin, a key regulator of the entry of iron into the circulatory system in mammals.[174] In these people, excessive iron intake can result in iron overload disorders, known medically as hemochromatosis.[5] Many people have an undiagnosed genetic susceptibility to iron overload, and are not aware of a family history of the problem. For this reason, people should not take iron supplements unless they suffer from iron deficiency and have consulted a doctor. Hemochromatosis is estimated to be the cause of 0.3 to 0.8% of all metabolic diseases of Caucasians.[175]
Overdoses of ingested iron can cause excessive levels of free iron in the blood. High blood levels of free ferrous iron react with peroxides to produce highly reactive free radicals that can damage DNA, proteins, lipids, and other cellular components. Iron toxicity occurs when the cell contains free iron, which generally occurs when iron levels exceed the availability of transferrin to bind the iron. Damage to the cells of the gastrointestinal tract can also prevent them from regulating iron absorption, leading to further increases in blood levels. Iron typically damages cells in the heart, liver and elsewhere, causing adverse effects that include coma, metabolic acidosis, shock, liver failure, coagulopathy, long-term organ damage, and even death.[176] Humans experience iron toxicity when the iron exceeds 20 milligrams for every kilogram of body mass; 60 milligrams per kilogram is considered a lethal dose.[177] Overconsumption of iron, often the result of children eating large quantities of ferrous sulfate tablets intended for adult consumption, is one of the most common toxicological causes of death in children under six.[177] The Dietary Reference Intake (DRI) sets the Tolerable Upper Intake Level (UL) for adults at 45 mg/day. For children under fourteen years old the UL is 40 mg/day.[178]
The medical management of iron toxicity is complicated, and can include use of a specific chelating agent called deferoxamine to bind and expel excess iron from the body.[176][179][180]
ADHD
Some research has suggested that low thalamic iron levels may play a role in the pathophysiology of ADHD.[181] Some researchers have found that iron supplementation can be effective especially in the inattentive subtype of the disorder.[182] Further, research has shown that iron has the potential to decrease the risk of cardiovascular events during treatment with ADHD drugs or can be used as an intervention to optimize response to psychostimulants at a lower dose[citation needed].
Cancer
The role of iron in cancer defense can be described as a "double-edged sword" because of its pervasive presence in non-pathological processes.[183] People having chemotherapy may develop iron deficiency and anemia, for which intravenous iron therapy is used to restore iron levels.[184] Iron overload, which may occur from high consumption of red meat,[5] may initiate tumor growth and increase susceptibility to cancer onset,[184] particularly for colorectal cancer.[5]
Marine systems
Iron plays an essential role in marine systems and can act as a limiting nutrient for planktonic activity.[185] Because of this, too much of a decrease in iron may lead to a decrease in growth rates in phytoplanktonic organisms such as diatoms.[186] Iron can also be oxidized by marine microbes under conditions that are high in iron and low in oxygen.[187]
Iron can enter marine systems through adjoining rivers and directly from the atmosphere. Once iron enters the ocean, it can be distributed throughout the water column through ocean mixing and through recycling on the cellular level.[188] In the arctic, sea ice plays a major role in the store and distribution of iron in the ocean, depleting oceanic iron as it freezes in the winter and releasing it back into the water when thawing occurs in the summer.[189] The iron cycle can fluctuate the forms of iron from aqueous to particle forms altering the availability of iron to primary producers.[190] Increased light and warmth increases the amount of iron that is in forms that are usable by primary producers.[191]
See also
- El Mutún in Bolivia, where 10% of the world's accessible iron ore is located
- Iron and steel industry
- Iron cycle
- Iron nanoparticle
- Iron–platinum nanoparticle
- Iron fertilization – proposed fertilization of oceans to stimulate phytoplankton growth
- Iron-oxidizing bacteria
- List of countries by iron production
- Pelletising – process of creation of iron ore pellets
- Rustproof iron
- Steel
References
- ^ "Standard Atomic Weights: Iron". CIAAW. 1993.
- ^ Ram, R. S.; Bernath, P. F. (2003). "Fourier transform emission spectroscopy of the g4Δ–a4Δ system of FeCl". Journal of Molecular Spectroscopy. 221 (2): 261. Bibcode:2003JMoSp.221..261R. doi:10.1016/S0022-2852(03)00225-X.
- ^ Demazeau, G.; Buffat, B.; Pouchard, M.; Hagenmuller, P. (1982). "Recent developments in the field of high oxidation states of transition elements in oxides stabilization of six-coordinated Iron(V)". Zeitschrift für anorganische und allgemeine Chemie. 491: 60–66. doi:10.1002/zaac.19824910109.
- ^ Lu, J.; Jian, J.; Huang, W.; Lin, H.; Li, J; Zhou, M. (2016). "Experimental and theoretical identification of the Fe(VII) oxidation state in FeO4−". Physical Chemistry Chemical Physics. 18 (45): 31125–31131. Bibcode:2016PCCP...1831125L. doi:10.1039/C6CP06753K. PMID 27812577.
- ^ a b c d e f g h i j k l m n o p q "Iron". Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis, Oregon. April 2016. Retrieved 6 March 2018.
- ^ a b c d e f g h Greenwood and Earnshaw, pp. 1075–79
- ^ Hirose, K., Tateno, S. (2010). "The Structure of Iron in Earth's Inner Core". Science. American Association for the Advancement of Science. 330 (6002): 359–361. Bibcode:2010Sci...330..359T. doi:10.1126/science.1194662. PMID 20947762. S2CID 206528628.
- ^ Chamati, Gaminchev (2014). "Dynamic stability of Fe under high pressure". Journal of Physics. IOP Publishing. 558 (1): 012013. Bibcode:2014JPhCS.558a2013G. doi:10.1088/1742-6596/558/1/012013.
- ^ Boehler, Reinhard (2000). "High-pressure experiments and the phase diagram of lower mantle and core materials". Reviews of Geophysics. American Geophysical Union. 38 (2): 221–45. Bibcode:2000RvGeo..38..221B. doi:10.1029/1998RG000053. S2CID 33458168.
- ^ Stixrude, Lars; Wasserman, Evgeny; Cohen, Ronald E. (10 November 1997). "Composition and temperature of Earth's inner core". Journal of Geophysical Research: Solid Earth. 102 (B11): 24729–39. Bibcode:1997JGR...10224729S. doi:10.1029/97JB02125.
- ^ Greenwood and Earnshaw, p. 1116
- ^ a b c d e f Greenwood and Earnshaw, pp. 1074–75
- ^ Boehler, Reinhard; Ross, M. (2007). "Properties of Rocks and Minerals_High-Pressure Melting". Mineral Physics. Treatise on Geophysics. Vol. 2. Elsevier. pp. 527–41. doi:10.1016/B978-044452748-6.00047-X. ISBN 9780444527486.
- ^ Steinmetz, Charles (1917). "fig. 42". Theory and Calculation of Electric Circuits. McGraw-Hill.
- ^ a b Cullity; C. D. Graham (2008). Introduction to Magnetic Materials, 2nd. New York: Wiley–IEEE. p. 116. ISBN 978-0-471-47741-9.
- ^ a b Bramfitt, B.L.; Benscoter, Arlan O. (2002). "The Iron Carbon Phase Diagram". Metallographer's guide: practice and procedures for irons and steels. ASM International. pp. 24–28. ISBN 978-0-87170-748-2.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Rugel, G.; Faestermann, T.; Knie, K.; Korschinek, G.; Poutivtsev, M.; Schumann, D.; Kivel, N.; Günther-Leopold, I.; Weinreich, R.; Wohlmuther, M. (2009). "New Measurement of the 60Fe Half-Life". Physical Review Letters. 103 (7): 072502. Bibcode:2009PhRvL.103g2502R. doi:10.1103/PhysRevLett.103.072502. PMID 19792637.
- ^ Dauphas, N.; Rouxel, O. (2006). "Mass spectrometry and natural variations of iron isotopes" (PDF). Mass Spectrometry Reviews. 25 (4): 515–50. Bibcode:2006MSRv...25..515D. doi:10.1002/mas.20078. PMID 16463281. Archived from the original (PDF) on 10 June 2010.
- ^ Mostefaoui, S.; Lugmair, G.W.; Hoppe, P.; El Goresy, A. (2004). "Evidence for live 60Fe in meteorites". New Astronomy Reviews. 48 (1–4): 155–59. Bibcode:2004NewAR..48..155M. doi:10.1016/j.newar.2003.11.022.
- ^ Fewell, M. P. (1995). "The atomic nuclide with the highest mean binding energy". American Journal of Physics. 63 (7): 653. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ a b c Greenwood and Earnshaw, p. 12
- ^ Woosley, S.; Janka, T. (2006). "The physics of core collapse supernovae". Nature Physics. 1 (3): 147–54. arXiv:astro-ph/0601261. Bibcode:2005NatPh...1..147W. doi:10.1038/nphys172. S2CID 118974639.
- ^ McDonald, I.; Sloan, G. C.; Zijlstra, A. A.; Matsunaga, N.; Matsuura, M.; Kraemer, K. E.; Bernard-Salas, J.; Markwick, A. J. (2010). "Rusty Old Stars: A Source of the Missing Interstellar Iron?". The Astrophysical Journal Letters. 717 (2): L92–L97. arXiv:1005.3489. Bibcode:2010ApJ...717L..92M. doi:10.1088/2041-8205/717/2/L92. S2CID 14437704.
- ^ Bautista, Manuel A.; Pradhan, Anil K. (1995). "Iron and Nickel Abundances in H~II Regions and Supernova Remnants". Bulletin of the American Astronomical Society. 27: 865. Bibcode:1995AAS...186.3707B.
- ^ Dyson, Freeman J. (1979). "Time without end: Physics and biology in an open universe". Reviews of Modern Physics. 51 (3): 447–60. Bibcode:1979RvMP...51..447D. doi:10.1103/RevModPhys.51.447.
- ^ Aron, Jacob. "Supernova space bullets could have seeded Earth's iron core". New Scientist. Retrieved 2 October 2020.
- ^ Croswell, Ken. "Iron in the Fire: The Little-Star Supernovae That Could". Scientific American. Retrieved 3 January 2021.
- ^ Buchwald, V F (1992). "On the Use of Iron by the Eskimos in Greenland". Materials Characterization. 29 (2): 139–176. doi:10.1016/1044-5803(92)90112-U.
- ^ Emiliani, Cesare (1992). Planet earth: cosmology, geology, and the evolution of life and environment. Cambridge University Press. p. 152. Bibcode:1992pecg.book.....E. ISBN 978-0-521-40949-0.
- ^ Pernet-Fisher, J.; Day, J.M.D.; Howarth, G.H.; Ryabov, V.V.; Taylor, L.A. (2017). "Atmospheric outgassing and native-iron formation during carbonaceous sediment–basalt melt interactions". Earth and Planetary Science Letters. 460: 201–212. Bibcode:2017E&PSL.460..201P. doi:10.1016/j.epsl.2016.12.022.
- ^ Stark, Anne M. (20 September 2007) Researchers locate mantle's spin transition zone, leading to clues about earth's structure. Lawrence Livermore National Laboratory
- ^ Ferropericlase. Mindat.org
- ^ Murakami, M.; Ohishi Y.; Hirao N.; Hirose K. (2012). "A perovskitic lower mantle inferred from high-pressure, high-temperature sound velocity data". Nature. 485 (7396): 90–94. Bibcode:2012Natur.485...90M. doi:10.1038/nature11004. PMID 22552097. S2CID 4387193.
- ^ Sharp, T. (27 November 2014). "Bridgmanite – named at last". Science. 346 (6213): 1057–58. Bibcode:2014Sci...346.1057S. doi:10.1126/science.1261887. PMID 25430755. S2CID 206563252.
- ^ Kong, L. T.; Li, J. F.; Shi, Q. W.; Huang, H. J.; Zhao, K. (6 March 2012). "Dynamical stability of iron under high-temperature and high-pressure conditions". EPL. 97 (5): 56004p1–56004p5. Bibcode:2012EL.....9756004K. doi:10.1209/0295-5075/97/56004. S2CID 121861429.
- ^ Gaminchev, K. G.; Chamati, H. (3 December 2014). "Dynamic stability of Fe under high pressure". J. Phys. 558 (1): 012013(1–7). Bibcode:2014JPhCS.558a2013G. doi:10.1088/1742-6596/558/1/012013.
- ^ Morgan, John W. & Anders, Edward (1980). "Chemical composition of Earth, Venus, and Mercury". Proc. Natl. Acad. Sci. 77 (12): 6973–77. Bibcode:1980PNAS...77.6973M. doi:10.1073/pnas.77.12.6973. PMC 350422. PMID 16592930.
- ^ "Pyrrhotite". Mindat.org. Retrieved 7 July 2009.
- ^ Klein, Cornelis and Cornelius S. Hurlbut, Jr. (1985) Manual of Mineralogy, Wiley, 20th ed, pp. 278–79 ISBN 0-471-80580-7
- ^ a b Greenwood and Earnshaw, p. 1071
- ^ Lyons, T. W.; Reinhard, C. T. (2009). "Early Earth: Oxygen for heavy-metal fans". Nature. 461 (7261): 179–181. Bibcode:2009Natur.461..179L. doi:10.1038/461179a. PMID 19741692. S2CID 205049360.
- ^ Cloud, P. (1973). "Paleoecological Significance of the Banded Iron-Formation". Economic Geology. 68 (7): 1135–43. doi:10.2113/gsecongeo.68.7.1135.
- ^ Dickinson, Robert E. (1964). Germany: A regional and economic geography (2nd ed.). London: Methuen.
- ^ Naturwerksteine in Baden-Württemberg. Landesamt für Geologie, Rohstoffe und Bergbau, Baden-Württemberg
- ^ "Tales From The Riverbank". Minerva Stone Conservation. Retrieved 22 September 2015.
- ^ Klingelhöfer, G.; Morris, R. V.; Souza, P. A.; Rodionov, D.; Schröder, C. (2007). "Two earth years of Mössbauer studies of the surface of Mars with MIMOS II". Hyperfine Interactions. 170 (1–3): 169–77. Bibcode:2006HyInt.170..169K. doi:10.1007/s10751-007-9508-5. S2CID 98227499.
- ^ Metal Stocks in Society: Scientific synthesis, 2010, International Resource Panel, UNEP
- ^ Stoll, Heather. "30 years of the iron hypothesis of ice ages." Nature vol. 578,7795 (2020): 370-371. doi:10.1038/d41586-020-00393-x
- ^ Greenwood and Earnshaw, p. 905
- ^ a b Greenwood and Earnshaw, p. 1070
- ^ Huang, Wei; Xu, Wen-Hua; Schwarz, W.H.E.; Li, Jun (2 May 2016). "On the Highest Oxidation States of Metal Elements in MO4 Molecules (M = Fe, Ru, Os, Hs, Sm, and Pu)". Inorganic Chemistry. 55 (9): 4616–25. doi:10.1021/acs.inorgchem.6b00442. PMID 27074099.
- ^ Lu, Jun-Bo; Jian, Jiwen; Huang, Wei; Lin, Hailu; Li, Jun; Zhou, Mingfei (16 November 2016). "Experimental and theoretical identification of the Fe(VII) oxidation state in FeO4−". Phys. Chem. Chem. Phys. 18 (45): 31125–31131. Bibcode:2016PCCP...1831125L. doi:10.1039/c6cp06753k. PMID 27812577.
- ^ Nam, Wonwoo (2007). "High-Valent Iron(IV)–Oxo Complexes of Heme and Non-Heme Ligands in Oxygenation Reactions" (PDF). Accounts of Chemical Research. 40 (7): 522–531. doi:10.1021/ar700027f. PMID 17469792.
- ^ a b c d e f Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Iron". Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 1125–46. ISBN 3-11-007511-3.
- ^ Reiff, William Michael; Long, Gary J. (1984). "Mössbauer Spectroscopy and the Coordination Chemistry of Iron". Mössbauer spectroscopy applied to inorganic chemistry. Springer. pp. 245–83. ISBN 978-0-306-41647-7.
- ^ Ware, Mike (1999). "An introduction in monochrome". Cyanotype: the history, science and art of photographic printing in Prussian blue. NMSI Trading Ltd. pp. 11–19. ISBN 978-1-900747-07-3.
- ^ Gmelin, Leopold (1852). "Mercury and Iron". Hand-book of chemistry. Vol. 6. Cavendish Society. pp. 128–29.
- ^ a b c Greenwood and Earnshaw, p. 1079
- ^ a b c d Greenwood and Earnshaw, pp. 1082–84
- ^ Siegfried Pohl, Ulrich Bierbach, Wolfgang Saak; "FeI3SC(NMe2)2, a Neutral Thiourea Complex of Iron(III) Iodide", Angewandte Chemie International Edition in English (1989) 28 (6), 776-777. https://doi.org/10.1002/anie.198907761
- ^ Nicholas A. Barnes, Stephen M.Godfrey, Nicholas Ho, Charles A.McAuliffe, Robin G.Pritchard; "Facile synthesis of a rare example of an iron(III) iodide complex, [FeI3(AsMe3)2], from the reaction of Me3AsI2 with unactivated iron powder", Polyhedron (2013) 55, 67-72. https://doi.org/10.1016/j.poly.2013.02.066
- ^ a b c d e Greenwood and Earnshaw, pp. 1088–91
- ^ a b c Greenwood and Earnshaw, pp. 1091–97
- ^ Clausen, C.A.; Good, M.L. (1968). "Stabilization of the hexachloroferrate(III) anion by the methylammonium cation". Inorganic Chemistry. 7 (12): 2662–63. doi:10.1021/ic50070a047.
- ^ James, B.D.; Bakalova, M.; Lieseganga, J.; Reiff, W.M.; Hockless, D.C.R.; Skelton, B.W.; White, A.H. (1996). "The hexachloroferrate(III) anion stabilized in hydrogen bonded packing arrangements. A comparison of the X-ray crystal structures and low temperature magnetism of tetrakis(methylammonium) hexachloroferrate(III) chloride (I) and tetrakis(hexamethylenediammonium) hexachloroferrate(III) tetrachloroferrate(III) tetrachloride (II)". Inorganica Chimica Acta. 247 (2): 169–74. doi:10.1016/0020-1693(95)04955-X.
- ^ Giannoccaro, P.; Sacco, A. (1977). Bis[ethylenebis(diphenylphosphine)]-Hydridoiron Complexes. Inorg. Synth. Inorganic Syntheses. Vol. 17. pp. 69–72. doi:10.1002/9780470132487.ch19. ISBN 978-0-470-13248-7.
- ^ Lee, J.; Jung, G.; Lee, S.W. (1998). "Structure of trans-chlorohydridobis(diphenylphosphinoethane)iron(II)". Bull. Korean Chem. Soc. 19 (2): 267–69. doi:10.1007/BF02698412. S2CID 35665289.
- ^ Echigo, Takuya; Kimata, Mitsuyoshi (2008). "Single-crystal X-ray diffraction and spectroscopic studies on humboldtine and lindbergite: weak Jahn–Teller effect of Fe2+ ion". Phys. Chem. Minerals. 35 (8): 467–75. Bibcode:2008PCM....35..467E. doi:10.1007/s00269-008-0241-7. S2CID 98739882.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 1282–86. ISBN 978-0-08-022057-4..
- ^ Kealy, T.J.; Pauson, P.L. (1951). "A New Type of Organo-Iron Compound". Nature. 168 (4285): 1039–40. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0. S2CID 4181383.
- ^ Miller, S. A.; Tebboth, J. A.; Tremaine, J. F. (1952). "114. Dicyclopentadienyliron". J. Chem. Soc.: 632–635. doi:10.1039/JR9520000632.
- ^ Wilkinson, G.; Rosenblum, M.; Whiting, M. C.; Woodward, R. B. (1952). "The Structure of Iron Bis-Cyclopentadienyl". J. Am. Chem. Soc. 74 (8): 2125–2126. doi:10.1021/ja01128a527.
- ^ Okuda, Jun (28 December 2016). "Ferrocene – 65 Years After". European Journal of Inorganic Chemistry. 2017 (2): 217–219. doi:10.1002/ejic.201601323. ISSN 1434-1948.
- ^ Greenwood and Earnshaw, p. 1104
- ^ Bullock, R.M. (11 September 2007). "An Iron Catalyst for Ketone Hydrogenations under Mild Conditions". Angew. Chem. Int. Ed. 46 (39): 7360–63. doi:10.1002/anie.200703053. PMID 17847139.
- ^ Weeks 1968, p. 4.
- ^ a b Weeks 1968, p. 29.
- ^ a b c Weeks 1968, p. 31.
- ^ Bjorkman, Judith Kingston (1973). "Meteors and Meteorites in the ancient Near East". Meteoritics. 8 (2): 91–132. Bibcode:1973Metic...8...91B. doi:10.1111/j.1945-5100.1973.tb00146.x.
- ^ Comelli, Daniela; d'Orazio, Massimo; Folco, Luigi; El-Halwagy, Mahmud; Frizzi, Tommaso; Alberti, Roberto; Capogrosso, Valentina; Elnaggar, Abdelrazek; Hassan, Hala; Nevin, Austin; Porcelli, Franco; Rashed, Mohamed G; Valentini, Gianluca (2016). "The meteoritic origin of Tutankhamun's iron dagger blade". Meteoritics & Planetary Science. 51 (7): 1301–09. Bibcode:2016M&PS...51.1301C. doi:10.1111/maps.12664.
- ^ Walsh, Declan (2 June 2016). "King Tut's Dagger Made of 'Iron From the Sky,' Researchers Say". The New York Times. Archived from the original on 3 January 2022. Retrieved 4 June 2016.
the blade's composition of iron, nickel and cobalt was an approximate match for a meteorite that landed in northern Egypt. The result "strongly suggests an extraterrestrial origin"
- ^ Ure, Andrew (1843). Technisches wörterbuch oder Handbuch der Gewerbskunde ... : Bearb. nach Dr. Andrew Ure's Dictionary of arts, manufactures and mines (in German). G. Haase. p. 492.
- ^ a b c d Weeks 1968, p. 32.
- ^ McNutt, Paula (1990 1). The Forging of Israel: Iron Technology, Symbolism and Tradition in Ancient Society. A&C Black.
- ^ Tewari, Rakesh. "The origins of Iron Working in India: New evidence from the Central Ganga plain and the Eastern Vindhyas" (PDF). State Archaeological Department. Retrieved 23 May 2010.
- ^ Photos, E. (1989). "The Question of Meteoritic versus Smelted Nickel-Rich Iron: Archaeological Evidence and Experimental Results". World Archaeology. Taylor & Francis, Ltd. 20 (3): 403–21. doi:10.1080/00438243.1989.9980081. JSTOR 124562.
- ^ Muhly, James D. (2003). "Metalworking/Mining in the Levant". In Lake, Richard Winona (ed.). Near Eastern Archaeology IN: Eisenbrauns. Vol. 180. pp. 174–83.
- ^ Witzel, Michael (2001), "Autochthonous Aryans? The Evidence from Old Indian and Iranian Texts", in Electronic Journal of Vedic Studies (EJVS) 7-3, pp. 1–93
- ^ Weeks, p. 33, quoting Cline, Walter (1937) "Mining and Metallurgy in Negro Africa," George Banta Publishing Co., Menasha, Wis., pp. 17–23.
- ^ Riederer, Josef; Wartke, Ralf-B. (2009) "Iron", Cancik, Hubert; Schneider, Helmuth (eds.): Brill's New Pauly, Brill.
- ^ Sawyer, Ralph D. and Sawyer, Mei-chün (1993). The Seven Military Classics of Ancient China. Boulder: Westview. ISBN 0-465-00304-4. p. 10.
- ^ Pigott, Vincent C. (1999). The Archaeometallurgy of the Asian Old World. Philadelphia: University of Pennsylvania Museum of Archaeology and Anthropology. ISBN 0-924171-34-0, p. 8.
- ^ Golas, Peter J. (1999). Science and Civilisation in China: Volume 5, Chemistry and Chemical Technology, Part 13, Mining. Cambridge University Press. p. 152. ISBN 978-0-521-58000-7.
earliest blast furnace discovered in China from about the first century AD
- ^ Pigott, Vincent C. (1999). The Archaeometallurgy of the Asian Old World. Philadelphia: University of Pennsylvania Museum of Archaeology and Anthropology. ISBN 0-924171-34-0, p. 191.
- ^ The Coming of the Ages of Steel. Brill Archive. 1961. p. 54.
- ^ Mott, R.A (2014). "Dry and Wet Puddling". Transactions of the Newcomen Society. 49: 156–57. doi:10.1179/tns.1977.011.
- ^ Wagner, Donald B. (2003). "Chinese blast furnaces from the 10th to the 14th century" (PDF). Historical Metallurgy. 37 (1): 25–37. Archived from the original (PDF) on 7 January 2018. Retrieved 7 January 2018. originally published in Wagner, Donald B. (2001). "Chinese blast furnaces from the 10th to the 14th century". West Asian Science, Technology, and Medicine. 18: 41–74. doi:10.1163/26669323-01801008.
- ^ Giannichedda, Enrico (2007): "Metal production in Late Antiquity", in Technology in Transition AD 300–650 Lavan, L.; Zanini, E. and Sarantis, A.(eds.), Brill, Leiden; ISBN 90-04-16549-5, p. 200.
- ^ a b c d e f g Biddle, Verne; Parker, Gregory. Chemistry, Precision and Design. A Beka Book, Inc.
- ^ Wagner, Donald B. (1993). Iron and Steel in Ancient China. Brill. pp. 335–340. ISBN 978-90-04-09632-5.
- ^ a b c d Greenwood and Earnshaw, p. 1072
- ^ Schivelbusch, G. (1986) The Railway Journey: Industrialization and Perception of Time and Space in the 19th Century. Oxford: Berg.
- ^ Spoerl, Joseph S. A Brief History of Iron and Steel Production Archived 2 June 2010 at the Wayback Machine. Saint Anselm College
- ^ Enghag, Per (8 January 2008). Encyclopedia of the Elements: Technical Data – History – Processing – Applications. pp. 190–91. ISBN 978-3-527-61234-5.
- ^ Whitaker, Robert D (1975). "An historical note on the conservation of mass". Journal of Chemical Education. 52 (10): 658. Bibcode:1975JChEd..52..658W. doi:10.1021/ed052p658.
- ^ Fontenrose, Joseph (1974). "Work, Justice, and Hesiod's Five Ages". Classical Philology. 69 (1): 1–16. doi:10.1086/366027. JSTOR 268960. S2CID 161808359.
- ^ Schmidt, Eva (1981) Der preußische Eisenkunstguss. (Art of Prussian cast iron) Technik, Geschichte, Werke, Künstler. Verlag Mann, Berlin, ISBN 3-7861-1130-8
- ^ Lux, H. (1963) "Metallic Iron" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. G. Brauer (ed.), Academic Press, NY. Vol. 2. pp. 1490–91.
- ^ Steel Statistical Yearbook 2010. World Steel Association
- ^ a b c d e f g Greenwood and Earnshaw, p. 1073
- ^ Song Yingxing (1637): The Tiangong Kaiwu encyclopedia.
- ^ Wang, Peng; Ryberg, Morten; Yang, Yi; Feng, Kuishuang; Kara, Sami; Hauschild, Michael; Chen, Wei-Qiang (6 April 2021). "Efficiency stagnation in global steel production urges joint supply- and demand-side mitigation efforts". Nature Communications. 12 (1): 2066. doi:10.1038/s41467-021-22245-6. ISSN 2041-1723. PMC 8024266. PMID 33824307.
- ^ Verhoeven, J.D. (1975) Fundamentals of Physical Metallurgy, Wiley, New York, p. 326
- ^ Greenwood and Earnshaw, pp. 1070–71
- ^ a b Kohl, Walter H. (1995). Handbook of materials and techniques for vacuum devices. Springer. pp. 164–67. ISBN 1-56396-387-6.
- ^ a b Kuhn, Howard; Medlin, Dana; et al., eds. (2000). ASM Handbook – Mechanical Testing and Evaluation (PDF). Vol. 8. ASM International. p. 275. ISBN 0-87170-389-0. Archived from the original (PDF) on 9 February 2019. Retrieved 22 February 2022.
- ^ "Hardness Conversion Chart". Maryland Metrics. Archived from the original on 18 June 2015. Retrieved 23 May 2010.
- ^ Takaji, Kusakawa; Toshikatsu, Otani (1964). "Properties of Various Pure Irons: Study on pure iron I". Tetsu-to-Hagane. 50 (1): 42–47. doi:10.2355/tetsutohagane1955.50.1_42.
- ^ Raghavan, V. (2004). Materials Science and Engineering. PHI Learning Pvt. Ltd. p. 218. ISBN 81-203-2455-2.
- ^ Martin, John Wilson (2007). Concise encyclopedia of the structure of materials. Elsevier. p. 183. ISBN 978-0-08-045127-5.
- ^ a b Camp, James McIntyre; Francis, Charles Blaine (1920). The Making, Shaping and Treating of Steel. Pittsburgh: Carnegie Steel Company. pp. 173–74. ISBN 1-147-64423-3.
- ^ a b Smith, William F.; Hashemi, Javad (2006), Foundations of Materials Science and Engineering (4th ed.), McGraw-Hill, p. 431, ISBN 0-07-295358-6.
- ^ a b "Classification of Carbon and Low-Alloy Steels". Retrieved 5 January 2008.
- ^ HSLA Steel, 15 November 2002, archived from the original on 30 December 2009, retrieved 11 October 2008.
- ^ Oberg, E.; et al. (1996), "Machinery's Handbook", New York: Industrial Press (25th ed.), Industrial Press Inc: 440–42, Bibcode:1984msh..book.....R
- ^ Rokni, Sayed H.; Cossairt, J. Donald; Liu, James C. (January 2008). "Radiation Shielding at High-Energy Electron and Proton Accelerators" (PDF). Retrieved 6 August 2016.
- ^ a b c Greenwood and Earnshaw, p. 1076
- ^ Kolasinski, Kurt W. (2002). "Where are Heterogenous Reactions Important". Surface science: foundations of catalysis and nanoscience. John Wiley and Sons. pp. 15–16. ISBN 978-0-471-49244-3.
- ^ McKetta, John J. (1989). "Nitrobenzene and Nitrotoluene". Encyclopedia of Chemical Processing and Design: Volume 31 – Natural Gas Liquids and Natural Gasoline to Offshore Process Piping: High Performance Alloys. CRC Press. pp. 166–67. ISBN 978-0-8247-2481-8.
- ^ Raso, R.; García, L.; Ruiz, J.; Oliva, M.; Arauzo, J. (1 April 2021). "Aqueous phase hydrogenolysis of glycerol over Ni/Al-Fe catalysts without external hydrogen addition". Applied Catalysis B: Environmental. 283: 119598. doi:10.1016/j.apcatb.2020.119598. ISSN 0926-3373. S2CID 225148435.
- ^ da Silva, Márcio J.; de Andrade Leles, Lorena C.; Teixeira, Milena Galdino (1 December 2020). "Lewis acid metal cations exchanged heteropoly salts as catalysts in β-pinene etherification". Reaction Kinetics, Mechanisms and Catalysis. 131 (2): 875–887. doi:10.1007/s11144-020-01888-4. ISSN 1878-5204. S2CID 224783194.
- ^ Rydel-Ciszek, Katarzyna (1 August 2021). "The most reactive iron and manganese complexes with N-pentadentate ligands for dioxygen activation—synthesis, characteristics, applications". Reaction Kinetics, Mechanisms and Catalysis. 133 (2): 579–600. doi:10.1007/s11144-021-02008-6. ISSN 1878-5204. S2CID 235442316.
- ^ Mazzucato, Marco; Daniel, Giorgia; Mehmood, Asad; Kosmala, Tomasz; Granozzi, Gaetano; Kucernak, Anthony; Durante, Christian (15 August 2021). "Effects of the induced micro- and meso-porosity on the single site density and turn over frequency of Fe-N-C carbon electrodes for the oxygen reduction reaction". Applied Catalysis B: Environmental. 291: 120068. doi:10.1016/j.apcatb.2021.120068. ISSN 0926-3373. S2CID 233831901.
- ^ Besegatto, Stefane V.; da Silva, Adriano; Campos, Carlos E. M.; de Souza, Selene M. A. Guelli Ulson; de Souza, Antônio A. Ulson; González, Sergio Yesid Gómez (5 May 2021). "Perovskite-based Ca-Ni-Fe oxides for azo pollutants fast abatement through dark catalysis". Applied Catalysis B: Environmental. 284: 119747. doi:10.1016/j.apcatb.2020.119747. ISSN 0926-3373. S2CID 229444245.
- ^ López-Vinent, N.; Cruz-Alcalde, A.; Giménez, J.; Esplugas, S.; Sans, C. (5 August 2021). "Improvement of the photo-Fenton process at natural condition of pH using organic fertilizers mixtures: Potential application to agricultural reuse of wastewater". Applied Catalysis B: Environmental. 290: 120066. doi:10.1016/j.apcatb.2021.120066. ISSN 0926-3373. S2CID 233833901.
- ^ Filho, José B. G.; Bruziquesi, Carlos G. O.; Rios, Regiane D. F.; Castro, Alexandre A.; Victória, Henrique F. V.; Krambrock, Klaus; Mansur, Alexandra A. P.; Mansur, Herman S.; Siniterra, Ruben D.; Ramalho, Teodorico C.; Pereira, Márcio C.; Oliveira, Luiz C. A. (15 May 2021). "Selective visible-light-driven toxicity breakdown of nerve agent simulant methyl paraoxon over a photoactive nanofabric". Applied Catalysis B: Environmental. 285: 119774. doi:10.1016/j.apcatb.2020.119774. ISSN 0926-3373. S2CID 230544411.
- ^ Romero-Sánchez, L. B.; Alonso-Núñez, G.; Prieto-García, R.; de León, J. N. Díaz; Fuentes, S.; Del Valle, M.; Vega-Granados, K.; Paraguay-Delgado, F.; Cruz-Reyes, J. (1 August 2021). "Hydrodesulfurization of dibenzothiophene using novel unsupported FeMoS catalysts prepared by in-situ activation from Fe (III)-containing thiomolybdate salts". Reaction Kinetics, Mechanisms and Catalysis. 133 (2): 1027–1044. doi:10.1007/s11144-021-02040-6. ISSN 1878-5204. S2CID 236940863.
- ^ a b c Wildermuth, Egon; Stark, Hans; Friedrich, Gabriele; Ebenhöch, Franz Ludwig; Kühborth, Brigitte; Silver, Jack; Rituper, Rafael (2000). "Iron Compounds". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a14_591. ISBN 3-527-30673-0.
- ^ Stroud, Robert (1933). Diseases of Canaries. Canary Publishers Company. p. 203. ISBN 978-1-4465-4656-7.
- ^ Dlouhy, Adrienne C.; Outten, Caryn E. (2013). Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 241–78. doi:10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. PMC 3924584. PMID 23595675. electronic-book ISBN 978-94-007-5561-1
- ^ Yee, Gereon M.; Tolman, William B. (2015). Peter M.H. Kroneck; Martha E. Sosa Torres (eds.). Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. Vol. 15. Springer. pp. 131–204. doi:10.1007/978-3-319-12415-5_5. PMID 25707468.
- ^ a b c d e f g h i j k l m n o p Greenwood and Earnshaw, pp. 1098–104
- ^ Lippard, S.J.; Berg, J.M. (1994). Principles of Bioinorganic Chemistry. Mill Valley: University Science Books. ISBN 0-935702-73-3.
- ^ Kikuchi, G.; Yoshida, T.; Noguchi, M. (2005). "Heme oxygenase and heme degradation". Biochemical and Biophysical Research Communications. 338 (1): 558–67. doi:10.1016/j.bbrc.2005.08.020. PMID 16115609.
- ^ Uebe, René; Schüler, Dirk; "The Formation of Iron Biominerals ", pp 159-184 in "Metals, Microbes and Minerals: The Biogeochemical Side of Life" (2021) pp xiv + 341. Walter de Gruyter, Berlin. Editors Kroneck, Peter M.H. and Sosa Torres, Martha. DOI 10.1515/9783110589771-006
- ^ Neilands, J.B. (1995). "Siderophores: structure and function of microbial iron transport compounds". The Journal of Biological Chemistry. 270 (45): 26723–26. doi:10.1074/jbc.270.45.26723. PMID 7592901.
- ^ Neilands, J.B. (1981). "Microbial Iron Compounds". Annual Review of Biochemistry. 50 (1): 715–31. doi:10.1146/annurev.bi.50.070181.003435. PMID 6455965.
- ^ Boukhalfa, Hakim; Crumbliss, Alvin L. (2002). "Chemical aspects of siderophore mediated iron transport". BioMetals. 15 (4): 325–39. doi:10.1023/A:1020218608266. PMID 12405526. S2CID 19697776.
- ^ Nanami, M.; Ookawara, T.; Otaki, Y.; Ito, K.; Moriguchi, R.; Miyagawa, K.; Hasuike, Y.; Izumi, M.; Eguchi, H.; Suzuki, K.; Nakanishi, T. (2005). "Tumor necrosis factor-α-induced iron sequestration and oxidative stress in human endothelial cells". Arteriosclerosis, Thrombosis, and Vascular Biology. 25 (12): 2495–501. doi:10.1161/01.ATV.0000190610.63878.20. PMID 16224057.
- ^ Rouault, Tracey A. (2003). "How Mammals Acquire and Distribute Iron Needed for Oxygen-Based Metabolism". PLOS Biology. 1 (3): e9. doi:10.1371/journal.pbio.0000079. PMC 300689. PMID 14691550.
- ^ Boon EM, Downs A, Marcey D. "Proposed Mechanism of Catalase". Catalase: H2O2: H2O2 Oxidoreductase: Catalase Structural Tutorial. Retrieved 11 February 2007.
- ^ Boyington JC, Gaffney BJ, Amzel LM (1993). "The three-dimensional structure of an arachidonic acid 15-lipoxygenase". Science. 260 (5113): 1482–86. Bibcode:1993Sci...260.1482B. doi:10.1126/science.8502991. PMID 8502991.
- ^ Gray, N.K.; Hentze, M.W. (August 1994). "Iron regulatory protein prevents binding of the 43S translation pre-initiation complex to ferritin and eALAS mRNAs". EMBO J. 13 (16): 3882–91. doi:10.1002/j.1460-2075.1994.tb06699.x. PMC 395301. PMID 8070415.
- ^ Gregory B. Vásquez; Xinhua Ji; Clara Fronticelli; Gary L. Gilliland (1998). "Human Carboxyhemoglobin at 2.2 Å Resolution: Structure and Solvent Comparisons of R-State, R2-State and T-State Hemoglobins". Acta Crystallogr. D. 54 (3): 355–66. doi:10.1107/S0907444997012250. PMID 9761903.
- ^ Sanderson, K (2017). "Mussels' iron grip inspires strong and stretchy polymer". Chemical & Engineering News. American Chemical Society. 95 (44): 8. doi:10.1021/cen-09544-notw3. Retrieved 2 November 2017.
- ^ Food Standards Agency – Eat well, be well – Iron deficiency Archived 8 August 2006 at the Wayback Machine. Eatwell.gov.uk (5 March 2012). Retrieved on 27 June 2012.
- ^ Hoppe, M.; Hulthén, L.; Hallberg, L. (2005). "The relative bioavailability in humans of elemental iron powders for use in food fortification". European Journal of Nutrition. 45 (1): 37–44. doi:10.1007/s00394-005-0560-0. PMID 15864409. S2CID 42983904.
- ^ Pineda, O.; Ashmead, H. D. (2001). "Effectiveness of treatment of iron-deficiency anemia in infants and young children with ferrous bis-glycinate chelate". Nutrition. 17 (5): 381–4. doi:10.1016/S0899-9007(01)00519-6. PMID 11377130.
- ^ Ashmead, H. DeWayne (1989). Conversations on Chelation and Mineral Nutrition. Keats Publishing. ISBN 0-87983-501-X.
- ^ Institute of Medicine (US) Panel on Micronutrients (2001). "Iron" (PDF). Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Iron. National Academy Press. pp. 290–393. ISBN 0-309-07279-4. PMID 25057538.
- ^ "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF). European Food Safety Authority. 2017.
- ^ "Tolerable Upper Intake Levels For Vitamins And Minerals" (PDF). European Food Safety Authority. 2006.
- ^ "Iron Deficiency Anemia". MediResource. Retrieved 17 December 2008.
- ^ Milman, N. (1996). "Serum ferritin in Danes: studies of iron status from infancy to old age, during blood donation and pregnancy". International Journal of Hematology. 63 (2): 103–35. doi:10.1016/0925-5710(95)00426-2. PMID 8867722.
- ^ "Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982" (PDF).
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)". Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ Centers for Disease Control and Prevention (2002). "Iron deficiency – United States, 1999–2000". MMWR. 51 (40): 897–99. PMID 12418542.
- ^ Hider, Robert C.; Kong, Xiaole (2013). "Chapter 8. Iron: Effect of Overload and Deficiency". In Astrid Sigel, Helmut Sigel and Roland K.O. Sigel (ed.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 229–94. doi:10.1007/978-94-007-7500-8_8. PMID 24470094.
- ^ Dlouhy, Adrienne C.; Outten, Caryn E. (2013). "Chapter 8.4 Iron Uptake, Trafficking and Storage". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 241–78. doi:10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. PMC 3924584. PMID 23595675. electronic-book ISBN 978-94-007-5561-1
- ^ CDC Centers for Disease Control and Prevention (3 April 1998). "Recommendations to Prevent and Control Iron Deficiency in the United States". Morbidity and Mortality Weekly Report. 47 (RR3): 1. Retrieved 12 August 2014.
- ^ Centers for Disease Control and Prevention. "Iron and Iron Deficiency". Retrieved 12 August 2014.
- ^ Ramzi S. Cotran; Vinay Kumar; Tucker Collins; Stanley Leonard Robbins (1999). Robbins pathologic basis of disease. Saunders. ISBN 978-0-7216-7335-6. Retrieved 27 June 2012.
- ^ Ganz T (August 2003). "Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation". Blood. 102 (3): 783–8. doi:10.1182/blood-2003-03-0672. PMID 12663437. S2CID 28909635.
- ^ Durupt, S.; Durieu, I.; Nové-Josserand, R.; Bencharif, L.; Rousset, H.; Vital Durand, D. (2000). "Hereditary hemochromatosis". Rev Méd Interne. 21 (11): 961–71. doi:10.1016/S0248-8663(00)00252-6. PMID 11109593.
- ^ a b Cheney, K.; Gumbiner, C.; Benson, B.; Tenenbein, M. (1995). "Survival after a severe iron poisoning treated with intermittent infusions of deferoxamine". J Toxicol Clin Toxicol. 33 (1): 61–66. doi:10.3109/15563659509020217. PMID 7837315.
- ^ a b "Toxicity, Iron". Medscape. Retrieved 23 May 2010.
- ^ Dietary Reference Intakes (DRIs): Recommended Intakes for Individuals (PDF), Food and Nutrition Board, Institute of Medicine, National Academies, 2004, archived from the original (PDF) on 14 March 2013, retrieved 9 June 2009
- ^ Tenenbein, M. (1996). "Benefits of parenteral deferoxamine for acute iron poisoning". J Toxicol Clin Toxicol. 34 (5): 485–89. doi:10.3109/15563659609028005. PMID 8800185.
- ^ Wu H, Wu T, Xu X, Wang J, Wang J (May 2011). "Iron toxicity in mice with collagenase-induced intracerebral hemorrhage". J Cereb Blood Flow Metab. 31 (5): 1243–50. doi:10.1038/jcbfm.2010.209. PMC 3099628. PMID 21102602.
- ^ Robberecht, Harry; et al. (2020). "Magnesium, Iron, Zinc, Copper and Selenium Status in Attention-Deficit/Hyperactivity Disorder (ADHD)". Molecules. 25 (19): 4440. doi:10.3390/molecules25194440. PMC 7583976. PMID 32992575.
- ^ Soto-Insuga, V; et al. (2013). "[Role of iron in the treatment of attention deficit-hyperactivity disorder]". An Pediatr (Barc). 79 (4): 230–235. doi:10.1016/j.anpedi.2013.02.008. PMID 23582950.
- ^ Thévenod, Frank (2018). "Chapter 15. Iron and Its Role in Cancer Defense: A Double-Edged Sword". In Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland K. O. (eds.). Metallo-Drugs: Development and Action of Anticancer Agents. Metal Ions in Life Sciences. Vol. 18. Berlin: de Gruyter GmbH. pp. 437–67. doi:10.1515/9783110470734-021. PMID 29394034.
- ^ a b Beguin, Y; Aapro, M; Ludwig, H; Mizzen, L; Osterborg, A (2014). "Epidemiological and nonclinical studies investigating effects of iron in carcinogenesis--a critical review". Critical Reviews in Oncology/Hematology. 89 (1): 1–15. doi:10.1016/j.critrevonc.2013.10.008. PMID 24275533.
- ^ Morel, F.M.M., Hudson, R.J.M., & Price, N.M. (1991). Limitation of productivity by trace metals in the sea. Limnology and Oceanography, 36(8), 1742-1755. doi:10.4319/lo.1991.36.8.1742
- ^ Brezezinski, M.A., Baines, S.B., Balch, W.M., Beucher, C.P., Chai, F., Dugdale, R.C., Krause, J.W., Landry, M.R., Marchi, A., Measures, C.I., Nelson, D.M., Parker, A.E., Poulton, A.J., Selph, K.E., Strutton, P.G., Taylor, A.G., & Twining, B.S.(2011). Co-limitation of diatoms by iron and silicic acid in the equatorial Pacific. Deep-Sea Research Part II: Topical Studies in Oceanography, 58(3-4), 493-511. doi:10.1016/j.dsr2.2010.08.005
- ^ Field, E. K., Kato, S., Findlay, A. J., MacDonald, D. J., Chiu, B. K., Luther, G. W., & Chan, C. S. (2016). Planktonic marine iron oxidizers drive iron mineralization under low-oxygen conditions. Geobiology, 14(5), 499-508. doi:10.1111/gbi.12189
- ^ Wells, M.L., Price, N.M., & Bruland, K.W. (1995). Iron chemistry in seawater and its relationship to phytoplankton: a workshop report. Marine Chemistry, 48(2), 157-182. doi:10.1016/0304-4203(94)00055-I
- ^ Lannuzel, D., Vancoppenolle, M., van der Merwe, P., de Jong, J., Meiners, K.M., Grotti, M., Nishioska, J., & Schoemann. (2016). Iron in sea ice: Review and new insights. Elementa: Science of the Anthropocene, 4 000130. doi:10.12952/journal.elementa.000130
- ^ Raiswell, R. 2011. Iron Transport from the Continents to the Open Ocean: The Aging–Rejuvenation Cycle. Elements, 7(2), 101–106. doi:10.2113/gselements.7.2.101
- ^ Tagliabue, A., Bopp, L., Aumont,O., & Arrigo, K.R. (2009). Influence of light and temperature on the marine iron cycle: From theoretical to global modeling. Global Biogeochemical Cycles, 23. doi:10.1029/2008GB003214
Bibliography
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Weeks, Mary Elvira; Leichester, Henry M. (1968). "Elements known to the ancients". Discovery of the elements. Easton, PA: Journal of Chemical Education. pp. 29–40. ISBN 0-7661-3872-0. LCCN 68-15217.
Further reading
- H.R. Schubert, History of the British Iron and Steel Industry ... to 1775 AD (Routledge, London, 1957)
- R.F. Tylecote, History of Metallurgy (Institute of Materials, London 1992).
- R.F. Tylecote, "Iron in the Industrial Revolution" in J. Day and R.F. Tylecote, The Industrial Revolution in Metals (Institute of Materials 1991), 200–60.
External links
- It's Elemental – Iron
- Iron at The Periodic Table of Videos (University of Nottingham)
- Metallurgy for the non-Metallurgist
- Iron by J.B. Calvert