주석
Tin | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주석 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 동소체 | 은백색, β(알파); 회색, α(알파) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 표준 원자량Ar°(Sn) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표의 주석 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그룹. | 그룹 14(탄소 그룹) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기간 | 기간 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 블록 | p블록 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 구성 | [Kr] 4d10 5s2 5p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 셸당 전자 수 | 2, 8, 18, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리 속성 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 단계 STP에서 | 단단한 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | 505.08 K (231.93 °C, 449.47 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 비등점 | 2875 K (2602 °C, 4716 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (근처) | 흰색, β: 7.265 g/cm3 회색,α: 5.769g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 액상일 때(로) | 6.99 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | 흰색, β: 7.03 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기화열 | 흰색, β: 296.1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰 열용량 | 흰색, β: 27.112 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
증기압
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 특성 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | -4, -3, -2, -1, 0,[2] +1,[3] +2, +3, +[4]4(양성 산화물) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 | 폴링 스케일: 1.96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 경험적: 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 공유 반지름 | 139±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 반데르발스 반지름 | 217 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주석의 스펙트럼 라인 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기타 속성 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자연발생 | 원시적인 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 체심 사각형 흰색(β) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 얼굴 중심 다이아몬드 광택 회색(α) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 음속 얇은 막대기 | 2730 m/s (에서)(롤) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열팽창 | 22.0 µm/(mkK) (25°C에서) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 66.8 W/(mµK) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 저항률 | 115 NΩm(0°C에서) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 자기 순서 | 회색: 반자성[5] 흰색(β): 상사성 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰 자화율 | (흰색) +3.1×10cm−63/mol(298K)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 영률 | 50 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전단 계수 | 18 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 벌크 계수 | 58 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 포아송비 | 0.36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 모스 경도 | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 브리넬 경도 | 50 ~ 440 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 역사 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 검출 | 기원전 35세기 무렵의 원시 역사 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기호. | "Sn": 라틴어 표준 번호에서 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주석의 주요 동위원소 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
주석(Tin)은 화학 원소로 기호는 Sn(라틴어: stannum)이고 원자 번호는 50입니다.주석이란 은빛을 띤 금속이다.
깡통은 거의 힘을 들이지 않고 자를[7] 수 있을 정도로 부드러우며, 깡통은 손으로 거의 힘을 들이지 않고 구부릴 수 있다.구부렸을 때 주석 [8]결정의 쌍둥이 작용의 결과로 소위 "주석 울음"이라고 불리는 소리를 들을 수 있습니다. 이 특성은 고체 상태에서 인듐, 카드뮴, 아연 및 수은에 의해 공유됩니다.
응고 후의 순수한 주석의 외관은 대부분의 금속과 유사하다.대부분의 주석 합금(예: 퓨터)에서 금속은 칙칙한 회색으로 응고됩니다.
주석은 원소 주기율표 14군에 속하는 전이 후 금속이다.그것은 주로 산화스탠, SnO를
2 함유한 미네랄 캐시타이트로부터 얻어진다.주석은 14족인 게르마늄과 납의 두 이웃과 화학적 유사성을 보이며, +2와 약간 더 안정적인 +4의 두 가지 주요 산화 상태를 가지고 있다.주석은 지구상에서 49번째로 풍부한 원소이며, 10개의 안정 동위원소를 가지고 있으며, 그것의 엄청난 양성자 수 덕분에 주기율표에서 가장 많은 안정 동위원소를 가지고 있다.
상온에서 안정 동소체는 은백색의 가단성 금속인 β-주석이며, 저온에서는 다이아몬드 입방체 구조를 가진 덜 조밀한 회색 α-주석이다.금속 주석은 공기와 물에서 쉽게 산화되지 않는다.
대규모로 사용된 최초의 주석 합금은 청동으로 만들어졌다. 기원전 3000년부터 1⁄8 주석과 7⁄8 구리.기원전 600년 이후, 순수한 금속 주석들이 생산되었다.퓨터는 85~90% 주석의 합금이고 나머지는 구리, 안티몬, 비스무트, 때로는 납과 은으로 구성되며 청동기 시대부터 평판 식기에 사용되어 왔습니다.오늘날 주석은 많은 합금, 특히 주석/납 연납땜에 사용되며, 일반적으로 주석의 60% 이상이 함유되어 있으며 광전자 분야에서 산화인듐 주석의 투명하고 전기 전도성 피막 제조에 사용됩니다.또 다른 대규모 적용 분야는 강철의 내식성 주석 도금입니다.무기 주석의 독성이 낮기 때문에 주석 도금강은 깡통으로서 식품포장에 널리 사용되고 있다.어떤 유기화합물들은 매우 독성이 강할 수 있다.
특성.
물리적.

주석이란 부드럽고 가단성이 있으며 연성이 있으며 결정성이 높은 은백색의 금속입니다.주석 막대가 구부러질 때 "주석 울음"으로 알려진 탁탁거리는 소리가 [8]수정의 쌍둥이 결합에서 들립니다.주석 녹는 온도는 그룹 14에서 가장 낮은 약 232°C(450°F)입니다.11nm [9][10]입자의 경우 녹는점이 177.3°C(351.1°F)로 더 낮아집니다.
| 외부 비디오 | |
|---|---|
β-주석(금속 형태 또는 백주석)은 BCT 구조를 가지며 상온 이상에서 안정적이며 가단성이 있다.비금속 형태 또는 회색 주석인 α-tin은 13.2°C(55.8°F) 이하에서 안정적이며 부서지기 쉽다.α-주석은 다이아몬드, 실리콘 또는 게르마늄과 유사한 다이아몬드 입방정 결정 구조를 가지고 있다.α-주석은 원자가 전자가 자유롭게 움직일 수 없는 공유 구조를 형성하기 때문에 금속 특성이 없다.α-tin은 둔탁한 분말상 물질로 특수한 반도체 [8]용도 외에는 일반적인 용도가 없다.γ-tin 및 γ-tin은 161°C(322°F) 이상의 온도와 여러 [11]GPa 이상의 압력에서 존재한다.
추운 조건에서 β-주석은 "주석 페스트" 또는 "주석 질환"[citation needed]으로 알려진 현상인 α-주석으로 자발적으로 변환되는 경향이 있다.또한 1812년 나폴레옹의 러시아 전역 동안 온도가 너무 낮아져서 시간이 지남에 따라 병사들의 제복의 양철 단추가 분해되어 영구적인 [13][14][15]전설인 [12]대육군을 물리치는 데 기여했다고 일부 입증할 수 없는 소식통들은 말한다.
α-β 변환 온도는 13.2°C(55.8°F)이지만, 불순물(예: Al, Zn 등)은 0°C(32°F) 이하로 낮춘다.안티몬이나 비스무트를 첨가하면 변환이 전혀 이루어지지 않아 [16]내구성이 향상됩니다.
소량의 비스무트, 안티몬, 납 및 은이 불순물로 존재하는 것을 억제하기 때문에 주석(주석함유율 99.8%)의 상용 등급은 변형을 저항한다.구리, 안티몬, 비스무트, 카드뮴, 은 등의 합금 원소는 [citation needed]주석의 경도를 높인다.주석은 일반적으로 바람직하지 않은 단단하고 부서지기 쉬운 금속 간 단계를 쉽게 형성합니다.그것은 대부분의 금속과 원소와 용액에 섞이지 않기 때문에 주석에는 고체 용해성이 많지 않습니다.주석과 비스무트, 갈륨, 납, 탈륨 및 아연이 혼합되어 간단한 공정 체계를 [16]형성합니다.
주석은 3.72K[17] 이하의 초전도체가 되며 최초로 [18]연구된 초전도체 중 하나였다.초전도체의 특징 중 하나인 마이스너 효과는 초전도 주석 [18]결정에서 처음 발견되었다.
화학의
주석의 경우 물에 의한 부식에 강하지만 산과 알칼리에 의해 부식될 수 있습니다.주석의 광택은 매우 뛰어나고 다른 [8]금속의 보호막으로 사용될 수 있으며, 산화물(수동) 보호층이 더 이상의 [19]산화를 방지합니다.주석은 산소를 포함한 용액의 화학 반응을 일으키는 촉매 역할을 하며 화학 [citation needed]반응 속도를 높이는 데 도움이 됩니다.
동위원소
주석에는 10개의 안정 동위원소가 있는데, 이는 모든 원소 중 가장 많은 수이다.주석의 동위원소는 원자 질량이 112, 114, 115, 116, 117, 118, 119, 120, 122, 124이다.120Sn은 주석의 거의 3분의 1을 차지한다. Sn과 Sn도 흔하며 Sn은 가장 흔하지 않은 안정 동위원소이다.짝수 질량수를 가진 동위원소는 핵 스핀이 없는 반면, 홀수 질량수를 가진 동위원소는 1/2 스핀을 갖는다.주석은 분자량에 의존하는 NMR 분광법으로 검출 및 분석하기 가장 쉬운 원소 중 하나이며 SnMe에 [notes 1][20]대해 주석의
4 화학적 변화를 참조한다.안정 동위원소 수가 많은 것은 핵물리학에서 "마법의 숫자"인 원자 번호 50을 가진 주석의 직접적인 결과로 생각된다.
주석에는 질량수가 99에서 139에 이르는 31개의 불안정한 동위원소가 있다.불안정한 주석 동위원소는 Sn의 반감기가 230,000년인 것을 제외하고 반감기가 1년 미만이다.100Sn과 Sn은 중성자-프로톤 비율이 매우 고르지 않음에도 불구하고 Sn보다 가볍고 Sn보다 무거운 주석 동위원소가 훨씬 [21]덜 안정적인 끝점인 "이중 마법" 핵을 가진 몇 안 되는 핵종 중 두 개이다.111에서 131 사이의 주석 동위원소에 대해 30개의 준안정 이성질체가 확인되었으며, 가장 안정적인 것은 Sn이며, 반감기는 43.[22]9년이다.
주석의 안정적인 동위원소 수의 상대적 차이는 그들이 항성 핵합성 과정에서 어떻게 형성되는지에 의해 설명될 수 있다.116Sn ~ Sn은 대부분의 별에서 s-과정(느린 중성자 포획)에서 형성되며, Sn과 Sn은 가장 일반적인 주석 동위원소이다. 반면 Sn과 Sn은 초신성의 r-과정(급속 중성자 포획)에서만 형성되며 덜 흔하다.주석 동위원소 Sn ~ Sn도 r-공정에서 [citation needed]생성된다.112Sn, Sn, Sn은 s- 또는 r-공정에서 유의하게 생성될 수 없으며 기원이 잘 파악되지 않는 p-핵에 속한다.이들의 형성에 대한 일부 아이디어는 양성자 포획과 광분해를 포함하며 Sn은 직접 및 장수 In의 [23]딸로서 s-공정에서 부분적으로 생성될 수 있다.
어원학
주석이라는 단어는 게르만어족 언어들 사이에서 공유되며, 독일조어의 *tin-om을 재구성한 것으로 거슬러 올라갈 수 있다. 동족어로는 독일어 진, 스웨덴어 tenn, 네덜란드어 주석 등이 있다.게르만어(예를 들어 [24][25]영어에서 아일랜드 주석)를 차용한 경우를 제외하고 인도-유럽어족의 다른 어족에서는 찾아볼 수 없다.
스탠넘이라는 라틴어 이름은 원래 은과 납의 합금이라는 뜻이었고[26] 4세기에 주석이라는 뜻이었는데, 초기 라틴어로는 플럼칸디디움 또는 "흰 납"이라는 뜻이었다.스탠넘은 분명히 주석의 [24][27]로망스 용어와 켈트 용어의 기원인 초기 스타넘(같은 [24]물질을 의미)에서 유래한 것으로 보인다.스탠넘/스태넘의 기원은 알려져 있지 않으며, 인도 유럽 [28]이전일 수 있습니다.
마이어스 콘버세이션-렉시콘은 대신 스탠넘이 콘월에서 왔고 서기 1세기 콘월이 [citation needed]주석의 주요 공급원이었다는 증거라고 주장한다.
역사

주석 추출과 사용은 다른 금속 성분을 가진 다금속 광석으로 형성된 구리 물체가 다른 물리적 특성을 [29]가진 것이 관찰된 기원전 3000년 경 청동기 시대의 시작으로 거슬러 올라갈 수 있다.최초의 청동 물체는 주석 또는 비소 함량이 2% 미만이었으며, 구리 [30]광석의 미량 금속 함량에 의한 의도하지 않은 합금의 결과로 여겨진다.구리에 두 번째 금속을 추가하면 경도가 높아지고, 용해 온도가 낮아지며, 더 밀도가 높고 덜 스폰지 [30]같은 금속으로 냉각되는 더 많은 유체 용융물이 생성되어 주조 공정도 개선됩니다.이것은 청동기 시대의 닫힌 틀에 주조된 훨씬 더 복잡한 형태를 가능하게 하는 중요한 혁신이었다.비소 청동 물체는 구리 광석과 함께 비소가 흔히 발견되는 근동에서 처음 등장하지만 건강상의 위험이 빠르게 인식되었고 훨씬 덜 위험한 주석 광석의 출처를 찾는 것은 청동기 [31]시대 초기에 시작되었다.이것은 희귀한 주석 금속에 대한 수요를 창출했고 주석의 먼 원천과 청동기 문화의 [citation needed]시장을 연결하는 무역망을 형성했다.
주석의 산화물 형태인 카시테라이트(SnO
2)가 주석의 원래 공급원이었을 가능성이 높다.다른 주석 광석은 스탄나이트와 같이 보다 복잡한 제련 과정을 필요로 하는 덜 흔한 황화물입니다.카시테라이트는 동반된 [30]화강암보다 더 단단하고 무겁고 화학적으로 더 강하기 때문에 종종 사광 퇴적물로 충적 채널에 축적됩니다.카시테라이트는 보통 검은색이나 어두운 색이며, 이러한 퇴적물은 강둑에서 쉽게 볼 수 있다.충적(사광) 퇴적물은 우연히 금 [32]패닝과 유사한 방법으로 수집 및 분리되었을 수 있습니다.
화합물 및 화학
대부분의 화합물에서 주석의 산화 상태는 II 또는 IV입니다.
무기 화합물
할로겐화합물은 두 산화상태 모두로 알려져 있다.Sn(IV)의 경우 SnF4, SnCl4, SnBr4 및 SnI의4 4가지 할로겐화물이 모두 잘 알려져 있습니다.3개의 무거운 구성 요소는 휘발성 분자 화합물인 반면, 4불화물은 중합체이다.SnF2, SnCl
2, SnBr2 및 SnI의2 4가지 할로겐화물도 모두 Sn(II)로 알려져 있습니다.모두 고분자 고체입니다.이 8가지 화합물 중 요오드화물만 [33]착색된다.
염화 주석(II)은 가장 중요한 상업용 할로겐화 주석이다.이러한 화합물로의 경로를 설명하면 염소는 주석 금속과 반응하여 SnCl을 생성하는4 반면 염산과 주석의 반응은 SnCl과
2 수소 가스를 생성합니다.또는4 SnCl과 Sn은 [34]합성이라고 하는 과정을 통해 염화석탄과 결합합니다.
- SnCl4 + Sn → 2 SnCl
2
주석은 많은 산화물, 황화물 및 다른 카르코게니드 유도체를 형성할 수 있다.이산화 SnO
2(카시테라이트)는 주석의 공기 [33]중 가열 시 형성됩니다.Sn)
2은 양성체이며, 이는 산성 용액과 염기성 [35]용액에 모두 녹는다는 것을 의미한다.K[Sn(OH)]
6와 같이
2 [Sn(OH)]
62− 구조의 스타네이트도 알려져 있지만, 유리 스타네이트
2 H[Sn(OH)]
6는 알려져 있지 않다.
주석의 황화물은 주석(II) 황화물과 주석(IV) 황화물(모자이크 골드)의 +2 및 +4 산화상태로 존재한다.
하이드라이드
주석의 산화 상태가 +4인 Stannane(SnH
4)은 불안정하다.그러나 유기소 수소화물은 예를 들어 트리부틸틴 수소화물(Sn(CH49)3H)[8]과 같이 잘 알려져 있다.이러한 화합물은 주석(III)[37] 화합물의 드문 예인 일시적인 트리부틸 주석기를 방출한다.
유기 화합물
때때로 스타난이라고 불리는 유기물 화합물은 주석-탄소 [38]결합을 가진 화합물이다.주석 화합물 중 유기 유도체가 상업적으로 가장 유용하다.[39]몇몇 유기화합물들은 매우 독성이 강하며 바이오시드로 사용되어 왔다.최초로 보고된 오르가노틴 화합물은 1849년 [40]에드워드 프랭클랜드가 보고한 디에틸틴 디요오드화물(CH25)2 SnI였다2.
대부분의 오르가노틴 화합물은 공기와 물에 안정적인 무색의 액체나 고체이다.그들은 사면체 기하학을 채택한다.테트라알킬 및 테트라아릴틴 화합물은 그리냐드 [39]시약을 사용하여 제조할 수 있다.
- SnCl
4 + 4 RMgBr → RSn
4 + 4 MgBrCl
혼합 할로겐화 알킬은 테트라오르가노 유도체보다 더 흔하고 상업적으로 더 중요하며, 재분배 반응에 의해 제조됩니다.
- SnCl
4 + RSn
4 → 2 SnClR
22
2가의 오르가노틴 화합물은 드물지만, 관련된 2가의 오르가노제르마늄 및 유기규소 화합물보다 더 흔하다.Sn(II)이 더 큰 안정화를 누리는 것은 "불활성 쌍 효과"에 기인한다.오르가노틴(II) 화합물은 알케인과 거의 동등한 스탠닐렌(단일 카벤으로 보이는 공식: RSn2)과 디스타닐렌(RSN42)을 모두 포함한다.두 클래스 모두 특이한 [41]반응을 보입니다.
발생.

주석은 질량이 태양의 0.6배에서 10배인 중질량별에서 긴 s-과정을 거쳐 생성되며, 마지막으로 무거운 [42]인듐 동위원소의 베타 붕괴에 의해 생성된다.
주석은 아연 75ppm, 구리 50ppm, [43]납 14ppm에 비해 2ppm으로 지각에서 49번째로 풍부한 원소이다.
주석은 원소로 발생하지 않지만 다양한 광석에서 추출해야 합니다.카시테라이트(SnO
2)는 상업적으로 중요한 주석의 유일한 공급원인데, 비록 소량의 주석들이 스탄나이트, 원통형석, 프랑스카이트, 캔필라이트, 그리고 텔라이트와 같은 복잡한 황화물로부터 회수된다.주석 함유 광물은 거의 항상 화강암과 관련이 있으며, 보통 산화 주석 [44]함량이 1%입니다.
이산화 주석의 비중이 높기 때문에 채굴된 주석의 약 80%는 1차 광맥 하류에 있는 2차 퇴적물에서 나옵니다.과거에 하류에 떠내려온 과립에서 회수되어 계곡이나 바다에 퇴적되는 경우가 많다.주석 채굴의 가장 경제적인 방법은 준설, 수압 또는 개방된 구덩이에 의한 것이다.전 세계 주석의 대부분은 사광 [45]퇴적물로 생산되는데, 사광 퇴적물은 0.015%의 주석만을 함유하고 있다.
세계 주석 광산 매장량(톤수,[46] 2011년)| 나라 | 예비비 |
|---|---|
| 1,500,000 | |
| 250,000 | |
| 310,000 | |
| 800,000 | |
| 590,000 | |
| 400,000 | |
| 350,000 | |
| 180,000 | |
| 170,000 | |
| 다른. | 180,000 |
| 총 | 4,800,000 |
| 연도 | 백만 톤 |
|---|---|
| 1965 | 4,265 |
| 1970 | 3,930 |
| 1975 | 9,060 |
| 1980 | 9,100 |
| 1985 | 3,060 |
| 1990 | 7,100 |
| 2000 | 7,100[46] |
| 2010 | 5,200[46] |
2011년 약 253,000톤의 주석 광산이 이루어졌으며, 주로 중국(11,000t), 인도네시아(51,000t), 페루(34,600t), 볼리비아(20,700t), 브라질(12,000t)[46]에서 채굴되었다.주석 생산의 추정치는 시장과 채굴 기술에 따라 역사적으로 달라져 왔다.현재의 소비율과 기술로는, 지구는 40년 [47]안에 채굴 가능한 주석의 고갈을 겪을 것으로 추정된다.2006년 레스터 브라운은 연간 2%의 [48]성장률에 대한 보수적인 추정에 근거해 20년 이내에 주석의 고갈이 일어날 수 있다고 제안했습니다.
고철은 금속의 중요한 공급원이다.재활용을 통한 주석 회수가 급증하고 있다.미국은 1993년 이후 주석 채굴도 제련도 하지 않았지만 2006년에는 [46]약 1만4000t을 재활용하는 2차 생산국이었다.
몽골에서는 [49]새로운 퇴적물이 보고되고 있으며,[50] 2009년에는 콜롬비아에서 새로운 주석 퇴적물이 발견되었다.
.
주석의 생산은 탄소 또는 코크스와 함께 산화물의 탄화수소를 환원함으로써 이루어진다.반사로와 전기로를 모두 사용할 [51][52][53]수 있습니다.
과
★★★
기업은 10년에 했다.
세계 주석의 대부분은 8개국에서 17개 브랜드 [54]이하의 LME로 거래되고 있습니다.
최대 규모의 주석 생산 회사([55]톤)| ★★★ | 2006 | 2007 | 2017년[56] | 2006-2017 | |
|---|---|---|---|---|---|
| ★★★ | ,339 | ,196 | 74,500 | 42.3 | |
| Timah PT ★★ | ★★★★★★★★★★★★★★★」 | ,689 | ,180 | 30,200 | -32.4 |
| ★★★★★★★★★★★★★★★」 | 22,850 | 25,471 | ,200 | 19.0 | |
| ★★★ | 21,765 | ,000 | 26,800 | 23.1 | |
| ★★★ | 40,977 | 35,940 | ,000 | -56.1 | |
| Vinto EM | ★★★★★★★★★★★★★★★★★」 | 11,804 | 9,448 | 12,600 | 6.7 |
| 주석 | ★★★ | / | / | 11,500 | |
| ★★★★★ | ,828 | ,9,826 | 10,600 | -61.9 | |
| ★★★★★★★★★★★★★★★★★」 | 8,049 | 8,372 | 9,700 | 20.5 | |
| Zi Li | ★★★ | / | / | 8,700 |
주석 가격을 통제하기 위해 1947년에 국제 주석 위원회가 설립되었습니다.그것은 1985년에 붕괴되었다.1984년에는 호주, 볼리비아, 인도네시아, 말레이시아, 나이지리아, 태국, 자이르를 [57]회원으로 하여 주석 생산국 협회가 결성되었다.
과 ★★★★★★★★★★★★★★★★★」
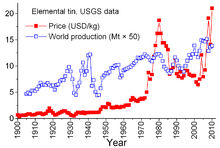
주석은 1921년부터 시작된 생산국과 소비국 간의 복잡한 협정 때문에 광물 상품 중에서 독특하다.이전의 합의는 다소 비공식적인 경향이 있었고, 1985년에 사실상 결렬된 시리즈 중 첫 번째 시리즈인 1956년에 "제1차 국제 주석 협정"으로 이어졌다.이 협정들을 통해, 국제 주석 평의회는 주석 가격에 상당한 영향을 끼쳤다.ITC는 저가격 기간에는 완충재 비축용 주석을 사들이고, 고가격 기간에는 재고품을 팔아 가격을 억제할 수 있었다.이것은 소비국으로의 주석의 충분한 흐름과 생산국의 이익을 보장하기 위해 고안된 반자유시장적 접근법이었다.그러나 완충재고는 충분치 않았고, 그 29년의 대부분 기간 동안 주석 가격은, 특히 심한 인플레이션이 많은 세계 경제를 괴롭혔던 1973년부터 1980년까지,[58] 때때로 급격하게 올랐다.
1970년대 후반과 1980년대 초반, 미국은 부분적으로 역사적으로 높은 주석 가격을 이용하기 위해 전략적인 주석 비축량을 줄였다.1981-82년의 불황은 주석 산업에 타격을 주었다.주석 소비는 극적으로 감소했다.ITC는 완충재고에 대한 구매 가속화를 통해 정말로 가파른 하락을 피할 수 있었습니다. 이 활동에는 대규모 차입이 필요했습니다.ITC는 신용한도에 도달한 1985년 후반까지 대출을 계속했다.즉시, 주석의 「주석 위기」가 뒤따랐다.주석은 런던 금속 거래소에서 약 3년간 거래에서 제외되었다.ITC는 곧 해체되었고, 현재는 자유 시장 환경에서 주석 가격은 파운드당 4달러까지 떨어졌고 1990년대까지 [58]그 수준을 유지했다.가격은 2007-2008년 경제위기 이후 소비가 회복되고 재입고와 [46]소비의 지속적인 성장에 따라 2010년까지 다시 상승하였다.
런던금속거래소(LME)는 주석의 주요 거래처다.[46]다른 주석 계약 시장으로는 쿠알라룸푸르 주석 시장(KLTM)과 인도네시아 주석 거래소(INATIN)[59]가 있다.
2021년 글로벌 서플라이 체인(supply-chain) 위기와 관련된 요인으로 인해 주석 가격은 2020년에서 21년 사이에 거의 두 배로 증가했으며 30년 만에 가장 큰 연간 상승률을 기록했습니다.국제 주석 협회는 COVID-19 대유행으로 전세계 제조 산업이 [60]혼란에 빠지면서 2020년에 1.6% 감소한 후 2021년에 전 세계 정제 주석 소비가 7.2% 증가할 것이라고 추정했다.
연간 kg당 가격:
주석([61][62]kg당 US$)| 2008 | 2009 | 2010 | 2011 | 2012 | 2021 | |
|---|---|---|---|---|---|---|
| 가격. | 18.51 | 13.57 | 20.41 | 26.05 | 21.13 | 38.67 |
적용들
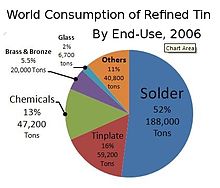
2018년에는 전체 주석 생산량의 절반도 안 되는 양이 납땜에 사용되었습니다.나머지는 주석도금, 주석화학, 황동과 청동합금, 틈새용도로 나뉜다.[63]
납땜

주석의 양은 납을 납땜으로 하는 합금에 5~70% w/w의 양으로 오랫동안 사용되어 왔습니다.납을 함유한 주석의 무게는 61.9%, 납은 38.1%(원자비율: 73.9%, 납은 26.1%)이며 용해 온도는 183°C(361.4°F)이다.이러한 납땜은 주로 파이프 또는 전기 회로를 접합하는 데 사용됩니다.2006년 7월 1일 유럽연합 폐기물 전기전자기기 지침(WEEE 지침) 및 유해물질 제한 지침이 발효된 이후, 이러한 합금의 납 함량은 감소했습니다.납 노출은 심각한 건강 문제와 관련이 있지만, 무연 납땜에는 높은 녹는점, 전기 문제를 일으키는 주석 수염의 형성 등 과제가 없는 것은 아닙니다.주석 해충은 무연 납땜에서 발생하여 납땜 접합부가 손실될 수 있습니다.대체 합금이 발견되고 있지만 접합부의 무결성 문제는 여전히 [64]남아 있습니다.
주석 도금

주석 결합은 철과 쉽게 결합되어 납, 아연, 강철을 코팅하여 부식을 방지하는 데 사용됩니다.주석 도금(또는 주석 도금) 강철 용기는 식품 보존을 위해 널리 사용되고 있으며, 이는 금속 주석 시장의 큰 부분을 형성하고 있습니다.음식을 보관하기 위한 양철 통은 [65]1812년 런던에서 처음 제조되었다.영국 영어를 사용하는 사람들은 이러한 용기를 "tins"라고 부르는 반면, 미국 영어를 사용하는 사람들은 "cannes" 또는 "tin cans"라고 부릅니다.이러한 용어의 파생어 중 하나는 호주에서 "맥주 캔"을 뜻하는 속어 "tinnie" 또는 "tinny"입니다.주석 호루라기는 주석 도금 강철로 [66][67]처음 대량 생산되었기 때문에 그렇게 불린다.
냄비나 프라이팬과 같은 구리 조리용기는 산성 식품과 함께 구리 조리기를 사용하면 독성이 있기 때문에 종종 주석의 얇은 도금, 전기 도금 또는 전통적인 화학 방법으로 안감된다.
특수 합금

주석과 다른 원소의 조합은 매우 다양한 유용한 합금을 형성합니다.주석과 구리는 가장 일반적으로 합금된다.Pewter는 주석 [68]함량이 85~99%이며, 베어링 금속도 주석 함량이 높습니다.[69][70]청동은 대부분 구리와 12% 주석으로 이루어져 있으며, 인을 첨가하면 인광 청동이 생성됩니다.벨 금속도 구리-주석 합금으로, 주석 함량은 22%입니다.주석은 때때로 주화에 사용되어 왔다; 주석은 한때 미국과 캐나다[72] 페니의[71] 한 자릿수 퍼센티지를 형성했다.구리는 종종 아연을 포함한 그러한 동전의 주요 금속이기 때문에, 이것들은 청동 또는 황동 합금이라고 불릴 수 있다.
니오브-주석 화합물3 NbSn은 높은 임계 온도(18K)와 임계 자기장(25T) 때문에 초전도 자석의 코일에 상업적으로 사용됩니다.무게가 2kg에 불과한 초전도 자석은 무게가 [73]톤인 기존 전자석의 자기장을 발생시킬 수 있다.
핵연료 [74]피복용 지르코늄 합금에는 소량의 주석도 첨가된다.
파이프 오르간의 금속 파이프는 대부분 주석/납 합금으로 구성되며, 가장 일반적인 구성은 50/50입니다.파이프 내 주석의 비율은 주석의 음색을 정의합니다. 주석의 음색은 바람직한 음색 공명을 가지기 때문입니다.주석/납 합금이 냉각되면 먼저 납상이 응고된 다음 공정 온도에 도달하면 남은 액체가 층상 주석/납 공정 구조를 형성하여 광택이 납니다. 납상과의 대비로 얼룩 또는 얼룩 효과가 발생합니다.이 금속 합금을 점착 금속이라고 합니다.파이프에 주석 사용의 주요 장점은 외관, 작업성 및 [75][76]내식성입니다.
옵토일렉트로닉스
인듐과 주석의 산화물은 전기적으로 전도성이 높고 투명하며, 액정 [77]디스플레이와 같은 광전자 공학 장치에 응용된 투명한 전기 전도성 필름을 만드는 데 사용됩니다.
기타 응용 프로그램
천공 주석 도금 강철은, 펑크 주석이라고도 불리며, 기능적이고 장식적인 가정 용품을 만들기 위해 중부 유럽에서 유래한 장인 기술입니다.지역 전통과 장인에 따라 다양한 장식의 피어싱 디자인이 존재합니다.양철등은 이 장인 기술의 가장 일반적인 응용 분야이다.뚫린 디자인 사이로 비치는 촛불의 빛은 그것이 앉아 있는 방에 장식적인 빛 무늬를 만들어 냅니다.초롱과 다른 천공 주석 물품들은 신대륙에서 초기 유럽 정착지에서 만들어졌다.잘 알려진 예는 폴 리비어의 이름을 딴 리비어 [78]랜턴이다.
현대 이전 알프스 산맥의 일부 지역에서는 염소나 양의 뿔을 갈고 1부터 9까지의 숫자와 알파벳을 사용하여 주석 판넬을 박아내곤 했다.이 학습 도구는 적절하게 "경적음"으로 알려져 있습니다.현대의 복제품은 하트나 튤립 등의 모티브로 장식되어 있습니다.
미국에서는 파이 금고와 식품 금고가 냉장되기 전에 사용되었다.이것들은 다양한 스타일과 크기의 나무 찬장으로, 바닥에 서 있거나 매달아 놓은 찬장으로 해충과 곤충을 방지하고 부패하기 쉬운 음식에서 먼지를 막아준다.이러한 캐비닛은 문과 때로는 측면에 양철판 삽입물이 있었는데, 집주인, 가구공, 깡통 장인이 다양한 디자인으로 천공하여 파리를 배제하고 공기 순환을 가능하게 했습니다.이 기사들의 현대 복제품들은 [79]북미에서 여전히 인기가 있다.
창유리는 녹은 주석(플로트 유리) 위에 용융된 유리를 띄워 평평하고 흠잡을 데 없는 표면을 만들어 내는 경우가 많습니다.이를 "필킹턴 프로세스"[80]라고도 합니다.
주석은 첨단 리튬 이온 배터리에서 음극으로 사용됩니다.일부 주석[which?] [81]표면이 Li-ion 배터리에 사용되는 탄산염계 전해질의 분해를 촉매한다는 사실로 인해 응용이 다소 제한됩니다.
불화 주석(II)은 일부 치과 치료[82] 제품에 불화석(SnF2)으로 첨가됩니다.플루오르화 주석(II)은 칼슘 연마제와 혼합될 수 있지만, 보다 일반적인 플루오르화 나트륨은 칼슘 [83]화합물의 존재 하에서 점차 생물학적으로 비활성화됩니다.그것은 또한 치은염 [84]조절에 불화나트륨보다 더 효과적인 것으로 나타났다.
극자외선 리소그래피의 광원 역할을 하는 레이저 유도 플라즈마를 만들기 위해 주석으로 사용됩니다.
유기 화합물
유기화합물이 가장 많이 사용된다.전 세계 산업 생산량은 5만 [85]톤을 넘을 것으로 예상된다.
PVC 스태빌라이저
유기화합물의 주요 상업적 용도는 PVC 플라스틱의 안정화이다.이러한 안정제가 없을 경우 PVC는 열, 빛 및 대기 산소에 의해 급속히 분해되어 변색되고 부서지기 쉬운 제품이 됩니다.주석 스캐빈지는 불안정한 염화물 이온(Cl−)을 제거하며, 그렇지 않으면 플라스틱 [86]재료에서 HCl을 제거할 수 있습니다.대표적인 주석 화합물은 디부틸틴 이염화물의 카르복실산 유도체(예: 딜라우레이트)[87]이다.
살충제
몇몇 유기화합물들은 장점과 문제점 모두를 가지고 비교적 독성이 있다.그것들은 살균제, 살충제, 녹조제, 목재 방부제,[86] 오염 방지제 등의 생물 살상 용도로 사용된다.트리부틸틴 옥시드는 목재 [88]방부제로 사용된다.트리부틸틴은 제지 공장의 슬라임 제어, 순환하는 공업용 [89]냉각수의 소독 등 다양한 산업 용도로도 사용됩니다.트리부틸틴은 선박 내 오염 생물의 성장을 방지하기 위해 선박용 페인트에 첨가물로 사용되었으며, 유기물 화합물이 일부 해양 생물(예를 들어 [90]개골)에게 높은 독성을 가진 지속성 유기 오염 물질로 인식되면서 사용이 감소하였다.EU2003,[91]에 organotin 화합물의 사용을 금지했다 이러한 화합물의 해양 생물과(약간의 보고 해양 생물을 향한 1nanogram의 리터 당 농도에서 생물학적는 영향을 서술하라)은 전 세계에 국제 Mariti에 의해 주도하고 있는데 해양 species[86]의 재생산과 성장으로 피해에 독성에 대한 우려.나 Orga니제이션[92]많은 나라들이 현재 유기화합물의 사용을 [86]25미터(82피트) 이상의 선박으로 제한하고 있다.수생 환경에서 트리부틸틴의 지속성은 [93]생태계의 특성에 따라 달라집니다.이러한 지속성과 선박용 도료 첨가물로 사용되기 때문에 해군 [94]부두 근처에 위치한 해양 퇴적물에서 고농도의 트리부틸틴이 발견되었습니다.트리부틸틴은 적어도 82종이 [95]알려진 네오그라스트로포드에서 인펙스의 바이오마커로 사용되어 왔다.현지 연안 지역에서 높은 TBT가 발생함에 따라 조개류는 출하 활동에 의해 악영향을 [93]받았다.임펙스란 남성 성징이 여성 표본에서 음경과 [95][96]창백한 정관이 자라는 것을 말한다.높은 수준의 TBT는 포유류의 내분비선, 생식 및 중추 신경계, 뼈 구조 및 위장관을 [96]손상시킬 수 있습니다.트리부틸틴은 포유류뿐만 아니라 수달, 고래, 돌고래,[96] 그리고 사람에게도 영향을 미친다.
유기화학
몇몇 주석 시약들은 유기 화학에 유용하다.가장 큰 용도에서는 염화석탄은 니트로 및 옥심기를 아민으로 변환하기 위한 일반적인 환원제이다.Stille 반응은 유기 할로겐화물 또는 의사할라이드와 유기질 [97]화합물을 결합시킵니다.
리튬 이온 전지
주석은 리튬 금속과 여러 금속 간 상(相)을 형성하므로 배터리 용도에 적합한 소재가 될 수 있습니다.리튬 합금 시 주석의 부피적 팽창과 낮은 전기화학적 전위에서의 주석-유기 전해질 계면의 불안정성은 상업용 전지의 고용에 있어 가장 큰 과제이다.이 문제는 [citation needed]소니에 의해 부분적으로 해결되었다.코발트와 탄소를 함유한 주석 금속간 화합물은 소니가 2000년대 후반 출시한 넥슬리온 셀에 구현했다.활성 물질의 구성은 대략 SnCoC입니다0.30.40.3.연구에 따르면 사각형(베타) Sn의 일부 결정성 면만 바람직하지 않은 전기화학적 [98]활성의 원인이 되는 것으로 나타났다.
주의사항
주석 금속, 산화물 및 소금에 의한 중독 사례는 거의 알려져 있지 않습니다.반면에, 어떤 유기소 화합물들은 거의 [39]시안화물만큼 독성이 있다.
작업장에서 주석 노출은 흡입, 피부 접촉 및 눈 접촉에 의해 발생할 수 있습니다.미국 산업안전보건국(OSHA)은 작업장 내 주석 노출에 대한 허용 피폭 한도를 8시간 근무일에 걸쳐 2mg/m로3 설정했다.미국 국립산업안전보건연구소(NIOSH)는 8시간 근무일에 걸쳐 2mg/m의3 권장 피폭 한계(REL)를 결정했다.100 mg/m3 수준에서 주석의 생명과 [99]건강에 즉시 위험합니다.
「 」를 참조해 주세요.
메모들
- ^ 동위원소를 포함한 샘플의 경우 자연적 풍부함에서 NMR 분석을 사용하기 쉬운 것은 H, F, P, Tl 및 Xe만이 NMR 분석을 쉽게 사용할 수 있다.
레퍼런스
- ^ "Standard Atomic Weights: Tin". CIAAW. 1983.
- ^ "New Type of Zero-Valent Tin Compound". Chemistry Europe. 27 August 2016.
- ^ "HSn". NIST Chemistry WebBook. National Institute of Standards and Technology. Retrieved 2013-01-23.
- ^ "SnH3". NIST Chemistry WebBook. National Institure of Standards and Technology. Retrieved 2013-01-23.
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Gray, Theodore (2007). "Tin images". The Elements. Black Dog & Leventhal.
- ^ a b c d e Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Tin". Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 793–800. ISBN 978-3-11-007511-3.
- ^ "Ink with tin nanoparticles could print future circuit boards". Phys.org. 12 April 2011. Archived from the original on 16 September 2011.
- ^ Jo, Yun Hwan; Jung, Inyu; Choi, Chung Seok; Kim, Inyoung; Lee, Hyuck Mo (2011). "Synthesis and characterization of low temperature Sn nanoparticles for the fabrication of highly conductive ink". Nanotechnology. 22 (22): 225701. Bibcode:2011Nanot..22v5701J. doi:10.1088/0957-4484/22/22/225701. PMID 21454937.
- ^ Molodets, A.M.; Nabatov, S.S. (2000). "Thermodynamic potentials, diagram of state, and phase transitions of tin on shock compression". High Temperature. 38 (5): 715–721. doi:10.1007/BF02755923. S2CID 120417927.
- ^ Le Coureur, Penny; Burreson, Jay (2004). Napoleon's Buttons: 17 molecules that changed history. New York: Penguin Group, USA.
- ^ Öhrström, Lars (2013). The Last Alchemist in Paris. Oxford: Oxford University Press. ISBN 978-0-19-966109-1.
- ^ Cotton, Simon (29 April 2014). "Book review: The last alchemist in Pari". Chemistry World. Royal Society of Chemistry. Archived from the original on 10 August 2014. Retrieved 22 November 2019.
- ^ Emsley, John (1 October 2011) [2001]. Nature's Building Blocks: an A-Z Guide to the Elements (New ed.). New York, United States: Oxford University Press. p. 552. ISBN 978-0-19-960563-7.
Only officers had metal buttons, and those were made of brass.
- ^ a b Schwartz, Mel (2002). "Tin and alloys, properties". Encyclopedia of Materials, Parts and Finishes (2nd ed.). CRC Press. ISBN 978-1-56676-661-6.
- ^ Dehaas, W.; Deboer, J.; Vandenberg, G. (1935). "The electrical resistance of cadmium, thallium and tin at low temperatures". Physica. 2 (1–12): 453. Bibcode:1935Phy.....2..453D. doi:10.1016/S0031-8914(35)90114-8.
- ^ a b Meissner, W.; R. Ochsenfeld (1933). "Ein neuer effekt bei eintritt der Supraleitfähigkeit". Naturwissenschaften. 21 (44): 787–788. Bibcode:1933NW.....21..787M. doi:10.1007/BF01504252. S2CID 37842752.
- ^ Craig, Bruce D.; Anderson, David S.; International, A. S. M. (January 1995). Handbook of corrosion data. p. 126. ISBN 978-0-87170-518-1. Archived from the original on 2016-05-11.
- ^ "Interactive NMR Frequency Map". Archived from the original on 2011-06-04. Retrieved 2009-05-05.
- ^ Walker, Phil (1994). "Doubly Magic Discovery of Tin-100". Physics World. 7 (June): 28. doi:10.1088/2058-7058/7/6/24.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Cameron, A. G. W. (1973). "Abundance of the Elements in the Solar System" (PDF). Space Science Reviews. 15 (1): 121–146. Bibcode:1973SSRv...15..121C. doi:10.1007/BF00172440. S2CID 120201972. Archived from the original (PDF) on 2011-10-21.
- ^ a b c "tin". Oxford English Dictionary (Online ed.). Oxford University Press. (가입 또는 참여기관 회원가입 필요)
- ^ Harper, Douglas. "tin". Online Etymology Dictionary.
- ^ 브리태니커 백과사전, 1911년 제11판, s.v. 'tin'은 H. Kopp을 인용했다.
- ^ "The Ancient Mining of Tin". oxleigh.freeserve.co.uk. Archived from the original on 2009-04-03. Retrieved 2009-07-07.
- ^ 미국 유산 사전
- ^ Cierny, J.; Weisgerber, G. (2003). "The "Bronze Age tin mines in Central Asia". In Giumlia-Mair, A.; Lo Schiavo, F. (eds.). The Problem of Early Tin. Oxford: Archaeopress. pp. 23–31. ISBN 978-1-84171-564-3.
- ^ a b c Penhallurick, R. D. (1986). Tin in Antiquity: its Mining and Trade Throughout the Ancient World with Particular Reference to Cornwall. London: The Institute of Metals. ISBN 978-0-904357-81-3.
- ^ Lamberg-Karlovsky, C. C.; Franklin, Alan D.; Olin, Jacqueline S.; Wertime, Theodore A., eds. (July 1980). "The development of the usage of tin and tin-bronze: some problems". The Search for Ancient Tin. Technology and Culture. Vol. 21. Washington D.C.: A seminar organized by Theodore A. Wertime and held at the Smithsonian Institution and the National Bureau of Standards, Washington D.C. March 14–15, 1977. p. 474. doi:10.2307/3103162. ISSN 0040-165X. JSTOR 3103162.
- ^ Dube, RK (September 2006). "Interrelation between gold and tin: A historical perspective". Gold Bulletin. 39 (3): 103–113. doi:10.1007/BF03215537.
- ^ a b Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (ed.), Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.[페이지 필요]
- ^ Taylor, F. Sherwood (1942). Inorganic & Theoretical Chemistry (6th ed.). Heineman.
- ^ J. M. Leger; J. Haines; A. Atouf (1996). "The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl
2". J. Phys. Chem. Solids. 57 (1): 7–16. Bibcode:1996JPCS...57....7L. doi:10.1016/0022-3697(95)00060-7. - ^ Gaur, D. P.; Srivastava, G.; Mehrotra, R. C. (1973). "Organic Derivatives of Tin. III. Reactions of Trialkyltin Ethoxide with Alkanolamines". Zeitschrift für Anorganische und Allgemeine Chemie. 398: 72. doi:10.1002/zaac.19733980109.
- ^ Elschenbroich, Christoph (2006). Organometallics (3rd, completely rev. and extended ed.). Weinheim: Wiley-VCH. ISBN 3-527-29390-6. OCLC 64305455.
- ^ a b c Graf, G. G. (2000) 울만의 산업화학 백과사전, 2005 Wiley-VCH, Weinheim doi: 10.1002/14356007.a27_049의 주석, 주석합금 및 주석화합물
- ^ Thoonen, Sander H. L.; Deelman, Berth-Jan; van Koten, Gerard (2004). "Synthetic aspects of tetraorganotins and organotin(IV) halides" (PDF). Journal of Organometallic Chemistry. 689 (13): 2145–2157. doi:10.1016/j.jorganchem.2004.03.027. hdl:1874/6594. S2CID 100214292. Archived from the original (PDF) on 2011-08-07. Retrieved 2009-07-31.
- ^ Peng, Yang; Ellis, Bobby D.; Wang, Xinping; Fettinger, James C.; Power, P. P. (2009). "Reversible Reactions of Ethylene with Distannynes Under Ambient Conditions". Science. 325 (5948): 1668–1670. Bibcode:2009Sci...325.1668P. doi:10.1126/science.1176443. PMID 19779193. S2CID 3011002.
- ^ Shu, Frank H. (1982). The physical universe: An introduction to astronomy. University Science Books. pp. 119–121. ISBN 978-0-935702-05-7.
- ^ Emsley 2001, 페이지 124, 231, 449 및 503.
- ^ a b "Tin: From Ore to Ingot". International Tin Research Institute. 1991. Archived from the original on 2009-03-22. Retrieved 2009-03-21.
- ^ Sutphin, David M.; Sabin, Andrew E.; Reed, Bruce L. (1 June 1992). Tin – International Strategic Minerals Inventory Summary Report. p. 9. ISBN 978-0-941375-62-7. Archived from the original on 2016-04-28.
- ^ a b c d e f g Carlin, Jr., James F. "Tin: Statistics and Information" (PDF). United States Geological Survey. Archived from the original on 2008-12-06. Retrieved 2008-11-23.
- ^ Reilly, Michael (26 May 2007). "How Long Will it Last?". New Scientist. 194 (2605): 38–39. Bibcode:2007NewSc.194...38R. doi:10.1016/S0262-4079(07)61508-5. ISSN 0262-4079.
- ^ Brown, Lester (2006). Plan B 2.0. New York: W.W. Norton. p. 109. ISBN 978-0-393-32831-8.
- ^ Kovalenko, V. I.; Yarmolyuk, V. V. (1995). "Endogenous rare metal ore formations and rare metal metallogeny of Mongolia". Economic Geology. 90 (3): 520. doi:10.2113/gsecongeo.90.3.520. Archived from the original on 2008-09-05.
- ^ "Seminole Group Colombia Discovers High Grade Tin Ore in the Amazon Jungle". FreePR101 PressRelease. Archived from the original on 2014-08-26.
- ^ Schrader, George F.; Elshennawy, Ahmad K.; Doyle, Lawrence E. (July 2000). Manufacturing processes and materials. ISBN 978-0-87263-517-3. Archived from the original on 2016-05-11.
- ^ Louis, Henry (1911). Metallurgy of tin. McGraw-Hill book Company.
- ^ Knorr, Klaus (1945). Tin Under Control. Stanford University Press. ISBN 978-0-8047-2136-3. Archived from the original on 2016-05-19.
- ^ "LME Tin Brands". ITRI.co.uk. International Tin Research Institute. Archived from the original on 2008-12-07. Retrieved 2009-05-05.
- ^ "Top Ten Tin Producing Companies". itri.co.uk. International Tin Research Institute. Archived from the original on 2008-12-07. Retrieved 2009-05-05.
- ^ "The World's Biggest Tin Producers". The Balance. 13 January 2019.
- ^ "Agreement establishing the Association of Tin Producing Countries [1984] ATS 10". Australasian Legal Information Institute, Australian Treaties Library.
- ^ a b Carlin, Jr., James F. (1998). "Significant events affecting tin prices since 1958" (PDF). USGS. Archived from the original (PDF) on 2011-10-28.
- ^ "12 Januari Pemasaran Perdana INATIN". 15 December 2011. Archived from the original on 2012-04-26.
- ^ Daly, Tom (5 December 2021). "Tin surge worsens supply chain woes for electronics, solar and auto firms". Reuters. Retrieved 2021-12-07.
- ^ "Tin (USD cents per kg)". Helgi Library. Archived from the original on 2014-02-22. Retrieved 2014-02-10.
- ^ "Daily Metal Spot Prices Tin Price (USD / Kilogram) for the Last Day". Retrieved 2021-12-07.
- ^ "Tin demand to decline – International Tin Association". Mining.com. 18 October 2019. Retrieved 2021-07-03.
- ^ Black, Harvey (2005). "Getting the Lead Out of Electronics". Environmental Health Perspectives. 113 (10): A682–5. doi:10.1289/ehp.113-a682. PMC 1281311. PMID 16203230.
- ^ Childs, Peter (July 1995). "The tin-man's tale". Education in Chemistry. Vol. 32, no. 4. Royal Society of Chemistry. p. 92. Retrieved 2018-06-19.
- ^ Control, Tin Under (1945). Tin Under Control. pp. 10–15. ISBN 978-0-8047-2136-3. Archived from the original on 2016-05-31.
- ^ Panel On Tin, National Research Council (U.S.). Committee on Technical Aspects of Critical and Strategic Materials (1970). Trends in the use of tin. pp. 10–22. Archived from the original on 2016-05-22.
- ^ Hull, Charles (1992). Pewter. Osprey Publishing. pp. 1–5. ISBN 978-0-7478-0152-8.
- ^ Brakes, James (2009). "Introduction". Analysis of Babbit. BiblioBazaar, LLC. pp. 1–2. ISBN 978-1-110-11092-6.
- ^ Williams, Robert S. (2007). Principles of Metallography. Read books. pp. 46–47. ISBN 978-1-4067-4671-6.
- ^ "The Composition of the Cent". US Mint. Archived from the original on 2011-10-25. Retrieved 2011-10-28.
- ^ "Composition of canadian coins" (PDF). Canadian Mint. Archived (PDF) from the original on 2012-01-13. Retrieved 2011-10-28.
- ^ Geballe, Theodore H. (October 1993). "Superconductivity: From Physics to Technology". Physics Today. 46 (10): 52–56. Bibcode:1993PhT....46j..52G. doi:10.1063/1.881384.
- ^ Campbell, Flake C. (2008). "Zirconium". Elements of Metallurgy and Engineering Alloys. p. 597. ISBN 978-0-87170-867-0. Archived from the original on 2016-05-28.
- ^ Robert Palmieri, ed. (2006). "Pipe Metal". Encyclopedia of keyboard instruments. New York: Garland. p. 411. ISBN 978-0-415-94174-7.
- ^ George Ashdown Audsley (1988). "Metal Pipes: And the Materials used in their Construction". The Art of Organ Building Audsley, George Ashdown. Courier Dover Publications. p. 501. ISBN 978-0-486-21315-6.
- ^ Kim, H.; Gilmore, C.; Pique, A.; Horwitz, J.; Mattoussi, H.; Murata, H.; Kafafi, Z.; Chrisey, D. (1999). "Electrical, optical, and structural properties of indium tin oxide thin films for organic light-emitting devices". Journal of Applied Physics. 86 (11): 6451. Bibcode:1999JAP....86.6451K. doi:10.1063/1.371708.
- ^ Bridge, Janet (September 1996). Making & decorating picture frames. North Light Books. ISBN 978-0-89134-739-2.
- ^ "Tin punching". Archived from the original on 2011-08-11. Retrieved 2011-08-15.
- ^ Pilkington, L. A. B. (1969). "Review Lecture. The Float Glass Process". Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences. 314 (1516): 1–25. Bibcode:1969RSPSA.314....1P. doi:10.1098/rspa.1969.0212. JSTOR 2416528. S2CID 109981215.
- ^ Lucas, Ivan T.; Syzdek, Jarosław; Kostecki, Robert (2011). "Interfacial processes at single-crystal β-Sn electrodes in organic carbonate electrolytes". Electrochemistry Communications. 13 (11): 1271–1275. doi:10.1016/j.elecom.2011.08.026.
- ^ "Colgate Gel-Kam". Archived from the original on 2009-04-27. Retrieved 2009-05-05.
- ^ Hattab, F. (April 1989). "The State of Fluorides in Toothpastes". Journal of Dentistry. 17 (2): 47–54. doi:10.1016/0300-5712(89)90129-2. PMID 2732364.
- ^ Perlich, M. A.; Bacca, L. A.; Bollmer, B. W.; Lanzalaco, A. C.; McClanahan, S. F.; Sewak, L. K.; Beiswanger, B. B.; Eichold, W. A.; Hull, J. R.; et al. (1995). "The clinical effect of a stabilized stannous fluoride dentifrice on plaque formation, gingivitis and gingival bleeding: a six-month study". The Journal of Clinical Dentistry. 6 (Special Issue): 54–58. PMID 8593194.
- ^ Ebdon, L.; Britain), Royal Society of Chemistry (Great (2001). "Organotin in Industrial and Domestic Products". Trace element speciation for environment, food and health. p. 144. ISBN 978-0-85404-459-7. Archived from the original on 2016-05-21.
- ^ a b c d Atkins, Peter; Shriver, Duward F.; Overton, Tina & Rourke, Jonathan (2006). Inorganic chemistry (4th ed.). W.H. Freeman. pp. 343, 345. ISBN 978-0-7167-4878-6.
- ^ Wilkes, Charles E.; Summers, James W.; Daniels, Charles Anthony; Berard, Mark T. (August 2005). PVC handbook. p. 108. ISBN 978-1-56990-379-7. Archived from the original on 2016-05-09.
- ^ David N.-S. Hon; Nobuo Shiraishi, eds. (2001). "Preservation of Wood". Wood and cellulosic chemistry. New York, NY: Dekker. p. 799. ISBN 978-0-8247-0024-9.
- ^ Antizar-Ladislao, Blanca (1 February 2008). "Environmental levels, toxicity and human exposure to tributyltin (TBT)-contaminated marine environment. A review". Environment International. 34 (2): 292–308. doi:10.1016/j.envint.2007.09.005. ISSN 0160-4120. PMID 17959247.
- ^ Eisler, Ronald. "Tin Hazards To Fish, Wildlife, and Invertebrates: A Synoptic Review" (PDF). U.S. Fish and Wildlife Service Patuxent Wildlife Research Center. Archived (PDF) from the original on 2012-01-18.
- ^ "Regulation (EC) No 782/2003 of the European Parliament and of the Council of 14 April 2003 on the prohibition of organotin compounds on ships". europa.eu. Retrieved 2009-05-05.
- ^ Dürr, Simone; Thomason, Jeremy, eds. (2008). "Fouling on Shipping". Biofouling. Oxford: Blackwell. p. 227. ISBN 978-1-4051-6926-4.
- ^ a b Maguire, R. James (1987). "Environmental aspects of tributyltin". Applied Organometallic Chemistry. 1 (6): 475–498. doi:10.1002/aoc.590010602. ISSN 1099-0739.
- ^ de Mora, S. J.; Stewart, C.; Phillips, D. (1 January 1995). "Sources and rate of degradation of tri(n-butyl)tin in marine sediments near Auckland, New Zealand". Marine Pollution Bulletin. 30 (1): 50–57. doi:10.1016/0025-326X(94)00178-C. ISSN 0025-326X.
- ^ a b Axiak, Victor; Micallef, Diane; Muscat, Joanne; Vella, Alfred; Mintoff, Bernardette (1 March 2003). "Imposex as a biomonitoring tool for marine pollution by tributyltin: some further observations". Environment International. Secotox S.I. 28 (8): 743–749. doi:10.1016/S0160-4120(02)00119-8. ISSN 0160-4120. PMID 12605923.
- ^ a b c "The Effects of Tributyltin on the Marine Environment". ScienceBuzz. 17 November 2018. Retrieved 2020-11-17.
- ^ Farina, Vittorio; Krishnamurthy, Venkat; Scott, William J. (1997). "The Stille Reaction". Organic Reactions. pp. 1–652. doi:10.1002/0471264180.or050.01. ISBN 0-471-26418-0.
- ^ Lucas, Ivan; Syzdek, Jaroslaw (2011). "Interfacial processes at single-crystal β-Sn electrodes in organic carbonate electrolytes". Electrochemistry Communications. 13 (11): 1271. doi:10.1016/j.elecom.2011.08.026.
- ^ "CDC - NIOSH Pocket Guide to Chemical Hazards - Tin". www.cdc.gov. Archived from the original on 2015-11-25. Retrieved 2015-11-24.
참고 문헌
 이 기사에는 공공 도메인에 있는 이 출처의 텍스트가 포함되어 있다: 칼린, 제임스 F. 주니어(1998).1958년 이후 주석 가격에 영향을 미치는 중대한 사건.미국 국립 측지학 조사국
이 기사에는 공공 도메인에 있는 이 출처의 텍스트가 포함되어 있다: 칼린, 제임스 F. 주니어(1998).1958년 이후 주석 가격에 영향을 미치는 중대한 사건.미국 국립 측지학 조사국- CRC contributors (2006). David R. Lide (ed.). Handbook of Chemistry and Physics (87th ed.). Boca Raton, Florida: CRC Press, Taylor & Francis Group. ISBN 978-0-8493-0487-3.
{{cite book}}:author=범용명(도움말)이 있습니다. - Emsley, John (2001). "Tin". Nature's Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. pp. 445–450. ISBN 978-0-19-850340-8.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Heiserman, David L. (1992). "Element 50: Tin". Exploring Chemical Elements and their Compounds. New York: TAB Books. ISBN 978-0-8306-3018-9.
- MacIntosh, Robert M. (1968). "Tin". In Clifford A. Hampel (ed.). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. pp. 722–732. LCCN 68-29938.
- Stwertka, Albert (1998). "Tin". Guide to the Elements (Revised ed.). Oxford University Press. ISBN 978-0-19-508083-4.
외부 링크
- 주기율표의 주석 (노팅엄 대학교)
- 테오도르 그레이의 나무 주기율표:주석 샘플 및 주조물
- 비금속:주석
- CDC - 화학적 위험에 대한 NIOSH 포켓 가이드
- 주석(kg당 USD센트)