전이
Metastasis| 전이 | |
|---|---|
| 기타 이름 | 전이병 |
 | |
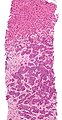
| 혈전 전이를 보여주는 그림 | |
| 발음 | |
| 전문 | 종양학 |
전이(Metastasis)는 초기 또는 1차 부위에서 숙주 체내의 다른 또는 2차 부위로 확산되는 병원성 물질로,[1] 이 용어는 일반적으로 암 종양에 의한 전이를 언급할 때 사용된다.[2]그렇다면, 새로운 병리학적 사이트는 전이(metastes)이다.[3][4]일반적으로 암세포가 인접한 조직으로 직접 확장되어 침투하는 암침투와 구별된다.[5]
암은 세포가 빠르고 무기한 증식을 위해 유전적으로 변형된 후에 발생한다.체세포 분열에 의한 이러한 통제되지 않은 증식은 일차 이질 종양을 생성한다.종양을 구성하는 세포들은 결국 메타폴라시아를 겪게 되고, 뒤이어 이형화, 아나플라시아를 거쳐 악성 표현형을 낳게 된다.이 악성종양은 순환에 침입을 허용하고, 그 다음엔 두 번째 종양부위까지 침입한다.
순환종양세포로 알려진 일부 암세포는 임파선이나 혈관의 벽을 관통하는 능력을 갖게 되고, 그 후에는 혈류를 통해 체내의 다른 부위와 조직으로 순환할 수 있게 된다.[6]이 과정은 (존중적으로) 림프나 혈액생성 확산으로 알려져 있다.종양 세포가 다른 부위에서 쉬게 된 후 혈관이나 벽을 다시 침식하고 증식을 계속하며 결국 또 다른 임상적으로 감지할 수 있는 종양을 형성한다.[citation needed]이 새로운 종양은 전이성 종양으로 알려져 있다.전이성(metastasis)은 암의 특징 중 하나로 양성종양과 구별된다.[7]대부분의 암은 비록 각도는 다르지만 전이될 수 있다.예를 들어 기저세포암은 거의 전이되지 않는다.[7]
종양세포가 전이되면 새로운 종양을 2차 또는 전이종양이라고 하며, 세포는 원래 종양이나 1차 종양과 유사하다.[8]유방암이 폐로 전이되면 2차 종양이 폐세포가 아닌 비정상적인 유방세포로 이뤄진다는 의미다.폐에 있는 종양을 폐암이 아닌 전이성 유방암이라고 부른다.전이(Metastasis)는 TNM staging system과 같은 암 발생 시스템의 핵심 요소로서, M을 대표하며, 전체 단계 그룹에서 전이(Metastasis)는 4단계에 암을 배치한다.치료 치료의 가능성은 크게 감소하거나 암이 전이되었을 때 완전히 제거되는 경우가 많다.
징후 및 증상
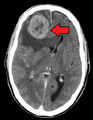
초기에는 근처의 림프절이 일찍 타격된다.[9]폐, 간, 뇌, 뼈는 고형 종양에서 가장 흔한 전이 위치다.[9]
- 림프절 전이에서는 일반적인 증상이 림프선병증이다.
- 폐 전이 : 기침, 혈전분해, 호흡곤란[9](호흡곤란)
- 간 전이 : 간전(간증), 메스꺼움[9], 황달[9]
- 뼈 전이 : 뼈 통증,[9] 해당 뼈의[9] 골절
- 뇌전증: 두통,[9] 발작,[9] 현기증[9] 등의 신경학적 증상
비록 암이 진행된 것이 고통을 유발할 수 있지만, 그것은 종종 첫 번째 증상이 아니다.
그러나 일부 환자들은 별다른 증상을 보이지 않는다.[9]장기가 전이성 질환에 걸리면 림프절이 터지거나 용해될 때까지 수축하기 시작한다.
병리학
전이성 종양은 암 말기에 매우 흔하다.전이 확산은 혈액이나 림프계를 통해서 또는 양쪽 경로를 통해서 발생할 수 있다.전이가 일어나는 가장 흔한 부위는 폐, 간, 뇌, 뼈다귀다.[10]
현재 암의 전이 경로를 설명하기 위해 상피-망막 전이(EMT)와 중피-망막 전이(MET) 가설(1) 암 줄기세포 가설(2), 대식세포-암세포 융합 하이브리드 가설(3) 등 3가지 주요 이론이 제시됐다.새로운 가설도 제시되었다. 즉, 특정 생화학적 및/또는 물리적 스트레스 요인의 영향으로 암세포는 후속 대식세포 포획과 핵융합, 그리고 암융합세포(CFCs)의 형성과 함께 핵배출을 겪을 수 있다.[11]
관련 요인
전이에는 암세포가 원래 종양 부위에서 벗어나 혈류, 림프계통 또는 직접 연장을 통해 신체의 다른 부분으로 이동하는 복잡한 일련의 단계가 포함된다.이를 위해 악성 세포는 1차 종양에서 벗어나 주변 세포외 기질(ECM)을 구성하는 단백질에 부착돼 분해되는데, 이 단백질은 종양과 인접한 조직을 분리한다.이러한 단백질을 분해함으로써 암세포가 ECM을 침범하여 탈출할 수 있다.전이된 암의 위치가 항상 무작위인 것은 아니며, 다른 종류의 암이 통계적 기회만으로 예상보다 높은 비율로 특정 장기와 조직에 퍼지는 경향이 있다.[12]예를 들어 유방암은 뼈와 폐로 전이되는 경향이 있다.이 특이성은 케모킨과[13] 같은 수용성 신호 분자와 변형성장인자 베타에 의해 매개되는 것처럼 보인다.[14]신체는 전이 억제기로 알려진 일련의 단백질의 작용을 통해 다양한 메커니즘에 의해 전이에 저항하며, 그 중 약 십여 개가 알려져 있다.[15]
인간의 세포는 집단 운동성, 중수형 운동, 아메보이드 운동 등 다른 종류의 운동을 보인다.암세포는 종종 기회적으로 다른 종류의 움직임 사이를 전환한다.일부 암 연구자들은 하나 이상의 운동에서 필요한 단계를 어떻게든 막음으로써 암의 확산을 멈추거나 최소한 속도를 늦출 수 있는 치료법을 찾기를 희망한다.[16][17]
전이성 폭포의 모든 단계는 많은 물리적 프로세스를 포함한다.세포이동은 힘의 생성을 필요로 하며, 암세포가 혈관 조직을 통해 전이될 때, 이것은 형성되기 위해 혈관의 물리적 간격을 필요로 한다.[18]힘 외에도, 전이가 진행되는 동안 다양한 종류의 세포와 세포 매트릭스 접착제의 규제는 매우 중요하다.
전이 단계는 혈관 세포(내피세포), 면역세포 또는 스트롬세포 등 다양한 세포 유형에 의해 비판적으로 조절된다.종양 혈관신생이라고 불리는 새로운 혈관망의 성장은 암의 중요한 특징이다.[19]따라서 혈관신생 억제제가 전이성 성장을 방해할 것이라는 주장이 제기되었다.[7]내피세포는 전이 및 혈관신생에 강한 영향을 미치는 것으로 나타났다.[20][21]내피 세포는 종양의 성장, 혈관신생, 전이 등에 중요하며, DNA 결합 억제제 1(ID1)을 사용하여 표시할 수 있다.이 새로운 발견은 수사관들이 골수에서 혈액, 종양-스트롬에 이르는 내피 세포들을 추적할 수 있는 능력을 얻었고 심지어 종양 정관에도 포함되었다는 것을 의미했다.종양 혈관조직에 통합된 내피 세포는 혈액-혈관 발달에서 이 세포 유형이 종양 세팅과 전이에서 중요하다는 것을 암시한다.게다가 골수에서 내피 세포가 절제되면 종양 성장과 혈관 형성 발달의 현저한 감소를 초래할 수 있다.따라서 종양생물학에서는 내피세포가 중요하며 새로운 치료목표를 제시한다.[22]면역 체계는 일반적으로 암에서 규제를 완화하며 전이를 포함한 종양 진행의 많은 단계에 영향을 미친다.
후생유전적 규제는 또한 확산된 종양 세포의 전이적 성장에도 중요한 역할을 한다.메타스타즈는 일차 종양과 비교했을 때 H3K4-메틸화, H3K9-메틸화와 같은 히스톤 수정의 변화를 보여준다.[23]전이에서의 이러한 후생유전학적 수정은 먼 장기에 전파된 종양 세포의 증식과 생존을 가능하게 할 수 있다.[24]
최근의 연구는 PKC-iota가 EMT 동안 비멘틴을 활성화하여 흑색종 세포 침투를 촉진한다는 것을 보여준다. PKC-iota 억제 또는 녹다운으로 인해 E-cadherin과 RhoA 수치가 증가하면서 동시에 총 비멘틴, 인산염화 비멘틴(S39), 파6는 전이성 흑색종 세포에서 감소한다는 것을 보여준다.이러한 결과는 흑색종에서 EMT를 상향 조정하여 전이를 직접적으로 자극하는 신호 경로에 PKC-multi가 관여하고 있음을 시사했다.[25]
최근 일련의 높은 주목을 받는 실험은 외측두엽에 의해 매개되는 세포간 교차 대화의 공동 선택이 침공-전파 폭포의 모든 단계에 관여하는 중요한 요소라는 것을 시사한다.[26]
경로
전이가 발생하는 경로는 다음 네 가지 경로로 구분된다.
트랜스코엘로믹
악성 종양이 신체 공동으로 퍼지는 것은 복막, 흉막, 심막 또는 아악막하 공간의 표면을 관통함으로써 발생할 수 있다.예를 들어 난소종양은 간 표면으로 복강경으로 전이될 수 있다.
림프 스프레드
림프성 확산은 종양세포를 1차 종양 근처의 지역 림프절과 궁극적으로 신체의 다른 부분으로 이동시킬 수 있게 한다.이것을 노달 관여, 양성 노드 또는 지역 질병이라고 한다."양성 노드"는 악성 종양 검사에서 양성 반응을 보인 지역 림프절을 설명하기 위해 의료전문가가 사용하는 용어다.종양을 검사하거나 제거하는 수술을 할 때 종양 부위 근처에 있는 림프절을 적어도 한 개 이상 조직검사를 하는 것이 일반적인 의료행위다.이 림프절을 보초 림프절이라고 부른다.임파선 확산은 발암에 대한 초기 전이의 가장 흔한 경로다.[7]이와는 대조적으로 육종이 이 경로를 통해 전이되는 경우는 드물다.1차 종양 근처의 지역 림프절까지 국부적으로 퍼지는 것은 비록 더 나쁜 결과를 나타내는 징조이긴 하지만 보통 전이로 간주되지 않는다.림프계는 결국 흉관과 우측 림프관에서 정맥 각도의 전신 정맥계와 대뇌수두 정맥으로 배수되며, 따라서 이러한 전이 세포도 결국 혈액유전 경로를 통해 확산될 수 있다.
혈액생성확산
이것은 사르코마에게는 전형적인 전이 경로지만, 신장에서 발원하는 신장세포암, 갑상선의 모낭암과 같은 특정 종류의 암에도 선호되는 경로다.벽이 얇기 때문에 동맥보다 정맥이 더 자주 침범하고 전이가 정맥류 패턴을 따르는 경향이 있다.즉, 혈액생성 스프레드는 1차 종양의 위치에 따라 뚜렷한 패턴을 따르는 경우가 많다.예를 들어 대장암은 주로 문맥을 통해 간으로 전이된다.
운하 스프레드
일부 종양, 특히 암은 해부학적 관상 공간을 따라 전이될 수 있다.이러한 공간에는 예를 들어 담즙관, 비뇨기 계통, 기도와 아황색 공간이 포함된다.그 과정은 초코로믹 스프레드와 유사하다.그러나 동시에 진단된 운하계통의 종양이 하나의 전이 과정인지 아니면 실제로 같은 작용제에 의해 야기된 독립적 종양인지(장암화)는 여전히 불명확한 경우가 많다.
기관별 표적
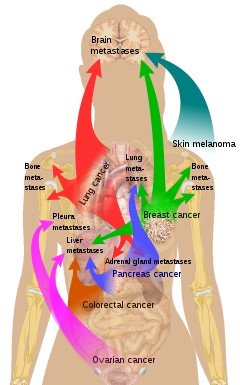
특정 종양이 특정 장기에 씨앗을 뿌리는 경향이 있다.이것은 1889년 스티븐 파짓에 의해 "씨앗과 흙" 이론으로 처음 논의되었다.전이세포가 특정 장기로 전이되는 성향을 '조직성'이라고 한다.예를 들어, 전립선암은 보통 뼈까지 전이된다.이와 비슷한 방식으로 대장암은 간으로 전이되는 경향이 있다.위암은 종종 여성에게서 난소에 전이되는데, 그 때 그것을 크루켄베르크 종양이라고 부른다.
'씨앗과 토양' 이론에 따르면 암세포가 원산지 이외에서 생존하기 어렵기 때문에 전이하기 위해서는 유사한 특성을 가진 장소를 찾아야 한다.[28]예를 들어, 모유에서 칼슘 이온을 모으는 유방종양세포는 뼈 조직으로 전이되는데, 뼈에서 칼슘 이온을 모을 수 있다.악성 흑색종은 신경조직과 멜라노사이트가 배아의 동일한 세포라인에서 발생하기 때문에 뇌로 퍼진다.[29]
1928년 제임스 이윙은 '씨앗과 흙' 이론에 도전하여 전이가 순전히 해부학적, 기계적 경로에 의해 발생한다고 제안했다.이 가설은 최근에 순환 종양 세포(CTCs)의 수명 주기에 대한 몇 가지 가설을 제시하고 확산의 패턴을 '필터와 흐름' 관점을 통해 더 잘 이해할 수 있다고 가정하는 데 활용되었다.[30]그러나, 현대의 증거는 1차 종양이 들어오는 전이 세포가 형성되고 식민지가 될 수 있는 먼 곳에서 전 전이성 틈새의 형성을 유도함으로써 유기성 전이를 지시할 수 있다는 것을 보여준다.[26]특히 종양에 의해 분비되는 엑소솜 방광은 2차 종양 성장을 위한 바람직한 미세 환경을 조성하기 위해 혈관신생과 같은 친금속적 과정을 활성화하고 면역 맥락을 수정하는 전이현장의 본거지로 보여졌다.[26]
전이 및 1차 암
전이가 항상 1차 암과 일치한다는 이론이 있으며, 이와 같이 신체의 다른 부분에 있는 암세포나 세포에서 시작된 종양이다.그러나 종양치료실에 입원한 환자의 10% 이상이 1차 종양이 발견되지 않은 상태에서 전이될 것이다.이런 경우 의사들은 1차 종양을 '알 수 없다'거나 '오컬트'라고 부르는데, 환자는 1차 종양(CUP)을 알 수 없거나 1차 종양(UPT)을 알 수 없는 암에 걸린다고 한다.[31]모든 암의 3%가 원인 불명의 1차적 원인인 것으로 추정된다.[32]연구에 따르면 단순한 심문이 암의 근원을 밝혀내지 못한다면('가능성 있는 폐', '소변성 혈액', '확률적인 방광'), 복잡한 영상촬영도 마찬가지일 것이다.[32]이 경우 일부의 경우 나중에 1차 종양이 나타날 수 있다.
면역역학 화학의 사용은 병리학자들이 이러한 전이들 중 많은 것에 정체성을 부여하도록 허용했다.그러나 표시된 영역의 영상촬영은 가끔만 1차 영상을 드러낸다.드물게(예: 흑색종) 1차 종양은 부검에서도 발견되지 않는다.따라서 일부 일차 종양은 완전히 퇴행할 수 있지만 전이된 종양은 남겨둘 수 있다고 생각된다.다른 경우에는 종양이 너무 작거나 진단하기에는 비정상적인 위치에 있을 수 있다.
진단
전이성 종양의 세포는 1차 종양의 세포와 유사하다.일단 세포 유형을 결정하기 위해 암 조직을 현미경으로 검사하면, 의사는 보통 세포의 종류가 조직 샘플이 채취된 신체 부위에서 정상적으로 발견되는지 여부를 알 수 있다.
예를 들어 유방암 세포는 유방에서 발견되거나 신체의 다른 부위로 전이되었든 똑같아 보인다.그래서 폐의 종양에서 채취한 조직 샘플에 유방세포처럼 생긴 세포가 들어있다면 의사는 폐종양이 2차 종양이라고 판단한다.그래도 1차 종양의 판단은 매우 어려울 수 있는 경우가 많고, 병리학자는 면역화학, FIH(상황 잡종의 형광) 등 여러 가지 보조 기법을 사용해야 할 수도 있다.기술의 사용에도 불구하고, 어떤 경우에는 1차 종양이 미확인 상태로 남아있다.
전이성 암은 1차 종양과 동시에 발견되거나 몇 달 또는 몇 년 후에 발견될 수 있다.과거 암 치료를 받은 환자에게서 2차 종양이 발견되면 다른 1차 종양보다 전이가 되는 경우가 많다.
이전에는 대부분의 암세포가 전이 잠재력이 낮고, 체세포 돌연변이의 발달을 통해 전이 능력을 발달시키는 희귀 세포가 있다고 생각했었다.[33]이 이론에 따르면 전이암의 진단은 전이 발생 후에만 가능하다.암을 진단하는 전통적인 방법(예: 조직검사)은 암세포의 아군을 조사할 뿐 전위성을 가진 아군체에서 표본을 추출하지 않을 가능성이 매우 높다.[34]
전이성 발달의 체세포 돌연변이 이론은 인간 암에서 입증되지 않았다.오히려, 1차 종양의 유전적 상태는 암이 전이되는 능력을 반영하는 것 같다.[34]일차성 아데노카르시노마스와 전이성 아데노카르시노마스의 유전자 발현을 비교한 연구 결과, 일차성 종양과 전이성 종양을 구별할 수 있는 유전자의 서브셋이 확인되었는데, 이 유전자는 '이태성 시그니처'라고 불린다.[34]서명에는 SNRPF, HNRPAB, DHPS 및 증권 유전자가 포함된다.액틴, 마이오신, MHC 클래스 II 하한 규정도 서명과 관련이 있었다.또한 일부 1차 종양에서도 이들 유전자의 전이 관련 발현이 관찰되어 전이 가능성이 있는 세포가 1차 종양의 진단과 동시에 식별될 수 있음을 알 수 있었다.[35]최근의 연구는 전이를 일으키는 원인으로서 염색체 불안정(CIN)이라고 불리는 암에서 유전적 불안정의 한 형태를 확인했다.[36]공격적인 암세포에서는 불안정한 염색체에서 나온 느슨한 DNA 파편이 사이토솔에 흘러나와 선천적인 면역 경로의 만성적인 활성으로 이어지며, 이는 암세포에 의해 납치되어 먼 장기로 전이된다.
이 전이성 서명의 표현은 좋지 않은 예후와 상관관계가 있어 여러 종류의 암에서 일관성이 있는 것으로 나타났다.1차 종양이 전이성 서식을 나타내는 개인들의 예후가 더 나쁜 것으로 나타났다.[34]또한 이러한 전이성 관련 유전자의 발현이 자궁선암 이외에도 다른 암 종류에도 적용되는 것으로 나타났다.유방암의 전이, 중수모세포종, 전립선암은 모두 이러한 전이 관련 유전자의 발현 패턴이 유사했다.[34]
이 전이 관련 서명의 식별은 1차 종양 내에서 전이 가능성이 있는 세포를 식별하고 이러한 전이 관련 암의 예후를 개선할 수 있는 가능성을 제공한다.또한 전이 과정에서 발현이 바뀌는 유전자를 식별하면 전이를 억제할 수 있는 잠재적 표적이 된다.[34]
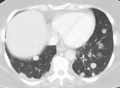
다중 간 전이물의 CT 영상
간 조직검사에서 입증된 전이(tumor (adenocarcinoma)—이미지의 3분의 2 이하).H&E 얼룩.
관리
치료와 생존은 암이 국부적으로 유지되는지, 아니면 체내의 다른 곳으로 퍼지는지에 의해 크게 결정된다.만약 암이 다른 조직이나 장기로 전이된다면 그것은 대개 환자의 사망 가능성을 극적으로 증가시킨다.어떤 형태의 백혈병, 혈액의 암, 또는 뇌의 악성종양과 같은 일부 암은 전혀 퍼지지 않고 죽일 수 있다.
일단 암이 전이되면 그것은 여전히 방사선 수술, 화학요법, 방사선 치료, 생물학적 치료, 호르몬 치료, 수술 또는 이러한 개입의 조합으로 치료될 수 있다.치료의 선택은 1차 암의 종류, 전이체의 크기와 위치, 환자의 나이와 일반 건강, 이전에 사용된 치료의 종류 등 많은 요인에 따라 달라진다.CUP로 진단된 환자의 경우 1차 종양을 찾을 수 없을 때에도 여전히 병을 치료할 수 있는 경우가 많다.
현재의 치료법은 고환암이나 갑상선암과 같은 일부 종양은 보통 치료할 수 있지만 전이암을 치료할 수 있는 경우는 드물다.
전이를 위한 관리 프로그램의 일환으로 주요 질환자의 삶의 질을 향상시키기 위한 관리인 완화의료가 추천되었다.[37]뇌 전이 방사선 치료에 관한 문헌을 체계적으로 검토한 결과, 삶의 질, 기능적 상태, 인지적 효과에 대한 비교 효과와 환자 중심 결과를 알려 줄 증거가 거의 없는 것으로 나타났다.[38]
리서치
전이가 종양 세포 이동의 결과로 널리 받아들여지고 있지만, 일부 전이가 비정상적인 면역 세포에 의한 염증 작용의 결과라는 가설이 있다.[39]또한 일차 종양이 없는 상태에서 전이암이 존재한다는 것은 전이가 항상 일차 종양을 남기는 악성 세포에 의해 발생하는 것은 아니라는 것을 시사한다.[40]
Sarna의 연구팀이 수행한 연구는 색소가 많이 함유된 흑색종 세포가 약 4.93의 영의 계수를 가지고 있다는 것을 증명했는데, 그 때는 0.98에 불과했다.[41]또 다른 실험에서 그들은 흑색종 세포의 탄력성이 전이와 성장에 중요하다는 것을 발견했다. 즉, 비응고 종양이 색소 침착보다 더 컸고 확산이 훨씬 쉬웠다.그들은 흑색종양에는 색소 세포와 비색소 세포가 모두 있어 약물 내성과 전이성을 모두 가질 수 있다는 것을 보여주었다.[41]
역사
2014년 3월, 연구원들은 전이성 암에 걸린 인간의 가장 오래된 완벽한 예를 발견했다.이 종양은 2013년 수단의 한 무덤에서 발견된 기원전 1200년 전의 3,000년 된 해골에서 발견되었다.골격은 방사선 촬영과 스캐닝 전자현미경을 이용해 분석했다.이 연구결과는 공공과학도서관에 게재되었다.[42][43][44]
어원
전이(Metastasis)는 μετά, meta, "next", σσάσ, stasis, "placement"에서 "displacement"를 뜻하는 그리스어 낱말이다.
참고 항목
- 압점 효과
- 뇌 전이
- 브라운-세콰드 증후군(굴절 기형, 생식종, 신장세포암, 폐암에 관한 부분)
- 집단세포이전
- 연락처 정규화
- 전파병
- 마이크로메타스테시스
- 마우스 유방암 전이 모형
- 양전자 방출 단층 촬영(PET)
- 요로성 골반 악성성
참조
- ^ "메타스타시스", 메리암-웹스터 온라인, 2017년 8월 20일에 접속.
- ^ "What is Metastasis?". Cancer.Net. 2 February 2016.
- ^ Klein CA (September 2008). "Cancer. The metastasis cascade". Science. 321 (5897): 1785–7. doi:10.1126/science.1164853. PMID 18818347. S2CID 206515808.
- ^ Chiang AC, Massagué J (December 2008). "Molecular basis of metastasis". The New England Journal of Medicine. 359 (26): 2814–23. doi:10.1056/NEJMra0805239. PMC 4189180. PMID 19109576.
- ^ "Invasion and metastasis". Cancer Australia. 2014-12-16. Retrieved 2018-10-26.
- ^ Maheswaran S, Haber DA (February 2010). "Circulating tumor cells: a window into cancer biology and metastasis". Current Opinion in Genetics & Development. 20 (1): 96–9. doi:10.1016/j.gde.2009.12.002. PMC 2846729. PMID 20071161.
- ^ a b c d Kumar V, Abbas AK, Fausto N, Robbins SL, Cotran RS (2005). Robbins and Cotran pathologic basis of disease (7th ed.). Philadelphia: Elsevier Saunders. ISBN 978-0-7216-0187-8.
- ^ "O que é a metástase?" (in Brazilian Portuguese). Dr. Felipe Ades MD PhD—Oncologista. 2018-07-24. Retrieved 2018-10-23.
- ^ a b c d e f g h i j k 국립 암 연구소: 전이성 암: 질문과 답변.2008-11-01</rc-c2d-number>에서 검색됨
- ^ "Metastatic Cancer: Questions and Answers". National Cancer Institute. Retrieved 2008-08-28.
- ^ 올테아누 G-E, 미하이 I-M, 보진 F, 가브릴리우크 O, 파우네스쿠 V.암의 자연 적응적 진화:암세포의 전이 능력.기초 의학 과학 [인터넷]의 Bosn J.2020년 2월3. https://www.bjbms.org/ojs/index.php/bjbms/article/view/4565에서 이용 가능:
- ^ Nguyen DX, Massagué J (May 2007). "Genetic determinants of cancer metastasis". Nature Reviews. Genetics. 8 (5): 341–52. doi:10.1038/nrg2101. PMID 17440531. S2CID 17745552.
- ^ Zlotnik A, Burkhardt AM, Homey B (August 2011). "Homeostatic chemokine receptors and organ-specific metastasis". Nature Reviews. Immunology. 11 (9): 597–606. doi:10.1038/nri3049. PMID 21866172. S2CID 34438005.
- ^ Drabsch Y, ten Dijke P (June 2011). "TGF-β signaling in breast cancer cell invasion and bone metastasis". Journal of Mammary Gland Biology and Neoplasia. 16 (2): 97–108. doi:10.1007/s10911-011-9217-1. PMC 3095797. PMID 21494783.
- ^ Yoshida BA, Sokoloff MM, Welch DR, Rinker-Schaeffer CW (November 2000). "Metastasis-suppressor genes: a review and perspective on an emerging field". Journal of the National Cancer Institute. 92 (21): 1717–30. doi:10.1093/jnci/92.21.1717. PMID 11058615.
- ^ 마테오 파리, 파올라 치아루기."암세포 운동성 조절에 있어 Rac 및 Rho GTPases" 2010
- ^ Friedl P, Wolf K (May 2003). "Tumour-cell invasion and migration: diversity and escape mechanisms". Nature Reviews. Cancer. 3 (5): 362–74. doi:10.1038/nrc1075. PMID 12724734. S2CID 5547981.
- ^ Escribano J, Chen MB, Moeendarbary E, Cao X, Shenoy V, Garcia-Aznar JM, et al. (May 2019). "Balance of mechanical forces drives endothelial gap formation and may facilitate cancer and immune-cell extravasation". PLOS Computational Biology. 15 (5): e1006395. arXiv:1811.09326. Bibcode:2019PLSCB..15E6395E. doi:10.1371/journal.pcbi.1006395. PMC 6497229. PMID 31048903.
- ^ Weidner N, Semple JP, Welch WR, Folkman J (January 1991). "Tumor angiogenesis and metastasis--correlation in invasive breast carcinoma". The New England Journal of Medicine. 324 (1): 1–8. doi:10.1056/NEJM199101033240101. PMID 1701519.
- ^ Gao D, Nolan DJ, Mellick AS, Bambino K, McDonnell K, Mittal V (January 2008). "Endothelial progenitor cells control the angiogenic switch in mouse lung metastasis". Science. 319 (5860): 195–8. Bibcode:2008Sci...319..195G. doi:10.1126/science.1150224. PMID 18187653. S2CID 12577022.
- ^ Nolan DJ, Ciarrocchi A, Mellick AS, Jaggi JS, Bambino K, Gupta S, et al. (June 2007). "Bone marrow-derived endothelial progenitor cells are a major determinant of nascent tumor neovascularization". Genes & Development. 21 (12): 1546–58. doi:10.1101/gad.436307. PMC 1891431. PMID 17575055.
- ^ Mellick AS, Plummer PN, Nolan DJ, Gao D, Bambino K, Hahn M, et al. (September 2010). "Using the transcription factor inhibitor of DNA binding 1 to selectively target endothelial progenitor cells offers novel strategies to inhibit tumor angiogenesis and growth". Cancer Research. 70 (18): 7273–82. doi:10.1158/0008-5472.CAN-10-1142. PMC 3058751. PMID 20807818.
- ^ Franci C, Zhou J, Jiang Z, Modrusan Z, Good Z, Jackson E, Kouros-Mehr H (2013). "Biomarkers of residual disease, disseminated tumor cells, and metastases in the MMTV-PyMT breast cancer model". PLOS ONE. 8 (3): e58183. Bibcode:2013PLoSO...858183F. doi:10.1371/journal.pone.0058183. PMC 3592916. PMID 23520493.
- ^ Lujambio A, Esteller M (February 2009). "How epigenetics can explain human metastasis: a new role for microRNAs". Cell Cycle. 8 (3): 377–82. doi:10.4161/cc.8.3.7526. PMID 19177007.
- ^ Ratnayake WS, Apostolatos AH, Ostrov DA, Acevedo-Duncan M (November 2017). "Two novel atypical PKC inhibitors; ACPD and DNDA effectively mitigate cell proliferation and epithelial to mesenchymal transition of metastatic melanoma while inducing apoptosis". International Journal of Oncology. 51 (5): 1370–1382. doi:10.3892/ijo.2017.4131. PMC 5642393. PMID 29048609.
- ^ a b c Syn N, Wang L, Sethi G, Thiery JP, Goh BC (July 2016). "Exosome-Mediated Metastasis: From Epithelial-Mesenchymal Transition to Escape from Immunosurveillance". Trends in Pharmacological Sciences. 37 (7): 606–617. doi:10.1016/j.tips.2016.04.006. PMID 27157716.
- ^ 포함된 항목 및 참조 목록은 Commons: Commons:의 기본 이미지 페이지에서 찾을 수 있다.파일:일반 암에 대한 전이 사이트.svg#요약
- ^ Hart IR (1982). "'Seed and soil' revisited: mechanisms of site-specific metastasis". Cancer and Metastasis Reviews. 1 (1): 5–16. doi:10.1007/BF00049477. PMID 6764375. S2CID 19573769.
- ^ Weinberg RA (2007). The Biology of Cancer. New York: Taylor & Francis. ISBN 978-0-8153-4076-8. 에 인용된.
- ^ Scott J, Kuhn P, Anderson AR (July 2012). "Unifying metastasis--integrating intravasation, circulation and end-organ colonization". Nature Reviews. Cancer. 12 (7): 445–6. doi:10.1038/nrc3287. PMC 4533867. PMID 22912952.
- ^ Ettinger DS, Agulnik M, Cates JM, Cristea M, Denlinger CS, Eaton KD, et al. (December 2011). "NCCN Clinical Practice Guidelines Occult primary". Journal of the National Comprehensive Cancer Network. 9 (12): 1358–95. doi:10.6004/jnccn.2011.0117. PMID 22157556.
- ^ a b Briasoulis E, Pavlidis N (1997). "Cancer of Unknown Primary Origin". The Oncologist. 2 (3): 142–152. doi:10.1634/theoncologist.2-3-142. PMID 10388044.
- ^ Poste G, Fidler IJ (January 1980). "The pathogenesis of cancer metastasis". Nature. 283 (5743): 139–46. Bibcode:1980Natur.283..139P. CiteSeerX 10.1.1.553.5472. doi:10.1038/283139a0. PMID 6985715. S2CID 4302076.
- ^ a b c d e f Ramaswamy S, Ross KN, Lander ES, Golub TR (January 2003). "A molecular signature of metastasis in primary solid tumors". Nature Genetics. 33 (1): 49–54. doi:10.1038/ng1060. PMID 12469122. S2CID 12059602.
- ^ van 't Veer LJ, Dai H, van de Vijver MJ, He YD, Hart AA, Mao M, et al. (January 2002). "Gene expression profiling predicts clinical outcome of breast cancer". Nature. 415 (6871): 530–6. doi:10.1038/415530a. hdl:1874/15552. PMID 11823860. S2CID 4369266.
- ^ Bakhoum SF, Ngo B, Laughney AM, Cavallo JA, Murphy CJ, Ly P, et al. (January 2018). "Chromosomal instability drives metastasis through a cytosolic DNA response". Nature. 553 (7689): 467–472. Bibcode:2018Natur.553..467B. doi:10.1038/nature25432. PMC 5785464. PMID 29342134.
- ^ Irwin KE, Greer JA, Khatib J, Temel JS, Pirl WF (February 2013). "Early palliative care and metastatic non-small cell lung cancer: potential mechanisms of prolonged survival". Chronic Respiratory Disease. 10 (1): 35–47. doi:10.1177/1479972312471549. PMID 23355404. S2CID 6743524.
- ^ Garsa A, Jang JK, Baxi S, Chen C, Akinniranye O, Hall O, et al. (2021). "Radiation Therapy for Brain Metastases: A Systematic Review". Practical Radiation Oncology. 11 (5): 354–365. doi:10.1016/j.prro.2021.04.002. PMID 34119447.
- ^ Shahriyari L (2016). "A new hypothesis: some metastases are the result of inflammatory processes by adapted cells, especially adapted immune cells at sites of inflammation". F1000Research. 5: 175. doi:10.12688/f1000research.8055.1. PMC 4847566. PMID 27158448.
- ^ López-Lázaro M (2015-01-01). "The migration ability of stem cells can explain the existence of cancer of unknown primary site. Rethinking metastasis". Oncoscience. 2 (5): 467–75. doi:10.18632/oncoscience.159. PMC 4468332. PMID 26097879.
- ^ a b Sarna M, Krzykawska-Serda M, Jakubowska M, Zadlo A, Urbanska K (June 2019). "Melanin presence inhibits melanoma cell spread in mice in a unique mechanical fashion". Scientific Reports. 9 (1): 9280. Bibcode:2019NatSR...9.9280S. doi:10.1038/s41598-019-45643-9. PMC 6594928. PMID 31243305.
- ^ Kelland K (17 March 2014). "Archaeologists discover earliest example of human with cancer". Reuters. Retrieved 18 March 2014.
- ^ Ghosh P (18 March 2014). "Ancient skeleton is the earliest case of cancer yet detected". BBC. Retrieved 18 March 2014.
- ^ Ross P (17 March 2014). "Possible Oldest Cancer Found In 3,000-Year-Old Skeleton Could Reveal 'Evolution' Of Modern Disease". International Business Times. Retrieved 18 March 2014.
외부 링크
| 무료 사전인 위키트리노리에서 전이를 찾아봐. |
| 위키미디어 커먼즈에는 메타스타제 관련 미디어가 있다. |