오피오이드 사용장애
Opioid use disorder| 오피오이드 사용장애 | |
|---|---|
| 기타이름 | 오피오이드 중독,[1] 문제성 오피오이드 사용,[1] 오피오이드 남용,[2] 오피오이드 의존[3] |
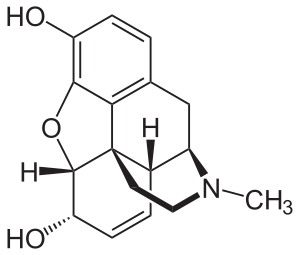 | |
| 모르핀의 분자구조 | |
| 전문 | 중독의학, 정신과 |
| 증상 | 오피오이드 사용에 대한 강한 욕구, 오피오이드에 대한 내성 증가, 의무 불이행, 사용 감소 문제, 중단과[4][5] 함께 금단 증후군 |
| 합병증 | 오피오이드 과다복용, C형 간염, 결혼문제, 실업, 빈곤[4][5] |
| 지속 | 장기[6] |
| 원인들 | 오피오이드[3] |
| 진단방법 | DSM-5의[4] 기준에 의거 |
| 감별진단 | 알코올 중독 |
| 치료 | 오피오이드 대체 요법, 행동 요법, 12단계 프로그램, 홈날록손[7][8][9] 복용 |
| 약 | 부프레노르핀, 메타돈, 날트렉손[7][10] |
| 빈도수. | 1,600만[11] |
| 죽음 | 120,000[11] |
오피오이드 사용 장애(Oud)는 오피오이드에 대한 갈망, 신체적 및/또는 심리적 악화에도 불구하고 지속적인 사용, 사용에 대한 내성 증가, 오피오이드 중단 후 금단 증상 등을 특징으로 하는 물질 사용 장애입니다.[12] 오피오이드 금단 증상으로는 메스꺼움, 근육통, 설사, 수면 곤란, 동요, 기분 저하 등이 있습니다.[5] 중독과 의존성은 오피오이드 사용 장애의 중요한 구성 요소입니다.[13]
위험 요소에는 오피오이드 오남용 이력, 현재 오피오이드 오남용, 젊은 나이, 사회경제적 지위, 인종, 치료되지 않은 정신 질환, 오남용을 촉진하는 환경(사회, 가족, 전문가 등)이 포함됩니다.[14][15] 합병증에는 오피오이드 과다 복용, 자살, HIV/AIDS, C형 간염 및 사회적 또는 전문적 책임을 충족시키는 문제가 포함될 수 있습니다.[5][4] 진단은 DSM-5의 미국 정신 의학 협회 기준에 근거할 수 있습니다.[4]
오피오이드에는 헤로인, 모르핀, 펜타닐, 코데인, 디하이드로코데인, 옥시코돈, 하이드로코돈 등의 물질이 포함됩니다.[5][6] 다양한 오피오이드의 상대적 강도에 대한 유용한 기준은 모르핀 밀리그램 당량(MME)입니다.[16] 오피오이드를 처방할 때 임상의가 매일 MMEs를 참고하여 오남용 및 부작용의 위험을 줄이는 것이 좋습니다.[17]
오피오이드 장기 복용은 외상이나 수술과 관련된 통증으로 사용한 후 약 4%에서 발생합니다.[18] 미국에서 대부분의 헤로인 사용자들은 불법적으로 살 수도 있는 처방된 오피오이드를 사용하는 것으로 시작합니다.[19][20]
오피오이드 사용 장애가 있는 사람들은 메타돈이나 부프레노르핀을 이용한 오피오이드 대체 요법으로 치료하는 경우가 많습니다.[21] 이러한 치료는 사망 위험을 줄여줍니다.[21] 또한 인지 행동 치료, 개인 또는 그룹 치료, 12단계 프로그램 및 기타 동료 지원 프로그램과 같은 정신 건강 전문가의 다른 형태의 지원을 통해 도움을 받을 수 있습니다.[22] 약 날트렉손은 재발을 예방하는 데에도 유용할 수 있습니다.[10][8] 날록손은 오피오이드 과다 복용을 치료하는 데 유용하고 위험에 처한 사람들에게 집으로 가져가도록 하는 것이 유익합니다.[23] 2020년 CDC는 미국에서 거의 300만 명이 OUD와 함께 살고 있었고 65,000명 이상이 오피오이드 과다복용으로 사망했으며 그 중 15,000명 이상이 헤로인 과다복용이었다고 추정했습니다.[24][25]
진단.
오피오이드 사용 장애 진단을 위한 DSM-5 지침은 오피오이드 사용과 관련하여 개인에게 중대한 장애나 고통이 있을 것을 요구합니다.[4] 진단을 수행하려면 주어진 연도에 11개 기준 중 2개 이상이 있어야 합니다.[4]
- 의도한 것보다 더 많은 오피오이드를 복용합니다.
- 개인은 오피오이드의 사용 횟수를 줄일 수 없습니다.
- 오피오이드를 얻거나, 오피오이드를 사용하거나, 복용 후 회복하기 위해 많은 시간이 소요됩니다.
- 오피오이드에 대한 갈망이 있는 사람은
- 직장이나 학교에서 전문적인 업무를 수행하는 데 어려움이 있음
- 오피오이드의 지속적인 사용이 사회적, 대인관계적 결과를 초래함
- 사회적 또는 오락적 활동의 감소
- 신체적으로 위험한 환경에서도 오피오이드 사용
- 오피오이드가 신체적 또는 정신적 건강을 악화시킴에도 불구하고 지속적인 사용(예: 우울증, 변비)
- 관용
- 철수
중증도는 존재하는 기준의 수에 따라 경증, 중등도 또는 중증으로 분류할 수 있습니다.[6] 적절한 의료 감독 하에서만 오피오이드를 복용하는 개인에 대한 허용 오차 및 금단 기준은 충족되지 않는 것으로 간주됩니다.[4] 중독과 의존성은 물질 사용 장애의 구성 요소이며 중독은 더 심각한 형태입니다.[13]
징후 및 증상
오피오이드 중독
오피오이드 중독의 징후와 증상은 다음과 같습니다.[5][26]
오피오이드 과다복용

오피오이드 과다 복용의 징후 및 증상은 다음과 같습니다.[28]
- 핀 포인트 동공이 발생할 수 있습니다. 동공이 확장된 환자는 여전히 오피오이드 과다복용을 경험하고 있을 수 있습니다.
- 심박수 감소
- 체온저하
- 호흡 저하
- 의식 수준이 달라졌습니다. 사람들은 반응이 없거나 의식이 없을 수 있습니다.
- 폐부종(폐에 체액이 축적됨)
- 쇼크
- 죽음.
철수
오피오이드 금단현상은 장기간 사용 후 오피오이드의 급격한 감소 또는 중단과 함께 발생할 수 있습니다.[29][30] 금단의 시작은 마지막으로 사용된 오피오이드의 반감기에 달려 있습니다.[31] 헤로인의 경우 일반적으로 사용 후 5시간 후에 발생하며, 메타돈의 경우 2일이 소요될 수 있습니다.[31] 주요 증상이 발생하는 기간도 사용되는 오피오이드에 따라 다릅니다.[31] 헤로인 금단증의 경우 일반적으로 증상이 2~4일에 가장 크며 최대 2주까지 지속될 수 있습니다.[32][31] 덜 심각한 증상이 훨씬 더 오랜 기간 동안 남아 있을 수 있으며, 이 경우에는 금단 후 급성 금단 증후군으로 알려져 있습니다.[31]
금단 치료에는 메타돈과 부프레노르핀이 포함될 수 있습니다. 메스꺼움이나 설사에 대한 약물도 사용할 수 있습니다.[30]
원인
자가 투약으로 인해 오피오이드 사용 장애가 발생할 수 있습니다.[33] 만성 통증 환자의 아편 중독 가능성을 평가하기 위한 점수 체계가 도출되었습니다.[34] 의료 종사자들은 통증 관리를 위한 오피오이드의 효과적인 사용에도 불구하고, 장기간의 오피오이드 사용을 뒷받침하는 경험적 증거는 미미하다는 것을 오랫동안 알고 있었습니다.[35][36][37][38][39] 만성 통증 환자를 대상으로 한 많은 연구는 장기간의 오피오이드 사용으로 통증이나 기능 능력이 지속적으로 개선되는 것을 보여주지 못했습니다.[36][40][41][42][39]
유엔 마약범죄사무소와 세계보건기구가 발표한 오피오이드 의존 치료에 관한 입장 논문에 따르면, 돌봄 제공자는 오피오이드 사용 장애를 약한 도덕적 성격이나 의지의 결과로 취급해서는 안 되며, 의학적 상태로 취급해야 합니다.[15][43][44] 일부 증거는 보상과 자발성을 포함하는 뇌 회로의 조절 장애와 같이 식별하거나 변경하기 어려울 수 있는 유전적 또는 기타 화학적 메커니즘으로 인해 오피오이드 사용 장애가 발생할 가능성을 시사합니다. 그러나 관련된 정확한 메커니즘은 불분명하며, 생물학의 영향과 자유의지에 대한 논쟁으로 이어집니다.[45][46]
메카니즘
중독
중독은 부작용에도 불구하고 약물을 강박적으로 사용하는 것을 특징으로 하는 뇌 질환입니다.[13][47][48][49] 중독은 음식과 성을 찾는 것과 같은 생존 및 생식 건강과 관련된 동기 부여에 필수적인 뇌의 중피질 소엽 보상 회로(보상 시스템)를 과도하게 자극하는 것을 포함합니다.[50] 이 보상 시스템은 연상 학습과 목표 지향 행동을 장려합니다. 중독 시 물질이 이 회로를 과활성화시켜 뇌 시냅스의 변화로 강박행동을 유발합니다.[51]
인센티브 감작 이론은 "원하기"(보상 회로에서 도파민에 의해 구동됨)와 "좋아하기"(뇌 쾌락 센터와 관련됨)를 구별합니다.[52] 이것은 유쾌하지 않은 물질의 중독 가능성과 행복감 효과에 대한 내성에도 불구하고 아편 중독의 지속성을 설명합니다. 중독은 보상 중심의 행동을 다시 활성화하는 신호와 스트레스를 포함하는 단순한 금단 회피를 능가합니다.[50] 이것은 해독만으로는 90% 성공하지 못하는 중요한 이유입니다.[53][54][55]

핵에 축적된 유전자 전사 인자 δFosB의 과발현은 약물 보상을 민감하게 하고 강박적인 약물 추구 행동을 증폭시킴으로써 오피오이드 및 기타 중독성 약물에 대한 중독을 발생시키는 데 중요한 역할을 합니다. 다른 중독성 약물과 마찬가지로 오피오이드의 과다 복용은 핵 축적에서 δFosB 발현을 증가시킵니다. 오피오이드는 도파민 신경 전달을 부정적으로 조절하는 RMTg(rostromedial tegmental nucleus)로부터 복부 피질 영역(VTA)으로의 GABA 기반 투사를 억제함으로써 도파민 경로의 억제를 통해 핵 축적물에서 도파민 신경 전달에 영향을 미칩니다.[60][61] 다시 말해서, 오피오이드는 RMTg에서 VTA로 투사되는 것을 억제하고, 이것은 다시 VTA에서 핵으로 그리고 뇌의 다른 곳으로 투사되는 도파민 경로를 억제합니다.[60][61]
각 개인에 대한 도파민 수용체를 암호화하는 유전적 영역의 차이는 오피오이드 중독과 일반적인 물질 남용의 위험의 일부를 설명하는 데 도움이 될 수 있습니다. 특히 D2 도파민 수용체에 대한 연구는 몇 가지 유망한 결과를 보여주었습니다. 하나의 특정 SNP는 TaqI RFLP(rs1800497)에 있습니다. 메타돈 유지 치료 프로그램에서 530명의 한 중국인 헤로인에 중독된 사람들을 대상으로 한 연구에서 특정 유전적 변이가 있는 사람들은 SNP가 없는 사람들보다 약 2배 더 높은 평균 헤로인 소비를 보였습니다.[62] 이 연구는 도파민 수용체가 물질 중독, 더 구체적으로 오피오이드 남용에 기여한다는 것을 보여주는 데 도움이 됩니다.[62]
신경영상은 뇌의 기능적, 구조적 변화를 보여주었습니다.[63] 헤로인과 같은 오피오이드의 만성적인 섭취는 보상 관련 행동, 감정 반응, 불안을 조절하는 데 필수적인 전전두엽 궤도(OFC)에 장기적인 영향을 미칠 수 있습니다.[64] 게다가, 신경영상과 신경심리학적 연구들은 감정, 스트레스 그리고 높은 충동성과 관련된 회로의 조절 장애를 보여줍니다.[65]
의존성
오피오이드 의존성은 신체적 의존성, 심리적 의존성 또는 둘 다로 발생할 수 있습니다.[66] 약물 의존성은 자극(예: 약물 섭취)에 대한 반복적인 노출이 중단될 때 금단 증후군과 관련된 적응 상태입니다.[47][48][49] 의존성은 물질 사용 장애의 한 요소입니다.[13][67] 오피오이드 의존성은 신체적 의존성, 심리적 의존성 또는 둘 다로 나타날 수 있습니다.[66][48][67]
복부피질영역(VTA)에서 증가된 뇌유래 신경영양인자(BDNF) 신호전달은 인슐린 수용체 기질 2(IRS2), 단백질 키나제 B(AKT) 및 라파마이신 복합체 2(mTORC2)의 기계적 표적의 하향 조절을 통해 오피오이드 유도 금단 증상을 매개하는 것으로 나타났습니다.[47][68] 이러한 단백질을 통한 하향 조절된 신호전달의 결과로, 아편은 VTA 신경세포 과흥도 및 수축(구체적으로 신경세포종의 크기가 감소됨)을 유발합니다.[47] 아편 순진한 사람이 행복감을 유발하는 농도의 아편을 사용하기 시작하면 VTA에서 BDNF 신호전달이 증가하는 것으로 나타났습니다.[69]
핵에 축적된 유전자 전사 인자인 cAMP 반응 요소 결합 단백질(CREB)에 의한 순환 아데노신 일인산(cAMP) 신호 전달 경로의 상향 조절은 여러 종류의 남용 약물 사이에서 심리적 의존성의 일반적인 메커니즘입니다.[66][47] 유전자좌에서 동일한 경로의 상향 조절은 또한 오피오이드 유도 물리적 의존성의 특정 측면에 책임이 있는 메커니즘입니다.[66][47]
20개 의약품의 위해 및 의존 책임을 비교하는 척도를 개발했습니다.[70] 이 척도는 신체적 의존성, 심리적 의존성 및 즐거움을 평가하기 위해 0에서 3까지의 등급을 사용하여 의존성에 대한 평균 점수를 만듭니다.[70] 선정된 결과는 아래 차트에서 확인할 수 있습니다. 헤로인과 모르핀 모두 3.0으로 가장 높은 점수를 받았습니다.[70]
| 약물 | 의미하다 | 내 기쁨이지. | 심리적 의존성 | 물리적 의존성 |
|---|---|---|---|---|
| 헤로인/모핀 | 3.00 | 3.0 | 3.0 | 3.0 |
| 코카인 | 2.39 | 3.0 | 2.8 | 1.3 |
| 술 | 1.93 | 2.3 | 1.9 | 1.6 |
| 벤조디아제핀 | 1.83 | 1.7 | 2.1 | 1.8 |
| 담배 | 2.21 | 2.3 | 2.6 | 1.8 |
오피오이드 수용체
통증 치료에서 오피오이드의 효능에 대한 유전적 근거는 여러 특정 변형에 대해 입증되었지만 오피오이드 효과의 임상적 차이에 대한 증거는 모호합니다.[71] 오피오이드 사용 장애에 대한 유전적 기여는 50%로 추정됩니다.[71][72] 오피오이드 수용체와 그 내인성 리간드의 약리유전체학은 연관 연구에서 집중적인 활동의 대상이 되어 왔습니다. 이러한 연구는 오피오이드 의존성, 코카인 의존성, 알코올 의존성, 필로폰 의존성/정신병증, 날트렉손 치료에 대한 반응, 성격 특성 등을 포함한 여러 표현형을 광범위하게 테스트합니다. 조절 영역뿐만 아니라 두 코딩 서열의 모든 수용체 및 리간드 코딩 유전자에 대해 주요 및 사소한 변이가 보고되었습니다.[72] 내인성 오피오이드 수용체에 대한 연구는 μ-오피오이드 수용체를 암호화하는 OPRM1 유전자뿐만 아니라 κ 수용체와 δ 수용체를 각각 암호화하는 OPRK1 및 OPRD1 유전자에 초점을 맞추고 있습니다. 새로운 접근 방식은 특정 유전자 및 영역의 분석에서 벗어나며 문제의 표현형과 명백한 관계가 없는 전체 유전체에 걸친 편향되지 않은 유전자 스크린을 기반으로 합니다. 이러한 GWAS 연구는 많은 관련 유전자를 산출하지만, 그 중 다수는 세포 부착, 전사 조절, 세포 구조 결정, RNA, DNA 및 단백질 취급/변형과 같은 과정에서 겉보기에는 관련이 없어 보이는 단백질을 암호화합니다.[73]
118A>G변종
오피오이드 mu-수용체에 대해 100개 이상의 변이체가 확인되었지만, 가장 많이 연구된 mu-수용체 변이체는 비동의어 118A>G 변이체로서, 낮은 결합 부위 가용성, 감소된 mRNA 수준, 변경된 신호 전달 및 베타-엔돌핀에 대한 증가된 친화성을 포함하여 수용체에 대한 기능적 변화를 초래합니다. 이론적으로 이러한 모든 기능적 변화는 외인성 오피오이드의 영향을 감소시켜 동일한 치료 효과를 얻기 위해 더 높은 용량이 필요합니다. 이것은 통증 조절을 달성하기 위해 더 높은 용량을 필요로 하는 사람들에게 더 큰 중독 용량의 가능성을 지적합니다. 그러나 118A>G 변이와 오피오이드 의존성을 연결하는 증거는 여러 연구 그룹에서 나타난 연관성과 함께 혼합되지만 다른 그룹에서는 부정적인 결과를 가져옵니다. 혼합된 결과에 대한 한 가지 설명은 118A>G 변이체와 연결 불균형에 있으므로 오피오이드 의존성과 더 구체적으로 관련된 다른 일배체형 패턴에 기여하는 다른 변이체의 가능성입니다.[74]
비오피오이드 수용체 유전자
오피오이드 수용체가 가장 널리 연구되었지만 다른 많은 유전자가 OUD와 관련이 있습니다. 프리프로엔케팔린 유전자인 PENK에 인접한 더 많은 수의 (CA) 반복이 아편 의존성과 관련이 있습니다.[75] 멜라노코르틴 수용체 2형을 암호화하는 MCR2 유전자에 대해 헤로인 중독에 대한 보호와 위험을 모두 내포하는 엇갈린 결과가 나왔습니다.[75] 시토크롬 P450 계열의 많은 효소들은 또한 오피오이드와 그 수용체들의 분해의 변화로 인해 의존성과 과다복용에 역할을 할 수 있습니다. 또한 CYP 효소를 유도하는 효과 때문에 오피오이드를 항우울제 및 항간질제(둘 다 만성 통증 환자에 대한 관련성이 높은 약물)와 결합하면 여러 잠재적 합병증이 발생할 수 있습니다.[76] 특히 CYP2D6의 유전자형 분석은 환자가 오피오이드 및 기타 많은 약물을 개별적으로 치료할 수 있도록 돕는 데 미래의 역할을 할 수 있습니다.[76]
예방
CDC는 오피오이드의 개시, 임상적으로 적절한 오피오이드의 사용, 오피오이드 치료와 관련된 가능한 위험을 평가하는 것과 관련하여 처방사에게 구체적인 권고사항을 제공합니다.[77] 미국의 대형 소매 약국 체인점들은 사용하지 않는 오피오이드를 회수하기 위한 프로토콜, 지침 및 이니셔티브를 시행하고 있으며, 날록손 키트를 제공하고 있으며, 의심스러운 처방에 대해 경계하고 있습니다.[78][79][80] 보험 프로그램은 처방전에 수량 제한을 설정하거나 특정 약물에 대한 사전 승인을 요구함으로써 오피오이드 사용을 제한하는 데 도움이 될 수 있습니다.[81]
날록손은 과다복용의 응급 치료에 사용됩니다.[82] 많은 경로(예: 근육내(IM), 정맥내(IV), 피하, 비강내 및 흡입)에 의해 투여될 수 있으며, 오피오이드 수용체로부터 오피오이드를 대체하고 이러한 수용체의 활성화를 방지함으로써 신속하게 작용합니다.[80] 날록손 키트는 오피오이드 과다 복용을 경험할 수 있는 일반인, 오피오이드에 대한 처방이 많은 사람, 약물 사용 치료 프로그램을 사용하는 사람, 그리고 최근 수감에서 풀려난 사람들에게 권장됩니다.[83] 이것은 생명을 구하는 약이기 때문에, 미국의 많은 지역에서는 필요에 따라 나록손을 휴대하고 투여하라는 법 집행의 상비 명령을 시행하고 있습니다.[84][85] 또한 날록손은 오피오이드 중독 관리에 사용되는 날트렉손과 같은 약물을 시작하기 전에 사람의 오피오이드 금주 상태에 도전하는 데 사용될 수 있습니다.[86]
착한 사마리아인 법은 일반적으로 날록손을 투여하는 방관자를 보호합니다. 미국에서는 최소 40개 주에서 방관자들이 기소에 대한 두려움 없이 행동할 수 있도록 권장하는 착한 사마리아인 법이 있습니다.[87] 2019년 기준으로 48개 주에서 약사에게 개별 처방 없이 날록손을 유통할 수 있는 권한을 부여하고 있습니다.[88]
살인, 자살, 사고 및 간 질환 또한 OUD 환자의 오피오이드 관련 사망 원인입니다.[89][90] 사망 진단서에 대한 정보가 제한되어 있기 때문에 이러한 사망 원인 중 많은 부분이 눈에 띄지 않습니다.[89][91]
경감
"고통-미국을 위한 오피오이드 처방을 위한 CDC 임상 실무 지침, 2022"은 오피오이드 오남용, OUD, 오피오이드 과다 복용과 관련된 권고사항을 제시하고 있습니다.[16] 미국 식품의약국(FDA)에서 표시한 오피오이드(예: OxyContinue)가 OUD 위험 완화에 효과적이라는 임상적 증거가 부족하다고 보고했습니다.[16][92] CDC 지침은 지속 시간이 긴(장기 작용) 오피오이드 또는 시간이 지남에 따라 방출되는(연장 방출) 오피오이드 대신 즉시 방출 오피오이드를 처방할 것을 제안합니다.[16] 다른 권장 사항으로는 오피오이드가 없는 ï브 환자의 통증을 성공적으로 해결하는 최소 오피오이드 용량을 처방하고 이미 오피오이드 치료제를 복용하는 환자와 협력하여 비 오피오이드 진통제의 효과를 극대화하는 것이 있습니다.
오피오이드 치료를 받는 동안 환자는 주기적으로 오피오이드 관련 합병증에 대해 평가를 받아야 하며 임상의는 주 처방 약물 모니터링 프로그램 시스템을 검토해야 합니다.[16] 후자는 오피오이드 용량 또는 약물 조합으로 인한 환자의 과다복용 위험을 줄이기 위해 평가되어야 합니다.[16] 위험이 이익보다 큰 오피오이드 치료를 받는 환자의 경우 임상의와 환자는 오피오이드 용량을 점진적으로 줄이기 위한 치료 계획을 개발해야 합니다.[16]
오피오이드 과다복용에 관한 보다 구체적인 완화 전략은 오피오이드 과다복용 § 예방을 참조하십시오.
관리
오피오이드 사용 장애는 일반적으로 환자의 위험을 줄이고 장기적인 신체적, 심리적 상태를 개선하기 위한 목적으로 장기간의 치료와 관리가 필요합니다.[44]
일차 관리에는 오피오이드 대체 요법, 특히 메타돈 및 부프레노르핀/날록손의 사용이 포함됩니다. HIV 및 C형 간염의 위험 증가, 과다복용 사망률 및 거의 보편적인 재발과의 연관성 때문에 금단 관리는 강력하게 권장되지 않습니다.[93][94] 이러한 접근 방식은 오피오이드 작용제 치료와 같은 장기적인 증거 기반 중독 치료로의 전환에 대한 계획 없이는 효과가 없는 것으로 여겨집니다.[53] 치료는 사망률을 감소시키지만 치료 시작 후 첫 4주와 치료 중단 후 4주는 약물과 관련된 사망에 가장 위험한 시기입니다.[7] 이러한 취약성 증가 기간은 치료 중인 많은 사람들이 이 기간 동안 프로그램을 떠나기 때문에 중요합니다.[7] 의약품 오피오이드에 의존하는 오피오이드 사용 장애가 있는 사람들은 헤로인을 복용하는 사람들과는 다른 관리 방법이 필요할 수 있다는 증거가 있습니다.[95]
약
오피오이드 대체 요법(OST) 또는 오피오이드 사용 장애를 위한 의약품(MOUD)으로도 알려진 오피오이드 대체 요법(ORT)은 헤로인과 같은 오피오이드를 대체하는 것을 포함합니다.[96][97] ORT에 일반적으로 사용되는 약물은 메타돈과 부프레노르핀/날록손(Suboxone)이며, 이들은 의료 감독 하에 복용됩니다.[97] 부프레노르핀/날록손은 주로 과다복용의[98] 위험과 심장에 대한 영향(QTc 연장)과 관련하여 훨씬 더 나은 안전성 프로필 때문에 메타돈보다 일반적으로 선호됩니다.[99][100]
부프레노르핀/날록손, 메타돈, 날트렉손은 미국 식품의약국(FDA)으로부터 약물 보조 치료(MAT) 승인을 받았습니다.[101] 미국에서는 물질남용정신건강서비스청(SAMHSA)이 메타돈 클리닉에서 메타돈을 조제할 수 있는 오피오이드 치료 프로그램(OTP)을 인증하고 있습니다.[102] 2023년 현재, "옴니버스 법안"으로도 알려진 포기 제거(MAT Act)는 OUD 치료에 대한 접근성을 높이기 위해 의료 제공자가 부프레노르핀을 처방하기 위해 포기를 받아야 하는 연방 규정을 삭제했습니다.[103]
ORT의 구동 원리는 환자가 자기 주도적인 삶을 되찾는 것입니다.[104] ORT는 약물 금단과 약물 갈망의 증상을 줄임으로써 이 과정을 용이하게 합니다.[97][104] (미국이나 호주가 아닌) 일부 국가의 경우,[97] 규정은 안정적인 경제적, 심리적 상황을 달성할 때 끝나는 ORT 프로그램에 대해 사람들에게 제한된 시간을 강제합니다. (HIV/AIDS 또는 C형 간염을 가진 사람들은 일반적으로 이 요구사항에서 제외됩니다.) 실제로 환자의 40-65%는 오피오이드 대체 요법을 받는 동안 추가적인 오피오이드의 금욕을 유지하며 70-95%는 사용을 크게 줄일 수 있습니다.[97] 불법 오피오이드 사용으로 인해 발생할 수 있는 의료적(부적합 희석제, 비살균 주사 장비), 심리사회적(정신건강, 관계), 법적(구속 및 수감) 문제를 동시에 제거하거나 축소합니다.[97] 클로니딘이나 로펙시딘은 금단 증상을 치료하는 데 도움이 될 수 있습니다.[105]
메타돈을 시작하는 기간과 두 약물로 치료를 중단한 직후는 특히 사망 위험이 증가하는 기간으로, 공중 보건과 임상 전략 모두에서 다루어야 합니다.[7] ORT는 불법 아편 사용 또는 의존을 경험하는 사람들의 건강과 생활 상태를 개선하는 가장 효과적인 치료법으로 입증되었습니다. 여기에는 사망률 감소와[97][106][7] 약물 관련 범죄 및 의료비 지출로 인한 경제적 손실과 같은 전반적인 사회적 비용이 포함됩니다.[97] 영국 병원 정책을 검토한 결과, 지역 지침은 예를 들어 처방 전에 최근 사용 또는 전문 의약품 팀의 입력을 입증하기 위해 실험실 테스트를 요구함으로써 대체 오피오이드에 대한 접근을 지연시킨 것으로 나타났습니다. 접근이 지연되면 의학적 조언에 반해 조기 퇴원할 위험이 높아질 수 있습니다.[107][108] ORT는 주사를 줄이고 HIV/AIDS의 위험을 낮추며 항레트로바이러스 요법에 대한 순응을 촉진하는 데 효과적이라고 세계보건기구, 유엔의약품범죄사무소 및 UNAIDS에 의해 승인되었습니다.[7]
부프레노르핀과 메타돈은 오피오이드 갈망을 줄이고 금단 증상을 완화하며 교차 내성을 통해 오피오이드의 행복감 효과를 차단함으로써 작용하며,[109] 고친화성 부분 오피오이드 작용제인 부프레노르핀의 경우에도 오피오이드 수용체 포화로 인해 작용합니다.[110] 효능이 떨어지는 다른 오피오이드가 몸 밖으로 나오기 전에 투여하면 급성 금단현상을 유발할 수 있는 것이 바로 부프레노르핀의 이런 성질입니다.
부프레노르핀과 부프레노르핀/날록손
부프레노르핀은 독립형 제품으로 투여하거나 오피오이드 길항제 날록손과 함께 투여할 수 있습니다. 이러한 포함은 전략적인 것으로, 약물의 파쇄 및 주입을 방지하여 오남용을 방지하고 대신 규정된 설하(혀 밑) 경로를 장려합니다.[97] 부프레노르핀/날록손 제제는 정제 및 필름으로 제공되며,[111] 이러한 제제는 설하제 복용 시 효과적으로 작동합니다. 이 형태에서 부프레노르핀의 생체이용률은 35-55%로 견고하게 유지되는 반면, 날록손의 생체이용률은 현저히 감소합니다(~10%).[112] 그러나 주사하면 날록손의 생체 이용률이 증가하여 부프레노르핀의 오피오이드 효과를 효과적으로 차단하여 잠재적 남용을 억제합니다.
부프레노르핀은 부분 오피오이드 수용체 작용제로서 메타돈과 같은 완전 작용제와 구별됩니다. 독특한 약리학적 프로필은 "천장 효과" 덕분에 호흡 저하를 일으킬 가능성을 낮춥니다.[113][114] 부프레노르핀/날록손 병용제나 메타돈에 비해 부프레노르핀 단독제는 오남용이나 과다복용의 위험성이 높은 반면, 그 사용은 사망률 감소와 관련이 있습니다.[115][7] 2002년 미국에서 오피오이드 의존성 치료제로 승인된 [116]부프레노르핀은 이후 형태가 확장되어 2017년 FDA에서 한 달간 주사제 버전을 승인했습니다.[117]
buprenorphine/naloxone 요법을 시작할 때 몇 가지 중요한 요소를 고려해야 합니다. 여기에는 금단 증상의 중증도, 마지막 오피오이드 사용 후 경과된 시간, 관련된 오피오이드의 유형(장작용 대 단작용)이 포함됩니다.[118] 표준 유도 방법은 Clinical Opiate Draft Scale에 의해 측정된 바와 같이 환자가 중간 정도의 금단 증상을 보일 때까지 기다렸다가 약 12점을 획득하는 것입니다. 또는 "마이크로 도즈먼트"는 금단 증상에 관계없이 즉시 적은 용량으로 시작하여 치료 개시에 대한 보다 유연한 접근 방식을 제공합니다.[119] "대량 투여"는 더 많은 양의 수복손(Suboxone)으로 시작하는데, 이는 자체적인 고려 사항이 포함된 다른 유도 전략입니다.[120]
메타돈
메타돈은 오피오이드 사용 장애 치료에 일반적으로 사용되는 완전 오피오이드 작용제입니다. 오피오이드 중독자의 금단 증상과 갈망을 완화하는 데 효과적이며, 특정 상황에서 통증 조절에도 사용할 수 있습니다.[115] 메타돈은 널리 처방되는 OAT 형태이지만, 종종 부프레노르핀/날록손에 비해 더 자주 임상 방문을 요구하며, 이는 또한 더 나은 안전 프로파일과 호흡 억제 및 과다 복용의 위험이 더 낮습니다.[121]
메타돈을 시작할 때 중요하게 고려해야 할 사항은 환자의 오피오이드 내성, 마지막 오피오이드 사용 후 시간, 사용된 오피오이드 유형(장작용 대 단작용), 메타돈 독성의 위험 등입니다.[122] 메타돈은 정제, 경구 용액 또는 주사제와 같은 다양한 형태로 제공됩니다.[115]
메타돈의 장점 중 하나는 체내에서 56시간까지 지속될 수 있기 때문에 환자가 하루 복용량을 놓치면 일반적으로 금단 증상으로 고생하지 않는다는 것입니다.[115] 메타돈의 다른 장점으로는 주사 약물 사용과 관련된 감염병 감소, 사망률 감소 등이 있습니다. 메타돈은 호흡 저하, 메스꺼움, 구토, 불안 및 두통을 포함한 여러 가지 잠재적인 부작용을 가지고 있습니다.[123]
날트렉손
날트렉손은 오피오이드 중독 치료에 사용되는 오피오이드 수용체 길항제입니다.[124][125] 낮은 환자 수용률, 매일 투여로 인한 미부착, 치료 시작 전 오피오이드 금욕 달성의 어려움 등으로 인해 OUD용 부프레노르핀이나 메타돈만큼 널리 사용되지는 않습니다. 또한 최근 오피오이드 사용 후 날트렉손을 투여하면 금단현상이 발생할 수 있습니다. 반대로, 오피오이드 수용체에서의 날트렉손 길항제는 더 높은 용량의 오피오이드로 극복될 수 있습니다.[126] Naltrexone 월간 IM 주사제는 금욕적인 오피오이드 사용자의 오피오이드 의존성 치료에 대해 2010년 FDA 승인을 받았습니다.[124][127]
기타 오피오이드
2010년 현재 메타돈 대비 헤로인 유지 효과의 증거는 불분명합니다.[128] Cochrane 리뷰는 다른 치료법으로 개선되지 않은 오피오이드 사용자들에게서 몇 가지 증거를 발견했습니다.[129] 스위스, 독일, 네덜란드 및 영국에서는 메타돈 및 기타 약물 옵션의 혜택을 받지 못하는 장기 주사 약물 사용자를 의료진의 관리 하에 투여하는 주사형 헤로인으로 치료할 수 있습니다.[130] 스페인, 덴마크, 벨기에, 캐나다, 룩셈부르크 등이 있습니다.[131]또한 일부 유럽 국가에서는 메타돈 또는 부프레노르핀의 대체제로 확장 방출 및 즉시 방출 형태의 디하이드로코데인이 유지 치료에 사용되기도 합니다.[132] 디하이드로코데인은 오피오이드 작용제입니다.[133] 2차 치료제로 사용할 수 있습니다.[134] 2020년 체계적인 검토 결과 디하이드로코데인이 불법 아편 사용을 줄이는 데 있어 일상적으로 사용되는 다른 약물 개입보다 더 효과적이지 않을 수 있다는 저품질 증거가 발견되었습니다.[135]확장 방출 모르핀은 오피오이드 사용을 줄일 수 있고 우울한 증상은 적지만 전반적으로 다른 형태의 오래 지속되는 오피오이드에 비해 더 많은 부작용을 제공합니다. 치료 유지율은 크게 다르지 않은 것으로 나타났습니다.[136] 스위스에서 사용되고 최근에는 캐나다에서 사용됩니다.[137]
임신중
오피오이드 사용 장애가 있는 임산부도 메타돈, 날트렉손, 부프레노르핀 치료를 받을 수 있습니다.[138] 부프레노르핀은 임신 중 오피오이드 사용 장애(OUD) 치료를 위한 메타돈에 비해 더 유리한 결과와 관련이 있는 것으로 보입니다. 연구에 따르면 부프레노르핀은 위해성 증가 없이 조산 위험을 낮추고, 출생 체중을 늘리고, 머리 둘레를 늘리는 것과 관련이 있다고 합니다.[139] 메타돈에 비해 지속적으로 출생 체중과 임신 연령이 개선되지만, 이러한 결과는 잠재적인 편향으로 인해 주의해서 해석해야 합니다.[140] 부프레노르핀 사용은 또한 메타돈과 유사한 모성 결과의 유사한 위험과 함께 신생아 부작용의 위험이 낮은 것과 상관관계가 있습니다.[141] 부프레노르핀 치료를 받은 산모에게서 태어난 영아는 일반적으로 출생 체중이 더 높고 금단 증상이 적으며 조산 가능성이 더 낮습니다.[142] 또한, 이러한 유아들은 신생아 금욕 증후군에 대한 치료가 덜 필요한 경우가 많고, 임신 초기에 치료를 시작할 가능성이 높은 산모를 가지고 있어 임신 기간이 길어지고 아기가 커집니다.[143] 이러한 결과는 buprenorphine이 임신 중 OUD 치료에 더 유리한 선택이 될 수 있음을 시사하지만 개별 상황과 치료 가능성을 고려해야 합니다.
행동치료
다양한 의학적 치료와 마찬가지로, OUD를 치료하기 위한 많은 형태의 심리치료와 지역사회 지원이 있습니다. 주요 증거 기반 심리치료로는 인지행동치료(CBT), 동기강화치료(MET), 우연성관리(CM), 12단계 프로그램이 있습니다. 지원 그룹(예: 마약 익명)과 OUD 환자를 위한 치료 주택과 같은 지역 사회 기반 지원도 치유의 중요한 측면입니다.[144][145]
인지행동치료
인지행동치료(CBT)는 어떤 문제에 대한 생각, 느낌, 행동을 체계적으로 평가하고 그러한 문제를 통해 작동하기 위한 대처 전략을 개발하기 위해 노력하는 심리사회적 개입의 한 형태입니다.[146] 이 개입은 많은 정신 의학적 조건(예: 우울증)과 물질 사용 장애(예: 담배)에서 성공을 입증했습니다.[147] 그러나 OUD에 대한 CBT 단독 사용은 효능 부족으로 인해 감소했으며, 둘 다 CBT 단독 사용보다 더 효과적인 것으로 밝혀졌기 때문에 많은 사람들이 CBT를 사용한 약물 요법 또는 약물 요법에 의존합니다.[148] CBT는 진행 중인 약물 사용의 치료보다 재발 예방에 더 성공적인 것으로 나타났습니다.[144] 특히 내구성으로 유명합니다.[149]
동기부여 강화요법
MET(Motivation Enhanced Therapy)는 수동화된 형태의 MI(Motivation Interviewing)입니다. MI는 교육, 재발 예방 전략 수립, 치료 지침 준수에 대한 보상을 통해 회복하려는 개인의 내재적 동기를 활용합니다. 그리고 사람의 사회경제적 지위, 성별, 인종, 민족성, 성적 성향 및 회복 준비 상태에 기반한 높은 동기를 유지하기 위한 긍정적인 사고.[148][150][151] CBT와 마찬가지로 MET만으로는 OUD에 대한 설득력 있는 효능을 보여주지 못했습니다. 다른 치료법과 결합하는 데 더 강력한 지원이 있습니다.[149]
우발상황관리요법
우연성 관리 요법(CMT)은 특정 목표(예: 검증된 금욕, 일반적으로 소변 약물 테스트의 형태)에 도달하기 위한 인센티브를 사용하는 것과 같은 작동적 행동 조절과 유사한 원칙을 사용합니다.[144] 이러한 형태의 심리 치료는 약물 중독 치료에 대한 가장 강력하고 강력한 경험적 지원을 제공합니다.[144][149][152] 외래 환자는 바우처 기반 인센티브를 사용할 때 약물 순응도, 보유 및 금욕이 향상된 것으로 나타났습니다.[144][149] 이를 구현하는 한 가지 방법은 메타돈 프로그램에 대한 테이크 홈 권한을 제공하는 것입니다. 치료 중 효과에도 불구하고 일단 치료가 끝나면 효과가 떨어지는 경향이 있습니다. 또한, 비용 장벽은 임상 사회에서의 적용을 제한합니다.[144]
12단계 프로그램
의료적 치료는 오피오이드 금단의 초기 증상에 도움이 될 수 있지만, 일단 금단의 첫 단계가 끝나면, 장기적인 예방적 치료를 위한 방법은 마약 익명과 같은 12단계 그룹에 출석하는 것입니다.[153] 일부 증거는 청소년들에게도 이러한 프로그램의 사용을 뒷받침합니다.[154]
역학

전 세계적으로 오피오이드 의존증 환자 수는 1990년 1,040만 명에서 2010년 1,550만 명으로 증가했습니다.[7] 2016년에는 이 장애를 경험한 2천 7백만 명으로 증가했습니다.[156] 오피오이드 사용 장애는 2015년 전 세계적으로 122,000명의 사망자를 낳았는데,[157] 이는 1990년의 18,000명에 비해 증가한 수치입니다.[158] 모든 원인으로 인한 사망자는 1990년 4,750만 명에서 2013년 5,580만 명으로 증가했습니다.[158][157]
미국

현재 유행하는 오피오이드 남용은 미국 역사상 가장 치명적인 약물 유행입니다.[20] 미국 질병통제예방센터(CDC)가 설명한 바와 같이 오피오이드 과다복용 사망의 물결로 위기를 구분할 수 있습니다.[159] 첫 번째 파동은 1990년대에 시작되었는데, 이는 천연 오피오이드(코데인, 모르핀 등), 반합성 오피오이드(옥시코돈, 하이드로코돈, 하이드로모르폰, 옥시모르폰), 메타돈 등 합성 오피오이드 처방의 증가와 관련이 있습니다.[160][159] 미국에서는 1999년부터 2010년 사이 오피오이드 진통제를 포함한 연령 조정 약물 중독 사망률이 인구 10만 명당 1.4명에서 5.4명으로 증가했습니다.[161] 두 번째 파동은 헤로인으로 인한 오피오이드 과다복용의 급속한 증가와 함께 2010년경으로 거슬러 올라갑니다.[160] 이때까지 이미 1999년에 비해 과다 복용으로 인한 사망자가 4배나 많았습니다.[161] 헤로인과 관련된 연령 조정 약물 중독 사망률은 1999~2011년 인구 10만 명당 0.7명에서 1.4명으로 두 배가량 증가한 뒤 2015년 4.1명으로 계속 증가했습니다.[162] 2013년 합성 오피오이드, 특히 불법적으로 생산된 펜타닐과 관련된 세 번째 과다복용 사망 파동이 시작되었습니다.[160] 불법 펜타닐 시장이 지속적으로 변화했지만 일반적으로 마약은 헤로인의 불순물로 판매됩니다. 연구에 따르면 펜타닐이 불법 오피오이드 시장으로 빠르게 증가하는 것은 주로 공급 측면에서 주도되었으며 2006년으로 거슬러 올라갑니다. 헤로인 순도의 감소, 처방약에 대한 접근성의 증가, 그리고 "지그프리드 방법"(비교적 간단하고 비용 효율적인 펜타닐 생산 방법)의 보급은 길거리 공급업체들이 그들의 제품에 펜타닐을 포함시킨 주요 요인이었습니다.[163][164] 현재 네 번째 파동은 펜타닐과 같은 합성 오피오이드와 필로폰이나 코카인과 같은 자극제가 섞여 있어 다물질 과다 복용이 특징입니다.[165][166] 2010년에 오피오이드 관련 사망의 약 0.5%가 자극제와의 혼합으로 인한 것이었습니다. 이 수치는 오피오이드 관련 사망자의 약 3분의 1인 34,000명이 각성제 사용과 관련된 2021년까지 50배 이상 증가했습니다.[166]
2017년, 미국 보건복지부(HHS)는 오피오이드의 오남용이 증가함에 따라 공중보건 비상사태를 발표했습니다.[167] 미국 행정부는 '오피오이드 5점 전략'이라는 전략적 틀을 도입했는데, 여기에는 접근 복구 서비스 제공, 약물 과다 복용에 대한 역전제의 가용성 증가, 오피오이드 오남용 및 통증 연구 자금 지원, 통증을 관리하는 사람들의 치료법 변경 등이 포함됩니다. 그리고 오피오이드 약물 오남용과 관련된 공중 보건 보고서를 업데이트합니다.[167][168]
2000년대 미국의 유행은 여러 요인과 관련이 있습니다.[15] 오피오이드 사용률과 의존성은 연령, 성별, 인종, 사회경제적 지위에 따라 다릅니다.[15] 인종과 관련하여 사망의 차이는 의사 처방과 의료 및 특정 처방 약물에 대한 접근 부족 사이의 상호 작용 때문인 것으로 생각됩니다.[15] 남성이 여성보다 오피오이드 사용 및 의존 위험이 높고,[169][170] 남성이 여성보다 오피오이드 과다복용을 더 많이 차지하기도 하지만, 이 격차는 줄어들고 있습니다.[169] 여성은 진통제를 처방받고, 더 높은 용량을 투여받고, 더 오랜 기간 동안 사용하고, 더 빨리 의존하게 될 가능성이 높습니다.[171]
오피오이드 사용으로 인한 사망은 다른 불법 약물 사용으로 인한 사망보다 나이를 더 많이 먹는 경향이 있습니다.[170][172][173] 이것은 젊은 사람들을 포함한 전체적인 오피오이드 사용을 반영하지 않습니다. 헤로인 과다복용이 20~30세에서 가장 많은 반면,[173] 오피오이드 과다복용은 40~50세에서 가장 많습니다.[172] 오피오이드 사용장애로 치료에 들어가는 사람들의 77%를 21~35세가 차지하지만,[174] 처방받은 진통제를 처음 사용하는 사람들의 평균 연령은 21세였습니다.2013년에 2년.[175] 중산층 중에서 자금을 획득하는 수단에는 카리브해 전역에서 거래 사기에 집행력이 부족한 노인 금융 남용과 국제 딜러가 포함됩니다.[176]
2018년부터 연방정부의 Support(오피오이드 회복 및 환자 및 지역사회 치료를 촉진하는 물질 사용-장애 예방법) 법안 통과로 메디케어를 받는 환자에 대한 메타돈 사용에 대한 연방정부의 제한이 해제되었습니다.[177] 2020년 3월부터 미국에서는 코로나19 팬데믹으로 인해 원격의료를 통해 부프레노르핀을 투약할 수 있습니다.[178][179]
2021년 10월, 캐시 호철 뉴욕 주지사는 오피오이드 위기를 해결하기 위한 법안에 서명했습니다. 여기에는 주 및 지방 교정 시설에 수감된 개인에 대한 약물 보조 약물 사용 장애 치료 프로그램 구축, 피하주사기 및 주사기 소지 및 판매 비범죄화, 오피오이드 길항제 유통업체에 대한 온라인 디렉토리 구축, 그리고 물질 사용 치료 프로그램으로의 전환을 고려할 수 있는 물질 사용 장애를 가진 개인이 저지르는 적격 범죄의 수를 확대합니다.[180] 이 법들이 서명되기 전까지, 수감된 뉴욕 시민들은 약물 보조 치료에 대한 확실한 접근권을 갖지 못했고, 주사기 교환 및 접근 프로그램을 승인하고 자금을 지원했음에도 불구하고 주사기 소지는 여전히 A급 경범죄였습니다.[181] 이 법안은 뉴욕주 법률이 오피오이드 사망에 기여한 방식을 인정합니다. 2020년 뉴욕주에서 5112명 이상이 과다복용으로 사망했고, 뉴욕시에서 2192명이 사망했습니다.[182]
2023년 현재, 포기 제거(MAT Act)는 통합 세출법 제1262조(또는 "옴니버스 법안")의 일부로서, OUD 치료에 대한 접근성을 높이기 위해 의료 제공자가 부프레노르핀을 처방하기 위해 포기를 받아야 한다는 연방 규정을 삭제했습니다.[103] 이 법안 이전에, 개업의들은 부프레노르핀을 처방하기 전에 "x-waiver"라고도 알려진 2000년 약물 중독 치료법(DATA) 면제를 받아야 했습니다. 또한 이제 더 이상 공급자가 부프레노르핀을 OUD에 처방할 수 있는 환자 수에 제한이 없습니다.[103]
- 특정 오피오이드 및 오피오이드 등급과 관련된 사망 차트 - 미국 국립 약물 남용 연구소
- 모든 오피오이드 약물로 인한 미국의 연간 사망. 이 숫자에는 헤로인 및 불법 합성 오피오이드와 함께 오피오이드 진통제가 포함됩니다.[183]
- 약물 범주별 미국 연간 사망자 수.[183]
- 헤로인과 관련된 오피오이드 과다복용 사망자가 미국에서 매년 발생하고 있습니다.[184]
- 정신자극제(주로 필로폰)와 관련된 미국의 연간 오피오이드 과다복용 사망.[184]
COVID-19가 오피오이드 과다복용 및 원격건강 치료에 미치는 영향
코로나19 팬데믹이 오피오이드 위기를 가속화했다는 역학 연구 결과가 나왔습니다.[164][185][186] 오피오이드 과다복용 데이터의 전반적인 추세는 2017-18년경 사망률의 정체를 보여주었으며, 2019년에는 펜타닐과 같은 합성 오피오이드에 주로 기인한 갑작스럽고 급격한 증가를 보였습니다.[184] 2020년 미국에서 오피오이드 과다복용으로 인한 약물 과다복용은 93,400건으로 73% 이상(약 69,000건)이었습니다.[187] Gomes et al. 의 한 JAMA 리뷰에 따르면 미국에서 오피오이드 독성으로 인한 추정 수명 손실(YLL)이 276% 증가한 것으로 나타났습니다. 이러한 증가는 YLL이 거의 3배 증가한 15세에서 19세 사이에서 특히 느껴졌습니다. 젊은 남성 성인의 효과 크기가 가장 컸습니다.[186] COVID-19의 시작과 동시에 미국과 캐나다의 오피오이드 데이터에 대한 다른 리뷰는 오피오이드 관련 응급 의약품 활용률이 크게 증가하고, 오피오이드에 대한 긍정성이 증가했으며, 날록손 분배의 변화가 감소하지 않은 것으로 나타났습니다.[188]
원격 의료는 OUD 치료 접근에 큰 역할을 했고, 원격 의료에 관한 법률은 계속해서 발전하고 있습니다. 새로운 OUD를 가진 메디케어 수혜자들을 대상으로 한 연구에 따르면 원격 의료 서비스를 받은 사람들은 과다복용으로 사망할 위험이 33%나 낮았습니다.[189] 흑인 및 히스패닉계 미국인과 같은 소수 집단도 다른 OUD 관련 결과의 격차가 증가함에도 불구하고 팬데믹 기간 동안 도입된 원격 의료 프로그램으로 인해 액세스가 증가함에 따라 혜택을 받는 것으로 나타났습니다.[190] DEA와 HHS는 2024년 12월 31일까지 OUD용 부프레노르핀 등 관리물질 처방과 관련해 원격의료 유연성을 확대했습니다.[191]
역사
아편 오용은 적어도 기원전 300년부터 기록되어 왔습니다. 그리스 신화는 네펜테 (그리스어로 "슬픔으로부터 자유롭다")와 오디세이의 영웅이 그것을 어떻게 사용했는지를 묘사합니다. 오피오이드는 근동에서 수세기 동안 사용되어 왔습니다. 아편의 정제와 분리는 19세기 초에 발생했습니다.[28]
레바세틸메타돌은 이전에 오피오이드 의존성을 치료하는 데 사용되었습니다. 2003년에 이 약의 제조사는 생산을 중단했습니다. 사용 가능한 일반 버전이 없습니다. LAAM은 치료를 받는 사람이 메타돈과 달리 일주일에 세 번만 병원을 방문할 수 있는 오래 지속되는 효과를 나타냈습니다.[192] 2001년, 레바세틸메타돌은 생명을 위협하는 심실 리듬 장애에 대한 보고로 유럽 시장에서 제거되었습니다.[193] 2003년, Roxane Laboratories, Inc.는 미국의 Orlaam을 중단했습니다.[194]
참고 항목
- 벤조디아제핀 금단증후군
- 닥터쇼핑
- 오피오이드 남용의 맥락에서 정서적 고통에 대한 과민증, 하이퍼카티페아
- 처방약 남용
참고문헌
- ^ a b "FDA approves first buprenorphine implant for treatment of opioid dependence". U.S. Food and Drug Administration (FDA) (Press release). 26 May 2016. Retrieved 16 March 2017.
- ^ "3 Patient Assessment". Clinical Guidelines for the Use of Buprenorphine in the Treatment of Opioid Addiction. Rockville (MD): Substance Abuse and Mental Health Services Administration (US). 2004.
- ^ a b "Commonly Used Terms". www.cdc.gov. 29 August 2017. Retrieved 16 July 2018.
- ^ a b c d e f g h i j k l m n o p q r s American Psychiatric Association (2013), Diagnostic and Statistical Manual of Mental Disorders (5th ed.), Arlington: American Psychiatric Publishing, pp. 540–546, ISBN 978-0890425558
- ^ a b c d e f Substance Use and Mental Health Services Administration (30 September 2014). "Substance Use Disorders".
- ^ a b c "Opioid Use and Opioid Use Disorder in Pregnancy". ACOG. August 2017. Retrieved 16 July 2018.
- ^ a b c d e f g h i Sordo L, Barrio G, Bravo MJ, Indave BI, Degenhardt L, Wiessing L, Ferri M, Pastor-Barriuso R (April 2017). "Mortality risk during and after opioid substitution treatment: systematic review and meta-analysis of cohort studies". BMJ. 357: j1550. doi:10.1136/bmj.j1550. PMC 5421454. PMID 28446428.
- ^ a b "Treatment for Substance Use Disorders". Substance Abuse and Mental Health Services Administration. October 2014.
- ^ McDonald R, Strang J (July 2016). "Are take-home naloxone programmes effective? Systematic review utilizing application of the Bradford Hill criteria". Addiction. 111 (7): 1177–87. doi:10.1111/add.13326. PMC 5071734. PMID 27028542.
- ^ a b Sharma B, Bruner A, Barnett G, Fishman M (July 2016). "Opioid Use Disorders". Child and Adolescent Psychiatric Clinics of North America. 25 (3): 473–87. doi:10.1016/j.chc.2016.03.002. PMC 4920977. PMID 27338968.
- ^ a b Dydyk, Alexander M.; Jain, Nitesh K.; Gupta, Mohit (2022), "Opioid Use Disorder", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 31985959, retrieved 16 November 2022
- ^ Diagnostic and statistical manual of mental disorders : DSM-5. Internet Archive. Arlington, VA : American Psychiatric Association. 2013. ISBN 978-0-89042-554-1.
{{cite book}}: CS1 유지보수: 기타(링크) - ^ a b c d Volkow ND, Koob GF, McLellan AT (January 2016). "Neurobiologic Advances from the Brain Disease Model of Addiction". The New England Journal of Medicine. 374 (4): 363–71. doi:10.1056/NEJMra1511480. PMC 6135257. PMID 26816013.
Addiction: A term used to indicate the most severe, chronic stage of substance-use disorder, in which there is a substantial loss of self-control, as indicated by compulsive drug taking despite the desire to stop taking the drug. In the DSM-5, the term addiction is synonymous with the classification of severe substance-use disorder.
- ^ Webster, Lynn R. (November 2017). "Risk Factors for Opioid-Use Disorder and Overdose". Anesthesia and Analgesia. 125 (5): 1741–1748. doi:10.1213/ANE.0000000000002496. PMID 29049118. S2CID 19635834.
- ^ a b c d e Santoro, T. N.; Santoro, J. D. (2018). "Racial Bias in the US Opioid Epidemic: A Review of the History of Systemic Bias and Implications for Care". Cureus. 10 (12): e3733. doi:10.7759/cureus.3733. PMC 6384031. PMID 30800543.
- ^ a b c d e f g h Dowell, Deborah; Ragan, Kathleen R.; Jones, Christopher M.; Baldwin, Grant T.; Chou, Roger (4 November 2022). "CDC Clinical Practice Guideline for Prescribing Opioids for Pain — United States, 2022". MMWR. Recommendations and Reports. 71 (3): 1–95. doi:10.15585/mmwr.rr7103a1. PMC 9639433. PMID 36327391.
- ^ "A Prescriber's Guide to Medicare Prescription Drug (Part D) Opioid Policies" (PDF).
- ^ Mohamadi A, Chan JJ, Lian J, Wright CL, Marin AM, Rodriguez EK, von Keudell A, Nazarian A (August 2018). "Risk Factors and Pooled Rate of Prolonged Opioid Use Following Trauma or Surgery: A Systematic Review and Meta-(Regression) Analysis". The Journal of Bone and Joint Surgery. American Volume. 100 (15): 1332–1340. doi:10.2106/JBJS.17.01239. PMID 30063596. S2CID 51891341.
- ^ "Prescription opioid use is a risk factor for heroin use". National Institute on Drug Abuse. October 2015. Retrieved 16 July 2018.
- ^ a b Hughes, Evan (2 May 2018). "The Pain Hustlers". New York Times. Retrieved 3 May 2018.
- ^ a b "Trends in the Use of Methadone, Buprenorphine, and Extended-release Naltrexone at Substance Abuse Treatment Facilities: 2003–2015 (Update)". www.samhsa.gov. Retrieved 16 November 2022.
- ^ Donovan, Dennis M.; Ingalsbe, Michelle H.; Benbow, James; Daley, Dennis C. (2013). "12-Step Interventions and Mutual Support Programs for Substance Use Disorders: An Overview". Social Work in Public Health. 28 (3–4): 313–332. doi:10.1080/19371918.2013.774663. PMC 3753023. PMID 23731422.
- ^ "Opioid Overdose Prevention Programs Providing Naloxone to Laypersons — United States, 2014". www.cdc.gov. Retrieved 16 November 2022.
- ^ CDC (30 August 2022). "Disease of the Week – Opioid Use Disorder". Centers for Disease Control and Prevention. Retrieved 16 November 2022.
- ^ "Data Brief 294. Drug Overdose Deaths in the United States, 1999–2016" (PDF). CDC. Retrieved 18 May 2018.
- ^ Treatment, Center for Substance Abuse (2006). "[Table], Figure 4-4: Signs and Symptoms of Opioid Intoxication and Withdrawal". www.ncbi.nlm.nih.gov. Retrieved 6 April 2019.
- ^ 펜타닐. 17번의 이미지 4. 마약 단속국. "대부분의 사람들에게 치명적인 용량인 펜타닐 2밀리그램의 사진 삽화"라는 캡션이 있는 아카이브를 참조하십시오.
- ^ a b Kosten TR, Haile CN. 오피오이드 관련 장애. 인: 캐스퍼 D, 파우치 A, 하우저 S, 롱고 D, 제임스슨 J, 로스칼조 J. 에드스. Harrison's Principle of Internal Medicine, 19e New York, McGraw-Hill; 2014. http://accessmedicine.mhmedical.com/content.aspx?bookid=1130§ionid=79757372 2017년 3월 9일 접속.
- ^ Diagnostic and statistical manual of mental disorders : DSM-5 (5th ed.). American Psychiatric Association. 2013. pp. 547–549. ISBN 9780890425541.
- ^ a b Shah, Mansi; Huecker, Martin R. (2019), "Opioid Withdrawal", StatPearls, StatPearls Publishing, PMID 30252268, retrieved 21 October 2019
- ^ a b c d e f g h i j k Ries RK, Miller SC, Fiellin DA (2009). Principles of Addiction Medicine. Lippincott Williams & Wilkins. pp. 593–594. ISBN 9780781774772.
- ^ Rahimi-Movaghar A, Gholami J, Amato L, Hoseinie L, Yousefi-Nooraie R, Amin-Esmaeili M (June 2018). "Pharmacological therapies for management of opium withdrawal". The Cochrane Database of Systematic Reviews. 2018 (6): CD007522. doi:10.1002/14651858.CD007522.pub2. PMC 6513031. PMID 29929212.
- ^ Chen KW, Banducci AN, Guller L, Macatee RJ, Lavelle A, Daughters SB, Lejuez CW (November 2011). "An examination of psychiatric comorbidities as a function of gender and substance type within an inpatient substance use treatment program". Drug and Alcohol Dependence. 118 (2–3): 92–9. doi:10.1016/j.drugalcdep.2011.03.003. PMC 3188332. PMID 21514751.
- ^ Webster LR, Webster RM (2005). "Predicting aberrant behaviors in opioid-treated patients: preliminary validation of the Opioid Risk Tool". Pain Medicine. 6 (6): 432–42. doi:10.1111/j.1526-4637.2005.00072.x. PMID 16336480.
- ^ Papaleontiou, Maria; Henderson, Jr, Charles R.; Turner, Barbara J.; Moore, Alison A.; Olkhovskaya, Yelena; Amanfo, Leslie; Reid, M. Carrington (July 2010). "Outcomes Associated with Opioid Use in the Treatment of Chronic Noncancer Pain in Older Adults: A Systematic Review and Meta-Analysis". Journal of the American Geriatrics Society. 58 (7): 1353–1369. doi:10.1111/j.1532-5415.2010.02920.x. PMC 3114446. PMID 20533971.
- ^ a b Noble, Meredith; Tregear, Stephen J.; Treadwell, Jonathan R.; Schoelles, Karen (February 2008). "Long-Term Opioid Therapy for Chronic Noncancer Pain: A Systematic Review and Meta-Analysis of Efficacy and Safety". Journal of Pain and Symptom Management. 35 (2): 214–228. doi:10.1016/j.jpainsymman.2007.03.015. PMID 18178367.
- ^ Martell, Bridget A.; O'Connor, Patrick G.; Kerns, Robert D.; Becker, William C.; Morales, Knashawn H.; Kosten, Thomas R.; Fiellin, David A. (16 January 2007). "Systematic Review: Opioid Treatment for Chronic Back Pain: Prevalence, Efficacy, and Association with Addiction". Annals of Internal Medicine. 146 (2): 116–127. doi:10.7326/0003-4819-146-2-200701160-00006. PMID 17227935. S2CID 28969290.
- ^ Kalso, Eija; Edwards, Jayne E.; Moore, Andrew R.; McQuay, Henry J. (December 2004). "Opioids in chronic non-cancer pain: systematic review of efficacy and safety". Pain. 112 (3): 372–380. doi:10.1016/j.pain.2004.09.019. PMID 15561393. S2CID 25807828.
- ^ a b Goesling, Jenna; DeJonckheere, Melissa; Pierce, Jennifer; Williams, David A.; Brummett, Chad M.; Hassett, Afton L.; Clauw, Daniel J. (May 2019). "Opioid cessation and chronic pain: perspectives of former opioid users". Pain. 160 (5): 1131–1145. doi:10.1097/j.pain.0000000000001493. PMC 8442035. PMID 30889052.
- ^ Krebs, Erin E.; Gravely, Amy; Nugent, Sean; Jensen, Agnes C.; DeRonne, Beth; Goldsmith, Elizabeth S.; Kroenke, Kurt; Bair, Matthew J.; Noorbaloochi, Siamak (6 March 2018). "Effect of Opioid vs Nonopioid Medications on Pain-Related Function in Patients With Chronic Back Pain or Hip or Knee Osteoarthritis Pain: The SPACE Randomized Clinical Trial". JAMA. 319 (9): 872–882. doi:10.1001/jama.2018.0899. PMC 5885909. PMID 29509867.
- ^ Eriksen, Jørgen; Sjøgren, Per; Bruera, Eduardo; Ekholm, Ola; Rasmussen, Niels K. (November 2006). "Critical issues on opioids in chronic non-cancer pain". Pain. 125 (1): 172–179. doi:10.1016/j.pain.2006.06.009. PMID 16842922. S2CID 24858908.
- ^ Chaparro, Luis Enrique; Furlan, Andrea D.; Deshpande, Amol; Mailis-Gagnon, Angela; Atlas, Steven; Turk, Dennis C. (April 2014). "Opioids Compared With Placebo or Other Treatments for Chronic Low Back Pain: An Update of the Cochrane Review". Spine. 39 (7): 556–563. doi:10.1097/BRS.0000000000000249. PMID 24480962. S2CID 25356400.
- ^ Substitution maintenance therapy in the management of opioid dependence and HIV/AIDS prevention (PDF). World Health Organization. 2004. ISBN 978-92-4-159115-7.
- ^ a b "Treatment of opioid dependence". WHO. 2004. Archived from the original on 14 June 2010. Retrieved 28 August 2016.[needs 업데이트]
- ^ Longo, Dan L.; Volkow, Nora D.; Koob, George F.; McLellan, A. Thomas (28 January 2016). "Neurobiologic Advances from the Brain Disease Model of Addiction". New England Journal of Medicine. 374 (4): 363–371. doi:10.1056/NEJMra1511480. PMC 6135257. PMID 26816013.
- ^ Hyman, SE (January 2007). "The neurobiology of addiction: implications for voluntary control of behavior". The American Journal of Bioethics. 7 (1): 8–11. doi:10.1080/15265160601063969. PMID 17366151. S2CID 347138.
- ^ a b c d e f g Nestler EJ (December 2013). "Cellular basis of memory for addiction". Dialogues in Clinical Neuroscience. 15 (4): 431–43. doi:10.31887/DCNS.2013.15.4/enestler. PMC 3898681. PMID 24459410.
Despite the importance of numerous psychosocial factors, at its core, drug addiction involves a biological process.
- ^ a b c Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and Addictive Disorders". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 364–375. ISBN 9780071481274.
- ^ a b "Glossary of Terms". Mount Sinai School of Medicine. Department of Neuroscience. Archived from the original on 10 May 2019. Retrieved 9 February 2015.
- ^ a b Schultz, Wolfram (July 2015). "Neuronal Reward and Decision Signals: From Theories to Data". Physiological Reviews. 95 (3): 853–951. doi:10.1152/physrev.00023.2014. PMC 4491543. PMID 26109341.
- ^ Brain & Behavior Research Foundation (2019년 3월 13일). '중독의 생물학'. 유튜브.
- ^ Robinson, Terry E; Berridge, Kent C (12 October 2008). "The incentive sensitization theory of addiction: some current issues". Philosophical Transactions of the Royal Society B: Biological Sciences. 363 (1507): 3137–3146. doi:10.1098/rstb.2008.0093. PMC 2607325. PMID 18640920.
- ^ a b "Opioid Use Disorder".
- ^ "Medically Supervised Withdrawal (Detoxification) from Opioids". pcssnow.org. 11 June 2021.
- ^ Weiss, Roger D (December 2011). "Adjunctive counseling during brief and extended buprenorphine-naloxone treatment for prescription opioid dependence: a 2-phase randomized controlled trial". Arch Gen Psychiatry. 68 (12): 1238–46 – via PubMed.
- ^ a b Robison AJ, Nestler EJ (October 2011). "Transcriptional and epigenetic mechanisms of addiction". Nature Reviews. Neuroscience. 12 (11): 623–37. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
- ^ a b Olsen CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109–22. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101.
- ^ a b Ruffle JK (November 2014). "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". The American Journal of Drug and Alcohol Abuse. 40 (6): 428–37. doi:10.3109/00952990.2014.933840. PMID 25083822. S2CID 19157711.
- ^ Blum K, Werner T, Carnes S, Carnes P, Bowirrat A, Giordano J, Oscar-Berman M, Gold M (2012). "Sex, drugs, and rock 'n' roll: hypothesizing common mesolimbic activation as a function of reward gene polymorphisms". Journal of Psychoactive Drugs. 44 (1): 38–55. doi:10.1080/02791072.2012.662112. PMC 4040958. PMID 22641964.
- ^ a b Bourdy R, Barrot M (November 2012). "A new control center for dopaminergic systems: pulling the VTA by the tail". Trends in Neurosciences. 35 (11): 681–90. doi:10.1016/j.tins.2012.06.007. PMID 22824232. S2CID 43434322.
- ^ a b "Morphine addiction – Homo sapiens (human)". KEGG. Kanehisa Laboratories. 18 June 2013. Retrieved 11 September 2014.
- ^ a b Mistry C, Bawor M, Desai D, Marsh D, Samaan Z (May 2014). "Genetics of Opioid Dependence: A Review of the Genetic Contribution to Opioid Dependence". Current Psychiatry Reviews. 10 (2): 156–167. doi:10.2174/1573400510666140320000928. PMC 4155832. PMID 25242908.
- ^ Goldstein RZ, Volkow ND (October 2011). "Dysfunction of the prefrontal cortex in addiction: neuroimaging findings and clinical implications". Nature Reviews. Neuroscience. 12 (11): 652–69. doi:10.1038/nrn3119. PMC 3462342. PMID 22011681.
- ^ Schoenbum, Geoffrey; Shaham, Yavin (February 2008). "The role of orbitofrontal cortex in drug addiction: a review of preclinical studies". Biol Psychiatry. 63 (3): 256–262. doi:10.1016/j.biopsych.2007.06.003. PMC 2246020. PMID 17719014.
- ^ Ieong HF, Yuan Z (1 January 2017). "Resting-State Neuroimaging and Neuropsychological Findings in Opioid Use Disorder during Abstinence: A Review". Frontiers in Human Neuroscience. 11: 169. doi:10.3389/fnhum.2017.00169. PMC 5382168. PMID 28428748.
- ^ a b c d Nestler EJ (August 2016). "Reflections on: "A general role for adaptations in G-Proteins and the cyclic AMP system in mediating the chronic actions of morphine and cocaine on neuronal function"". Brain Research. 1645: 71–4. doi:10.1016/j.brainres.2015.12.039. PMC 4927417. PMID 26740398.
Specifically, opiates in several CNS regions including NAc, and cocaine more selectively in NAc induce expression of certain adenylyl cyclase isoforms and PKA subunits via the transcription factor, CREB, and these transcriptional adaptations serve a homeostatic function to oppose drug action. In certain brain regions, such as locus coeruleus, these adaptations mediate aspects of physical opiate dependence and withdrawal, whereas in NAc they mediate reward tolerance and dependence that drives increased drug self-administration.
- ^ a b "Opioid Use Disorder: Diagnostic Criteria". Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition (PDF). American Psychiatric Association. pp. 1–9. Archived from the original (PDF) on 26 November 2017. Retrieved 27 March 2017.
- ^ Vargas-Perez H, Ting-A Kee R, Walton CH, Hansen DM, Razavi R, Clarke L, Bufalino MR, Allison DW, Steffensen SC, van der Kooy D (June 2009). "Ventral tegmental area BDNF induces an opiate-dependent-like reward state in naive rats". Science. 324 (5935): 1732–4. Bibcode:2009Sci...324.1732V. doi:10.1126/science.1168501. PMC 2913611. PMID 19478142.
- ^ Laviolette SR, van der Kooy D (March 2001). "GABA(A) receptors in the ventral tegmental area control bidirectional reward signalling between dopaminergic and non-dopaminergic neural motivational systems". The European Journal of Neuroscience. 13 (5): 1009–15. doi:10.1046/j.1460-9568.2001.01458.x. PMID 11264674. S2CID 46694281.
- ^ a b c Nutt, David; King, Leslie A; Saulsbury, William; Blakemore, Colin (March 2007). "Development of a rational scale to assess the harm of drugs of potential misuse". The Lancet. 369 (9566): 1047–1053. doi:10.1016/S0140-6736(07)60464-4. PMID 17382831. S2CID 5903121.
- ^ a b Dydyk, AM; Jain, NK; Gupta, M (21 July 2023). Opioid Use Disorder. Treasure Island (FL): StatPearls Publishing. ISBN 31985959.
{{cite book}}: 확인.isbn=값 : 길이(도움말) - ^ a b c Dick, DM; Agrawal, A (2008). "The Genetics of Alcohol and Other Drug Dependence". Alcohol Res Health. 31 (2): 111–118 – via PubMed.
- ^ Hall FS, Drgonova J, Jain S, Uhl GR (December 2013). "Implications of genome wide association studies for addiction: are our a priori assumptions all wrong?". Pharmacology & Therapeutics. 140 (3): 267–79. doi:10.1016/j.pharmthera.2013.07.006. PMC 3797854. PMID 23872493.
- ^ Bruehl S, Apkarian AV, Ballantyne JC, Berger A, Borsook D, Chen WG, Farrar JT, Haythornthwaite JA, Horn SD, Iadarola MJ, Inturrisi CE, Lao L, Mackey S, Mao J, Sawczuk A, Uhl GR, Witter J, Woolf CJ, Zubieta JK, Lin Y (February 2013). "Personalized medicine and opioid analgesic prescribing for chronic pain: opportunities and challenges". The Journal of Pain. 14 (2): 103–13. doi:10.1016/j.jpain.2012.10.016. PMC 3564046. PMID 23374939.
- ^ a b Khokhar JY, Ferguson CS, Zhu AZ, Tyndale RF (2010). "Pharmacogenetics of drug dependence: role of gene variations in susceptibility and treatment". Annual Review of Pharmacology and Toxicology. 50: 39–61. doi:10.1146/annurev.pharmtox.010909.105826. PMID 20055697. S2CID 2158248.
- ^ a b Solhaug, V; Molden, E (17 October 2017). "Individual variability in clinical effect and tolerability of opioid analgesics - Importance of drug interactions and pharmacogenetics". Scand J Pain: 193–200 – via PubMed.
- ^ "CDC Guideline for Prescribing Opioids for Chronic Pain Drug Overdose CDC Injury Center". www.cdc.gov. 31 August 2018. Retrieved 3 November 2018.
- ^ "Our Commitment to Fight Opioid Abuse CVS Health". CVS Health. Retrieved 3 November 2018.
- ^ "Combat opioid abuse Walgreens". Walgreens. Retrieved 3 November 2018.
- ^ a b "Naloxone for Treatment of Opioid Overdose" (PDF). U.S. Food and Drug Administration (FDA). Retrieved 7 November 2017.
- ^ "Prevent Opioid Use Disorder Drug Overdose CDC Injury Center". www.cdc.gov. 31 August 2018. Retrieved 20 November 2018.
- ^ Naloxone. 23 October 2017. Retrieved 2 November 2017.
{{cite encyclopedia}}:work=무시됨(도움말) - ^ "Opioid Overdose Prevention Programs Providing Naloxone to Laypersons — United States, 2014". www.cdc.gov. Retrieved 9 March 2017.
- ^ Childs R (July 2015). "Law enforcement and naloxone utilization in the United States" (PDF). U.S. Food and Drug Administration (FDA). North Carolina Harm Reduction Coalition. pp. 1–24. Retrieved 2 November 2017.
- ^ "Case studies: Standing orders". NaloxoneInfo.org. Open Society Foundations. Archived from the original on 7 November 2017. Retrieved 2 November 2017.
- ^ Schuckit MA (July 2016). "Treatment of Opioid-Use Disorders". The New England Journal of Medicine. 375 (4): 357–68. doi:10.1056/NEJMra1604339. PMID 27464203.
- ^ 크리스티 C, 베이커 C, 쿠퍼 R, 케네디 CP, 마드라스 B, 본디 FA. 마약 중독과 오피오이드 사태를 막기 위한 대통령 위원회. Washington, D.C., 미국 정부 인쇄국, 2017년 11월; 1.
- ^ "Naloxone Opioid Overdose Reversal Medication". CVS Health. Retrieved 4 February 2019.
- ^ a b Morin, Kristen A; Vojtesek, Frank; Acharya, Shreedhar; Dabous, John R; Marsh, David C (26 October 2021). "Evidence of Increased Age and Sex Standardized Death Rates Among Individuals Who Accessed Opioid Agonist Treatment Before the Era of Synthetic Opioids in Ontario, Canada". Cureus. 13 (10): e19051. doi:10.7759/cureus.19051. PMC 8608679. PMID 34853762.
- ^ Hser, Yih-Ing; Hoffman, Valerie; Grella, Christine E.; Anglin, M. Douglas (May 2001). "A 33-Year Follow-up of Narcotics Addicts". Archives of General Psychiatry. 58 (5): 503–508. doi:10.1001/archpsyc.58.5.503. PMID 11343531.
- ^ Horon, Isabelle L.; Singal, Pooja; Fowler, David R.; Sharfstein, Joshua M. (June 2018). "Standard Death Certificates Versus Enhanced Surveillance to Identify Heroin Overdose–Related Deaths". American Journal of Public Health. 108 (6): 777–781. doi:10.2105/ajph.2018.304385. PMC 5944879. PMID 29672148.
- ^ Research, Center for Drug Evaluation and (2 March 2021). "Abuse-Deterrent Opioid Analgesics". FDA.
- ^ Amato, Laura; Davoli, Marina; Minozzi, Silvia; Ferroni, Eliana; Ali, Robert; Ferri, Marica (28 February 2013). "Methadone at tapered doses for the management of opioid withdrawal". Cochrane Database of Systematic Reviews. 2013 (2): CD003409. doi:10.1002/14651858.CD003409.pub4. PMC 7017622. PMID 23450540.
- ^ MacArthur, Georgina J.; van Velzen, Eva; Palmateer, Norah; Kimber, Jo; Pharris, Anastasia; Hope, Vivian; Taylor, Avril; Roy, Kirsty; Aspinall, Esther; Goldberg, David; Rhodes, Tim; Hedrich, Dagmar; Salminen, Mika; Hickman, Matthew; Hutchinson, Sharon J. (January 2014). "Interventions to prevent HIV and Hepatitis C in people who inject drugs: A review of reviews to assess evidence of effectiveness". International Journal of Drug Policy. 25 (1): 34–52. doi:10.1016/j.drugpo.2013.07.001. PMID 23973009.
- ^ Nielsen, Suzanne; Tse, Wai Chung; Larance, Briony (5 September 2022). Cochrane Drugs and Alcohol Group (ed.). "Opioid agonist treatment for people who are dependent on pharmaceutical opioids". Cochrane Database of Systematic Reviews. 2022 (9): CD011117. doi:10.1002/14651858.CD011117.pub3. PMC 9443668. PMID 36063082.
- ^ "Opioid substitution therapy or treatment (OST)". Migration and Home Affairs. European Commission. 14 March 2017.
- ^ a b c d e f g h i 리처드 P. Mattick et al.: 오피오이드 의존성에 대한 약물요법 국가평가(NEPOD): 결과보고 및 권고
- ^ Whelan, Paul J; Remski, Kimberly (2012). "Buprenorphine vs methadone treatment: A review of evidence in both developed and developing worlds". Journal of Neurosciences in Rural Practice. 3 (1): 45–50. doi:10.4103/0976-3147.91934. PMC 3271614. PMID 22346191.
- ^ Martin, Judith A.; Campbell, Anthony; Killip, Thomas; Kotz, Margaret; Krantz, Mori J.; Kreek, Mary Jeanne; McCarroll, Brian A.; Mehta, Davendra; Payte, J. Thomas; Stimmel, Barry; Taylor, Trusandra; Wilford, Bonnie B. (October 2011). "QT Interval Screening in Methadone Maintenance Treatment: Report of aSAMHSA Expert Panel". Journal of Addictive Diseases. 30 (4): 283–306. doi:10.1080/10550887.2011.610710. PMC 4078896. PMID 22026519.
- ^ https://www.bccsu.ca/wp-content/uploads/2023/11/BC-OUD-Treatment-Guideline_2023-Update.pdf
- ^ "MAT Medications, Counseling, and Related Conditions". www.samhsa.gov. Retrieved 10 November 2022.
- ^ "Methadone". www.samhsa.gov. Retrieved 10 November 2022.
- ^ a b c "Waiver Elimination (MAT Act)".
- ^ a b "Medication-Assisted Treatment (MAT)". www.samhsa.gov. Retrieved 9 November 2022.
- ^ Gowing L, Farrell M, Ali R, White JM (May 2016). "Alpha₂-adrenergic agonists for the management of opioid withdrawal". The Cochrane Database of Systematic Reviews. 2016 (5): CD002024. doi:10.1002/14651858.CD002024.pub5. PMC 7081129. PMID 27140827.
- ^ Michels, Ingo Ilja; Stöver, Heino; Gerlach, Ralf (2 February 2007). "Substitution treatment for opioid addicts in Germany". Harm Reduction Journal. 4 (1): 5. doi:10.1186/1477-7517-4-5. PMC 1797169. PMID 17270059.
- ^ "Many hospital policies create barriers to good management of opioid withdrawal". NIHR Evidence. 16 November 2022. doi:10.3310/nihrevidence_54639. S2CID 253608569.
- ^ Harris, Magdalena; Holland, Adam; Lewer, Dan; Brown, Michael; Eastwood, Niamh; Sutton, Gary; Sansom, Ben; Cruickshank, Gabby; Bradbury, Molly; Guest, Isabelle; Scott, Jenny (14 April 2022). "Barriers to management of opioid withdrawal in hospitals in England: a document analysis of hospital policies on the management of substance dependence". BMC Medicine. 20 (1): 151. doi:10.1186/s12916-022-02351-y. PMC 9007696. PMID 35418095.
- ^ Bonhomme J, Shim RS, Gooden R, Tyus D, Rust G (July 2012). "Opioid addiction and abuse in primary care practice: a comparison of methadone and buprenorphine as treatment options". Journal of the National Medical Association. 104 (7–8): 342–50. doi:10.1016/S0027-9684(15)30175-9. PMC 4039205. PMID 23092049.
- ^ Orman JS, Keating GM (2009). "Buprenorphine/naloxone: a review of its use in the treatment of opioid dependence". Drugs. 69 (5): 577–607. doi:10.2165/00003495-200969050-00006. PMID 19368419. S2CID 209147406.
- ^ "Buprenorphine". www.samhsa.gov. Retrieved 10 November 2022.
- ^ Yokell, Michael A.; Zaller, Nickolas D.; Green, Traci C.; Rich, Josiah D. (1 March 2011). "Buprenorphine and Buprenorphine/Naloxone Diversion, Misuse, and Illicit Use: An International Review". Current Drug Abuse Reviews. 4 (1): 28–41. doi:10.2174/1874473711104010028. PMC 3154701. PMID 21466501.
- ^ "Medications for Opioid Use Disorder – Treatment Improvement Protocol 63". Substance Abuse and Mental Health Services Administration. Retrieved 20 November 2018.[영구적 데드링크]
- ^ "What is Buprenorphine? UAMS Psychiatric Research Institute". psychiatry.uams.edu/. Retrieved 17 November 2022.
- ^ a b c d Koehl, Jennifer L; Zimmerman, David E; Bridgeman, Patrick J (18 July 2019). "Medications for management of opioid use disorder". American Journal of Health-System Pharmacy. 76 (15): 1097–1103. doi:10.1093/ajhp/zxz105. PMID 31361869.
- ^ "Subutex and Suboxone Approved to Treat Opiate Dependence". U.S. Food and Drug Administration (FDA). 8 October 2002. Retrieved 1 November 2014.
- ^ "Sublocade (buprenorphine) FDA Approval History". Drugs.com. Retrieved 10 November 2022.
- ^ "SAMHSA Buprenorphine Quick Start Guide" (PDF).
- ^ Wong, James S. H.; Nikoo, Mohammadali; Westenberg, Jean N.; Suen, Janet G.; Wong, Jennifer Y. C.; Krausz, Reinhard M.; Schütz, Christian G.; Vogel, Marc; Sidhu, Jesse A.; Moe, Jessica; Arishenkoff, Shane; Griesdale, Donald; Mathew, Nickie; Azar, Pouya (December 2021). "Comparing rapid micro-induction and standard induction of buprenorphine/naloxone for treatment of opioid use disorder: protocol for an open-label, parallel-group, superiority, randomized controlled trial". Addiction Science & Clinical Practice. 16 (1): 11. doi:10.1186/s13722-021-00220-2. PMC 7881636. PMID 33579359.
- ^ https://www.uptodate.com/contents/opioid-use-disorder-pharmacologic-management
- ^ https://www.bccsu.ca/about-opioid-addiction-treatment/
- ^ "West Virginia Department of Human Health & Resources_Burea for Medical Services_Methadone" (PDF).
- ^ "Methadone Side Effects: Common, Severe, Long Term". Drugs.com. Retrieved 10 November 2022.
- ^ a b "Vivitrol Prescribing Information" (PDF). Alkermes Inc. July 2013. Archived from the original (PDF) on 10 February 2017. Retrieved 2 November 2017.
- ^ Skolnick P (January 2018). "The Opioid Epidemic: Crisis and Solutions". Annual Review of Pharmacology and Toxicology. 58 (1): 143–159. doi:10.1146/annurev-pharmtox-010617-052534. PMID 28968188.
- ^ Sullivan MA, Garawi F, Bisaga A, Comer SD, Carpenter K, Raby WN, Anen SJ, Brooks AC, Jiang H, Akerele E, Nunes EV (December 2007). "Management of relapse in naltrexone maintenance for heroin dependence". Drug and Alcohol Dependence. 91 (2–3): 289–92. doi:10.1016/j.drugalcdep.2007.06.013. PMC 4153601. PMID 17681716.
- ^ Center for Substance Abuse Treatment (2009). Chapter 4—Oral Naltrexone. Substance Abuse and Mental Health Services Administration (US).
- ^ Dalsbø, TK; Steiro, AK; Hammerstrøm, KT; Smedslund, G (2010). Heroin Maintenance for Persons with Chronic Heroin Dependence (Report). Oslo, Norway: Knowledge Centre for the Health Services at The Norwegian Institute of Public Health. PMID 29320074.
- ^ Ferri M, Davoli M, Perucci CA (December 2011). "Heroin maintenance for chronic heroin-dependent individuals". The Cochrane Database of Systematic Reviews. 2011 (12): CD003410. doi:10.1002/14651858.CD003410.pub4. PMC 7017638. PMID 22161378. S2CID 6772720.
- ^ Rehm J, Gschwend P, Steffen T, Gutzwiller F, Dobler-Mikola A, Uchtenhagen A (October 2001). "Feasibility, safety, and efficacy of injectable heroin prescription for refractory opioid addicts: a follow-up study". Lancet. 358 (9291): 1417–23. doi:10.1016/S0140-6736(01)06529-1. PMID 11705488. S2CID 24542893.
- ^ "Heroin Assisted Treatment Drug Policy Alliance". Archived from the original on 16 March 2016. Retrieved 4 March 2016.
- ^ Robertson JR, Raab GM, Bruce M, McKenzie JS, Storkey HR, Salter A (December 2006). "Addressing the efficacy of dihydrocodeine versus methadone as an alternative maintenance treatment for opiate dependence: A randomized controlled trial". Addiction. 101 (12): 1752–9. doi:10.1111/j.1360-0443.2006.01603.x. PMID 17156174.
- ^ "Dihydrocodeine". Pubchem.
- ^ "Login". online.lexi.com. Retrieved 2 November 2018.
- ^ Carney, Tara; Van Hout, Marie Claire; Norman, Ian; Dada, Siphokazi; Siegfried, Nandi; Parry, Charles Dh (18 February 2020). "Dihydrocodeine for detoxification and maintenance treatment in individuals with opiate use disorders". The Cochrane Database of Systematic Reviews. 2 (2): CD012254. doi:10.1002/14651858.CD012254.pub2. PMC 7027221. PMID 32068247.
- ^ Ferri M, Minozzi S, Bo A, Amato L (June 2013). "Slow-release oral morphine as maintenance therapy for opioid dependence". The Cochrane Database of Systematic Reviews (6): CD009879. doi:10.1002/14651858.CD009879.pub2. PMID 23740540.
- ^ "Bundesamt für Gesundheit – Substitutionsgestützte Behandlung mit Diacetylmorphin (Heroin)". Archived from the original on 13 March 2016.
- ^ Tran, Tran H.; Griffin, Brooke L.; Stone, Rebecca H.; Vest, Kathleen M.; Todd, Timothy J. (2017). "Methadone, Buprenorphine, and Naltrexone for the Treatment of Opioid Use Disorder in Pregnant Women". Pharmacotherapy: The Journal of Human Pharmaoclogy and Drug Therapy. Wiley. 37 (7): 824–839. doi:10.1002/phar.1958. PMID 28543191. S2CID 13772333.
- ^ Zedler, Barbara K.; Mann, Ashley L.; Kim, Mimi M.; Amick, Halle R.; Joyce, Andrew R.; Murrelle, E. Lenn; Jones, Hendrée E. (December 2016). "Buprenorphine compared with methadone to treat pregnant women with opioid use disorder: a systematic review and meta-analysis of safety in the mother, fetus and child". Addiction. 111 (12): 2115–2128. doi:10.1111/add.13462. PMC 5129590. PMID 27223595.
- ^ Kinsella, Michael; Halliday, Lucy O. E.; Shaw, Martin; Capel, Yasmin; Nelson, Scott M.; Kearns, Rachel J. (29 July 2022). "Buprenorphine Compared with Methadone in Pregnancy: A Systematic Review and Meta-Analysis". Substance Use & Misuse. 57 (9): 1400–1416. doi:10.1080/10826084.2022.2083174. PMID 35758300.
- ^ Suarez, Elizabeth A.; Huybrechts, Krista F.; Straub, Loreen; Hernández-Díaz, Sonia; Jones, Hendrée E.; Connery, Hilary S.; Davis, Jonathan M.; Gray, Kathryn J.; Lester, Barry; Terplan, Mishka; Mogun, Helen; Bateman, Brian T. (1 December 2022). "Buprenorphine versus Methadone for Opioid Use Disorder in Pregnancy". New England Journal of Medicine. 387 (22): 2033–2044. doi:10.1056/NEJMoa2203318. PMC 9873239. PMID 36449419.
- ^ Suarez, Elizabeth A.; Huybrechts, Krista F.; Straub, Loreen; Hernández-Díaz, Sonia; Jones, Hendrée E.; Connery, Hilary S.; Davis, Jonathan M.; Gray, Kathryn J.; Lester, Barry; Terplan, Mishka; Mogun, Helen; Bateman, Brian T. (December 2022). "Buprenorphine versus Methadone for Opioid Use Disorder in Pregnancy". New England Journal of Medicine. 387 (22): 2033–2044. doi:10.1056/NEJMoa2203318. PMC 9873239. PMID 36449419.
- ^ Meyer, Marjorie C.; Johnston, Anne M.; Crocker, Abigail M.; Heil, Sarah H. (2015). "Methadone and buprenorphine for opioid dependence during pregnancy: A retrospective cohort study". Journal of Addiction Medicine. 9 (2): 81–86. doi:10.1097/ADM.0000000000000092. PMC 4375023. PMID 25622120.
- ^ a b c d e f Carley, Joseph A; Oesterle, Tyler (3 June 2021). "Therapeutic Approaches to Opioid Use Disorder: What is the Current Standard of Care?". Int J Gen Med. 14: 2305–2311 – via PubMed.
- ^ Dugosh, Karen; Abraham, Amanda; Seymour, Brittany (March–April 2016). "A Systematic Review on the Use of Psychosocial Interventions in Conjunction With Medications for the Treatment of Opioid Addiction". J Addict Med. 10 (2): 93–103 – via PubMed.
- ^ Beck JS (18 August 2011). Cognitive behavior therapy : basics and beyond (Second ed.). New York. pp. 19–20. ISBN 9781609185046. OCLC 698332858.
{{cite book}}: CS1 maint: 위치 누락 게시자(링크) - ^ Huibers MJ, Beurskens AJ, Bleijenberg G, van Schayck CP (July 2007). "Psychosocial interventions by general practitioners". The Cochrane Database of Systematic Reviews. 2007 (3): CD003494. doi:10.1002/14651858.CD003494.pub2. hdl:2066/52984. PMC 7003673. PMID 17636726.
- ^ a b Longo, Dan L.; Schuckit, Marc A. (28 July 2016). "Treatment of Opioid-Use Disorders". New England Journal of Medicine. 375 (4): 357–368. doi:10.1056/NEJMra1604339. PMID 27464203.
- ^ a b c d Carroll, Kathleen M. (August 2005). "Behavioral therapies for drug abuse". Am J Psychiatry. 162 (8): 1452–60 – via PubMed.
- ^ Vasilaki, Eirini I.; Hosier, Steven G.; Cox, W. Miles (May 2006). "The Efficacy of Motivational Interviewing as a Brief Intervention for Excessive Drinking: A Meta-Analytic Review". Alcohol and Alcoholism. 41 (3): 328–335. doi:10.1093/alcalc/agl016. PMID 16547122.
- ^ "Psychosocial interventions for opioid use disorder". UpToDate. Retrieved 2 November 2017.
- ^ Dutra, Lissa (February 2008). "A meta-analytic review of psychosocial interventions for substance use disorders". Am J Psychiatry. 165 (2): 179–187 – via PubMed.
- ^ Melemis SM (September 2015). "Relapse Prevention and the Five Rules of Recovery". The Yale Journal of Biology and Medicine. 88 (3): 325–32. PMC 4553654. PMID 26339217.
- ^ Sussman S (March 2010). "A review of Alcoholics Anonymous/ Narcotics Anonymous programs for teens". Evaluation & the Health Professions. 33 (1): 26–55. doi:10.1177/0163278709356186. PMC 4181564. PMID 20164105.
- ^ "One Pill Can Kill". US Drug Enforcement Administration. Archived from the original on 15 November 2023. Retrieved 15 November 2023.
- ^ "WHO Information sheet on opioid overdose". WHO. Retrieved 6 April 2019.
- ^ a b GBD 2015 Mortality Causes of Death Collaborators (October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1459–1544. doi:10.1016/S0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
- ^ a b GBD 2013 Mortality Causes of Death Collaborators (January 2015). "Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013". Lancet. 385 (9963): 117–71. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ^ a b "Understanding the Opioid Overdose Epidemic". cdc.gov.
- ^ a b c 오피오이드 데이터 분석 및 리소스. 약물 과다복용. CDC 부상 센터입니다. 질병통제예방센터. 그래프는 "상승률" 탭을 클릭합니다. 그래프 아래의 데이터 표를 참조하십시오.
- ^ a b American Society of Addiction Medicine. "Opioid Addiction 2016 Facts and Figures" (PDF).
- ^ Health, United States, 2016: With Chartbook on Long-term Trends in Health (PDF). Hyattsville, MD.: CDC, National Center for Health Statistics. 2017. p. 4.
- ^ Hempstead, Katherine (6 June 2013). "Supply-side response to declining heroin purity: fentanyl overdose episode in New Jersey". Health Economics. 23 (6): 688–705 – via Wiley Online Library.
- ^ a b Ciccarone, Daniel (1 July 2022). "The Rise of Illicit Fentanyls, Stimulants and the Fourth Wave of the Opioid Overdose Crisis". Curr Opin Psychiatry. 34 (4): 344–350 – via HHS Public Access.
- ^ Manchikanti, Laxmaiah; Singh, Vanila Mathur; Staats, Peter S; Trescot, Andrea M; Prunskis, John (March 2022). "Fourth Wave of Opioid (Illicit Drug) Overdose Deaths and Diminishing Access to Prescription Opioids and Interventional Techniques: Cause and Effect". Pain Physician. 25 (2): 97–124 – via Pubmed.
- ^ a b Friedman, J; Shover, CL (December 2023). "Charting the fourth wave: Geographic, temporal, race/ethnicity and demographic trends in polysubstance fentanyl overdose deaths in the United States". Addiction. 118 (12): 2477–2485 – via PubMed.
- ^ a b Digital Communications Division (8 May 2018). "5-Point Strategy To Combat the Opioid Crisis". U.S. Department of Health and Human Services. Retrieved 2 November 2018.
- ^ "Strategy to Combat Opioid, Abuse, Misuse, and Overdose" (PDF). U.S. Department of Health and Human Services. Retrieved 18 November 2018.
- ^ a b "Prescription Opioid Overdose Data". Center for Disease Control and Prevention. Retrieved 12 September 2016.
- ^ a b Paulozzi L (12 April 2012). "Populations at risk for opioid overdose" (PDF). U.S. Food and Drug Administration (FDA). Division of Unintentional Injury Prevention, National Center for Injury Prevention and Control Centers for Disease Control and Prevention. Retrieved 12 September 2016.
- ^ "Opioid Addiction: 2016 Facts and Figures" (PDF). American Society of Addiction Medicine. Retrieved 12 September 2016.
- ^ a b "How Bad is the Opioid Epidemic?". PBS. Retrieved 12 September 2016.
- ^ a b Han B, Polydorou S, Ferris R, Blaum CS, Ross S, McNeely J (10 November 2015). "Demographic Trends of Adults in New York City Opioid Treatment Programs—An Aging Population". Substance Use & Misuse. 50 (13): 1660–7. doi:10.3109/10826084.2015.1027929. PMID 26584180. S2CID 5520930.
- ^ "Facts & Faces of Opioid Addiction: New Insights". MAP Health Management. 2015. Archived from the original on 29 February 2020. Retrieved 12 September 2016.
- ^ "Opioids". Substance Abuse and Mental Health Services Administration. 23 February 2016. Retrieved 12 September 2016.
- ^ DeVencentis P (24 July 2017). "Grandson sold refrigerator for drugs, grandma says". USA Today.
- ^ Peterman, Nicholas J; Palsgaard, Peggy; Vashi, Aksal; Vashi, Tejal; Kaptur, Bradley D; Yeo, Eunhae; Mccauley, Warren (2022). "Demographic and Geospatial Analysis of Buprenorphine and Methadone Prescription Rates". Cureus. 14 (5): e25477. doi:10.7759/cureus.25477. PMC 9246456. PMID 35800815.
- ^ "Use of Telemedicine While Providing Medication Assisted Treatment (MAT)" (PDF). SAMHSA. 15 May 2018. Retrieved 15 May 2018.
- ^ Nunes, EV; Levin, FR; Reilly, MP; El-Bassel, N (March 2021). "Medication treatment for opioid use disorder in the age of COVID-19: Can new regulations modify the opioid cascade?". Journal of Substance Abuse Treatment. 122: 108196. doi:10.1016/j.jsat.2020.108196. PMC 7666540. PMID 33221125.
- ^ "Hochul signs legislation package to combat opioid crisis".
- ^ "NY Decriminalizes Syringe Possession as Part of Overdose Prevention Efforts". 7 October 2021.
- ^ "Products – Vital Statistics Rapid Release – Provisional Drug Overdose Data". 4 November 2021.
- ^ a b Abuse, National Institute on Drug (20 January 2022). "Overdose Death Rates". National Institute on Drug Abuse. Retrieved 10 November 2022.
- ^ a b c d 과다복용 사망률. NIDA(National Institute on Drug Overse).
- ^ Skolnick, P (May 2022). "Treatment of overdose in the synthetic opioid era". Pharmacol Ther. 233 – via Pubmed.
- ^ a b Gomes, Tara (2023). "Trends in Opioid Toxicity–Related Deaths in the US Before and After the Start of the COVID-19 Pandemic, 2011–2021". JAMA Netw Open. 6 (7) – via PubMed.
- ^ "A qualitative assessment of circumstances surrounding drug overdose deaths during early stages of the COVID-19 pandemic". cdc.gov. August 2022.
- ^ Simha, Siddartha; Ahmed, Yusef; Brummett, Chad M (January 2023). "Impact of the COVID-19 pandemic on opioid overdose and other adverse events in the USA and Canada: a systematic review". Reg Anesth Pain Med. 48 (1): 37–43 – via PubMed.
- ^ Jones, Christopher M.; Shoff, Carla (2023). "Fatal Drug Overdoses Among Medicare Beneficiaries Before and During the COVID-19 Pandemic". JAMA Psychiatry. 80 (5): 508–514 – via PubMed.
- ^ Moran, Kara M (29 July 2022). "Changes in Racial/Ethnic Disparities in Opioid-Related Outcomes in Urban Areas during the COVID-19 Pandemic: A Rapid Review of the Literature". Int J Environ Res Public Health. 19 (15) – via PubMed.
- ^ "Prescribing controlled substances via telehealth". 16 October 2023.
- ^ 생물심리학자 제임스 W. 칼라트. 학습에 도전합니다. 81페이지.
- ^ EMEA 2001년 4월 19일 유럽 연합의 Orlaam(Levacetylmethadol)에 대한 판매 허가 중단 권고에 대한 EMEA 공개 성명서
- ^ 미국 FDA 안전 경고: Orlaam(레보메타딜 아세테이트 염산염) 페이지 마지막 업데이트: 2013년 8월 20일 Wayback Machine에서 보관됨 2017년 1월 18일
더보기
- Brown TK, Alper K (2018). "Treatment of opioid use disorder with ibogaine: detoxification and drug use outcomes". The American Journal of Drug and Alcohol Abuse. 44 (1): 24–36. doi:10.1080/00952990.2017.1320802. PMID 28541119. S2CID 4401865.
- Neighbors CJ, Choi S, Healy S, Yerneni R, Sun T, Shapoval L (June 2019). "Age related medication for addiction treatment (MAT) use for opioid use disorder among Medicaid-insured patients in New York". Substance Abuse Treatment, Prevention, and Policy. 14 (1): 28. doi:10.1186/s13011-019-0215-4. PMC 6593566. PMID 31238952.
- Seabra, P., Sequira, A., Filipe, F., Amaral, P., Sim ões, A., & Sequira, R. (2022) 약물 중독 결과: 약물 기반 프로그램의 외래 환자 중증도 지표 국제정신건강과중독 저널, 20(3), 1837– 1853. https://doi.org/10.1007/s11469-021-00485-3
![US yearly deaths from all opioid drugs. Included in this number are opioid analgesics, along with heroin and illicit synthetic opioids.[183]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cb/NIDA_overdose_deaths.png/467px-NIDA_overdose_deaths.png)
![US yearly deaths by drug category.[183]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/84/NIDA_overdose_all.png/501px-NIDA_overdose_all.png)
![US yearly opioid overdose deaths involving prescription opioids. Non-methadone synthetics is a category dominated by illegally acquired fentanyl, and has been excluded.[184]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b3/NIDA_overdose_prescription.png/454px-NIDA_overdose_prescription.png)
![US yearly opioid overdose deaths involving heroin.[184]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/92/NIDA_overdose_heroin.png/439px-NIDA_overdose_heroin.png)
![US yearly opioid overdose deaths involving psychostimulants (primarily methamphetamine).[184]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/78/NIDA_overdose_stimulants.png/451px-NIDA_overdose_stimulants.png)



