옥시모르폰
Oxymorphone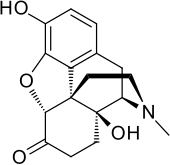 | |
 | |
| 임상 데이터 | |
|---|---|
| 상호 | Numorphan, Numorphone, Opana, 기타 |
| 기타 이름 | 14-히드록시디히드로몰피논 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a610022 |
| 라이선스 데이터 | |
| 루트 행정부. | 구강, 구강, 설하, 비강내, 정맥주사, 경막외, 피하, 근육내, 근육내 |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 바이오 어베이러빌리티 | 구강 : 10% 북칼: 28 % 하위 언어: 37.5% 비강내: 43 %[2] IV, IM 및 IT:[3] 100% |
| 단백질 결합 | 10%[3] |
| 대사 | 간(CYP3A4, 글루쿠론화)[3] |
| 반감기 제거 | 7~9시간[3] 동작시간: 6~8시간 경구, 4~6시간 비경구. |
| 배설물 | 소변, 대변[3] |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 첸블 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.000.873 |
| 화학 및 물리 데이터 | |
| 공식 | C17H19NO4 |
| 몰 질량 | 301.342g/120−1 |
| 3D 모델(JSmol) | |
| |
| |
| (표준) | |
옥시모르폰(누모르판, 오파나 등 상표명으로 판매)은 심한 통증 치료에 사용되는 매우 강력한 오피오이드 진통제입니다.주사 후 통증 완화는 약 5~10분 후에 시작되고, 경구 투여 후 약 30분 후에 시작되며, 즉시 방출되는 알약은 약 3~4시간,[4] 연장 방출 알약은 약 12시간 지속됩니다.옥시몰폰의 반감기는 정맥주사가 훨씬 빠르기 때문에 가장 일반적으로 [5]경구적으로 사용되는 약이다.옥시코돈처럼 옥시코돈도 [6]옥시코돈처럼 오남용 가능성이 높다.
1914년 독일에서 개발되었습니다.그것은 1955년에 특허를 받았고 [7]1959년에 의료용으로 승인되었다.2017년 6월 FDA는 엔도 제약에 미국 시장에서의 [8]제품 철수를 요청했다.이것은 부분적으로 미국에서 오피오이드 유행과 2012년 개혁이 불법 약물 주입을 막지 못했기 때문이다.엔도는 한달 뒤 자발적으로 [9]Opana ER을 시장에서 철수시키는 것으로 대응했다.Amanetal Pharmacuticals에서 제조한 것과 같은 확장판 옥시몰폰의 일반 버전은 [10]미국에서 여전히 구입할 수 있습니다.
의료 용도
Oxymorphone Immediate Release(옥시모르폰 즉시 방출)는 수술 후 급성 [11]통증 치료와 같이 중간 정도에서 심각한 통증을 완화하기 위해 사용됩니다.만성 통증 치료의 경우 임상의는 환자의 치료에 잠재적 위험을 초과하는 유의한 임상적 이점이 있는 경우에만 장기 사용을 고려해야 한다.만성 통증에 대한 첫 번째 치료법은 비약물 [12]및 비오피오이드제입니다.
옥시모르폰 연장 방출 정제는 만성 통증 관리를 위해 처방되며, 이미 장기간 강한 오피오이드를 정기적으로 복용하는 사람들에게만 처방된다.즉시 출시되는 옥시몰폰 태블릿은 출시 연장을 사용하는 사람들에게 획기적인 고통을 주기 위해 권장된다.옥시몰폰은 다른 오피오이드와 비교해도 비슷한 통증 완화 [13]효과가 있다.
미국에서는 ACSCN이 9652인 [14]부칙 II 제어 물질이다.
옥시모르폰 ER 태블릿은 [15]공복에 복용해야 합니다.
유용성
브랜드 및 폼
Oxymorphone은 단일 브랜드 제조업체인 Endo Pharmacuticals에 의해 Opana 및 Opana ER이라는 브랜드 이름으로 판매됩니다.Opana ER은 2017년에 제조사에서 철수하여 미국에서는 [16]사용할 수 없게 되었습니다.단, IR(즉시 릴리스)과 ER(확장 릴리스)의 조합은, 다수의 다른 연구소에서 제공하는 Oxymorphone 및 Oxymorphone ER 의 통칭으로 사용할 수 있습니다.
옥시모르폰은 입원 시 주사제로도 사용할 수 있으며 IV(맥내), IM(근내), SC(피하) 주사에도 사용할 수 있습니다.
약물의 약물역동학을 수정하는 확장 방출(ER) 수정 방출 투여 형태가 일반적으로 사용된다.
경구 투여 형태
옥시모르폰은 다양한 용량으로 제공됩니다.
| IR[17] 태블릿 | ER 12시간 태블릿[17] |
|---|---|
| 5밀리그램 | 5밀리그램 |
| 10밀리그램 | 7.5mg |
| 10밀리그램 | |
| 15 mg | |
| 20밀리그램 | |
| 30밀리그램 | |
| 40밀리그램 |
특수 모집단
이미 기력이 쇠약해진 환자들은 호흡기 우울증에 걸릴 위험이 훨씬 더 높다.이 집단에서는 비오피오이드 진통제가 고려되어야 한다.
고령의 환자는 낙상, 인지장애, 변비 등의 부작용에 훨씬 더 민감하기 때문에 이를 감시해야 한다.노화와 관련된 신장 기능의 감소는 약물의 클리어런스를 감소시켜 치료 기간을 좁히고 과다 복용의 위험을 증가시킨다.옥시몰폰이 절대적으로 나타나면 이 모집단에 대해 더 적은 초기 선량을 시작해야 한다.
임산부가 장시간 부정맥을 복용하면 신생아 금단 증상의 위험이 있습니다.옥시모르폰은 태반을 통과해 선천적 결함, 태아 성장 불량, 사산, 조산 등의 위험을 안고 있다.신체적으로 모순에 의존하는 어머니의 자녀들은 비슷한 의존성의 위험이 더 높다.이러한 심각한 위험 때문에, 이 사람들 사이에서 모순된 전화는 매우 인기가 없다.모유에 부정맥이 전달되는 양은 알려지지 않았으며 여성들은 이 [18]약을 복용하는 동안 모유 수유 전에 위험과 유익성을 따져보도록 주의한다.
부작용
옥시몰폰의 주요 부작용은 다른 오피오이드와 유사하며, 변비, 메스꺼움, 구토, 어지럼증, 구강건조, 졸음이 가장 일반적인 부작용이다.이 약은 다른 오피오이드와 마찬가지로 중독성이 강하며 화학적 의존과 [19]금단현상을 일으킬 수 있다.
과다 복용
다른 오피오이드와 마찬가지로, 옥시몰폰 과다 복용은 호흡기의 우울증, 졸음 또는 혼수상태로 진행되는 것, 골격근의 약화, 차갑고 끈적끈적한 피부, 그리고 때때로 느린 심박수와 저혈압으로 특징지어진다.과다 복용이 심한 경우, 무호흡, 순환기 붕괴, 심장마비, 사망 등이 발생할 [19]수 있습니다.
약리학
약역학
옥시모르폰은 μ-Opioid 수용체(MOR)와 훨씬 적은 범위로 γ-Opioid 수용체(DOR) 및 γ-Opioid 수용체(KOR)[3]에 결합 및 활성화함으로써 그 효과를 도출한다.DOR에서의 활동은 [3]MOR에서의 활동을 증가시킬 수 있다.옥시모르폰은 [20]모르핀보다 10배나 강력합니다.상대 효력 계산 결과, 옥시몰폰 염산염 1mg은 황산 모르핀 9.85mg, 옥시몰폰 염산염 1.02mg은 [21]황산 모르핀 10mg과 동일했다.
| 친화력()Ki | 비율 | ||
|---|---|---|---|
| MOR | DOR | KOR | MOR: DOR:KOR |
| 0.78nM | 50nM | 137 nM | 1:64:176 |
| 컴파운드 | 경로 | 양 |
|---|---|---|
| 코데인 | PO | 200밀리그램 |
| 하이드로코돈 | PO | 20–30 mg |
| Hydromorphone | PO | 7.5mg |
| Hydromorphone | IV | 1.5mg |
| 모르핀 | PO | 30밀리그램 |
| 옥시코 돈 | IV | 20밀리그램 |
| 모르핀 | IV | 10밀리그램 |
| 옥시코 돈 | PO | 20밀리그램 |
| 옥시모르폰 | PO | 7–10 mg |
| 옥시모르폰 | IV | 1mg |
약동학
화학
Oxymorphone 상업적으로 thebaine에서, 아편 양귀비(양귀비)의 사소한 유권자지만 thebaine 더 큰 풍부함(3%)에는 동양의 양귀비(숙근 양귀비)의 뿌리가 발견된다.[3][26]그 mid-1930s의 독일 특허 그리고 acetylmorphone만이 oxymorphone뿐만 아니라 hydromorphone, hydrocodone, oxycodone을 나타낸다 prepared—without 그 필요성에 대해 수소 gas—from 해결책의 코데인., 모르핀, dionine에 의해 refluxing는 산성 수용액 또는 전구 약물이 녹아에서 에탄올에 산화는 금속, n.고운 가루나 콜로이드 형태나 백금흑에 Amely 팔라듐과 백금.
Oxymorphone 염산 미색 가루로 냄새가 없는 하얀 수정 또는 흰색으로 발생한다그것은 색상의 빛에 장시간 노출되는 것과 어둡게 한다.옥시몰폰 염산염 1g은 물 4ml에 녹으며 알코올과 에테르에는 거의 녹지 않습니다.그것은 [19]빛에 닿으면 분해된다.
옥시모르폰은 모르핀, 하이드로모르폰, 그리고 다른 오피오이드와 같이 아세틸화 될 수 있다.옥시몰폰의 모노, 디, 트리, 테트라에스터는 1930년대에 개발되었지만 현재 의학에는 사용되지 않는다.아마도 니코티닐, 벤조일, 포르밀, 신니모일 및 c.와 같은 다른 에스테르를 [citation needed]제조할 수 있다.
2013년 미국 DEA의 연간 제조 쿼터는 환산용 18375kg(많은 약물은 진통제와 나록손과 같은 오피오이드 길항제 모두 옥시몰폰으로 제조 가능)과 [27]최종 제품의 직접 제조용 6875kg이었다.옥시모르폰은 또한 CYP2D6 매개 O-탈메틸화에 [3]의해 형성되는 옥시코돈의 미량 대사물입니다.
역사
옥시모르폰은 [28]1914년 독일에서 처음 개발돼 1955년 [29]엔도제약에 의해 미국에서 특허 취득됐다.그것은 1959년 1월 미국과 다른 나라들에 비슷한 시기에 [3]소개되었다.
사회와 문화
브랜드명
- Numorphan (보충제 및 주입 가능한 솔루션)
- Opana ER(확장 릴리스 태블릿):2017년 6월 링거 [30]남용률로 인한 FDA 제거 요청
- Opana IR(즉시 출시 태블릿)
- 지스카 제약의 방글라데시 O-Morphon.
상표명 누모르판은 옥시코돈 제품의 누코단 이름(또는 그 반대)과 디히드로모르핀 및 파라코딘의 파라모르판/파라모르판(디히드로코데인)과 유사하여 유래되었다.현재 전 세계에서 시판되고 있는 옥시몰폰의 염은 염산염뿐이며, 옥시몰폰 염산염은 0.891의 유리염기 전환율은 0.[19]85이다.
일반적인 알약 마킹은 ATV10/APO, HK10(10mg) 타원형 흰색 및 ATV20/APO, HK20(20mg) 타원형 [citation needed]흰색입니다.
남용
1924년 미국 의회는 1924년 항헤로인법의 또 다른 오피오이드 진통제인 헤로인의 판매, 수입 또는 제조를 금지했다.
지난 30년[when?] 동안 오피오이드 약물 남용은 공공 보건의 문제가 되어왔다.최근[when?] 몇 년 사이 이 문제는 본격적인 전염병으로 발전했고 C형 간염이나 인간면역결핍바이러스(HIV)[31][32]와 같은 질병의 확산을 포함한 여러 가지 다른 공중 보건 문제로 이어지고 있다.
미국에서는 2013년 현재 1년에 한 [33]번 이상 오피오이드 약을 남용하는 사람이 1200만 명 이상이다.2010년에는 16,652명이 아편 과다 복용으로 사망했으며, 2015년에는 33,[34][35]091명으로 증가했다.9월 2013년과 extended-release 장시간 작용하는 opioids을 위한 새로운 FDA라벨링 지침 제조 업체 사용 표시로 고통을 제거하지만, 그것은 온건파에 대해로 opioids 처방 의사들을 제한하지 않았" 아플 만큼 일상을 요구하고 24시간, 장기적인 오피오이드 치료"[36]그 약을 예약하고 요구했다.need" 용법.[33]
2013년 1월, 질병통제예방센터(CDC)는 테네시에서 경구 Opana ER(옥시모르폰)의 정맥주사(IV) 남용과 관련된 질병을 보고했다.이 증후군은 혈전성 혈소판 감소성 자반증(TTP)[37]과 유사했다.초기 치료에는 TTP의 경우 치료용 혈장 교환이 포함되었습니다.TTP와 달리 ADAMTS13 활성이 부족하거나 항ADAMTS13 항체가 발견되지 않았으며, 이는 다른 근본 원인의 혈전성 미세혈관증임을 나타낸다.IV Opana 오남용이 인정될 경우, 치료적 혈장 교환 대신 지원적 [38]치료를 고려할 수 있다.
2015년 1월 인디애나주 [39]남동부 스콧 카운티의 작은 시골 지역에서 처방된 오피오이드 약물의 남용과 관련된 첫 HIV 발병이 인디애나주 보건부(ISDH)에 의해 확인되었다.ISDH는 11명의 사람들이 HIV 양성 판정을 받고 나서 HIV 발병에 대한 조사에 착수했으며, 같은 지역 사회로 거슬러 올라갑니다.이 조사를 시작한 지 3개월 만에 ISDH는 총 135명의 HIV 감염자를 진단했으며 그 수는 여전히 증가하고 있다.이 발병의 원인은 오피오이드 남용자들 간의 주사바늘 공유와 관련이 있으며, 경우에 따라서는 최대 9개의 [32]다른 파트너와 주사바늘을 공유하는 것과 관련이 있다.
2015년 3월 말, 보도에 따르면 인디애나주 오스틴이 주사 가능한 레크리에이션 약물로써 옥시몰폰을 사용함으로써 발생한 HIV의 발생의 중심이었다.이번 사태는 주 정부 [40][41][42]관리들의 긴급 조치가 필요했다.2016년 3월 31일의 NPR 팟캐스트 "embedded" 에피소드는 인디애나주 오스틴의 모순된 전화 남용자들을 방문한 것에 대한 심층적인 기사였다.2016년에는 옥시몰폰 시세가 140달러로 [43]보고되었다.
이 발병에 의한 일반적인 오피오이드는 Endo Pharmacuticals에 의해 제조된 오파나 ER로 확인되었습니다.이 분쇄하기 어려운 제제는 분쇄된 알약을 흡입함으로써 남용될 위험을 줄이기 위해 2012년에 생산되었습니다.그러나 [39]오피오이드 남용자들은 약을 녹이고 주입하는 방법을 찾아냄으로써 이 문제를 회피했다.
이 발병의 정도는 CDC와 FDA 모두의 관심을 끌었다.CDC는 2012년 테네시 주 발병에 혈전성 혈소판 감소성 퍼부라(TTP) 유사 질환의 발생과 2015년 인디애나 주 HIV 발병에 초점을 맞춰 오파나 ER과 관련된 모든 질병 발생에 대한 대규모 조사를 시작했다.FDA는 2012년[44] Opana ER의 개혁에 관한 시판 후 안전성 연구를 개시했으며, 인디애나 주 정부는 2014년부터 [45]2015년까지 인디애나에서 HIV 감염과 옥시몰폰 주사 사용 사이의 연관성을 조사하는 또 다른 연구에 자금을 지원했다.
이러한 연구 결과는 오파나를 분쇄하기 어려운 알약으로 재구성한 것이 오피오이드 남용자들이 비강 경로를 통해 약물을 사용하는 것에서 주사제로 전환했기 때문에 의도치 않게 후천성 혈액 감염의 전염 위험을 증가시켰다는 것을 발견했다.이 유행병은 주사 가능한 헤로인이나 [31][44][45]코카인을 사용할 때 오피오이드를 사용할 때 혈액에 의한 감염에 걸릴 위험성을 증가시켰다.
2017년 6월 공중보건 위기, 오피오이드 유행에 직면한 FDA는 엔도 제약에 "오피오이드 진통제인 염산옥시모르폰 오파나 ER(Opana ER)를 시장에서 제거해 줄 것"을 요청했다.또한 2017년 6월 8일 보도자료에서 FDA가 "남용의 [30]공중 보건 결과로 인해 현재 시판되고 있는 오피오이드 진통제를 판매에서 제거하는" 조치를 취한 것은 이번이 처음이라고 언급했다.엔도인터내셔널은 2017년 7월 6일까지 자발적으로 FDA 퇴출요구에 [46]응했다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Drugs@FDA: FDA Approved Drug Products". www.accessdata.fda.gov. Retrieved 7 November 2017.
- ^ Hussain MA, Aungst BJ (August 1997). "Intranasal absorption of oxymorphone". Journal of Pharmaceutical Sciences. 86 (8): 975–6. doi:10.1021/js960513x. PMID 9269879.
- ^ a b c d e f g h i j Davis MP, Glare PA, Hardy J (2009) [2005]. Opioids in Cancer Pain (2nd ed.). Oxford, UK: Oxford University Press. pp. Chapter 17. ISBN 978-0-19-157532-7.
- ^ Sloan P (August 2008). "Review of oral oxymorphone in the management of pain". Therapeutics and Clinical Risk Management. 4 (4): 777–87. doi:10.2147/tcrm.s1784. PMC 2621383. PMID 19209260.
- ^ Smith HS (2009-04-01). "Clinical Pharmacology of Oxymorphone". Pain Medicine. 10 (suppl_1): S3–S10. doi:10.1111/j.1526-4637.2009.00594.x. ISSN 1526-2375.
- ^ Babalonis S, Lofwall MR, Nuzzo PA, Walsh SL (January 2016). "Pharmacodynamic effects of oral oxymorphone: abuse liability, analgesic profile and direct physiologic effects in humans". Addiction Biology. 21 (1): 146–58. doi:10.1111/adb.12173. PMC 4383736. PMID 25130052.
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 52X. ISBN 9783527607495.
- ^ Wolf LK (2017-06-19). "FDA takes aim at opioid epidemic". Chemical & Engineering News. 95 (25): 8.
- ^ Office of the Commissioner (2019-09-10). "Press Announcements – FDA requests removal of Opana ER for risks related to abuse". www.fda.gov.
- ^ Bernstein L, Merle R (2019-11-27). "Six drug companies subpoenaed in federal opioids probe". The Washington Post. Retrieved 18 April 2020.
- ^ Sloan P (August 2008). "Review of oral oxymorphone in the management of pain". Therapeutics and Clinical Risk Management. 4 (4): 777–87. doi:10.2147/TCRM.S1784. PMC 2621383. PMID 19209260.
- ^ "Guideline for Prescribing Opioids for Chronic Pain" (PDF). CDC. CDC. Retrieved 2 November 2018.
- ^ "Cancer pain management with opioids: Optimizing analgesia". UpToDate. UpToDate.
- ^ "Administration Controlled Substance Code Number". Drug Enforcement Administration US. DEA. Retrieved 2 November 2018.
- ^ "Oxymorphone ER Tablet". ClevelandClinic.org.
{{cite web}}: CS1 maint :url-status (링크) - ^ Barrett J (6 July 2017). "Endo to Pull Opana From the Market Following FDA Request". Pharmacy Times. Retrieved 1 November 2018.
- ^ a b "Oxymorphone IR Package Insert" (PDF). Endo Pharmaceuticals. U.S. Food and Drug Administration. Retrieved 19 November 2018.
- ^ "Login". www.crlonline.com. Retrieved 1 November 2018.
- ^ a b c d Brayfield, A, ed. (30 January 2013). "Oxymorphone Hydrochloride". Martindale: The Complete Drug Reference. Pharmaceutical Press. Retrieved 5 May 2014.
- ^ Prommer E (February 2006). "Oxymorphone: a review". Supportive Care in Cancer. 14 (2): 109–15. doi:10.1007/s00520-005-0917-1. PMID 16317569. S2CID 26359576.
- ^ Nathan, BE; Lyndon, EL (February 1, 1959). "The analgesic equivalence to morphine and relative side action liability of oxymorphone (14-hydroxydihydro morphinone)". Journal of Pharmacology and Experimental Therapeutics. 125 (2): 116–121. PMID 13631610. Retrieved 14 July 2021.
- ^ Corbett AD, Paterson SJ, Kosterlitz HW (1993). "Selectivity of Ligands for Opioid Receptors". Opioids. Handbook of Experimental Pharmacology. Vol. 104 / 1. pp. 645–679. doi:10.1007/978-3-642-77460-7_26. ISBN 978-3-642-77462-1. ISSN 0171-2004.
- ^ King TL, Miller EL (25 October 2010). "Analgesia and Anesthesia". In King TL, Brucker MC (eds.). Pharmacology for Women's Health. Jones & Bartlett Publishers. pp. 332–. ISBN 978-1-4496-1073-9.
- ^ Chestnut DH, Wong CA, Tsen LC, Ngan Kee WD, Beilin Y, Mhyre J (28 February 2014). Chestnut's Obstetric Anesthesia: Principles and Practice E-Book. Elsevier Health Sciences. pp. 611–. ISBN 978-0-323-11374-8.
- ^ Tiziani AP (1 June 2013). Havard's Nursing Guide to Drugs. Elsevier Health Sciences. pp. 933–. ISBN 978-0-7295-8162-2.
- ^ Corrigan D, Martyn EM (May 1981). "The thebaine content of ornamental poppies belonging to the papaver section oxytona". Planta Medica. 42 (1): 45–9. doi:10.1055/s-2007-971544. PMID 17401879.
- ^ "2013 – Proposed Adjustments to the Aggregate Production Quotas for Schedule I and II Controlled Substances and Assessment of Annual Needs for the List I Chemicals Ephedrine, Pseudoephedrine, and Phenylpropanolamine for 2013". www.deadiversion.usdoj.gov.
- ^ Sinatra R (2010). The Essence of Analgesia and Analgesics. MA, USA: Cambridge University Press; 1 edition. p. 123. ISBN 978-0521144506.
- ^ 미국 특허 2806033, Leweustein MJ, "모르핀 유도체", 1955-03-08 발행, 1957-10-09
- ^ a b "FDA requests removal of Opana ER for risks related to abuse" (Press release). Silver Spring, Maryland. U.S. Food and Drug Administration. June 8, 2017. Retrieved 26 October 2017.
Today, the U.S. Food and Drug Administration requested that Endo Pharmaceuticals remove its opioid pain medication, reformulated Opana ER (oxymorphone hydrochloride), from the market... This is the first time the agency has taken steps to remove a currently marketed opioid pain medication from sale due to the public health consequences of abuse...[FDA Commissioner Scott Gottlieb, M.D.]: "We are facing an opioid epidemic – a public health crisis, and we must take all necessary steps to reduce the scope of opioid misuse and abuse.
- ^ a b Raymond D (2015-03-02). "Injecting Opana: Indiana's HIV Outbreak and America's Opioid Epidemic". Medium. Retrieved 2 November 2018.
- ^ a b Dreisbach T (16 March 2017). "Dangers Of Opana Opioid Painkiller Outweigh Benefits, FDA Panel Says". NPR.org. Retrieved 2 November 2018.
- ^ a b Girioin L, Haely M (11 September 2013). "FDA to require stricter labeling for pain drugs". Los Angeles Times. pp. A1 and A9.
- ^ "Drug Overdose in the United States: Fact Sheet". Centers for Disease Control. Retrieved 12 September 2013.
- ^ Rudd RA, Seth P, David F, Scholl L (December 2016). "Increases in Drug and Opioid-Involved Overdose Deaths - United States, 2010-2015". MMWR. Morbidity and Mortality Weekly Report. 65 (50–51): 1445–1452. doi:10.15585/mmwr.mm655051e1. PMID 28033313.
- ^ "ER/LA Opioid Class Labeling Changes and Postmarket Requirements" (PDF). FDA. Retrieved 12 September 2013.
- ^ Marder E, Kirschke D, Robbins D, Dunn J, Jones TF, Racoosin J, Paulozzi L, Chang A (January 2013). "Thrombotic thrombocytopenic purpura (TTP)-like illness associated with intravenous Opana ER abuse--Tennessee, 2012". MMWR. Morbidity and Mortality Weekly Report. 62 (1): 1–4. PMC 4604918. PMID 23302815.
- ^ Miller PJ, Farland AM, Knovich MA, Batt KM, Owen J (July 2014). "Successful treatment of intravenously abused oral Opana ER-induced thrombotic microangiopathy without plasma exchange". American Journal of Hematology. 89 (7): 695–7. doi:10.1002/ajh.23720. PMID 24668845. S2CID 27414213.
- ^ a b "Community Outbreak of HIV Infection Linked to Injection Drug Use of Oxymorphone — Indiana, 2015". www.cdc.gov. Retrieved 2 November 2018.
- ^ Paquette D (30 March 2015). "How an HIV outbreak hit rural Indiana — and why we should be paying attention". Washington Post. Retrieved 1 April 2015.
- ^ Conrad C, Bradley HM, Broz D, Buddha S, Chapman EL, Galang RR, et al. (Centers for Disease Control Prevention (CDC)) (May 2015). "Community Outbreak of HIV Infection Linked to Injection Drug Use of Oxymorphone--Indiana, 2015". MMWR. Morbidity and Mortality Weekly Report. 64 (16): 443–4. PMC 4584812. PMID 25928470.
- ^ Strathdee SA, Beyrer C (July 2015). "Threading the Needle--How to Stop the HIV Outbreak in Rural Indiana". The New England Journal of Medicine. 373 (5): 397–9. doi:10.1056/NEJMp1507252. PMID 26106947.
- ^ McEvers K (2016-03-31). "Embedded". NPR.org.
- ^ a b Staffa J (13 March 2017). "Postmarketing Safety Issues Related to Reformulated Opana ER" (PDF). Joint Meeting of the Drug Safety and Risk Management (DSaRM) Advisory Committee and the Anesthetic and Analgesic Drug Products Advisory Committee (AADPAC) Meeting. United States: US Food and Drug Administration, Surveillance and Epidemiology.
- ^ a b Peters PJ, Pontones P, Hoover KW, Patel MR, Galang RR, Shields J, et al. (July 2016). "HIV Infection Linked to Injection Use of Oxymorphone in Indiana, 2014-2015". The New England Journal of Medicine. 375 (3): 229–39. doi:10.1056/nejmoa1515195. PMID 27468059.
- ^ Palmer E (July 6, 2017). "Endo caves to FDA pressure, will pull Opana ER from the market". Fierce Pharma. Retrieved 26 October 2017.
![]() Wikimedia Commons 옥시모르폰 관련 매체
Wikimedia Commons 옥시모르폰 관련 매체


