세포접착
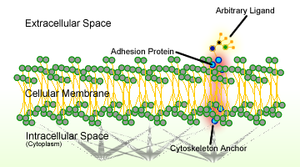
Cell adhesion세포 유착은 세포 표면의 특수 분자를 통해 세포가 상호작용하고 인접 세포에 부착하는 과정이다. 이 과정은 세포 결합과 같은 세포 표면 간의 직접 접촉이나 간접적 상호작용을 통해 발생할 수 있는데, 세포가 세포에 의해 방출된 분자를 사이의 공간으로 포함하는 젤 같은 구조인 주변 세포외 매트릭스에 세포가 부착된다.[1] 세포 접착은 세포 표면에 위치한 투과성 단백질인 세포 부착 분자(CAMs) 사이의 상호작용에서 발생한다.[2] 세포 접착은 다른 방식으로 세포들을 연결하며, 세포가 주변의 변화를 감지하고 반응하는 신호 전도에 관여할 수 있다.[1][3] 세포 유착에 의해 규제되는 다른 세포 과정에는 세포 이동과 다세포 유기체에서의 조직 개발이 포함된다.[4] 세포 유착의 변화는 중요한 세포 과정을 방해할 수 있고 암과[5][6] 관절염을 포함한 다양한 질병으로 이어질 수 있다.[7] 또한 박테리아나 바이러스 같은 전염성 유기체가 질병을 일으키기 위해서는 세포 유착이 필수적이다.[8][9]
일반 메커니즘
CAM은 통합형, 면역글로불린(Ig) 슈퍼 패밀리, 캐더린, 셀렉틴 등 4대 패밀리로 분류된다.[2] 캐더린과 IgSF는 다른 셀의 동일한 유형의 CAM에 직접 바인딩되기 때문에 동음이의성 CAM인 반면, 통합과 셀렉틴은 서로 다른 유형의 CAM에 바인딩되는 이질성 CAM이다.[2][citation needed] 이러한 접착 분자는 각각 다른 기능을 가지고 있으며 서로 다른 리간드를 인식한다. 세포 접착의 결함은 대개 CAM의 발현 결함에 기인한다.
다세포 유기체에서, CAM들 사이의 결합은 세포가 서로 달라붙게 하고 세포 접합이라고 불리는 구조를 만들어낸다. 이들의 기능에 따라 세포 접합부는 다음과 같이 분류할 수 있다.[1]
- 세포를 함께 유지하고 세포 간의 접촉을 강화하는 결합물(어드벤렌즈 결합물, 데스모솜, 헤미데스모솜)을 고정시킨다.
- 세포-세포 접촉을 통해 세포 사이의 간격을 봉합하는 결합(긴장 접합)을 막음으로써 확산에 대한 불침투적 장벽을 만든다.
- 인접 세포의 세포질을 연결시켜 세포간 분자 이송을 가능하게 하는 채널 형성 결합(갭 결합)
- 신경계의 시냅스가 될 수 있는 신호 전달 접합
또는 셀과 상호작용하는 것에 따라 두 가지 주요 유형으로 분류할 수 있다. 셀-셀 접합은 주로 캐더린에 의해 매개되며, 셀-매트릭스 접합은 주로 통합에 의해 매개된다.
세포-세포 접합
세포-세포 접합은 다른 형태로 발생할 수 있다. 아델렌 접합부와 데스모솜과 같은 세포 사이의 결합을 고정하는 데 있어, 존재하는 주요 CAM은 캐더린이다. 이 CAM 계열은 세포외 영역을 통해 세포-세포 유착을 중재하는 막 단백질로, 세포외2+ Ca 이온이 제대로 기능해야 한다.[2] 캐더린은 그들 사이에 동음이의 결합을 형성하는데, 이것은 유사한 유형의 세포가 서로 붙어 선택적 세포 유착으로 이어질 수 있어 척추동물 세포가 조직화된 조직으로 조립할 수 있게 한다.[1] 캐더린은 다세포 동물에서 세포-세포 접착과 세포 신호 전달에 필수적이며 클래식 캐더린과 비클래식 캐더린의 두 가지 유형으로 구분할 수 있다.[2]
아델렌즈 접합부
부속물 접합은 주로 조직의 형태를 유지하고 세포를 함께 고정하는 기능을 한다. 인접 세포 사이의 캐더린은 세포외 영역을 통해 상호작용하는데, 세포외 영역에서 칼슘에 민감한 보존 영역을 공유한다. 이 영역이 Ca2+ 이온과 접촉할 때, 캐더린의 세포외 영역은 동음이의 결합을 수행하기 위해 비활성 유연한 순응에서 보다 엄격한 순응으로 순응 변화를 겪는다. 캐더린의 세포내 영역도 카테닌이라는 단백질과 결합해 카테닌-카데린 콤플렉스를 형성하는 등 보존성이 높다. 이 단백질 복합체는 캐더린을 액틴 필라멘트와 연결시킨다. 액틴 필라멘트와의 이 연관성은 세포-세포 접착을 안정화시키기 위해 부속 결합에 필수적이다.[10][11][12] 액틴 필라멘트와의 상호작용은 또한 부속물 접합부의 조립에 관여하는 캐더린의 군집화를 촉진할 수 있다. 이것은 캐더린 클러스터가 액틴 필라멘트 폴리머화를 촉진하기 때문에, 그것은 다시 연결점에서 형성되는 캐더린-카테닌 콤플렉스에 결합함으로써 아드레날린 접합부의 조립을 촉진한다.[citation needed]
데스모솜
데스모솜은 구조적으로 부속물 접합부와 유사하지만 다른 성분으로 구성된다. 클래식 캐더린 대신 데스모글린, 데스모콜린 등 비클래식 캐더린은 접착분자 역할을 하며 액틴 필라멘트 대신 중간 필라멘트와 연동된다.[13] 데스모좀 캐더린의 세포 내 영역은 데스모좀에서 두꺼운 세포질 플라크를 형성하고 캐더린을 중간 필라멘트에 연결하는 데스모좀 플라그 단백질과 상호작용하기 때문에 데스모솜에는 카테닌이 존재하지 않는다.[14] 데스모솜은 유연하지만 탄력적인 중간 필라멘트 위에 힘을 내림으로써 기계적 스트레스에 대한 강도와 저항성을 제공하는데, 이것은 단단한 액틴 필라멘트로는 일어날 수 없는 것이다.[13] 이것은 데스모솜을 심장 근육과 상피와 같이 높은 수준의 기계적 스트레스를 받는 조직에서 중요하게 만들고, 왜 이런 종류의 조직에서 데스모솜이 자주 나타나는지를 설명한다.
촘촘한 접합부
촘촘한 접합은 일반적으로 상피조직과 내피조직에 존재하는데, 이 조직에서는 간격을 봉합하고 장벽으로 기능하는 조직에서 용액과 세포외 액체의 피세포수송을 조절한다.[15] 촘촘한 접합은 클라우딘, 오크루딘, 트리셀룰린을 포함한 투과성 단백질에 의해 형성되며, 동음이의 방식으로 인접한 막에서 서로 밀접하게 결합한다.[1] 이 촘촘한 접합단백질의 세포내 영역은 고정접합의 구조를 유지하기 위해 이들 단백질을 군집화시키고 이를 액틴 필라멘트로 연결하는 비계단백질로 묶여 있다.[16] 촘촘한 접합부의 형성에 필수적인 클라우딘은 엄격한 접합부를 가로질러 특정 이온을 선택적으로 통과시켜 장벽이 선택적으로 침투할 수 있도록 하는 파라셀룰라 모공을 형성한다.[15]
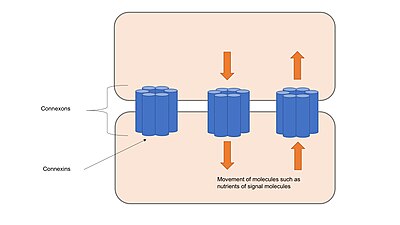
갭 결합
갭 결합은 코넥슨이라고 불리는 채널로 구성되어 있으며, 코넥신이라 불리는 트랜스메브레인 단백질로 구성되어 있다.[17] 인접한 셀의 커넥넥슨은 서로 접촉하고 정렬할 때 연속적인 채널을 형성한다. 이 채널들은 세포를 함께 고정하는 것 외에, 두 개의 인접한 세포의 세포질 사이에서 이온과 작은 분자의 이동을 가능하게 하며, 고정 결합물이나 팽팽한 결합물처럼 구조적 안정성을 제공한다.[1] 갭 접속 채널은 어떤 커넥터가 커넥션을 형성하느냐에 따라 특정 이온에 선택적으로 투과할 수 있으며, 이는 신호 전달 캐스케이드에 관여하는 분자의 전달을 조절함으로써 갭 접합을 세포 신호 전달에 관여할 수 있게 한다.[18] 채널은 많은 다른 자극에 반응할 수 있으며 전압 게이트와 같은 급속한 메커니즘 또는 갭 접점에 존재하는 채널의 수를 변경하는 것과 같은 느린 메커니즘에 의해 동적으로 조절된다.[17]
선택기에 의해 매개되는 접착
셀렉틴은 순환계에서 발생하는 과도 세포-세포 접착에 관련된 특수 CAM 제품군이다. 이들은 주로 백혈구가 내피세포에서 '롤링(roll)'할 수 있도록 해 혈류 내 백혈구(류세포)의 움직임을 가역적 결합을 통해 중재한다.[19] 셀렉틴은 세포외 영역이 다른 셀렉틴 대신 인접 세포의 탄수화물에 결합하는 한편, 캐더린과 마찬가지로 기능하기 위해 Ca2+ 이온을 필요로 하기 때문에 이단성 결합을 겪는다.[1] 백혈구가 내피세포에 대한 백혈구의 세포-세포 접착은 이 메커니즘을 통해 감염 또는 부상 부위로 이동할 수 있기 때문에 면역 반응에 중요하다.[20] 이들 현장에서는 굴러다니는 백혈구의 통합체가 활성화되어 국소 내피세포와 단단히 결합되어 백혈구가 이동을 멈추고 내피 장벽을 통과할 수 있다.[20]
면역글로불린 슈퍼 패밀리의 구성원에 의해 매개되는 접착력
면역글로불린 슈퍼패밀리(IgSF)는 체내에서 가장 큰 단백질의 슈퍼패밀리 중 하나로 다양한 기능에 관여하는 다양한 CAM을 포함하고 있다. 이러한 투과성 단백질은 세포외 영역에 하나 이상의 면역글로불린과 유사한 영역을 가지고 있으며 인접 세포에 리간드로 칼슘 독립 결합을 거친다.[21] 신경세포 접착분자(NCAMs)와 같은 일부 IgSF CAM은 균질 결합을 수행할 수 있고, ICAM(ICAMs)이나 혈관 세포 접착분자(VCAMs)와 같은 일부 IgSF CAM은 탄수화물이나 적분자와 같은 분자와 이질 결합을 할 수 있다.[22] ICAM과 VCAM은 모두 혈관 내피 세포에 표현되며 백혈구 부착과 내피 장벽을 통한 백혈구 이동을 돕기 위해 백혈구의 통합체와 상호작용한다.[22]
셀-매트릭스 접합
세포는 분자를 주변 세포외 공간으로 방출함으로써 세포외 기질을 만들어낸다. 세포는 세포외 기질 내의 분자와 결합하여 세포내 세포핵골격과 연결시키는 특정 CAM을 가지고 있다.[1] 세포외 매트릭스는 세포를 조직으로 조직화할 때 보조 역할을 할 수 있으며, CAM에 결합할 때 세포내 경로를 활성화하여 세포 신호 전달에도 관여할 수 있다.[2] 세포-매트릭스 결합은 주로 통합에 의해 매개되며, 또한 캐더린과 같은 클러스터로 단단한 접착을 형성한다. 통합은 서로 다른 도메인 구조를 가진 하위 유니트와 서로 다른 α 및 β 하위 유니트에 의해 형성된 투과성 헤테로디메이터다.[23] 통합은 양방향으로 신호를 보낼 수 있다: 내부 신호 전달, 세포 내 영역을 수정하는 세포 내 신호, 리간드에 대한 통합의 친화력을 조절할 수 있으며, 세포 외 영역에 바인딩되는 세포외 신호는 통합의 일치적 변화를 유도하고 신호 캐스케이드를 시작할 수 있다.[23] 세포외 통합 영역은 이질 결합을 통해 서로 다른 리간드에 결합할 수 있는 반면 세포 내 영역은 중간 필라멘트, 헤미데스모솜 형성 또는 초점 유착을 형성하는 액틴 필라멘트에 연결될 수 있다.[24]
헤미데스모솜
헤미데스모솜에서 통합체는 상피세포가 분비하는 세포외 기질인 기저 라미나에서 라미네인이라고 불리는 세포외 기질 단백질에 부착된다.[1] Integins는 세포외 매트릭스를 케라틴 중간 필라멘트에 연결하는데, 케라틴은 플렉틴과 BP230과 같은 어댑터 단백질을 통해 세포 내 통합 영역과 상호작용한다.[25] 헤미데스모솜은 상피세포가 세포외 기질을 통해 간접적으로 서로 고정시켜 구조 안정성을 유지하는 데 중요하다.
초점 접착제
초점 접착에서 통합체는 세포외 매트릭스의 성분인 피브로넥틴을 부착하여 세포 내 필라멘트를 작용시킨다.[24] 탈린, 빈쿨린, α-액티닌, 필라비타민과 같은 어댑터 단백질은 세포 내 통합 영역에서 복합체를 형성하고 액틴 필라멘트에 결합한다.[26] 통합과 액틴 필라멘트를 연결하는 이 다단백질 복합체는 세포 성장과 세포 운동성의 신호 역할을 하는 신호 전달 복합체의 조립에 중요하다.[26]
기타생물
에우카리오테스
식물 세포는 서로 밀착되어 식물 세포벽을 가로지르고 인접한 식물 세포의 세포질들을 연결하는 통로인 플라스모드마타를 통해 연결된다.[27] 성장에 필요한 영양소나 신호 중 하나인 분자는 식물 세포 사이에서 플라스모드마타를 통해 수동적이거나 선택적으로 운반된다.[27]
원생동물은 숙주세포 표면에 위치한 탄수화물에 서로 다른 특수성으로 여러 개의 접착 분자를 표현한다.[28] 세포-세포 접착은 병원성 원생동물이 숙주세포에 들어가 붙는 데 핵심이다. 병원성 원생대의 한 예가 말라리아 기생충(플라스모듐팔찌파룸)인데, 이 기생충은 원생동물의 단백질이라고 하는 하나의 접착 분자를 사용하여 간세포와 결합하고,[29] 또 다른 접착 분자는 메로동물의 표면 단백질로 불리는 적혈구를 결합하는 것이다.[30]
병원성 곰팡이는 세포벽에 존재하는 접착분자를 사용하여 단백질-단백질 또는 단백질-탄수화물 상호작용을 통해 세포나[31] 섬유소 매트릭스에 세포나 섬유소를 수용한다.[32]
원핵생물
프로카리오테는 세포 표면에 박테리아 접착제라고 불리는 접착 분자를 가지고 있는데, 세포 접착을 위해 섬유(핌브리애)와 플라겔라를 사용하는 것 외에 세포 표면에는 박테리아 접착제라고 불린다.[8] 접착제는 숙주 세포 표면에 존재하는 다양한 리간드와 세포외 매트릭스의 구성품을 인식할 수 있다. 또한 이 분자들은 숙주의 특이성을 통제하고 그들의 리간드와의 상호작용을 통해 열대성(현안 또는 세포 고유의 상호작용)을 조절한다.[33]
바이러스
바이러스는 또한 숙주 세포에 대한 바이러스 결합에 필요한 접착 분자를 가지고 있다. 예를 들어, 인플루엔자 바이러스는 그 표면에 헤마글루틴이 있는데, 이는 숙주 세포 표면 분자의 설탕 시알산을 인식하는 데 필요하다.[34] HIV에는 리간드 CD4에 결합하는 gp120이라는 접착 분자가 있는데, 이 분자는 림프구에 표현된다.[35] 바이러스는 또한 숙주세포에 침투하기 위해 세포접합물의 성분을 대상으로 할 수 있는데, 이것은 C형 간염 바이러스가 간세포에 들어가기 위해 촘촘한 결합에 있는 오크러딘과 클라우딘을 대상으로 할 때 발생한다.[9]
임상적 시사점
세포 유착의 기능장애는 암 전이 중에 발생한다. 전이성 종양 세포에서 세포-세포 접착력의 상실을 통해 그들은 그들의 원산지를 벗어나 순환계를 통해 확산될 수 있다.[5] 암에서 규제되지 않는 CAM의 한 예로는 유전자 돌연변이나 다른 인공 신호 분자에 의해 비활성화된 캐더린으로 암세포가 이주하고 더 침습적일 수 있다.[6] 셀렉틴과 통합과 같은 다른 CAM은 다른 먼 조직의 내피세포와 순환계의 전이 종양 세포 사이의 세포-세포 상호작용을 중재하여 전이를 촉진할 수 있다.[36] CAMs와 암 전이 사이의 연관성 때문에, 이 분자들은 암 치료의 잠재적인 치료 대상이 될 수 있다.
또한 특정한 접착 분자를 표현하지 못해 생기는 다른 인간 유전병도 있다. 대표적인 것이 백혈구 접착 결핍증-I(LAD-I)인데, 여기서 β2 integrintin 서브유닛의 발현이 감소하거나 상실된다.[37] 이로 인해 백혈구가 감염과 싸우기 위해 염증 현장의 내피벽에 단단히 부착하는 데 필요한 β2 적분 헤테로디메이터의 발현이 감소하게 된다.[38] LAD-I 환자의 백혈구는 내피세포를 고수할 수 없으며 환자는 생명을 위협할 수 있는 심각한 감염 증상을 보인다.
자가면역질환인 펨피구스(Pemphigus)는 사람 자신의 데스모솜 캐더린을 대상으로 하는 자가면역결핍증(Autoantibides)으로 인해 표피세포가 서로 분리되어 피부에 물집이 생기기도 하기 때문에 세포 유착력 상실에 의한 경우도 있다.[39]
세균, 바이러스, 원생동물 등 병원성 미생물이 숙주세포를 먼저 고수해야 감염이 되고 질병이 발생한다. 접착방지요법은 병원체나 숙주세포에 부착된 접착분자를 표적으로 하여 감염을 예방하는 데 사용할 수 있다.[40] 접착 분자의 생산을 바꾸는 것 외에도 세포 간의 결합을 방지하기 위해 접착 분자에 결합하는 경쟁 억제제도 사용할 수 있어 접착 방지제 역할을 한다.[41]
참고 항목
참조
- ^ a b c d e f g h i Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Morgan, David; Raff, Martin; Roberts, Keith; Walter, Peter (2014). Molecular Biology of the Cell (6th ed.). Garland Science. ISBN 9780815344322.
- ^ a b c d e f Lodish, Harvey; Berk, Arnold; Matsudaira, Paul; Kaiser, Chris A.; Krieger, Monty; Scott, Matthew P.; Zipursky, Lawrence; Darnell, James (2003). Molecular Cell Biology (5th ed.). W.H. Freeman. ISBN 978-0716743668.
- ^ Gumbiner, Barry M. (1996). "Cell Adhesion: The Molecular Basis of Tissue Architecture and Morphogenesis". Cell. 84 (3): 345–357. doi:10.1016/S0092-8674(00)81279-9. PMID 8608588. S2CID 13443584.
- ^ Sumigray, Kaelyn D.; Lechler, Terry (2015). Cell Adhesion in Epidermal Development and Barrier Formation. Current Topics in Developmental Biology. Vol. 112. pp. 383–414. doi:10.1016/bs.ctdb.2014.11.027. ISBN 9780124077584. PMC 4737682. PMID 25733147.
- ^ a b Okegawa, T; Pong, RC; Li, Y; Hsieh, JT (2004). "The role of cell adhesion molecule in cancer progression and its application in cancer therapy". Acta Biochimica Polonica. 51 (2): 445–57. doi:10.18388/abp.2004_3583. PMID 15218541.
- ^ a b Hirohashi, Setsuo; Kanai, Yae (2003). "Cell adhesion system and human cancer morphogenesis". Cancer Science. 94 (7): 575–581. doi:10.1111/j.1349-7006.2003.tb01485.x. PMID 12841864. S2CID 22154824.
- ^ Szekanecz, Zoltan; Koch, Alisa E (2000). "Cell–cell interactions in synovitis: Endothelial cells and immune cell migration". Arthritis Research. 2 (5): 368–373. doi:10.1186/ar114. PMC 130138. PMID 11094450.
- ^ a b Pizarro-Cerdá, Javier; Cossart, Pascale (2006). "Bacterial Adhesion and Entry into Host Cells". Cell. 124 (4): 715–727. doi:10.1016/j.cell.2006.02.012. PMID 16497583. S2CID 5769387.
- ^ a b Mateo, M.; Generous, A.; Sinn, P. L.; Cattaneo, R. (2015). "Connections matter - how viruses use cellcell adhesion components". Journal of Cell Science. 128 (3): 431–439. doi:10.1242/jcs.159400. PMC 4311127. PMID 26046138.
- ^ Meng, W.; Takeichi, M. (2009). "Adherens Junction: Molecular Architecture and Regulation". Cold Spring Harbor Perspectives in Biology. 1 (6): a002899. doi:10.1101/cshperspect.a002899. PMC 2882120. PMID 20457565.
- ^ Nicholl ID, Matsui T, Weiss TM, Stanley CB, Heller WT, Martel A, Farago B, Callaway DJ, Bu Z (Aug 21, 2018). "Alpha-catenin structure and nanoscale dynamics in solution and in complex with F-actin". Biophysical Journal. 115 (4): 642–654. Bibcode:2018BpJ...115..642N. doi:10.1016/j.bpj.2018.07.005. PMC 6104293. PMID 30037495.
- ^ Harris, Tony J. C.; Tepass, Ulrich (2010). "Adherens junctions: from molecules to morphogenesis". Nature Reviews Molecular Cell Biology. 11 (7): 502–514. doi:10.1038/nrm2927. PMID 20571587. S2CID 13638902.
- ^ a b Johnson, J. L.; Najor, N. A.; Green, K. J. (2014). "Desmosomes: Regulators of Cellular Signaling and Adhesion in Epidermal Health and Disease". Cold Spring Harbor Perspectives in Medicine. 4 (11): a015297. doi:10.1101/cshperspect.a015297. PMC 4208714. PMID 25368015.
- ^ Delva, E.; Tucker, D. K.; Kowalczyk, A. P. (2009). "The Desmosome". Cold Spring Harbor Perspectives in Biology. 1 (2): a002543. doi:10.1101/cshperspect.a002543. PMC 2742091. PMID 20066089.
- ^ a b Steed, Emily; Balda, Maria S.; Matter, Karl (2010). "Dynamics and functions of tight junctions". Trends in Cell Biology. 20 (3): 142–149. doi:10.1016/j.tcb.2009.12.002. PMID 20061152.
- ^ Niessen, Carien M. (2007). "Tight Junctions/Adherens Junctions: Basic Structure and Function". Journal of Investigative Dermatology. 127 (11): 2525–2532. doi:10.1038/sj.jid.5700865. PMID 17934504.
- ^ a b Goodenough, D. A.; Paul, D. L. (2009). "Gap Junctions". Cold Spring Harbor Perspectives in Biology. 1 (1): a002576. doi:10.1101/cshperspect.a002576. PMC 2742079. PMID 20066080.
- ^ Meşe, Gülistan; Richard, Gabriele; White, Thomas W. (2007). "Gap Junctions: Basic Structure and Function". Journal of Investigative Dermatology. 127 (11): 2516–2524. doi:10.1038/sj.jid.5700770. PMID 17934503.
- ^ McEver, Rodger P. (2015). "Selectins: initiators of leucocyte adhesion and signalling at the vascular wall". Cardiovascular Research. 107 (3): 331–339. doi:10.1093/cvr/cvv154. PMC 4592324. PMID 25994174.
- ^ a b Barthel, Steven R; Gavino, Jacyln D; Descheny, Leyla; Dimitroff, Charles J (2007). "Targeting selectins and selectin ligands in inflammation and cancer". Expert Opinion on Therapeutic Targets. 11 (11): 1473–1491. doi:10.1517/14728222.11.11.1473. PMC 2559865. PMID 18028011.
- ^ Wong, Chee Wai; Dye, Danielle E.; Coombe, Deirdre R. (2012). "The Role of Immunoglobulin Superfamily Cell Adhesion Molecules in Cancer Metastasis". International Journal of Cell Biology. 2012: 340296. doi:10.1155/2012/340296. PMC 3261479. PMID 22272201.
- ^ a b Aricescu, A Radu; Jones, E Yvonne (2007). "Immunoglobulin superfamily cell adhesion molecules: zippers and signals". Current Opinion in Cell Biology. 19 (5): 543–550. doi:10.1016/j.ceb.2007.09.010. PMID 17935964.
- ^ a b Takada, Yoshikazu; Ye, Xiaojing; Simon, Scott (2007). "The integrins". Genome Biology. 8 (5): 215. doi:10.1186/gb-2007-8-5-215. PMC 1929136. PMID 17543136.
- ^ a b Lodish, Harvey; Berk, Arnold; Zipursky, S Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). Molecular cell biology (4th ed.). W.H. Freeman. ISBN 978-0-7167-3136-8.
- ^ Borradori, Luca; Sonnenberg, Arnoud (1999). "Structure and Function of Hemidesmosomes: More Than Simple Adhesion Complexes". Journal of Investigative Dermatology. 112 (4): 411–418. doi:10.1046/j.1523-1747.1999.00546.x. PMID 10201522.
- ^ a b Critchley, David R (2000). "Focal adhesions – the cytoskeletal connection". Current Opinion in Cell Biology. 12 (1): 133–139. doi:10.1016/S0955-0674(99)00067-8. PMID 10679361.
- ^ a b Cilia, Michelle Lynn; Jackson, David (2004). "Plasmodesmata form and function". Current Opinion in Cell Biology. 16 (5): 500–506. doi:10.1016/j.ceb.2004.08.002. PMID 15363799.
- ^ Singh, Ram Sarup; Walia, Amandeep Kaur; Kanwar, Jagat Rakesh (2016). "Protozoa lectins and their role in host–pathogen interactions". Biotechnology Advances. 34 (5): 1018–1029. doi:10.1016/j.biotechadv.2016.06.002. PMID 27268207.
- ^ Rathore, Dharmendar; Sacci, John B.; de la Vega, Patricia; McCutchan, Thomas F. (2002). "Binding and Invasion of Liver Cells by Sporozoites". Journal of Biological Chemistry. 277 (9): 7092–7098. doi:10.1074/jbc.M106862200. PMID 11751898.
- ^ Kadekoppala, Madhusudan; Holder, Anthony A. (2010). "Merozoite surface proteins of the malaria parasite: The MSP1 complex and the MSP7 family". International Journal for Parasitology. 40 (10): 1155–1161. doi:10.1016/j.ijpara.2010.04.008. PMID 20451527.
- ^ Tronchin, Guy; Pihet, Marc; Lopes-Bezerra, Leila M.; Bouchara, Jean-Philippe (2008). "Adherence mechanisms in human pathogenic fungi". Medical Mycology. 46 (8): 749–772. doi:10.1080/13693780802206435. PMID 18651303.
- ^ Lima, O. C.; Figueiredo, C. C.; Previato, J. O.; Mendonca-Previato, L.; Morandi, V.; Lopes Bezerra, L. M. (2001). "Involvement of Fungal Cell Wall Components in Adhesion of Sporothrix schenckii to Human Fibronectin". Infection and Immunity. 69 (11): 6874–6880. doi:10.1128/IAI.69.11.6874-6880.2001. PMC 100066. PMID 11598061.
- ^ Klemm, Per; Schembri, Mark A. (2000). "Bacterial adhesins: function and structure". International Journal of Medical Microbiology. 290 (1): 27–35. doi:10.1016/S1438-4221(00)80102-2. PMID 11043979.
- ^ Garman, E. F. (2015). "Antiviral adhesion molecular mechanisms for influenza: W. G. Laver's lifetime obsession". Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1661): 20140034. doi:10.1098/rstb.2014.0034. PMC 4275904. PMID 25533092.
- ^ Capon, D J; Ward, R H R (1991). "The CD4-gpl20 Interaction and Aids Pathogenesis". Annual Review of Immunology. 9 (1): 649–678. doi:10.1146/annurev.iy.09.040191.003245. PMID 1910691.
- ^ Bendas, Gerd; Borsig, Lubor (2012). "Cancer Cell Adhesion and Metastasis: Selectins, Integrins, and the Inhibitory Potential of Heparins". International Journal of Cell Biology. 2012: 676731. doi:10.1155/2012/676731. PMC 3296185. PMID 22505933.
- ^ Harris, Estelle S.; Weyrich, Andrew S.; Zimmerman, Guy A. (2012). "Lessons from rare maladies: leukocyte adhesion deficiency syndromes". Current Opinion in Hematology. 20 (1): 16–25. doi:10.1097/MOH.0b013e32835a0091. PMC 3564641. PMID 23207660.
- ^ Hanna, Suhair; Etzioni, Amos (2012). "Leukocyte adhesion deficiencies". Annals of the New York Academy of Sciences. 1250 (1): 50–55. Bibcode:2012NYASA1250...50H. doi:10.1111/j.1749-6632.2011.06389.x. PMID 22276660. S2CID 33727687.
- ^ Tamgadge, Sandhya; Bhatt, DaivatM; Pereira, Treville; Tamgadge, Avinash; Bhalerao, Sudhir (2011). "Pemphigus vulgaris". Contemporary Clinical Dentistry. 2 (2): 134–7. doi:10.4103/0976-237X.83074. PMC 3180831. PMID 21957393.
- ^ Krachler, Anne Marie; Orth, Kim (2014). "Targeting the bacteria–host interface". Virulence. 4 (4): 284–294. doi:10.4161/viru.24606. PMC 3710331. PMID 23799663.
- ^ Ofek, Itzhak; Hasty, David L; Sharon, Nathan (2003). "Anti-adhesion therapy of bacterial diseases: prospects and problems". FEMS Immunology & Medical Microbiology. 38 (3): 181–191. CiteSeerX 10.1.1.320.1480. doi:10.1016/S0928-8244(03)00228-1. PMID 14522453.
외부 링크
| 위키미디어 커먼스는 셀 접착과 관련된 미디어를 보유하고 있다. |
- 더 셀 바이 지 쿠퍼 (온라인 교과서)
- 로디쉬 외 연구진(온라인 교과서)에 의한 분자 세포 생물학
- Alberts 외 (온라인 교과서)에 의한 세포의 분자생물학
- 세포접착과 세포외 매트릭스 - 생화학, 분자생물학, 세포생물학 가상도서관