화학 방정식
Chemical equation화학 방정식은 기호와 화학식의 형태로 화학 반응을 상징적으로 표현하는 것입니다.반응물 개체는 왼쪽에 주어지고 생성물 개체는 오른쪽에 주어지는데, 반응물과 생성물의 개체 사이에 플러스 기호가 붙어 있고, 반응 방향을 나타내기 위해 생성물을 가리키는 화살표가 있습니다.[1]화학식은 기호식, 구조식(그림식 다이어그램) 또는 혼합식일 수 있습니다.개체의 기호와 공식 옆에 있는 계수는 화학양론적 숫자의 절대값입니다.최초의 화학 방정식은 1615년 장 베갱에 의해 도식화되었습니다.[2]
구조.
화학 방정식(아래 예 참조)은 왼쪽의 반응물(시작 물질) 목록, 화살표 기호 및 오른쪽의 생성물(화학 반응에서 형성되는 물질) 목록으로 구성됩니다.각 물질은 화학 공식에 의해 지정되며, 선택적으로 화학양론적 계수라고 불리는 숫자 앞에 나타납니다.[a]이 계수는 해당 물질의 몇 개의 개체(예: 분자)가 분자 단위로 반응에 관여하는지를 지정합니다.명시적으로 작성하지 않은 경우 계수는 1과 같습니다.식의 어느 한 쪽에 있는 여러 물질은 플러스 기호로 서로 분리되어 있습니다.
예를 들어, 염산과 나트륨의 반응에 대한 방정식은 다음과 같이 나타낼 수 있습니다.
- 2HCl + 2Na → 2NaCl + H
공식이 상당히 간단하기 때문에 이 방정식은 "2개의 H-C-L에 2개의 N-A가 2개의 N-A-C-L과 H 2개의 산출물[b]"로 읽을 수 있습니다.또는 일반적으로 복잡한 화학 물질을 포함하는 방정식의 경우 IUPAC 명명법을 사용하여 화학 공식을 읽습니다. 이 명명법은 "염산 분자 2개와 나트륨 원자 2개가 반응하여 염화나트륨과 수소 가스 분자 2개의 공식 단위를 형성합니다."라고 표현할 수 있습니다.
반응형
화살표 기호의 다양한 변형은 반응 유형을 나타내는 데 사용됩니다.[1]
물질의 상태
화학 물질의 물리적 상태를 나타내기 위해, 괄호 안의 기호가 그 화학식에 부가될 수 있습니다: (s) 고체, (l) 액체, (g) 기체, 및 (aq) 수용액.이것은 특히 그 상태나 변화를 강조하고 싶을 때 행해집니다.예를 들어, 수성 염산과 고체 (금속) 나트륨의 반응은 수성 염화 나트륨과 수소 가스를 형성하는 다음과 같이 적습니다.
염화수소 가스가 염산을 반응물로 대체한다면 이 반응은 다른 열역학적 성질과 운동적 성질을 가질 것입니다.
또는 괄호가 없는 화살표는 기체 ↑의 형성을 나타내거나 ↓를 침전시키기 위해 사용되는 경우도 있습니다.이러한 종이 하나만 형성된 경우에 특히 유용합니다.다음은 수소 가스가 형성되는 예입니다.
촉매 및 기타 조건
반응에 에너지가 필요한 경우 화살표 위에 표시됩니다.그리스 문자로 된 대문자 델타(δ) 또는 삼각형(△)을 반응 화살표에 붙여 열 형태의 에너지가 반응에 추가됨을 보여줍니다.h ν라는 표현은 빛의 형태로 에너지를 더하는 기호로 사용됩니다.다른 기호는 다른 특정 유형의 에너지 또는 방사선에 사용됩니다.
마찬가지로, 어떤 특정한 특성을 갖는 특정한 배지가 반응에 필요한 경우, 배지로 사용되는 산 또는 염기의 이름이 화살표의 맨 위에 표시될 수 있습니다.특정한 산이나 염기가 필요하지 않은 경우, 산성 또는 염기의 사용을 나타내는 또 다른 방법은 화살표 상단에+ H 또는 OH−(또는 심지어 "산성" 또는 "염기")를 쓰는 것입니다.온도와 압력의 구체적인 조건, 촉매의 존재 여부 등은 동일한 방식으로 표시될 수 있습니다.
표기 변형

화학 방정식의 표준 표기법은 한 쪽에 모든 반응물, 다른 쪽에 모든 생성물, 그리고 모든 화학양론적 계수를 허용합니다.예를 들어, 메탄올을 디메틸에테르로 탈수시키는 방정식의 일반적인 형태는 다음과 같습니다.
때때로 확장이 사용되는데, 화학양론적 계수를 가진 일부 물질이 화살표 위 또는 아래로 이동하고, 반응물에는 + 기호 또는 없음 기호가 선행되며, 생성물에는 - 기호가 선행됩니다.그러면 같은 방정식이 다음과 같이 나타날 수 있습니다.
이러한 표기법은 방정식의 측면에서 덜 중요한 물질을 숨기고, 가까이에 있는 반응의 유형을 더 명확하게 만들고, 화학 방정식의 연쇄를 용이하게 하는 역할을 합니다.이는 다단계 반응 메커니즘을 설명하는 데 매우 유용합니다.이 경우 화살표 위 또는 아래의 물질은 일반적인 반응물 또는 생성물과 같이 반응에서 소비되거나 생성되기 때문에 촉매가 아닙니다.
반응 메커니즘에 사용되는 또 다른 확장은 일부 물질을 화살표의 가지로 이동시킵니다.두 확장 모두 메커니즘의 예제 그림에 사용됩니다.
아래 예제와 같이 식의 양쪽에서 음의 화학양론적 계수를 사용하는 것은 널리 채택되지 않으며 종종 권장되지 않습니다.[5][better source needed]
화학 방정식의 균형 조정
화학 반응에서 핵 반응이 일어나지 않기 때문에 화학 원소들은 그 반응을 변하지 않고 통과합니다.따라서 화학 방정식의 각 면은 특정 원소(또는 서로 다른 동위 원소가 고려된 경우 핵종)의 원자 수와 동일해야 합니다.전하량 절약법에 따라 전체 전하량에 대해서도 동일하게 적용됩니다.이러한 요건을 준수하는 방정식은 균형이 잡혀 있다고 합니다.
화학 방정식은 화학양론적 계수에 적합한 값을 할당하여 균형을 잡습니다.간단한 방정식은 검사, 즉 시행착오를 통해 균형을 맞출 수 있습니다.또 다른 기술은 선형 방정식 체계를 푸는 것을 포함합니다.
균형 방정식은 일반적으로 가장 작은 자연수 계수로 작성됩니다.그러나 때로는 다른 계수를 단순화하는 경우 분수 계수를 받아들이는 것이 유리할 수도 있습니다.따라서 서론 예는 다음과 같이 다시 작성될 수 있습니다.
어떤 상황에서는 분수계수가 불가피하기도 합니다.예를 들어, 형성의 표준 엔탈피에 해당하는 반응은 단일 생성물의 한 분자가 형성되도록 작성되어야 합니다.이를 위해서는 불화리튬 형성의 경우와 마찬가지로 일부 반응물 계수가 부분적이어야 하는 경우가 많습니다.
검사방법

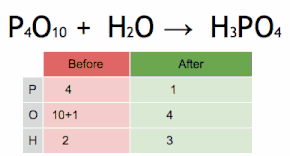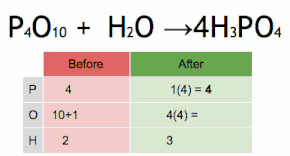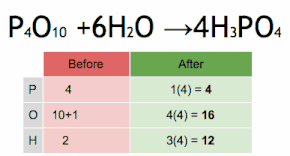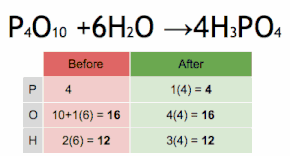
이 화학 방정식은 먼저 HPO에34 4를 곱하여 P 원자의 수와 일치시킨 후 HO에2 6을 곱하여 H와 O 원자의 수를 일치시킴으로써 균형을 이루고 있습니다.
검사방법은 가장 복잡한 물질의 화학양론계수를 1로 설정하고 단계적으로 다른 계수에 값을 할당하여 식의 양변이 원소별로 같은 원자수가 되도록 하는 것으로 요약할 수 있습니다.이 과정에서 분수 계수가 발생하면 모든 계수에 가장 낮은 공통 분모를 곱하여 분수의 존재를 언제든지 제거할 수 있습니다.
- 예
메탄의 완전연소를 위한 화학방정식의 균형화에 관한 연구
다음과 같이 달성됩니다.
- 계수 1은 가장 복잡한 공식(CH4) 앞에 배치됩니다.
- 왼쪽은 탄소 원자가 1개 있어서 CO2 1분자가 균형을 잡게 됩니다.또한 좌측에는 4개의 수소 원자가 존재하며, 2개의2 HO 분자로 균형을 이루게 됩니다.
- 우변의 산소 원자 4개를 O2 분자 2개로 균형을 맞추면 방정식이 나옵니다.
- 1과 같은 계수는 생략됩니다. 명시적으로 지정할 필요는 없기 때문입니다.
- 최종 방정식이 균형을 이루는지 확인하는 것이 현명합니다. 즉, 각 원소에 대해 왼쪽과 오른쪽에 같은 수의 원자가 있습니다. 탄소 1개, 수소 4개, 산소 4개입니다.
일차방정식
각 화학 원소(또는 핵종 또는 변하지 않는 부분 또는 전하) i에 대하여, 그 보존 요건은 수학 방정식으로 표현될 수 있습니다.
어디에
- a는ij (화학 방정식에서 공식 당) 물질 j의 분자에 있는 원소 i의 원자의 수이며,
- s는j 물질 j에 대한 화학양론적 계수입니다.
이것은 수학적 방법을 사용하여 쉽게 해결되는 균일한 선형 방정식 체계를 만듭니다.이러한 시스템은 항상 우리가 관심이 없는 모든 0의 사소한 솔루션을 가지고 있지만, 추가적인 솔루션이 있다면 무한히 많은 솔루션이 있을 것입니다.사소한 것이 아닌 어떤 해라도 화학 방정식의 균형을 맞출 것입니다."선호"해는 최대 공약수가 1인 정수, 대부분 양의[g] 양의 화학양론적 계수를j 갖는 해입니다.
예
앞 절의 화학 방정식의 화학양론적 계수에 변수를 할당하고 해당 선형 방정식을 작성해 보겠습니다.
이 선형 방정식 체계에 대한 모든 해는 다음과 같은 형태이며, 여기서 r은 임의의 실수입니다.
r = 1을 선택하면 선호하는 해결책이 나옵니다.
이는 균형 화학 방정식에 해당합니다.
행렬법
앞 절에서 소개한 선형 방정식 체계는 효율적인 행렬 형식주의를 사용하여 작성될 수도 있습니다.먼저 반응물과 생성물의 화학양론적 계수를j 통일하기 위해 수량을 소개합니다.
다음과 같이 선형 방정식을 단순화하는 화학양론적 수라고 합니다.[h]
여기서 J는 화학 방정식에서 반응물 및 생성물 물질(식)의 총 개수입니다.
합성 행렬의 i행과 j열에 aij 값 배치
- A =
그리고 화학양론적 숫자를 화학양론적 벡터로 배열하는 것.
- ν =
는 방정식 체계를 단일 행렬 방정식으로 표현할 수 있습니다.
- A ν = 0
이전과 마찬가지로, 행렬 방정식을 푸는 임의의 0이 아닌 화학양론 벡터 ν은 화학 방정식의 균형을 맞출 것입니다.
행렬 방정식의 해의 집합은 행렬 A의 커널이라고 불리는 선형 공간입니다.이 공간이 영이 아닌 벡터 ν를 포함하려면, 즉 양의 차원을 가져야 합니다. JN,조성 행렬 A의 N열은 선형 독립적이어서는 안 됩니다.화학 방정식의 균형을 맞추는 문제는 다음을 결정하는 문제가 됩니다.J-조성 행렬의 N차원 커널.주의할 점은 다음과 같습니다.J= N 밸런싱 문제에 대한 독특한 선호 해결책이 있을 것입니다.JN > 1 고객이 선호하는 솔루션은 무한히 많습니다.JN 선형적으로 독립적인 것으로 추정됩니다J= N 0, 사용할 수 없는 사소한 해결책인 영벡터만 있을 것입니다.
한 집합을 신속하게 계산하기 위한 기술이[6][7] 개발되었습니다.JN 결정적이고 균형 문제에 대한 모든 해결책을 산출한다는 점에서 검사 및 대수적 방법보다[citation needed] 우수한 균형 문제에 대한 독립적인 해결책.
- 예
동일한 화학 방정식을 다시 사용하여 해당 행렬 방정식을 작성해 보겠습니다.
이 솔루션의 형태는 다음과 같습니다. 여기서 r은 실수입니다.
r = 1과 처음 두 행의 부호 flip를 선택하면 균형 문제에 대한 바람직한 해결책을 얻을 수 있습니다.
이온 방정식
이온 방정식은 전해질이 해리된 이온으로 쓰여지는 화학 방정식입니다.이온 방정식은 수용액에서 발생하는 단일 및 이중 변위 반응에 사용됩니다.
예를 들어, 다음과 같은 강수 반응에서:
완전한 이온 방정식은 다음과 같습니다.
또는 모든 물리적 상태를 포함한 경우:
이 반응에서 Ca와2+ NO3− 이온은 용액에 남아 있고 반응의 일부가 아닙니다.즉, 이 이온들은 화학 방정식의 반응물과 생성물 쪽 모두에서 동일합니다.이러한 이온은 반응에 참여하지 않기 때문에 구경 이온이라고 불립니다.알짜 이온 방정식은 구경 이온이 제거된 완전한 이온 방정식입니다.[8]진행 반응의 순 이온 방정식은 다음과 같습니다.
또는 균형 잡힌 형태로,
중성화 또는 산/염기 반응에서 알짜 이온 방정식은 일반적으로 다음과 같습니다.
위에 표시된 물 분자 외에도 침전물을 생성하는 몇 가지 산/염기 반응이 있습니다.예를 들면, 수산화바륨과 인산의 반응은 물뿐만 아니라 불용성의 인산바륨을 생성합니다.이 반응에서는 구경 이온이 없기 때문에 알짜 이온 방정식은 완전 이온 방정식과 같습니다.
산과 반응하는 탄산염을 특징으로 하는 이중 변위 반응은 알짜 이온 방정식을 갖습니다.
만약 모든 이온이 "스펙터 이온"이라면 반응이 없었고, 알짜 이온 방정식은 null입니다.
일반적으로, z가j j번째 분자의 기본 전하의 배수라면, 전하 중성은 다음과 같이 쓸 수 있습니다.
여기서 ν는 위에서 설명한 화학양론적 계수입니다.z는j 위에서 설명한 행렬의ij 추가 행으로 포함될[6][7] 수 있으며, 적절하게 균형 잡힌 이온 방정식 또한 다음을 따를 것입니다.
역사
활자설정
메모들
- ^ 화학양론적 수치라고 불리는 관련 수량과 혼동하지 않아야 합니다.
- ^ 합성 효율의 정량화인 수율(화학)과 혼동하지 말 것.
- ^ ⇄ 표기법은 1884년 네덜란드의 화학자 야코부스 헨리쿠스 반트 호프에 의해 제안되었습니다.반 호프는 완료되지 않은 반응을 "제한된 반응"이라고 불렀습니다.그는 다음과 같이 썼습니다.[3]
이제 Pfaundler 씨는 관측된 한계를 두 개의 상반된 반응의 결과로 간주함으로써 이 두 현상에 단일 개념으로 합류했습니다. 예에서 인용된 하나는 천일염[즉, NaCl]과 질산, 그리고 다른 하나는 염산과 질산나트륨으로 이끌었습니다.실험에서 검증하는 이 고려 사항은 제한된 반응의 최종 상태를 특성화하는 데 사용되는 "화학적 평형"이라는 표현을 정당화합니다.이 표현을 다음 기호로 번역할 것을 제안합니다.
- HCl + NO Na ⇄ NOH + Cl Na.
따라서 나는 이 경우 화학 방정식의 = 기호를 기호 ⇄로 대체합니다. 이 기호는 실제로는 동등함만을 표현하는 것이 아니라 반응의 방향을 보여주기도 합니다.이것은 화학 작용이 두 개의 상반된 방향에서 동시에 일어난다는 것을 명확하게 표현합니다.
- ^ ↽- -⇀ {<=>}}라는 표기법은 1902년 Hugh Marshall에 의해 제안되었습니다.
- ^ 삼각형(△)은 원래 불의 화학적 기호였습니다.
- ^ 이 표현은 광자의 에너지인 E = h ν에 대한 플랑크 방정식에서 비롯되었습니다.그리스 문자 ν(nu)는 때때로 실수로 라틴 문자 v(v)로 바뀝니다.
- ^ 음의 화학양론적 계수는 화학 방정식의 잘못된 면에 있는 물질을 의미합니다.
- ^ 동등한 접근법은 화학양론적 계수 s를 화학양론적 수 ν로 대체하는 대신 반응물의 a 기호를 뒤집는 것입니다.
참고문헌
- ^ a b IUPAC, 화학 용어 해설서, 제2판("골드북") (1997).온라인 수정 버전: (2006–) "화학 반응 방정식".doi:10.1351/골드북.C01034
- ^ Crosland, M.P. (1959). "The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black". Annals of Science. 15 (2): 75–90. doi:10.1080/00033795900200088.
- ^ van 't Hoff, J.H. (1884). Études de Dynamique Chemique [Studies of chemical dynamics] (in French). Amsterdam, Netherlands: Frederik Muller & Co. pp. 4–5.
Or M. Pfaundler a relié ces deux phénomênes ... s'accomplit en même temps dans deux sens opposés.
- ^ Marshall, Hugh (1902). "Suggested Modifications of the Sign of Equality for Use in Chemical Notation". Proceedings of the Royal Society of Edinburgh. 24: 85–87. doi:10.1017/S0370164600007720.
- ^ "Why is the minus sign (-) not allowed in reaction equations?". Stack Exchange. 2017-09-20. Answer by Nicolau Saker Neto. Archived from the original on 2021-06-15.
- ^ a b Thorne, Lawrence R. (2010). "An Innovative Approach to Balancing Chemical-Reaction Equations: A Simplified Matrix-Inversion Technique for Determining the Matrix Null Space". Chem. Educator. 15: 304–308. arXiv:1110.4321.
- ^ a b Holmes, Dylan (2015). "The null space's insight into chemical balance". Dylan Holmes. Retrieved Oct 10, 2017.
- ^ James E. Brady; Frederick Senese; Neil D. Jespersen (December 14, 2007). Chemistry: matter and its changes. John Wiley & Sons. ISBN 9780470120941. LCCN 2007033355.









![{\displaystyle {\ce {2CH3OH->[{\overset {}{\ce {-H2O}}}]CH3OCH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9322a7fd3bb1fb28dab61d3c7fa287ab389d3c7)
































