리보솜
Ribosome| 세포생물학 | |
|---|---|
| 동물 세포도 | |
 |
(발견자 조지 팰레이드의 이름을 따서 그리고 그 입상 구조 때문에) 팔레드 과립이라고도 불리는 리보솜은 생물학적 단백질 합성(mRNA 번역)을 수행하는 고분자 기계이다.리보솜은 아미노산을 메신저 RNA(mRNA) 분자의 코돈에 의해 지정된 순서로 결합하여 폴리펩타이드 사슬을 형성합니다.리보솜은 두 가지 주요 성분으로 구성되어 있습니다: 작고 큰 리보솜 서브유닛입니다.각 서브유닛은 하나 이상의 리보솜 RNA(rRNA) 분자와 많은 리보솜 단백질(RPs 또는 r-단백질)[1][2][3]로 구성된다.리보솜과 관련 분자는 번역 기구로도 알려져 있다.
개요
단백질에서 아미노산의 염기서열을 암호화하는 DNA의 염기서열은 전달 RNA 사슬에 전사된다.리보솜은 메신저 RNA에 결합하고 아미노산의 정확한 염기서열을 결정하여 주어진 단백질을 생성하기 위해 그들의 염기서열을 사용한다.아미노산은 리보솜에 들어가 항코돈 스템 루프를 통해 메신저 RNA 사슬에 결합하는 전달 RNA(tRNA) 분자에 의해 선택되어 리보솜으로 운반된다.메신저 RNA의 코드화 트리플렛(코돈) 각각에 대해 정확한 항코돈 일치를 가져야 하며 성장하는 폴리펩타이드 사슬에 포함시키기 위해 올바른 아미노산을 운반해야 하는 고유한 전달 RNA가 있다.일단 단백질이 생성되면, 그것은 접혀서 기능적인 3차원 구조를 만들 수 있다.
리보솜은 RNA와 단백질의 복합체로 이루어져 리보핵단백질 복합체이다.각 리보솜은 서브유닛이라고 불리는 작은(30S)과 큰(50S) 컴포넌트로 구성되어 있으며, 이들은 서로 결합되어 있습니다.
- (30S)는 주로 복호화 기능을 가지며 mRNA에도 결합됩니다.
- (50S)는 주로 촉매 기능을 가지며 아미노아실화 tRNA와 결합되어 있다.
구성 요소에서 단백질의 합성은 시작, 신장, 종료 및 재활용의 4단계로 이루어집니다.모든 mRNA 분자의 시작 코돈은 AUG의 순서를 가진다.정지 코돈은 UAA, UAG 또는 UGA 중 하나입니다. 이러한 코돈을 인식하는 tRNA 분자가 없기 때문에 리보솜은 번역이 [4]완료되었음을 인식합니다.리보솜이 mRNA 분자를 다 읽었을 때, 두 개의 서브유닛은 분리되고 보통 분해되지만 재사용될 수 있습니다.아미노산을 연결하는 촉매 펩티딜전달효소 활성은 리보솜 [5]RNA에 의해 수행되기 때문에 리보솜은 리보자임이다.
리보솜은 종종 거친 소포체를 구성하는 세포 내막과 연관되어 있다.
3도메인 시스템의 박테리아, 고세균 및 진핵생물에서 나온 리보솜은 놀랄 만큼 서로 유사하며, 이는 공통 기원의 증거이다.그들은 크기, 배열, 구조, RNA에 대한 단백질의 비율이 다르다.구조상의 차이는 일부 항생제가 인간 리보솜을 영향을 받지 않고 그대로 두고 리보솜을 억제함으로써 박테리아를 죽일 수 있게 한다.모든 종에서, 하나 이상의 리보솜이 한 번에 하나의 mRNA 사슬을 따라 움직일 수 있으며, 각각은 특정 서열을 읽고 상응하는 단백질 분자를 생성한다.
진핵세포의 미토콘드리아 리보솜은 기능적으로 박테리아의 많은 특징과 유사하며, 이는 [6][7]미토콘드리아의 진화적 기원을 반영한다.
검출
리보솜은 1950년대 중반 루마니아계 미국인 세포생물학자 조지 에밀 팔레드에 의해 전자현미경을 사용하여 밀도가 높은 입자 또는 [8]과립으로 처음 관찰되었다."리보솜"이라는 용어는 1958년 말 과학자 Haguenau에 의해 제안되었습니다.
심포지엄 과정에서 의미상의 어려움이 명백해졌다.일부 참가자들에게 "마이크로솜"은 다른 단백질과 지질 물질에 의해 오염된 극소량의 리보핵단백질 입자를 의미하고, 다른 참가자들에게는, 마이크로솜은 입자에 의해 오염된 단백질과 지질로 구성됩니다."마이크로솜 입자"라는 문구는 적절해 보이지 않고 "마이크로솜 분율의 리보핵단백질 입자"는 너무 어색하다.회의 중에 리보솜이라는 단어가 제안되었는데, 매우 만족스러운 이름과 좋은 소리를 가지고 있습니다.만약 "리보솜"이 35에서 100S 사이즈의 리보핵단백질 입자를 지정하기 위해 채택된다면 현재의 혼란은 없어질 것이다.
--
1974년 리보솜의 [10]발견으로 알버트 클로드, 크리스티앙 드 뒤브, 조지 에밀 팔라드는 노벨 생리의학상을 공동 수상했다.2009년 노벨 화학상은 벤카트라만 라마크리슈난, 토마스 A에게 수여되었다. Steitz와 Ada E. 리보솜의 [11]상세한 구조와 메커니즘을 결정하기 위한 요나스.
구조.
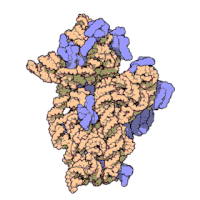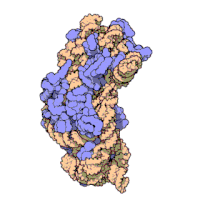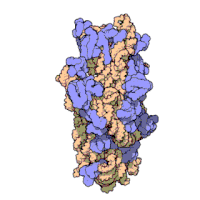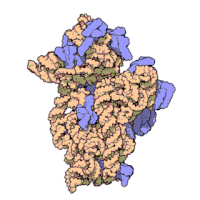
리보솜은 복잡한 세포 기계이다.그것은 리보솜 RNA (rRNA)로 알려진 특화된 RNA와 수십 개의 다른 단백질의 정확한 숫자는 종에 따라 약간 다르다.리보솜 단백질과 rRNA는 일반적으로 리보솜의 크고 작은 서브유닛으로 알려진 서로 다른 크기의 두 개의 서로 다른 리보솜 조각으로 배열됩니다.리보솜은 단백질 합성 중에 mRNA를 폴리펩타이드 사슬(polypptide chain)으로 변환하는 역할을 하는 두 개의 서브유닛(그림 2)으로 구성된다(그림 1).크기가 동일하지 않은 두 개의 서브유닛으로 구성되기 때문에 축이 직경보다 약간 더 깁니다.
원핵생물 리보솜
원핵생물 리보솜은 지름이 약 20 nm(200 200)이고 65 %의 rRNA와 35 %의 리보솜 [12]단백질로 구성되어 있다.진핵생물 리보솜의 지름은 25~30nm(250~300Ω)이며, rRNA 대 단백질 비는 [13]1에 가깝다.결정학 연구는[14] 폴리펩타이드 합성에 대한 반응 부위 근처에 리보솜 단백질이 없다는 것을 보여주었다.이는 리보솜의 단백질 성분이 펩타이드 결합 형성 촉매 작용에 직접 관여하지 않고, 오히려 이러한 단백질이 단백질 합성 능력을 향상시킬 수 있는 골격으로 작용함을 시사한다(참조: 리보솜
원핵생물과 진핵생물의 리보솜 서브유닛은 상당히 [16]유사하다.
리보솜 서브유닛과 rRNA 단편을 설명하는 데 사용되는 측정 단위는 크기가 아닌 원심분리에서의 침강 속도를 측정하는 Svedberg 단위이다.예를 들어 박테리아 70S 리보솜은 50S 및 30S 서브유닛으로 구성되어 있습니다.
원핵생물들은 각각 작은(30S)과 큰(50S) 서브유닛으로 구성된 70S 리보솜을 가지고 있다.예를 들어, 대장균은 21개의 단백질에 결합된 16S RNA 서브유닛(1540개의 뉴클레오티드로 구성됨)을 가지고 있습니다.큰 서브유닛은 5S RNA 서브유닛(120 뉴클레오티드), 23S RNA 서브유닛(2900 뉴클레오티드), 31개의 [16]단백질로 구성됩니다.
대장균(세균)[17]: 962 의 리보솜
리보솜 서브유닛 rRNA r-module(r-particle) 70S 50S 23S(2904 nt) 31 5S(120nt) 30S 16S (1542 nt) 21
대장균 리보솜의 tRNA 결합 부위에 대한 친화력 라벨은 펩티딜전달효소 [5]활성과 가장 연관성이 높은 A 및 P 부위 단백질을 식별할 수 있게 했다. 라벨이 부착된 단백질은 L27, L14, L15, L16, L2이며, 적어도 L27은 E와 같이 공여 부위에 위치한다.콜라츠와 A.P.[18][19] 체르닐롭스키입니다추가 연구는 S1 및 S21 단백질이 16S 리보솜 RNA의 3µ 말단과 관련하여 번역 [20]개시에 관여한다는 것을 보여주었다.
고대 리보솜
고고 리보솜은 50S의 큰 서브유닛과 30S의 작은 서브유닛으로 구성된 70S 리보솜이며 3개의 rRNA 사슬을 포함하는 박테리아 리보솜과 동일한 일반 치수를 공유합니다.하지만 배열 수준에서, 그들은 박테리아보다는 진핵세포에 훨씬 더 가깝다.박테리아와 비교되는 모든 여분의 리보솜 단백질 고균에는 진핵생물적 대응물이 있지만, 고균과 박테리아 [21][22][23]사이에는 그러한 관계가 적용되지 않는다.
진핵생물 리보솜
Eukaryotes 80S 그들의 시토졸에 위치한 작은(40S)과 큰(60S)소단위로 구성되고 있다.그들의 40S 소단윈18S RNA(1900개의 뉴클레오티드)과 33단백질을 가지고 있는 것.[24][25]그 큰 소단위는5S RNA(120개의 뉴클레오티드), 28S RNA(4700개의 뉴클레오티드),5.8S RNA(160개의 뉴클레오티드)서브 유닛들과 49단백질로 구성되어 있다.[16][24][26]
진핵의 시토졸의 리보솜:65(R. 쥐)[17].
리보솜 서브유닛 rRNA r-module(r-particle) 80S 60S 28S(4718 nt) 49 5.8S(160nt) 5S(120nt) 40S 18S(1874 nt) 33
1977년 동안, Czernilofsky는 쥐의 간 리보솜에 tRNA-binding 사이트를 확인할 친화력 라벨링 사용했다 연구를 출간했다.L32/33, L36, L21, L23, L28/29과 L13를 포함하는 여러 단백질, peptidyl 전달 효소나 중도 근처에 있는 것이라고 연루되어 있었다.[27]
플라스토리보솜 및 미토리보솜
eukaryotes안에서, 리보솜 미토콘드리아(때때로 mitoribosomes)와 엽록체(또한 plastoribosomes을 불렀다) 같은 plastids에 존재한다.그들은 또한 크고 작은 서브 유닛들 단백질과 한70S 입자에 함께 묶인로 이루어져 있다.[16]이 리보솜 그 박테리아의 이런 세포 기관은 둘 중에 공생 bacteria[16], 엽록체의. 리보솜에 가까운 세균들보다는mitochrondrial는 사람들로 유래된 것으로 여겨지 비슷하다.마이토크론드리아의 많은 리보솜 RNA 조각은 짧아지고, 5S rRNA의 경우 동물과 [28]곰팡이의 다른 구조로 대체된다.특히, Leishmania tarentolae는 미토콘드리아 [29]rRNA의 최소화된 세트를 가지고 있다.이와는 대조적으로 식물 미토리보솜은 박테리아에 비해 확장된 rRNA와 추가 단백질을 모두 가지고 있으며, 특히 많은 펜타트리코페타이드 반복 [30]단백질을 가지고 있다.
크립토모나드와 클로로크니오피테 조류는 진핵의 [31]흔적을 닮은 핵형질을 포함할 수 있다.진핵생물 80S 리보솜은 [32]핵형질을 포함하는 구획에 존재할 수 있다.
차이의 활용
박테리아와 진핵생물 리보솜의 차이는 감염된 사람의 세포를 해치지 않고 박테리아 감염을 파괴할 수 있는 항생제를 만들기 위해 제약 화학자들에 의해 이용된다.진핵생물인 80S 리보솜은 그렇지 [33]않은 반면, 그들 구조의 차이로 인해 박테리아 70S 리보솜은 이러한 항생제에 취약하다.비록 미토콘드리아가 박테리아와 비슷한 리보솜을 가지고 있지만, 미토콘드리아는 이러한 항생제를 세포에 쉽게 [34]들어가지 않는 이중 막으로 둘러싸여 있기 때문에 이러한 항생제의 영향을 받지 않는다.그러나 주목할 만한 반례로는 세균 50S 및 진핵생물 미토콘드리아 50S [35]리보솜을 성공적으로 억제하는 항종양 항생제 클로람페니콜을 들 수 있다.리보솜 단백질의 항생제 내성이 유전공학의 [36]지표로 도입되는 특성인 엽록체에 대해서도 같은 미토콘드리아를 말할 수 없다.
공통 속성
다양한 리보솜들은 코어 구조를 공유하는데, 이것은 큰 크기 차이에도 불구하고 매우 유사합니다.RNA의 대부분은 다양한 3차 구조 모티브로 고도로 조직되어 있으며, 예를 들어 동축 적층성을 나타내는 의사 노트가 있다.더 큰 리보솜에 있는 여분의 RNA는 여러 개의 길고 연속적인 [37]삽입에 있어서,[16] 그들은 그것을 방해하거나 바꾸지 않고 핵심 구조에서 루프를 형성합니다.리보솜의 모든 촉매 활성은 RNA에 의해 수행되고 단백질은 표면에 상주하며 [16]구조를 안정화시키는 것으로 보입니다.
고해상도 구조

리보솜의 일반적인 분자 구조는 1970년대 초부터 알려져 왔다.2000년대 초, 이 구조는 몇 개의 옹스트롬 정도의 고해상도로 달성되었습니다.
원자 분해능에서 리보솜의 구조를 제공하는 최초의 논문은 2000년 말에 거의 동시에 발표되었다.50S(대형 원핵생물) 서브유닛은 시조류 Haloarcula marismortui와[38] 박테리아 Deinoccus radiodurans에서,[39] 30S 서브유닛의 구조는 Thermus thermophilus에서 [15]결정되었다.이 구조 연구들은 2009년에 노벨 화학상을 받았다.2001년 5월에는 이 좌표를 사용하여 전체 T. 서모필러스 70S 입자를 5.5Ω [40]분해능으로 재구성하였다.
2005년 11월에 대장균 70S 리보솜의 구조에 관한 두 개의 논문이 발표되었습니다.빈 리보솜의 구조는 X선 [41]결정학을 이용하여 3.5Ω 분해능으로 측정되었다.그 후 2주 후, 새롭게 합성된 단백질 가닥을 단백질 전도 채널로 전달하는 과정에서 리보솜을 11~15Ω 분해능으로 묘사하는 극저온전자 현미경법에 기초한 구조가 [42]발표되었다.
tRNA 및 mRNA 분자와 복합된 리보솜의 첫 번째 원자 구조는 2.8Ω과[43] 3.7Ω에서 [44]X선 결정학을 독립적으로 사용하여 해결되었다.이러한 구조를 통해 Thermus thermophilus 리보솜과 mRNA 및 tRNA의 기존 리보솜 부위의 상호작용 세부사항을 볼 수 있다.리보솜과 샤인-달가르노 시퀀스를 포함하는 긴 mRNA의 상호작용은 그 직후 4.5~5.5Ω [45]분해능으로 시각화되었다.
2011년, 효모 사카로미세스 세레비시아에서 진핵생물 80S 리보솜의 첫 번째 완전한 원자 구조가 결정학에 [24]의해 얻어졌다.이 모델은 진핵생물 특이적 요소의 구조와 보편적으로 보존된 핵과의 상호작용을 드러낸다.동시에 Tetrahymena thermophila의 진핵생물 40S 리보솜 구조의 완전한 모델이 발표되었고, 40S 서브유닛의 구조와 번역 개시 [25]시 eIF1과의 상호작용에 대해 많은 것을 기술하였다.마찬가지로 진핵생물 60S 서브유닛 구조도 eIF6와 [26]복합체의 테트라히메나 테르모필라로부터 결정되었다.
.
리보솜은 단백질을 합성하는 기능을 하는 RNA와 관련 단백질로 구성된 미세한 입자입니다.단백질은 손상을 복구하거나 화학적 과정을 지시하는 것과 같은 많은 세포 기능을 위해 필요하다.리보솜은 세포질 내에서 부유하거나 소포체에 부착되어 있는 것을 발견할 수 있다.그들의 주된 기능은 유전자 코드를 아미노산 배열로 변환하고 아미노산 단량체로 단백질 중합체를 만드는 것이다.
리보솜은 펩티딜 전달과 펩티딜 가수분해라고 불리는 두 가지 매우 중요한 생물학적 과정에서 촉매 역할을 합니다. "PT 센터는 단백질 신장 동안 단백질 결합을 생성하는 데 책임이 있습니다."[46]
요약하자면, 리보솜은 메시지를 해독하고 펩타이드 결합을 형성하는 두 가지 주요 기능을 가지고 있다.이 두 가지 기능은 리보솜 서브유닛에 존재합니다.각 서브유닛은 하나 이상의 rRNA와 다수의 r-단백질로 구성된다.작은 서브유닛(세균 및 고세균에서 30S, 진핵생물에서 40S)은 디코딩 기능을 가지며, 큰 서브유닛(세균 및 고세균에서 50S, 진핵생물에서 60S)은 펩타이드 결합 형성을 촉매하며, 이를 펩티딜전달효소 활성이라고 한다.박테리아(및 고고학) 소단위에는 16S rRNA와 21개의 r-단백질(대장균)이 포함되어 있는 반면, 진핵생물 소단위에는 18S r-RNA와 32개의 r-단백질(종마다 수가 다르다.박테리아 대형 서브유닛은 5S, 23S rRNA와 34r-단백질(대장균)을 포함하고, 진핵생물 대형 서브유닛은 5S, 5.8S, 25S/28S rRNA와 46r-단백질(세레비시아, 다시 말해 정확한 숫자는 [47]종마다 다르다)을 포함한다.
★★
리보솜은 단백질 생합성, 즉 mRNA를 단백질로 변환하는 과정이다.mRNA는 리보솜에 의해 복호화되어 단백질을 만드는 일련의 코돈을 포함한다.mRNA를 템플릿으로 사용하여 리보솜은 mRNA의 각 코돈(3뉴클레오티드)을 횡단하여 아미노아실-tRNA가 제공하는 적절한 아미노산과 짝을 이룬다.아미노아실-tRNA는 한쪽 끝에는 상보적인 항코돈, 다른 한쪽 끝에는 적절한 아미노산이 함유되어 있다.적절한 tRNA를 빠르고 정확하게 인식하기 위해 리보솜은 큰 구조 변화(구성 교정)[48]를 이용한다.첫 번째 아미노산 메티오닌을 포함하는 아미노아실-tRNA에 전형적으로 결합된 작은 리보솜 서브유닛은 mRNA의 AUG 코돈에 결합하고 큰 리보솜 서브유닛을 모집한다.리보솜은 A, P, E로 지정된 세 개의 RNA 결합 부위를 포함합니다.A-사이트는 아미노아실-tRNA 또는 종단 방출 [49][50]인자를 결합하고, P-사이트는 펩티딜-tRNA(폴리펩타이드 사슬에 결합된 tRNA)를 결합하며, E-사이트(출구)는 유리 tRNA를 결합한다. 단백질 합성은 MRNA의 5' 말단 부근의 시작 코드 AUG에서 시작된다.리보솜은 원핵생물에서는 mRNA의 샤인-달가노 염기서열과 진핵생물에서는 코작 상자를 사용하여 시작 코돈을 인식합니다.
펩타이드 결합의 촉매 작용은 양성자 셔틀 메커니즘에서 RNA의 P-사이트 아데노신의 C2 수산화기를 포함하지만, 단백질 합성의 다른 단계(예: 전위)는 단백질 구조의 변화에 의해 야기된다.리보솜의 촉매핵이 RNA로 만들어졌기 때문에 리보솜은 [51]리보자임으로 분류되어 RNA 세계의 [52]잔재일 수 있다고 생각된다.
그림 5에서 두 리보솜 서브유닛(작은 단위와 큰 단위)은 시작 코돈(mRNA의 5' 끝 방향)에 집합한다.리보솜은 mRNA의 현재 코돈(트리플렛)과 일치하는 tRNA를 사용하여 아미노산을 폴리펩타이드 사슬에 추가합니다.이것은 mRNA의 각 트리플렛에 대해 수행되며, 리보솜은 mRNA의 3' 말단으로 이동합니다.보통 박테리아 세포에서는 여러 리보솜이 단일 mRNA에서 평행하게 작용하며 폴리리보솜 또는 폴리썸이라고 불리는 것을 형성합니다.
번역
리보솜은 단백질 [53][54]접힘에 적극적으로 관여하는 것으로 알려져 있다.이 방법으로 얻은 구조는 보통 단백질 화학 재형성 시 얻은 구조와 동일하지만 최종 제품으로 이어지는 경로는 [55][56]다를 수 있다.경우에 따라 리보솜은 기능성 단백질 형태를 얻는 데 매우 중요하다.예를 들어, 깊게 뭉친 단백질의 접힘 메커니즘 중 하나는 연결된 [57]루프를 통해 사슬을 밀어내는 리보솜에 의존합니다.
아미노산
리보솜 품질제어단백질 Rqc2의 존재는 mRNA의존성 단백질 [58][59]신장과 관련되어 있다.이러한 신장 현상은 CAT 꼬리의 리보솜 첨가(Rqc2가 가져온 tRNA를 통해): 리보솜은 알라닌과 트레오닌의 [60][61]무작위 번역의존 배열로 정지된 단백질의 C 말단을 확장한다.
리보솜은 "자유" 또는 "막 결합"으로 분류됩니다.

자유 리보솜과 막 결합 리보솜은 공간 분포만 다를 뿐 구조가 동일하다.리보솜이 자유상태로 존재하는지 막결합상태로 존재하는지 여부는 합성되는 단백질에 대한 ER-타겟팅 신호 배열의 존재에 따라 달라지기 때문에 개별 리보솜은 하나의 단백질을 만들 때 막결합할 수 있지만 다른 단백질을 만들 때는 세포질에서 자유로울 수 있다.
리보솜은 때때로 오르가넬이라고 언급되지만, 오르가넬이라는 용어의 사용은 종종 인지질막을 포함하는 세포 내 구성 요소를 설명하는 것으로 제한되는데, 리보솜은 완전히 미립자인 것이 아니다.이러한 이유로, 리보솜은 때때로 "비원소기관"으로 묘사될 수 있다.
유리 리보솜은 세포핵과 다른 세포기관에서 제외됩니다.유리 리보솜에서 형성된 단백질은 세포로 방출되어 세포 내에서 사용된다.시토솔은 고농도의 글루타티온을 함유하고 있어 환원환경이기 때문에 산화시스테인 잔기로 형성된 디술피드 결합을 포함한 단백질을 그 안에서 제조할 수 없다.
리보솜이 몇몇 세포소기관에서 필요한 단백질을 합성하기 시작할 때, 이 단백질을 만드는 리보솜은 "막 결합"이 될 수 있습니다.진핵 세포에서 이것은 "rough ER"이라고 불리는 소포체 영역에서 발생합니다.새로 생성된 폴리펩타이드 사슬은 벡터 합성을 수행하는 리보솜에 의해 ER에 직접 삽입된 후 분비 경로를 통해 목적지로 운반됩니다.결합 리보솜은 보통 혈장막 내에서 사용되거나 세포외이식을 [62]통해 세포에서 배출되는 단백질을 생산한다.
생성
박테리아 세포에서 리보솜은 여러 리보솜 유전자 오퍼론의 전사를 통해 세포질에서 합성된다.진핵생물에서, 그 과정은 세포질과 세포핵 내의 영역인 핵에서 일어난다.조립 과정은 4개의 rRNA의 합성 및 처리뿐만 아니라 리보솜 단백질과 이러한 rRNA의 조립에서 200개 이상의 단백질의 조정된 기능을 포함한다.
리보솜은 아미노산이 나타나기 [63]시작했을 때 단백질을 합성하는 능력을 나중에 진화시킨 자기 복제 복합체로 나타나면서 RNA 세계에서 처음 시작되었을지도 모른다.연구에 따르면 rRNA로만 구성된 고대 리보솜은 펩타이드 [64][65][66]결합을 합성하는 능력을 발달시켰을 수 있다.또한, 증거는 리보솜의 rRNA가 리보솜 자기 [67]복제에 필요한 tRNA와 단백질에 대해 코드화될 수 있기 때문에 정보, 구조 및 촉매적 목적을 가진 고대 리보솜을 자기 복제 복합체로 강하게 지적한다.자가 복제 RNA를 가지고 있지만 DNA가 없는 가상의 세포 유기체는 리보구(또는 리보세포)[68][69]라고 불립니다.
아미노산이 생체 전 [70][71]조건에서 RNA 세계에 점차 나타나면서, 촉매 RNA와의 상호작용은 촉매 RNA [63]분자의 기능 범위와 효율성을 증가시킬 것이다.따라서 리보솜이 고대 자기복제기에서 번역기로서 현재의 형태로 진화한 원동력은 리보솜의 자기복제 메커니즘에 단백질을 포함시켜 자기복제 [67][72][73]능력을 증가시키는 선택적 압력이었을 수 있다.
리보솜은 같은 진핵세포 내에 세포질 및 미토콘드리아 리보솜의 존재에 의해 증명된 바와 같이, 종 간에 그리고 심지어 같은 세포 내에 이질적으로 존재한다.어떤 연구자들은 포유류의 리보솜 단백질 구성에서의 이질성이 유전자 조절, 즉 전문화된 리보솜 [74][75]가설에 중요하다고 제안했다.그러나 이 가설은 논란의 여지가 있으며 현재 진행 중인 연구의 [76][77]주제이다.
리보솜 조성의 이질성은 Vince Mauro와 Gerald Edelman에 [78]의해 단백질 합성의 번역 제어에 관여하는 것으로 처음 제안되었다.그들은 리보솜의 조절 기능을 설명하기 위해 리보솜 필터 가설을 제안했다.증거는 다른 세포 집단에 특정한 특화된 리보솜이 유전자가 어떻게 [79]번역되는지에 영향을 줄 수 있다는 것을 시사했다.일부 리보솜 단백질은 조립된 복합체로부터 세포질[80] 복제와 교환하여 생체 내 리보솜의 구조가 완전히 새로운 리보솜을 합성하지 않고 수정될 수 있음을 시사한다.
특정 리보솜 단백질은 세포생활에 절대적으로 중요한 반면 다른 단백질은 그렇지 않다.발아 효모에서 14/78 리보솜 단백질은 성장에 필수적이지 않은 반면, 인간의 경우 이는 [81]연구 세포에 의존합니다.다른 형태의 이질성에는 아세틸화, 메틸화 및 [82]인산화와 같은 리보솜 단백질에 대한 번역 후 수정이 포함된다.Arabidopsis,[83][84][85][86] Viral Internal Ribosome Entry sites(IRES; 바이러스 내부 리보솜 진입 부위)는 구성적으로 다른 리보솜에 의해 번역을 매개할 수 있다.예를 들어 효모와 포유류 세포에서 eS25가 없는 40S 리보솜 단위는 CrPV IGR [87]IRES를 모집할 수 없다.
리보솜 RNA 변형의 이질성은 구조 유지 및/또는 기능에 중요한 역할을 하며, 대부분의 mRNA 변형은 고도로 보존된 [88][89]영역에서 발견된다.가장 일반적인 rRNA 변형은 리보스의 [90]의사유리지일화와 2'-O 메틸화이다.
「」도 .
- 후
- RNA 3 δ δ δ δ
- 아다 요나트 - 리보솜 구조에 대한 선구적인 연구로 유명한 이스라엘의 결정학자이며, 노벨상을 수상했습니다.
- ^ Konikkat S (February 2016). Dynamic Remodeling Events Drive the Removal of the ITS2 Spacer Sequence During Assembly of 60S Ribosomal Subunits in S. cerevisiae (Ph.D. thesis). Carnegie Mellon University. Archived from the original on 3 August 2017.
- ^ Weiler EW, Nover L (2008). Allgemeine und Molekulare Botanik (in German). Stuttgart: Georg Thieme Verlag. p. 532. ISBN 9783131527912.
- ^ de la Cruz J, Karbstein K, Woolford JL (2015). "Functions of ribosomal proteins in assembly of eukaryotic ribosomes in vivo". Annual Review of Biochemistry. 84: 93–129. doi:10.1146/annurev-biochem-060614-033917. PMC 4772166. PMID 25706898.
- ^ "Scitable by nature translation / RNA translation".
- ^ a b c Tirumalai MR, Rivas M, Tran Q, Fox GE (November 2021). "The Peptidyl Transferase Center: a Window to the Past". Microbiol Mol Biol Rev. 85 (4): e0010421. doi:10.1128/MMBR.00104-21. PMC 8579967. PMID 34756086.
- ^ Benne R, Sloof P (1987). "Evolution of the mitochondrial protein synthetic machinery". Bio Systems. 21 (1): 51–68. doi:10.1016/0303-2647(87)90006-2. PMID 2446672.
- ^ "Ribosomes". Archived from the original on 2009-03-20. Retrieved 2011-04-28.
- ^ Palade GE (January 1955). "A small particulate component of the cytoplasm". The Journal of Biophysical and Biochemical Cytology. 1 (1): 59–68. doi:10.1083/jcb.1.1.59. PMC 2223592. PMID 14381428.
- ^ Roberts RB, ed. (1958). "Introduction". Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ^ "The Nobel Prize in Physiology or Medicine 1974". Nobelprize.org. The Nobel Foundation. Archived from the original on 26 January 2013. Retrieved 10 December 2012.
- ^ "2009 Nobel Prize in Chemistry". The Nobel Foundation. Archived from the original on 28 April 2012. Retrieved 10 December 2012.
- ^ Kurland CG (1960). "Molecular characterization of ribonucleic acid from Escherichia coli ribosomes". Journal of Molecular Biology. 2 (2): 83–91. doi:10.1016/s0022-2836(60)80029-0.
- ^ Wilson DN, Doudna Cate JH (May 2012). "The structure and function of the eukaryotic ribosome". Cold Spring Harbor Perspectives in Biology. 4 (5): a011536. doi:10.1101/cshperspect.a011536. PMC 3331703. PMID 22550233.
- ^ Nissen P, Hansen J, Ban N, Moore PB, Steitz TA (August 2000). "The structural basis of ribosome activity in peptide bond synthesis" (PDF). Science. 289 (5481): 920–30. Bibcode:2000Sci...289..920N. doi:10.1126/science.289.5481.920. PMID 10937990. S2CID 8370119. Archived from the original (PDF) on 2020-11-30.
- ^ a b Wimberly BT, Brodersen DE, Clemons WM, Morgan-Warren RJ, Carter AP, Vonrhein C, Hartsch T, Ramakrishnan V (September 2000). "Structure of the 30S ribosomal subunit". Nature. 407 (6802): 327–39. Bibcode:2000Natur.407..327W. doi:10.1038/35030006. PMID 11014182. S2CID 4419944.
- ^ a b c d e f g Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). "Membrane-bound Ribosomes Define the Rough ER". Molecular Biology of the Cell (4th ed.). New York: Garland Science. p. 342. ISBN 978-0-8153-4072-0.
- ^ a b Garrett R, Grisham CM (2009). Biochemistry (4th ed.). Cengage Learning Services. ISBN 978-0-495-11464-2.
- ^ Collatz E, Küchler E, Stöffler G, Czernilofsky AP (April 1976). "The site of reaction on ribosomal protein L27 with an affinity label derivative of tRNA Met f". FEBS Letters. 63 (2): 283–6. doi:10.1016/0014-5793(76)80112-3. PMID 770196.
- ^ Czernilofsky AP, Collatz EE, Stöffler G, Kuechler E (January 1974). "Proteins at the tRNA binding sites of Escherichia coli ribosomes". Proceedings of the National Academy of Sciences of the United States of America. 71 (1): 230–4. Bibcode:1974PNAS...71..230C. doi:10.1073/pnas.71.1.230. PMC 387971. PMID 4589893.
- ^ Czernilofsky AP, Kurland CG, Stöffler G (October 1975). "30S ribosomal proteins associated with the 3'-terminus of 16S RNA". FEBS Letters. 58 (1): 281–4. doi:10.1016/0014-5793(75)80279-1. PMID 1225593.
- ^ Cullen KE (2009). "Archaeal Ribosomes". Encyclopedia of Life Science. New York: Facts On File. pp. 1–5. doi:10.1002/9780470015902.a0000293.pub3. ISBN 9780470015902. S2CID 243730576.
- ^ Tirumalai MR, Anane-Bediakoh D, Rajesh R, Fox GE (November 2021). "Net Charges of the Ribosomal Proteins of the S10 and spc Clusters of Halophiles Are Inversely Related to the Degree of Halotolerance". Microbiol. Spectrum. 9 (3): e0178221. doi:10.1128/spectrum.01782-21. PMC 8672879. PMID 34908470.
- ^ Wang J, Dasgupta I, Fox GE (28 April 2009). "Many nonuniversal archaeal ribosomal proteins are found in conserved gene clusters". Archaea. 2 (4): 241–51. doi:10.1155/2009/971494. PMC 2686390. PMID 19478915.
- ^ a b c Ben-Shem A, Garreau de Loubresse N, Melnikov S, Jenner L, Yusupova G, Yusupov M (December 2011). "The structure of the eukaryotic ribosome at 3.0 Å resolution". Science. 334 (6062): 1524–9. Bibcode:2011Sci...334.1524B. doi:10.1126/science.1212642. PMID 22096102. S2CID 9099683.
- ^ a b Rabl J, Leibundgut M, Ataide SF, Haag A, Ban N (February 2011). "Crystal structure of the eukaryotic 40S ribosomal subunit in complex with initiation factor 1" (PDF). Science. 331 (6018): 730–6. Bibcode:2011Sci...331..730R. doi:10.1126/science.1198308. hdl:20.500.11850/153130. PMID 21205638. S2CID 24771575.
- ^ a b Klinge S, Voigts-Hoffmann F, Leibundgut M, Arpagaus S, Ban N (November 2011). "Crystal structure of the eukaryotic 60S ribosomal subunit in complex with initiation factor 6". Science. 334 (6058): 941–8. Bibcode:2011Sci...334..941K. doi:10.1126/science.1211204. PMID 22052974. S2CID 206536444.
- ^ Fabijanski S, Pellegrini M (1977). "Identification of proteins at the peptidyl-tRNA binding site of rat liver ribosomes". Molecular & General Genetics. 184 (3): 551–6. doi:10.1007/BF00431588. PMID 6950200. S2CID 9751945.
- ^ Agrawal RK, Sharma MR (December 2012). "Structural aspects of mitochondrial translational apparatus". Current Opinion in Structural Biology. 22 (6): 797–803. doi:10.1016/j.sbi.2012.08.003. PMC 3513651. PMID 22959417.
- ^ Sharma MR, Booth TM, Simpson L, Maslov DA, Agrawal RK (June 2009). "Structure of a mitochondrial ribosome with minimal RNA". Proceedings of the National Academy of Sciences of the United States of America. 106 (24): 9637–42. Bibcode:2009PNAS..106.9637S. doi:10.1073/pnas.0901631106. PMC 2700991. PMID 19497863.
- ^ Waltz F, Nguyen TT, Arrivé M, Bochler A, Chicher J, Hammann P, Kuhn L, Quadrado M, Mireau H, Hashem Y, Giegé P (January 2019). "Small is big in Arabidopsis mitochondrial ribosome". Nature Plants. 5 (1): 106–117. doi:10.1038/s41477-018-0339-y. PMID 30626926. S2CID 58004990.
- ^ Archibald JM, Lane CE (2009). "Going, going, not quite gone: nucleomorphs as a case study in nuclear genome reduction". The Journal of Heredity. 100 (5): 582–90. doi:10.1093/jhered/esp055. PMID 19617523.
- ^ "Specialized Internal Structures of Prokaryotes Boundless Microbiology". courses.lumenlearning.com. Retrieved 2021-09-24.
- ^ Recht MI, Douthwaite S, Puglisi JD (June 1999). "Basis for prokaryotic specificity of action of aminoglycoside antibiotics". The EMBO Journal. 18 (11): 3133–8. doi:10.1093/emboj/18.11.3133. PMC 1171394. PMID 10357824.
- ^ O'Brien TW (May 1971). "The general occurrence of 55 S ribosomes in mammalian liver mitochondria". The Journal of Biological Chemistry. 246 (10): 3409–17. doi:10.1016/S0021-9258(18)62239-2. PMID 4930061.
- ^ "Chloramphenicol-lnduced Bone Marrow Suppression". JAMA. 213 (7): 1183–1184. 1970-08-17. doi:10.1001/jama.1970.03170330063011. ISSN 0098-7484. PMID 5468266.
- ^ Newman SM, Boynton JE, Gillham NW, Randolph-Anderson BL, Johnson AM, Harris EH (December 1990). "Transformation of chloroplast ribosomal RNA genes in Chlamydomonas: molecular and genetic characterization of integration events". Genetics. 126 (4): 875–88. doi:10.1093/genetics/126.4.875. PMC 1204285. PMID 1981764.
- ^ Penev PI, Fakhretaha-Aval S, Patel VJ, Cannone JJ, Gutell RR, Petrov AS, Williams LD, Glass JB (August 2020). "Supersized ribosomal RNA expansion segments in Asgard archaea". Genome Biology and Evolution. 12 (10): 1694–1710. doi:10.1093/gbe/evaa170. PMC 7594248. PMID 32785681.
- ^ a b Ban N, Nissen P, Hansen J, Moore PB, Steitz TA (August 2000). "The complete atomic structure of the large ribosomal subunit at 2.4 A resolution". Science. 289 (5481): 905–20. Bibcode:2000Sci...289..905B. CiteSeerX 10.1.1.58.2271. doi:10.1126/science.289.5481.905. PMID 10937989.
- ^ Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A (September 2000). "Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution". Cell. 102 (5): 615–23. doi:10.1016/S0092-8674(00)00084-2. PMID 11007480. S2CID 1024446.
- ^ Yusupov MM, Yusupova GZ, Baucom A, Lieberman K, Earnest TN, Cate JH, Noller HF (May 2001). "Crystal structure of the ribosome at 5.5 A resolution". Science. 292 (5518): 883–96. Bibcode:2001Sci...292..883Y. doi:10.1126/science.1060089. PMID 11283358. S2CID 39505192.
- ^ Schuwirth BS, Borovinskaya MA, Hau CW, Zhang W, Vila-Sanjurjo A, Holton JM, Cate JH (November 2005). "Structures of the bacterial ribosome at 3.5 A resolution". Science. 310 (5749): 827–34. Bibcode:2005Sci...310..827S. doi:10.1126/science.1117230. PMID 16272117. S2CID 37382005.
- ^ Mitra K, Schaffitzel C, Shaikh T, Tama F, Jenni S, Brooks CL, Ban N, Frank J (November 2005). "Structure of the E. coli protein-conducting channel bound to a translating ribosome". Nature. 438 (7066): 318–24. Bibcode:2005Natur.438..318M. doi:10.1038/nature04133. PMC 1351281. PMID 16292303.
- ^ Selmer M, Dunham CM, Murphy FV, Weixlbaumer A, Petry S, Kelley AC, Weir JR, Ramakrishnan V (September 2006). "Structure of the 70S ribosome complexed with mRNA and tRNA". Science. 313 (5795): 1935–42. Bibcode:2006Sci...313.1935S. doi:10.1126/science.1131127. PMID 16959973. S2CID 9737925.
- ^ Korostelev A, Trakhanov S, Laurberg M, Noller HF (September 2006). "Crystal structure of a 70S ribosome-tRNA complex reveals functional interactions and rearrangements". Cell. 126 (6): 1065–77. doi:10.1016/j.cell.2006.08.032. PMID 16962654. S2CID 13452915.
- ^ Yusupova G, Jenner L, Rees B, Moras D, Yusupov M (November 2006). "Structural basis for messenger RNA movement on the ribosome". Nature. 444 (7117): 391–4. Bibcode:2006Natur.444..391Y. doi:10.1038/nature05281. PMID 17051149. S2CID 4419198.
- ^ a b "Specialized Internal Structures of Prokaryotes Boundless Microbiology". courses.lumenlearning.com. Retrieved 2018-09-27.
- ^ 라퐁텐, D., 톨러비, D.리보솜의 기능과 합성.Nat Rev Mol Cell Biol 2, 514 – 520 (2001).https://doi.org/10.1038/35080045
- ^ Savir Y, Tlusty T (April 2013). "The ribosome as an optimal decoder: a lesson in molecular recognition". Cell. 153 (2): 471–9. Bibcode:2013APS..MARY46006T. doi:10.1016/j.cell.2013.03.032. PMID 23582332.
- ^ Korkmaz G, Sanyal S (September 2017). "Escherichia coli". The Journal of Biological Chemistry. 292 (36): 15134–15142. doi:10.1074/jbc.M117.785238. PMC 5592688. PMID 28743745.
- ^ Konevega AL, Soboleva NG, Makhno VI, Semenkov YP, Wintermeyer W, Rodnina MV, Katunin VI (January 2004). "Purine bases at position 37 of tRNA stabilize codon-anticodon interaction in the ribosomal A site by stacking and Mg2+-dependent interactions". RNA. 10 (1): 90–101. doi:10.1261/rna.5142404. PMC 1370521. PMID 14681588.
- ^ Rodnina MV, Beringer M, Wintermeyer W (January 2007). "How ribosomes make peptide bonds". Trends in Biochemical Sciences. 32 (1): 20–6. doi:10.1016/j.tibs.2006.11.007. PMID 17157507.
- ^ Cech TR (August 2000). "Structural biology. The ribosome is a ribozyme". Science. 289 (5481): 878–9. doi:10.1126/science.289.5481.878. PMID 10960319. S2CID 24172338.
- ^ Banerjee D, Sanyal S (October 2014). "Protein folding activity of the ribosome (PFAR) -- a target for antiprion compounds". Viruses. 6 (10): 3907–24. doi:10.3390/v6103907. PMC 4213570. PMID 25341659.
- ^ Fedorov AN, Baldwin TO (December 1997). "Cotranslational protein folding". The Journal of Biological Chemistry. 272 (52): 32715–8. doi:10.1074/jbc.272.52.32715. PMID 9407040.
- ^ Baldwin RL (June 1975). "Intermediates in protein folding reactions and the mechanism of protein folding". Annual Review of Biochemistry. 44 (1): 453–75. doi:10.1146/annurev.bi.44.070175.002321. PMID 1094916.
- ^ Das D, Das A, Samanta D, Ghosh J, Dasgupta S, Bhattacharya A, Basu A, Sanyal S, Das Gupta C (August 2008). "Role of the ribosome in protein folding" (PDF). Biotechnology Journal. 3 (8): 999–1009. doi:10.1002/biot.200800098. PMID 18702035.
- ^ Dabrowski-Tumanski P, Piejko M, Niewieczerzal S, Stasiak A, Sulkowska JI (December 2018). "Protein Knotting by Active Threading of Nascent Polypeptide Chain Exiting from the Ribosome Exit Channel". The Journal of Physical Chemistry B. 122 (49): 11616–11625. doi:10.1021/acs.jpcb.8b07634. PMID 30198720. S2CID 52176392.
- ^ Brandman O, Stewart-Ornstein J, Wong D, Larson A, Williams CC, Li GW, Zhou S, King D, Shen PS, Weibezahn J, Dunn JG, Rouskin S, Inada T, Frost A, Weissman JS (November 2012). "A ribosome-bound quality control complex triggers degradation of nascent peptides and signals translation stress". Cell. 151 (5): 1042–54. doi:10.1016/j.cell.2012.10.044. PMC 3534965. PMID 23178123.
- ^ Defenouillère Q, Yao Y, Mouaikel J, Namane A, Galopier A, Decourty L, Doyen A, Malabat C, Saveanu C, Jacquier A, Fromont-Racine M (March 2013). "Cdc48-associated complex bound to 60S particles is required for the clearance of aberrant translation products". Proceedings of the National Academy of Sciences of the United States of America. 110 (13): 5046–51. Bibcode:2013PNAS..110.5046D. doi:10.1073/pnas.1221724110. PMC 3612664. PMID 23479637.
- ^ Shen PS, Park J, Qin Y, Li X, Parsawar K, Larson MH, Cox J, Cheng Y, Lambowitz AM, Weissman JS, Brandman O, Frost A (January 2015). "Protein synthesis. Rqc2p and 60S ribosomal subunits mediate mRNA-independent elongation of nascent chains". Science. 347 (6217): 75–8. Bibcode:2015Sci...347...75S. doi:10.1126/science.1259724. PMC 4451101. PMID 25554787.
- ^ Keeley J, Gutnikoff R (2015-01-02). "Ribosome Studies Turn Up New Mechanism of Protein Synthesis" (Press release). Howard Hughes Medical Institute. Archived from the original on 2015-01-12. Retrieved 2015-01-16.
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). "Membrane-bound Ribosomes Define the Rough ER". Molecular Biology of the Cell (4th ed.). New York: Garland Science. ISBN 978-0-8153-4072-0.
- ^ a b Noller HF (April 2012). "Evolution of protein synthesis from an RNA world". Cold Spring Harbor Perspectives in Biology. 4 (4): a003681. doi:10.1101/cshperspect.a003681. PMC 3312679. PMID 20610545.
- ^ Dabbs ER (1986). Mutant studies on the prokaryotic ribosome. New York: Springer-Verlag.
- ^ Noller HF, Hoffarth V, Zimniak L (June 1992). "Unusual resistance of peptidyl transferase to protein extraction procedures". Science. 256 (5062): 1416–9. Bibcode:1992Sci...256.1416N. doi:10.1126/science.1604315. PMID 1604315.
- ^ Nomura M, Mizushima S, Ozaki M, Traub P, Lowry CV (1969). "Structure and function of ribosomes and their molecular components". Cold Spring Harbor Symposia on Quantitative Biology. 34: 49–61. doi:10.1101/sqb.1969.034.01.009. PMID 4909519.
- ^ a b Root-Bernstein M, Root-Bernstein R (February 2015). "The ribosome as a missing link in the evolution of life". Journal of Theoretical Biology. 367: 130–158. doi:10.1016/j.jtbi.2014.11.025. PMID 25500179.
- ^ Yarus M (2002). "Primordial genetics: phenotype of the ribocyte". Annual Review of Genetics. 36: 125–51. doi:10.1146/annurev.genet.36.031902.105056. PMID 12429689.
- ^ Forterre P, Krupovic M (2012). "The Origin of Virions and Virocells: The Escape Hypothesis Revisited". Viruses: Essential Agents of Life. pp. 43–60. doi:10.1007/978-94-007-4899-6_3. ISBN 978-94-007-4898-9.
- ^ Caetano-Anollés G, Seufferheld MJ (2013). "The coevolutionary roots of biochemistry and cellular organization challenge the RNA world paradigm". Journal of Molecular Microbiology and Biotechnology. 23 (1–2): 152–77. doi:10.1159/000346551. PMID 23615203. S2CID 41725226.
- ^ Saladino R, Botta G, Pino S, Costanzo G, Di Mauro E (August 2012). "Genetics first or metabolism first? The formamide clue". Chemical Society Reviews. 41 (16): 5526–65. doi:10.1039/c2cs35066a. PMID 22684046.
- ^ Fox GE (September 2010). "Origin and Evolution of the Ribosome". Cold Spring Harb Perspect Biol. 2 (9): a003483. doi:10.1101/cshperspect.a003483. PMC 2926754. PMID 20534711.
- ^ Fox GE (2016). "Origins and early evolution of the ribosome". In Hernández G, Jagus R (eds.). Evolution of the Protein Synthesis Machinery and Its Regulation. Switzerland: Springer, Cham. pp. 31–60. doi:10.1007/978-3-319-39468-8. ISBN 978-3-319-39468-8. S2CID 27493054.
- ^ Shi Z, Fujii K, Kovary KM, Genuth NR, Röst HL, Teruel MN, Barna M (July 2017). "Heterogeneous Ribosomes Preferentially Translate Distinct Subpools of mRNAs Genome-wide". Molecular Cell. Elsevier BV. 67 (1): 71–83.e7. doi:10.1016/j.molcel.2017.05.021. PMC 5548184. PMID 28625553.
- ^ Xue S, Barna M (May 2012). "Specialized ribosomes: a new frontier in gene regulation and organismal biology". Nature Reviews. Molecular Cell Biology. Springer Science and Business Media LLC. 13 (6): 355–369. doi:10.1038/nrm3359. PMC 4039366. PMID 22617470.
- ^ Ferretti MB, Karbstein K (May 2019). "Does functional specialization of ribosomes really exist?". RNA. Cold Spring Harbor Laboratory. 25 (5): 521–538. doi:10.1261/rna.069823.118. PMC 6467006. PMID 30733326.
- ^ Farley-Barnes KI, Ogawa LM, Baserga SJ (October 2019). "Ribosomopathies: Old Concepts, New Controversies". Trends in Genetics. Elsevier BV. 35 (10): 754–767. doi:10.1016/j.tig.2019.07.004. PMC 6852887. PMID 31376929.
- ^ Mauro VP, Edelman GM (September 2002). "The ribosome filter hypothesis". Proceedings of the National Academy of Sciences of the United States of America. 99 (19): 12031–6. Bibcode:2002PNAS...9912031M. doi:10.1073/pnas.192442499. PMC 129393. PMID 12221294.
- ^ Xue S, Barna M (May 2012). "Specialized ribosomes: a new frontier in gene regulation and organismal biology". Nature Reviews. Molecular Cell Biology. 13 (6): 355–69. doi:10.1038/nrm3359. PMC 4039366. PMID 22617470.
- ^ Mathis AD, Naylor BC, Carson RH, Evans E, Harwell J, Knecht J, Hexem E, Peelor FF, Miller BF, Hamilton KL, Transtrum MK, Bikman BT, Price JC (February 2017). "Mechanisms of In Vivo Ribosome Maintenance Change in Response to Nutrient Signals". Molecular & Cellular Proteomics. 16 (2): 243–254. doi:10.1074/mcp.M116.063255. PMC 5294211. PMID 27932527.
- ^ Steffen KK, McCormick MA, Pham KM, MacKay VL, Delaney JR, Murakami CJ, et al. (May 2012). "Ribosome deficiency protects against ER stress in Saccharomyces cerevisiae". Genetics. Genetics Society of America. 191 (1): 107–118. doi:10.1534/genetics.111.136549. PMC 3338253. PMID 22377630.
- ^ Lee SW, Berger SJ, Martinović S, Pasa-Tolić L, Anderson GA, Shen Y, et al. (April 2002). "Direct mass spectrometric analysis of intact proteins of the yeast large ribosomal subunit using capillary LC/FTICR". Proceedings of the National Academy of Sciences of the United States of America. 99 (9): 5942–5947. Bibcode:2002PNAS...99.5942L. doi:10.1073/pnas.082119899. PMC 122881. PMID 11983894.
- ^ Carroll AJ, Heazlewood JL, Ito J, Millar AH (February 2008). "Analysis of the Arabidopsis cytosolic ribosome proteome provides detailed insights into its components and their post-translational modification". Molecular & Cellular Proteomics. 7 (2): 347–369. doi:10.1074/mcp.m700052-mcp200. PMID 17934214.
- ^ Odintsova TI, Müller EC, Ivanov AV, Egorov TA, Bienert R, Vladimirov SN, et al. (April 2003). "Characterization and analysis of posttranslational modifications of the human large cytoplasmic ribosomal subunit proteins by mass spectrometry and Edman sequencing". Journal of Protein Chemistry. 22 (3): 249–258. doi:10.1023/a:1025068419698. PMID 12962325. S2CID 10710245.
- ^ Yu Y, Ji H, Doudna JA, Leary JA (June 2005). "Mass spectrometric analysis of the human 40S ribosomal subunit: native and HCV IRES-bound complexes". Protein Science. 14 (6): 1438–1446. doi:10.1110/ps.041293005. PMC 2253395. PMID 15883184.
- ^ Zeidan Q, Wang Z, De Maio A, Hart GW (June 2010). "O-GlcNAc cycling enzymes associate with the translational machinery and modify core ribosomal proteins". Molecular Biology of the Cell. 21 (12): 1922–1936. doi:10.1091/mbc.e09-11-0941. PMC 2883937. PMID 20410138.
- ^ Landry DM, Hertz MI, Thompson SR (December 2009). "RPS25 is essential for translation initiation by the Dicistroviridae and hepatitis C viral IRESs". Genes & Development. 23 (23): 2753–2764. doi:10.1101/gad.1832209. PMC 2788332. PMID 19952110.
- ^ Decatur WA, Fournier MJ (July 2002). "rRNA modifications and ribosome function". Trends in Biochemical Sciences. 27 (7): 344–51. doi:10.1016/s0968-0004(02)02109-6. PMID 12114023.
- ^ Natchiar SK, Myasnikov AG, Kratzat H, Hazemann I, Klaholz BP (November 2017). "Visualization of chemical modifications in the human 80S ribosome structure". Nature. 551 (7681): 472–477. Bibcode:2017Natur.551..472N. doi:10.1038/nature24482. PMID 29143818. S2CID 4465175.
- ^ Guo H (August 2018). "Specialized ribosomes and the control of translation". Biochemical Society Transactions. 46 (4): 855–869. doi:10.1042/BST20160426. PMID 29986937. S2CID 51609077.
( )
- 컴퓨터는 을 시뮬레이트합니다.
- 리보솜의 역할 그웬 V.자녀, 여기에 복사
- Proteopedia의 리보솜--단백질 및 기타 분자의 무료 3D 백과사전
- ExPASy의 리보솜 단백질 패밀리 웨이백 머신에서 2011-04-30 아카이브됨
- Month의 분자Wayback Machine© RCSB 단백질 데이터 뱅크에서 2009-10-27을 아카이브했습니다.
- Bank EM Data Bank(EMDB)의
 이 문서에는 NCBI 문서의 퍼블릭 도메인 자료가 포함되어 있습니다.
이 문서에는 NCBI 문서의 퍼블릭 도메인 자료가 포함되어 있습니다.