스토마
Stoma
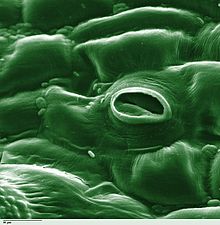
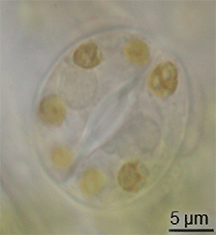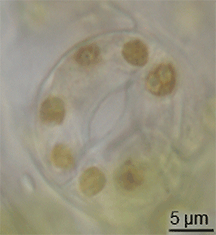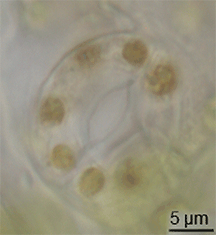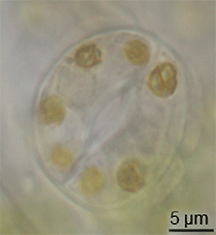
식물학에서 스토마(Stoma)는 기공(Stomate)이라고도 하며, 잎, 줄기 및 기타 기관의 표피에서 기체 교환 속도를 조절하는 기공이다.기공은 기공 개구부의 크기를 조절하는 역할을 하는 가드 세포로 알려진 한 쌍의 특수 실질 세포로 둘러싸여 있습니다.
이 용어는 일반적으로 한 쌍의 가드 세포와 기공 그 자체로 구성된 전체 기공 복합체를 지칭하는 데 사용되며, 기공 [1]개구부라고 합니다.호흡에 사용되는 산소와 광합성에 사용되는 이산화탄소를 포함한 공기는 기체 확산에 의해 기공을 통과한다.수증기는 기공을 통해 증산이라고 불리는 과정에서 대기 중으로 확산된다.
기공은 간나무를 제외한 모든 육지 식물군의 포자체 세대에 존재한다.혈관 식물에서 기공의 수, 크기 및 분포는 매우 다양하다.쌍떡잎은 보통 잎의 윗면보다 아랫면에 기공이 더 많다.양파, 귀리, 옥수수와 같은 단종류는 양쪽 잎 [2]: 5 표면에 거의 같은 수의 기공이 있을 수 있다.떠다니는 잎을 가진 식물에서 기공은 표피 상부에서만 발견될 수 있고 물에 잠긴 잎은 기공이 완전히 없을 수 있다.대부분의 나무 종들은 잎 표면 [3]아래에만 기공을 가지고 있다.상·하엽면에 기공이 있는 잎을 양구형 잎이라고 하고, 하엽에만 기공이 있는 잎은 하구형 잎, 상엽에만 기공이 있는 잎은 인식형 잎 또는 초구형 [3]잎이라고 합니다.크기는 종에 따라 다르며, 끝의 길이는 10 ~ 80 µm,[4] 폭은 수 ~ 50 µm이다.
기능.

CO2 게인 및 수분 손실
광합성의 핵심 반응 물질인 이산화탄소는 대기 중에 약 400ppm의 농도로 존재한다.대부분의 식물들은 기공이 낮에 열려있어야 한다.잎의 공기 공간은 수증기로 포화되어 있는데, 수증기는 기공을 통해 잎을 빠져나가는 증산 과정으로 알려져 있습니다.그러므로, 식물들은 동시에 [5]수증기를 잃지 않고서는 이산화탄소를 얻을 수 없다.
대체 어프로치
일반적으로 이산화탄소는 RuBis 효소에 의해 리불로스 1,5-이인산(RuBP)에 고정된다.잎 내부의 공기 공간에 직접 노출되는 중엽 세포의 CO.이는 두 가지 이유로 증산 문제를 악화시킵니다. 첫째, RuBisCo는 이산화탄소에 대한 친화력이 상대적으로 낮기 때문입니다. 둘째, RuBP에 산소를 고정시켜 광호흡이라고 불리는 과정에서 에너지와 탄소를 낭비합니다.이 두 가지 이유로, RuBisCo는 높은 이산화탄소 농도를 필요로 합니다. 이는 기공 개구부가 넓어 결과적으로 높은 수분 손실을 의미합니다.
좁은 기공 개구부는 이산화탄소 친화성이 높은 중간 분자인 포스포에놀피루브산카르복실화효소(PEPCase)와 함께 사용할 수 있다.그러나 PEPCase에서 탄소 고정 생성물을 회수하는 것은 에너지 집약적인 과정이다.그 결과, PEPCase 대안은 물이 제한적이지만 빛이 풍부한 경우 또는 고온에 의해 이산화탄소에 비해 산소의 용해도가 증가하여 RuBisCo의 산소화 문제를 확대하는 경우에만 바람직하다.
CAM 플랜트
주로 사막 식물인 "CAM" 식물(CAM 과정이 처음 발견된 종을 포함하는 Crassulacea과 이후의 Crassulacea 산 대사)의 그룹은 밤에 기공을 엽니다(소정의 기공 개방 정도 동안 잎에서 물이 더 느리게 증발하는 경우). 이산화탄소와 S를 고정하기 위해 PEP카르복실라아제를 사용합니다.제품을 큰 액포 모양으로 찢었다.다음날 기공을 닫고 전날 밤 고정한 이산화탄소를 RuBisCO 앞에 방출한다.이것은 RuBis를 포화시킵니다.이산화탄소와 함께 CO로 광호흡을 최소화합니다.그러나 이 접근법은 액포에 고정 탄소를 저장하는 용량에 의해 심각하게 제한되므로 물이 심각하게 제한될 때만 바람직하다.
개폐
그러나 대부분의 식물에는 CAM이 없기 때문에 빛의 강도, 습도, 이산화탄소 농도 등의 조건 변화에 따라 낮에 기공을 열고 닫아야 한다.조건이 기공 개방에 도움이 되는 경우(예: 높은 광도 및 높은 습도) 양성자 펌프는 가드 셀로부터 양성자(H+)를 구동합니다.이것은 셀의 전위가 점점 더 부정적이 된다는 것을 의미한다.음의 전위는 칼륨 전압 게이트 채널을 열어서 칼륨 이온+(K)의 흡수가 발생합니다.이 내부 음전압을 유지하기 위해 음이온은 칼륨 유입의 균형을 잡습니다.어떤 경우에는 염화 이온이 들어가는 반면, 다른 식물에서는 유기 이온 말레이트가 가드 세포에서 생성됩니다.용질 농도의 증가는 세포 내부의 물 잠재성을 낮추어 삼투압을 통해 세포 안으로 물이 확산되는 결과를 초래한다.이것은 세포의 부피와 팽압을 증가시킨다.그 후, 보호세포의 폭의 팽창을 막고, 따라서 주변 표피세포에 의해 끝이 단단히 고정되는 보호세포를 연장시키는 여분의 팽압만을 허용하는 셀룰로오스 미세섬유의 고리들 때문에, 두 보호세포는 서로 떨어져서 구부림으로써 연장되고, g를 통해 열린 구멍을 만듭니다.확산될 [6]수 있습니다.
뿌리가 토양에서 수분 부족을 감지하기 시작하면, 아브시스산([7]ABA)ABA는 먼저 세포 세포막의 pH를 높이고 세포 외부로부터의 유입과 내소체 및 [8]액포와 같은 내부 저장소에서 Ca의2+ 방출로 세포 내 유리2+ Ca의 농도를 증가시킨다.이로 인해 염화물(Cl−)과 유기 이온이 세포 밖으로 나오게 됩니다.둘째, 이것은 세포에 대한 추가적인+ K의 흡수를 중지하고, 결과적으로 K의 손실을+ 막는다.이러한 용질의 손실은 물의 잠재력 증가를 유발하며, 이는 삼투압에 의해 물이 세포 밖으로 다시 확산되는 결과를 초래한다.이것은 세포를 플라스마 용해시켜 기공의 폐쇄를 초래한다.
가드 세포는 가드 세포가 파생된 다른 표피 세포보다 더 많은 엽록체를 가지고 있습니다.그 기능은 [9][10]논란의 여지가 있다.
가스 교환으로 인한 기공 거동 추론
기공 저항의 정도는 잎의 잎 가스 교환을 측정하여 확인할 수 있습니다.증산 속도는 기공에서 제공하는 확산 저항과 잎 내부 공기 공간과 외부 공기 사이의 습도 구배에 따라 달라집니다.따라서 기공 저항(또는 기공 전도율 역)은 증산 속도와 습도 구배에서 계산할 수 있습니다.이것은 과학자들이 빛의 강도와 수증기, 이산화탄소, [11]오존과 같은 가스의 농도와 같은 환경 조건의 변화에 기공이 어떻게 반응하는지를 조사할 수 있게 해준다.증발(E)은 다음과 [12]같이 계산할 수 있습니다.
여기서i e와a e는 각각 잎과 주변 공기 중 물의 부분 압력이고, P는 대기압이고, r은 기공 저항이다.r의 역수는 수증기(g)에 대한 전도도이므로 방정식은 다음과 [12]같이 재배열할 수 있다.
g에 [12]대해 해결한다.
광합성2 CO 동화(A)는 다음과 같이 계산할 수 있습니다.
여기서a C와i C는 각각 CO의2 대기압과 아기공 분압이다.잎에서 증발하는 속도는 광합성 시스템을 사용하여 결정할 수 있다.이 과학 기구들은 잎에서 나오는 수증기의 양과 주변 공기의 증기 압력을 측정합니다.광합성 시스템은 물 사용 효율성(A/E), g, 고유 물 사용 효율성(A/g) 및i C를 계산할 수 있다.이 과학적 기구들은 식물 생리학자들에 의해 CO 흡수를 측정하기2 위해 일반적으로 사용되어 광합성 [13][14]속도를 측정한다.
진화
화석 기록에는 기공의 진화에 대한 증거는 거의 없지만, 실루리아기 [15]중반 무렵에는 육지 식물에 나타났다.그들은 식물의 조류 같은 [16]조상들로부터 개념의 수정에 의해 진화했을지도 모른다.그러나 기공의 진화는 왁시 큐티클의 진화와 동시에 일어났을 것이다. 이 두 가지 특성은 모두 초기 육생 [citation needed]식물에게 주요한 이점을 구성했다.
발전
세 가지 주요 표피 세포 유형이 있는데, 이 세포들은 모두 원배엽 세포라고 불리는 싹 끝의 가장 바깥쪽(L1) 조직 층에서 유래합니다: 트리콤, 포장 세포 및 가드 세포입니다. 이 세포들은 모두 랜덤하지 않은 방식으로 배열되어 있습니다.
비대칭 세포 분열은 원형 세포에서 일어나 포장 세포가 될 운명의 하나의 큰 세포와 결국 스토마를 둘러싼 보호 세포로 분화할 수 있는 메리스테모이드라고 불리는 작은 세포를 만든다.그리고 나서 이 자낭모이드는 보호모세포로 분화되기 전에 비대칭으로 1번에서 3번 나뉩니다.보호모세포는 한 쌍의 [17]보호세포를 형성하는 하나의 대칭적인 분할을 만든다.일부 세포에서는 세포분열이 억제되므로 기공 사이에는 [18]항상 적어도 하나의 세포가 존재한다.
기공 패턴화는 EPF(Epidermal Patterning Factor), ERL(ERECTa Like) 및 YODA(추정 MAP 키나제 키나제 키나제 키나제)[18]와 같은 많은 신호 전달 성분의 상호작용에 의해 제어된다.이러한 인자를 코드하는 유전자 중 하나의 돌연변이는 [18]표피의 기공의 발달을 변화시킬 수 있다.예를 들어, 한 유전자의 돌연변이는 더 많은 기공들을 함께 뭉치게 하여 Too Many Mouths (TMM)[17]라고 부른다. 반면, SPECHLESS 유전자의 교란은 [18]기공의 발달을 모두 방해한다.기공 생성의 활성화는 TMM/ERL을 활성화하는 EPF1의 활성화에 의해 발생할 수 있으며, 이 EPF1은 함께 YODA를 활성화하고, YODA는 SPCH를 억제하여 SPCH 활성을 감소시켜 기공 [18][19]형성을 시작하는 비대칭 세포 분열을 가능하게 한다.기공의 발달은 또한 기공이라는 세포 펩타이드 신호에 의해 조정되는데, 기공은 SPCH의 억제를 신호로 하여 [20]기공의 수를 증가시킨다.
환경적, 호르몬적 요인이 기공 발달에 영향을 미칠 수 있다.빛은 식물의 기공 발달을 증가시키는 반면, 어두운 곳에서 자라는 식물은 기공의 양이 적다.옥신은 ERL 및 TMM 수용체와 같이 수용체 수준에서 발달에 영향을 줌으로써 기공 발달을 억제한다.그러나 옥신 농도가 낮으면 가드 모세포가 균등하게 분열되어 가드세포가 [21]생성될 가능성이 높아집니다.
대부분의 배나무는 잎의 아랫부분에만 기공을 가지고 있다.포플러와 버드나무의 양면에는 모두 포플러와 버드나무가 있습니다.잎이 양쪽 잎 표면에 기공이 생기면 아래쪽 표면의 기공이 더 크고 더 많은 경향이 있지만, 종과 유전자형에 따라 크기와 빈도에 큰 차이가 있을 수 있다.하얀 화산재와 하얀 자작나무 잎은 기공이 적지만 크기가 더 컸다.반면 설탕 단풍과 은단풍은 작은 기공이 더 많았다.[22]
종류들
스토마 타입의 분류는 다릅니다.널리 사용되고 있는 것은 1889년에 줄리앙 조셉 베스크가 도입한 타입에 근거하고 있으며, Metcalfe와 [23]Chokk에 의해 한층 더 개발되었으며, 후에 다른 작가들에 의해 보완되었다.이것은 두 개의 가드 [24]셀을 둘러싸고 있는 보조 셀의 크기, 모양 및 배치를 기반으로 합니다.dicot은 다음과 같이 구분됩니다.
- 활동세포(별세포를 의미) 기공은 별과 같은 원을 형성하는 최소 5개의 방사세포로 둘러싸인 보호세포를 가지고 있다.예를 들어 에베나과에서 볼 수 있는 희귀종이다.
- 이소세포(불균등 세포) 기공은 두 개의 큰 보조 세포와 한 개의 뚜렷하게 작은 세포 사이에 보호 세포를 가지고 있다.이런 종류의 기공은 브라시카과, 솔라나과, 크라술라과를 포함한 30개 이상의 다이콧과에서 발견될 수 있다.그것은 때때로 십자형이라고 불린다.
- 비정형 세포 기공은 다른 표피 세포와 같은 크기, 모양, 배치를 가진 세포로 둘러싸인 보호 세포를 가지고 있다.이런 종류의 기공은 아포시나과, 보라긴과, 체노포디아과, 쿠쿠르비타과와 같은 100개 이상의 다이콧과에서 발견될 수 있다.라눈큘러 타입이라고 불리기도 하다.
- 확장(교차세포를 의미하는) 기공은 두 개의 보조세포로 둘러싸인 보호세포를 가지고 있으며, 각 세포는 개구부의 한쪽 끝을 둘러싸고 개구부의 중간과 서로 접촉한다.이런 종류의 기공은 Caryophyllaceae와 Acanthaceae와 같은 10개 이상의 쌍떡잎식물 과에서 발견될 수 있습니다.그것은 때때로 엽록소형이라고 불린다.
- 반생식성 기공은 주변 표피 세포와 다른 하나의 보조 세포로 둘러싸여 있으며, 기공 개구부와 평행한 길이입니다.이 유형은 예를 들어 Molluginaceae와 Aizoaceae에서 발생합니다.
- 파라시시스(평행 세포라는 뜻) 기공은 보호 세포 사이의 개구부에 평행한 하나 이상의 보조 세포를 가지고 있다.이러한 보조 세포는 가드 세포를 넘어 도달할 수도 있고 그렇지 않을 수도 있습니다.이런 종류의 기공은 루비아과, 콩볼불라과, 파바과와 같은 100개 이상의 쌍떡잎식물 과에서 발견될 수 있다.루비질 타입이라고 불리기도 합니다.
단일동물의 경우 다음과 같은 여러 가지 다른 유형의 기공이 발생합니다.
- 그라민성 또는 그라미노이드(풀과 비슷한) 기공은 두 개의 렌즈 모양의 보조 세포로 둘러싸인 두 개의 보호 세포를 가지고 있다.보호 세포는 가운데가 더 좁고 양끝이 구근이다.이 중간 부분은 매우 두꺼워졌습니다.보조 세포의 축은 평행 스토마 개구부입니다.이 유형은 Poaceae와 [25]Cyperaceae를 포함한 단일 식물 과에서 발견될 수 있습니다.
- 헥사시스(6세포를 의미) 기공은 양쪽 기공 주위에 6개의 보조세포를 가지고 있는데, 하나는 기공의 양쪽 끝에 있고, 하나는 각 기공 세포에 인접해 있으며, 하나는 마지막 보조세포와 표준 표피 세포 사이에 있다.이 유형은 일부 단조식물 과에서 발견될 수 있습니다.
- 4세포의 기공은 4개의 보조세포를 가지고 있으며, 각 보호세포 옆에 하나씩 있다.이 유형은 많은 단떡잎식물 과에서 발생하지만, 틸리아와 몇몇 단떡잎식물과 같은 일부 단떡잎식물에서도 발견될 수 있습니다.
양치식물에는 4가지 유형이 있습니다.
- 저혈구 기공은 한 층에 평범한 표피세포만 있는 두 개의 보조세포를 가지고 있지만, 표피 바깥 표면에 두 개의 보조세포가 있고, 그 사이에 모공이 있고, 기공 개구부를 덮고 있다.
- 주변 기공은 하나의 연속된 보조 세포(도넛과 같은)로 완전히 둘러싸인 두 개의 보호 세포를 가지고 있다.
- 탈모세포 기공은 끝부분(소시지처럼)이 합쳐지지 않은 하나의 보조세포로 완전히 둘러싸인 두 개의 보호세포를 가지고 있다.
- 폴로시티 기공은 주로 하나의 보조 세포로 둘러싸인 두 개의 보호 세포를 가지고 있지만, 또한 보통의 표피 세포와 접촉합니다(U 또는 말굽과 같은).
기공암호
기공암괴는 잎 표피의 움푹 들어간 부분으로, 하나 이상의 기공을 포함하고 때로는 삼염색체 또는 왁스 축적을 포함하는 챔버 형태의 구조를 형성한다.기공암괴는 기공암괴가 매우 뚜렷할 때 가뭄과 건조한 기후 조건에 적응할 수 있습니다.그러나 건조한 기후만이 그들이 발견되는 곳은 아니다.다음 식물들은 기공암호 또는 기공암호(antecamber)를 가진 종의 예입니다.네륨 올레인더, 침엽수, 그리고 [26]구름숲에서 발견되는 식물의 일종인 Drimys winteri.
병원성 경로로서의 기공
기공은 한동안 추정되었던 것처럼, 병원균이 문제없이 들어갈 수 있는 잎의 명백한 구멍이다.그러나 최근 기공이 사실은 전부는 아니더라도 일부 병원균의 존재를 의미한다는 것이 밝혀졌다.하지만, 실험에서 치명적인 박테리아가 아라비도시스 식물 잎에 적용되면서, 박테리아는 화학적인 코로나틴을 방출했고, 이것은 [27]몇 시간 안에 기공을 다시 열도록 만들었다.
기공과 기후변화
환경 요인에 대한 기공 반응
가뭄은 기공 개방을 억제하지만 중간 정도의 가뭄은 콩의 기공 폐쇄에 큰 영향을 미치지 않는다.기공 폐쇄에는 다른 메커니즘이 있습니다.낮은 습도 스트레스는 수경성 폐쇄라고 불리는 팽압 손실을 일으키는 세포를 보호한다.하이드로액티브 클로징은 전체 잎이 가뭄 스트레스의 영향을 받는 것과 대조되며, 아브시스산에 [28]의해 유발될 가능성이 가장 높다.
광합성, 식물수송(목질), 가스교환은 [29]식물의 기능에 중요한 기공 기능에 의해 조절된다.
기공은 빛에 반응하며 푸른 빛은 붉은 빛보다 거의 10배 효과적이다.연구는 이것이 푸른 빛에 대한 기공의 빛 반응이 엽록소와 같은 다른 잎 성분들과 독립적이기 때문이라고 암시한다.보호세포 원형플랫폼은 [30]칼륨을 충분히 사용할 수 있는 경우 푸른 빛 아래에서 부풀어 오른다만,여러 연구에서 칼륨 농도의 증가는 광합성 과정이 시작되기 전에 아침에 기공 개방을 증가시킬 수 있지만, 나중에 수크로스가 기공 [31]개방을 조절하는 데 더 큰 역할을 한다는 것을 뒷받침한다.
기공 밀도 및 개구부(기공 길이)는 대기 CO2 농도, 광강도, 대기 온도 및 광동작기(낮 시간 지속 시간)와 같은 다양한 환경 요인에 따라 달라집니다.[32][33]
기공 밀도 감소는 식물이 대기 중 CO2(CO2)atm[34] 농도 증가에 반응하는 한 가지 방법입니다.비록2 atm[CO] 반응의 변화가 기계적으로 가장 덜 이해되었지만, 이 기공 반응은 곧 식물의 [29][35]증산과 광합성 과정에 영향을 미칠 것으로 예상되는 곳에서 안정되기 시작했다.
기후 변화 시 향후 적응
[[29]CO2]atm는 2100년까지 500–1000ppm에 이를 것으로 예상된다. 과거 400,000년의 96%가 280ppm2 이하의 CO 수준을 경험했다.이 그림에서 볼 때, 오늘날 식물의 유전자형은 산업화 이전의 [29]친척으로부터 분리되었을 가능성이 높다.
유전자 HIC(고 이산화탄소)는 식물에서 [36]기공의 발달에 대한 부정적인 조절기를 암호화한다.Arabidopsis Thaliana를 사용한 HIC 유전자에 대한 연구는 지배적인 대립 유전자에서 기공 발달의 증가를 발견하지 못했지만, '야생형' 열성 대립 유전자에서는 둘 다 대기 중 [36]CO 수치2 상승에 반응하여 큰 증가를 보였다.이러한 연구는 식물의 CO 수준2 변화에 대한 반응이 대부분 유전학에 의해 제어된다는 것을 의미한다.
농업에 미치는 영향
COFertilizer2 효과는 대기 중 CO 수준이 증가하면2 광합성이 향상되고 증산이 감소하며 물 사용 효율(WUE)[34]이 높아지는 자유 공기 이산화탄소 농축(FACE) 실험에서 크게 과대평가되었습니다.바이오매스 증가는 [37]550ppm의2 CO에서 수확량이 5-20% 증가할 것으로 예측한 실험 시뮬레이션에서 나타난 영향 중 하나이다.잎 광합성 속도는 C3 식물에서 30~50% 증가했고, C4에서 10~25%는 CO 수준이2 [37]두 배 이하인 것으로 나타났다.피드백 메커니즘의 존재는 식물 호흡 및 기능의 [29][33]진화에 적응 특성이었을 수 있는 [CO2]atm에 반응하는 표현형 가소성을 초래한다.
적응 중 기공의 성능을 예측하는 것은 자연 및 농업 시스템 [32]모두에 대한 식물 시스템의 생산성을 이해하는 데 유용하다.식물 사육자와 농부들은 진화와 참여형 식물 사육을 통해 식량 안보 [34]문제에 직면했을 때 자연스럽게 진화할 수 있는 열과 가뭄에 강한 작물 품종과 같은 가장 적합한 종을 찾기 위해 협력하기 시작했습니다.
레퍼런스
- ^ Esau, K. (1977). Anatomy of Seed Plants. Wiley and Sons. p. 88. ISBN 978-0-471-24520-9.
- ^ Weyers, J. D. B.; Meidner, H. (1990). Methods in stomatal research. Longman Group UK Ltd. ISBN 978-0582034839.
- ^ a b Willmer, Colin; Fricker, Mark (1996). Stomata. Springer. p. 16. doi:10.1007/978-94-011-0579-8. ISBN 978-94-010-4256-7.
- ^ Fricker, M.; Willmer, C. (2012). Stomata. Springer Netherlands. p. 18. ISBN 978-94-011-0579-8. Retrieved 15 June 2016.
- ^ 데비 스와스아웃과 C.마이클 호건, 2010년기공. 지구 백과사전.전미과학환경협의회, 워싱턴 DC
- ^ N. S. CHRISTODOULAKIS; J. MENTI; B. GALATIS (January 2002). "Structure and Development of Stomata on the Primary Root of Ceratonia siliqua L." Annals of Botany. 89 (1): 23–29. doi:10.1093/aob/mcf002. PMC 4233769. PMID 12096815.
- ^ C. L. Trejo; W. J. Davies; LdMP. Ruiz (1993). "Sensitivity of Stomata to Abscisic Acid (An Effect of the Mesophyll)". Plant Physiology. 102 (2): 497–502. doi:10.1104/pp.102.2.497. PMC 158804. PMID 12231838.
- ^ Petra Dietrich; Dale Sanders; Rainer Hedrich (October 2001). "The role of ion channels in light-dependent stomatal opening". Journal of Experimental Botany. 52 (363): 1959–1967. doi:10.1093/jexbot/52.363.1959. PMID 11559731.
- ^ "Guard Cell Photosynthesis". Retrieved 2015-10-04.
- ^ Eduardo Zeiger; Lawrence D. Talbott; Silvia Frechilla; Alaka Srivastava; Jianxin Zhu (March 2002). "The Guard Cell Chloroplast: A Perspective for the Twenty-First Century". New Phytologist. 153 (3 Special Issue: Stomata): 415–424. doi:10.1046/j.0028-646X.2001.NPH328.doc.x. PMID 33863211.
- ^ Hopkin, Michael (2007-07-26). "Carbon sinks threatened by increasing ozone". Nature. 448 (7152): 396–397. Bibcode:2007Natur.448..396H. doi:10.1038/448396b. PMID 17653153.
- ^ a b c "Calculating Important Parameters in Leaf Gas Exchange". Plant Physiology Online. Sinauer. Retrieved 2013-02-24.
- ^ Waichi Agata; Yoshinobu Kawamitsu; Susumu Hakoyama; Yasuo Shima (January 1986). "A system for measuring leaf gas exchange based on regulating vapour pressure difference". Photosynthesis Research. 9 (3): 345–357. doi:10.1007/BF00029799. ISSN 1573-5079. PMID 24442366. S2CID 28367821.
- ^ Portable Gas Exchange Fluorescence System GFS-3000. Handbook of Operation (PDF), March 20, 2013
- ^ D. Edwards, H. Kerp; Hass, H. (1998). "Stomata in early land plants: an anatomical and ecophysiological approach". Journal of Experimental Botany. 49 (Special Issue): 255–278. doi:10.1093/jxb/49.Special_Issue.255.
- ^ Krassilov, Valentin A. (2004). "Macroevolutionary events and the origin of higher taxa". In Wasser, Solomon P. (ed.). Evolutionary theory and processes : modern horizons : papers in honour of Eviatar Nevo. Dordrecht: Kluwer Acad. Publ. pp. 265–289. ISBN 978-1-4020-1693-6.
- ^ a b Bergmann, Dominique C.; Lukowitz, Wolfgang; Somerville, Chris R.; Lukowitz, W; Somerville, CR (4 July 2004). "Stomatal Development and Pattern Controlled by a MAPKK Kinase". Science. 304 (5676): 1494–1497. Bibcode:2004Sci...304.1494B. doi:10.1126/science.1096014. PMID 15178800. S2CID 32009729.
- ^ a b c d e Pillitteri, Lynn Jo; Dong, Juan (2013-06-06). "Stomatal Development in Arabidopsis". The Arabidopsis Book / American Society of Plant Biologists. 11: e0162. doi:10.1199/tab.0162. ISSN 1543-8120. PMC 3711358. PMID 23864836.
- ^ Casson, Stuart A; Hetherington, Alistair M (2010-02-01). "Environmental regulation of stomatal development". Current Opinion in Plant Biology. 13 (1): 90–95. doi:10.1016/j.pbi.2009.08.005. PMID 19781980.
- ^ Sugano, Shigeo S.; Shimada, Tomoo; Imai, Yu; Okawa, Katsuya; Tamai, Atsushi; Mori, Masashi; Hara-Nishimura, Ikuko (2010-01-14). "Stomagen positively regulates stomatal density in Arabidopsis". Nature. 463 (7278): 241–244. Bibcode:2010Natur.463..241S. doi:10.1038/nature08682. hdl:2433/91250. ISSN 0028-0836. PMID 20010603. S2CID 4302041.
- ^ Balcerowicz, M.; Ranjan, A.; Rupprecht, L.; Fiene, G.; Hoecker, U. (2014). "Auxin represses stomatal development in dark-grown seedling via Aux/IAA proteins". Development. 141 (16): 3165–3176. doi:10.1242/dev.109181. PMID 25063454.
- ^ Pallardy, Stephen. Physiology of Woody Plants. p. 14.
- ^ Metcalfe, C.R.; Chalk, L. (1950). Anatomy of Dicotyledons. Vol. 1: Leaves, Stem, and Wood in relation to Taxonomy, with notes on economic Uses.
- ^ van Cotthem, W.R.F. (1970). "A Classification of Stomatal Types". Botanical Journal of the Linnean Society. 63 (3): 235–246. doi:10.1111/j.1095-8339.1970.tb02321.x.
- ^ Nunes, Tiago D. G.; Zhang, Dan; Raissig, Michael T. (February 2020). "Form, development and function of grass stomata". The Plant Journal. 101 (4): 780–799. doi:10.1111/tpj.14552. PMID 31571301.
- ^ Roth-Nebelsick, A.; Hassiotou, F.; Veneklaas, E. J (2009). "Stomatal crypts have small effects on transpiration: A numerical model analysis". Plant Physiology. 151 (4): 2018–2027. doi:10.1104/pp.109.146969. PMC 2785996. PMID 19864375.
- ^ Maeli Melotto; William Underwood; Jessica Koczan; Kinya Nomura; Sheng Yang He (September 2006). "Plant Stomata Function in Innate Immunity against Bacterial Invasion". Cell. 126 (5): 969–980. doi:10.1016/j.cell.2006.06.054. PMID 16959575. S2CID 13612107.
- ^ Principles of Plant Nutrition. Springer. 2001. p. 223.
- ^ a b c d e Rico, C; Pittermann, J; Polley, HW; Aspinwall, MJ; Fay, PA (2013). "The effect of subambient to elevated atmospheric CO2 concentration on vascular function in Helianthus annuus: implications for plant response to climate change". New Phytologist. 199 (4): 956–965. doi:10.1111/nph.12339. PMID 23731256.
- ^ McDonald, Maurice S. (2003). Photobiology of Higher Plants. Wiley. p. 293.
- ^ Principles of Plant Nutrition. Springer. 2001. p. 205.
- ^ a b Buckley, TN; Mott, KA (2013). "Modelling stomatal conductance in response to environmental factors". Plant, Cell and Environment. 36 (9): 1691–1699. doi:10.1111/pce.12140. PMID 23730938.
- ^ a b Rogiers, SY; Hardie, WJ; Smith, JP (2011). "Stomatal density of grapevine leaves (Vitis Vinifera L.) responds to soil temperature and atmospheric carbon dioxide". Australian Journal of Grape and Wine Research. 17 (2): 147–152. doi:10.1111/j.1755-0238.2011.00124.x.
- ^ a b c Ceccarelli, S; Grando, S; Maatougui, M; Michael, M; Slash, M; Haghparast, R; Rahmanian, M; Taheri, A; Al-Yassin, A; Benbelkacem, A; Labdi, M; Mimoun, H; Nachit, M (2010). "Plant breeding and climate changes". The Journal of Agricultural Science. 148 (6): 627–637. doi:10.1017/s0021859610000651. S2CID 86237270.
- ^ Serna, L; Fenoll, C (2000). "Coping with human CO2 emissions". Nature. 408 (6813): 656–657. doi:10.1038/35047202. PMID 11130053. S2CID 39010041.
- ^ a b Gray, J; Holroyd, G; van der Lee, F; Bahrami, A; Sijmons, P; Woodward, F; Schuch, W; Hetherington, A (2000). "The HIC signalling pathway links CO2 perception to stomatal development". Nature. 408 (6813): 713–716. Bibcode:2000Natur.408..713G. doi:10.1038/35047071. PMID 11130071. S2CID 83843467.
- ^ a b Tubiello, FN; Soussana, J-F; Howden, SM (2007). "Crop and pasture response to climate change". Proceedings of the National Academy of Sciences of the United States of America. 104 (50): 19686–19690. Bibcode:2007PNAS..10419686T. doi:10.1073/pnas.0701728104. PMC 2148358. PMID 18077401.