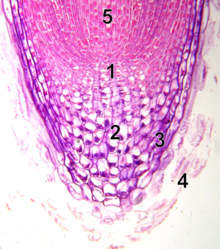
메리스템
Meristem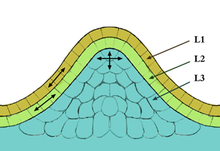
자낭은 식물에서 발견되는 조직의 일종이다.그것은 세포 분열이 가능한 미분화 세포(세균 세포)로 구성되어 있다.체내 세포는 식물에서 발생하는 다른 모든 조직과 장기로 발전할 수 있다.이 세포들은 분화할 때까지 계속 분열하다가 분열 능력을 잃는다.
분화된 식물 세포는 일반적으로 다른 종류의 세포를 분열시키거나 생산할 수 없다.연동 세포는 분화되지 않거나 불완전하게 분화된다.그들은 전능하며 지속적인 세포 분열을 할 수 있다.체간세포의 분열은 조직의 확장과 분화를 위한 새로운 세포를 제공하고 식물체의 기본 구조를 제공하는 새로운 장기의 개시를 위한 새로운 세포를 제공한다.세포는 작으며, 액포도 없거나 작은 액포도 없고 원형질도 세포를 완전히 채웁니다.색소체(염소체 또는 색소체)는 분화되지 않지만 기본적인 형태(프로플라스티드)로 존재한다.분열 세포는 세포간 공간 없이 촘촘히 채워져 있다.세포벽은 매우 얇은 1차 세포벽이다.
메리스템이라는 용어는 1858년 칼 빌헬름 폰 나겔리 (1817–1891)에 의해 그의 책 Beitrége zur Wissenschaftliken Botanik ("과학 식물학에 대한 공헌")[1]에서 처음 사용되었습니다.그것은 고유의 [citation needed]기능을 인식하여 분할한다는 뜻의 그리스어 merizein(μμδδδδδδα)에서 유래했다.
세 가지 유형의 연골 조직이 있습니다: 첨두부(끝 부분), 연간 또는 기저부(중간 부분), 그리고 측면부(옆 부분).분주기 정상에는, 천천히 분열하는 세포들로 이루어진 작은 그룹이 있는데, 이것은 보통 중앙 영역이라고 불립니다.이 구역의 세포들은 줄기세포 기능을 가지고 있고, 자궁 내막 유지에 필수적이다.메리스템 서밋의 확산과 성장률은 보통 주변국과는 상당히 다르다.
정점 연공
정점수명은 식물에서 완전히 구별되지 않은(미확정)수명입니다.이것들은 세 가지 주요 메리스템으로 구분됩니다.1차적인 메리스템은 2차적인 메리스템 타입은 2차 체공이다.이러한 2차적 연공은 측방향 성장에 관여하기 때문에 측방향 연공으로도 알려져 있다.
두 종류의 정점근막조직이 있습니다: 잎과 꽃과 같은 장기를 만드는 정점근막조직과 미래의 뿌리 성장을 위한 정점근막세포를 제공하는 정점근막조직입니다.SAM 셀과 RAM 셀은 급속히 분할되어 정의되어 있는 엔드 상태가 없기 때문에 불확정적인 것으로 간주됩니다.그런 의미에서, 연골 세포는 유사한 행동과 기능을 가진 동물의 줄기세포와 자주 비교된다.
꼭대기 층은 식물의 종류에 따라 층수가 다른 층으로 층을 이룬다.일반적으로 가장 바깥쪽 층은 튜니카라고 불리는 반면 가장 안쪽 층은 말뭉치이다.단일 동식물에서 튜니카는 잎 가장자리와 가장자리의 물리적 특성을 결정합니다.쌍떡잎에서 말뭉치의 레이어 2는 잎 가장자리의 특성을 결정한다.말뭉치와 튜니카는 모든 식물 세포가 체내에서 형성되기 때문에 식물의 물리적 외관상 중요한 부분을 담당한다.꼭대기 연골은 뿌리와 줄기 두 곳에서 발견됩니다.일부 북극 식물들은 식물의 하단/중간 부분에 첨단을 가지고 있다.이런 종류의 자외선은 북극에서 [citation needed]유리하기 때문에 진화한 것으로 생각된다.
정점 연수를 쏘다

새싹은 잎과 꽃과 같은 모든 지상 기관의 근원입니다.꼭대기 꼭대기의 세포는 주변 주변 영역에 줄기세포 역할을 하며, 그곳에서 빠르게 증식하고 분화 잎이나 꽃 원생에 통합됩니다.
새싹 끝부분의 자낭은 꽃이 [citation needed]피는 식물에서 태아 발생의 대부분의 장소이다.잎, 꽃잎, 꽃잎, 수술, 난소의 원시는 플라스토크로니라고 불리는 시간 간격마다 1개의 비율로 이곳에서 시작됩니다.꽃의 발육에 대한 최초의 징후가 나타나는 곳이다.이러한 징후들 중 하나는 첨단의 우성의 상실과 그렇지 않은 휴면 세포의 방출일 수 있으며, 첨단의 돔에서 두세 개 정도 떨어진 원시 축삭에 있는 일부 종에서 보조 촬영 경사로 발달할 수 있다.
촬영 첨단의 연공은 4개의 서로 다른 세포군으로 구성됩니다.
- 줄기세포
- 줄기세포의 직계 딸 세포는
- 인접 조직 센터
- ·주변지역 장기개시세포 설립
이들 4개의 별개의 구역은 복잡한 신호 전달 경로에 의해 유지됩니다.아라비도시스탈리아나는 [2]세포분열속도를 제어함으로써 샷피칼 메리스템 내 줄기세포 저장소의 크기를 조절하기 위해 3개의 상호작용하는 CLAVATA 유전자가 필요하다.CLV1 및 CLV2는 CLV3가 [3][4][5]배위자인 수용체 복합체(LR 수용체 유사 키나제 패밀리)를 형성할 것으로 예측된다.CLV3는 옥수수의 ESR 단백질과 일부 상동성을 공유하며,[6][7] 단백질 사이에 보존되는 짧은 14개의 아미노산 영역이 있습니다.이러한 보존 영역을 포함하는 단백질은 CLE 계열의 [6][7]단백질로 그룹화되었습니다.
CLV1은 다운스트림 시그널링에 관여할 가능성이 가장 높은 여러 세포질 단백질과 상호작용하는 것으로 나타났다.예를 들어 CLV 복합체는 Rho/Rac의 작은 GTPase 관련 [2]단백질과 관련이 있는 것으로 밝혀졌다.이러한 단백질은 CLV 복합체와 마이트젠 활성화 단백질 키나제(MAPK) 사이의 중간체 역할을 할 수 있으며, 마이트젠 활성화 단백질 키나제는 종종 신호 [8]전달 캐스케이드에 관여한다.KAPP는 CLV1과 [9]상호작용하는 것으로 나타난 키나아제 관련 단백질 포스파타아제이다.[9]
식물 체내 유지에서 또 다른 중요한 유전자는 WUSCHEL(WUS로 줄임말)로 CLV를 적극적으로 조절하는 것 외에 CLV 시그널링의 표적이 되어 피드백 [10]루프를 형성한다.WUS는 체내 줄기세포 아래의 세포에서 발현되며, 그 존재는 줄기세포의 [10]분화를 방해한다.CLV1은 줄기세포를 [2]포함한 중심부 밖에서 WUS 활동을 억제함으로써 세포 분화를 촉진하는 역할을 한다.
샷피칼 메리스템에서의 WUS의 기능은 피토호르몬 사이토키닌과 관련되어 있습니다.사이토키닌은 히스티딘 인산화효소를 활성화하여 히스티딘 인산화 단백질을 [11]인산화한다.이어서 인산기는 두 가지 유형의 Arabidopsis 응답 조절제(ARR)로 이동된다.타입 B의 ARS 및 타입 A의 ARR.B형 ARR은 A-ARR을 포함한 사이토키닌의 하류 유전자를 활성화하기 위한 전사 인자로 작용하며, A-ARR은 구조적으로 B-ARR과 유사하지만, A-ARR은 B-ARR이 가지고 있는 DNA 결합 도메인을 포함하지 않아 전사 [12]인자로 기능한다.따라서 A-ARR은 전사의 활성화에 기여하지 않으며, 포스포트랜스퍼트 단백질로부터 인산염과 경쟁함으로써 B-ARR의 [13]기능을 억제한다.SAM에서 B-ARR은 줄기세포 동일성을 [14]유도하는 WUS 발현을 유도한다.다음으로 WUS는 A-ARR을 [15]억제합니다.그 결과, B-ARR이 억제되지 않게 되어, 숏피칼 메리스템의 중앙에서 지속적인 사이토키닌 시그널링이 발생한다.CLAVATA 시그널링과 함께 이 시스템은 네거티브 피드백 루프로서 기능합니다.사이토키닌 시그널링은 WUS에 의해 적극적으로 강화되어 사이토키닌 시그널링의 억제를 방지하고, WUS는 CLV3 형태로 자체 억제제를 촉진하여 궁극적으로 WUS와 사이토키닌 시그널링을 [16]억제한다.
근첨부 연골
정점근막과는 달리, 뿌리 정점근막은 2차원의 세포를 생산합니다.그것은 대기중심세포라고 불리는 조직중심 주위에 두 개의 줄기세포 풀을 가지고 있고, 함께 성체 [17][18]뿌리에서 대부분의 세포를 생산한다.그 꼭대기에서, 뿌리줄기는 그것의 성장 궤적을 보호하고 이끄는 뿌리모자에 의해 덮여 있습니다.세포는 루트 캡의 바깥쪽 표면에서 연속적으로 슬러시됩니다.QC 세포는 낮은 유사분열 활성을 특징으로 합니다.증거는 QC가 아직 발견되지 않은 신호를 통해 줄기세포 분화를 방지함으로써 주변 줄기세포를 유지한다는 것을 시사한다.이를 통해 지속적인 뿌리 성장에 필요한 체내에서 새로운 세포를 지속적으로 공급할 수 있습니다.최근의 연구결과는 QC가 줄기세포의 저장고 역할을 하여 손실되거나 [19]손상된 것을 보충할 수 있다는 것을 보여준다.근첨근 및 조직 패턴은 1차근의 경우 배아에서, 2차근의 경우 새로운 측근 원초에서 확립된다.
월간 연골
혈관 배지에서, 간기(때로는 기저라고 불리기도 함)는 절점과 잎날개의 기부에 있는 단일 식물 줄기에서 발생합니다.호세테일과 웰위치아 또한 주기적 성장을 보인다.중간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체간 체대나무의 절점에 있는 중간 경혈은 빠른 줄기 신장을 가능하게 하는 반면, 대부분의 풀잎 날개의 밑부분에 있는 경혈은 손상된 잎이 빠르게 다시 자라도록 합니다.풀에서 다시 자라는 이 잎은 방목하는 초식동물에 의한 피해에 반응하여 진화했다.
플로럴 메리스템
식물이 꽃을 피우기 시작할 때, 새싹의 자낭은 꽃받침, 꽃잎, 수술, 그리고 꽃차례를 생산하는 꽃받침을 생산하는 꽃받침으로 변합니다.
식물성 수생 및 일부 꽃 수생과 달리, 꽃 수생은 무한히 자랄 수 없습니다.그들의 성장은 특정한 크기와 형태를 가진 꽃에 한정된다.꽃줄기에서 꽃줄기로의 전환은 꽃줄기세포의 생성 종료를 야기하는 꽃줄기세포의 정체성 유전자를 필요로 한다.AGAMLY(AGAMLY)는 꽃의 자낭 종단에 필요한 꽃의 동종 유전자이며 수술과 카르펠의 적절한 [2]발달을 위해 필요하다.AG는 꽃차례의 꽃차례로의 전환을 막기 위해 필요하지만, 동일 유전자 LEAPY(LFY)와 WUS이며 꽃차례의 중심 또는 안쪽 두 개의 [20]꽃차례로 제한된다.이 방법으로 꽃의 정체성과 지역특성을 달성할 수 있습니다.WUS는 AG의 두 번째 인트론에서 컨센서스 시퀀스에 바인드하여 AG를 활성화하고 LFY는 인접 인식 [20]사이트에 바인드한다.일단 AG가 활성화되면 Meristem이 [20]종료되는 WUS의 발현을 억제합니다.
몇 년 동안 과학자들은 경제적인 이유로 꽃꽂이를 조작해 왔다.예를 들어 돌연변이 담배 식물인 "메릴랜드 매머드"가 있다.1936년 스위스의 농업부는 이 식물과 함께 여러 가지 과학적 실험을 수행했다."메릴랜드 매머드"는 다른 담배 식물보다 훨씬 빨리 자란다는 점에서 특이하다.
정점 우위
정점 우위는 한 체공이 다른 체공의 성장을 막거나 억제하는 것이다.그 결과 플랜트에는 명확하게 정의된 메인트렁크가1개 있어요예를 들어, 나무에서, 주 줄기의 끝은 우세한 새싹을 가지고 있습니다.따라서, 줄기의 끝은 빠르게 자라며 나뭇가지에 의해 그늘지지 않습니다.지배적인 자낭이 끊어지면 하나 이상의 가지 끝부분이 지배적이 됩니다.브랜치 성장이 빨라지고 새로운 성장이 수직화될 것입니다.시간이 지남에 따라 브랜치는 점점 메인트렁크의 확장처럼 보일 수 있습니다.종종 몇몇 가지에서 첨단을 제거한 후에 이러한 동작을 보여서 무성하게 성장합니다.
꼭대기 우위의 메커니즘은 식물 성장 조절제의 유형인 옥신에 기초한다.이것들은 정점근에서 생성되어 캠비움 뿌리 쪽으로 운반된다.꼭대기 우위가 완전하면 꼭대기 자루가 활성화되어 있는 한 가지가 형성되는 것을 방지합니다.우위가 불완전하면 곁가지가 [citation needed]발달합니다.
근첨부의 우성과 가지 조절에 대한 최근의 연구는 스트리골락톤이라고 불리는 새로운 식물 호르몬 패밀리를 밝혀냈다.이들 화합물은 이전에는 종자 발아 및 균근균과의 소통에 관여하는 것으로 알려졌으며, 현재는 [21]분기의 억제에 관여하는 것으로 나타났다.
메리스템 아키텍처의 다양성
SAM은 줄기세포 집단을 포함하고 있으며, 줄기세포가 늘어나는 동안 측면 연공을 생성하기도 한다.줄기세포 번호의 조절 메커니즘은 진화적으로 보존될 수 있습니다.아라비도시스탈리아나의 줄기세포 개체군을 유지하는 CLAVATA 유전자 CLV2는 같은 [22]기능에 관여하는 옥수수 유전자 FASCIATED EAR2(FEA2)와 매우 밀접하게 관련되어 있다.마찬가지로 쌀에서 FON1-FON2 시스템은 아라비도시스 탈리아나의 [23]CLV 신호 시스템과 밀접한 관계가 있는 것으로 보인다.이러한 연구는 줄기세포 수, 정체성 및 분화의 조절이 혈관 배설이 아니더라도 단일 식물에서 진화적으로 보존된 메커니즘일 수 있음을 시사한다.쌀은 또한 줄기세포 [23]수를 조절하는 데 관여하는 FON1-FON2와 다른 유전자 시스템을 포함하고 있다.이 예는 생활 속에서 항상 진행되는 혁신을 강조하고 있습니다.
KNOX 계열 유전자의 역할
유전자 검사는 이 기능에서 녹스 계열에 속하는 유전자를 확인했습니다.이 유전자들은 본질적으로 줄기세포를 분화되지 않은 상태로 유지한다.KNOX 패밀리는 전체적인 메커니즘을 거의 비슷하게 유지하면서 상당히 진화적인 다양화를 거쳤습니다.녹스과의 일원들은 아라비도시스 탈리아나, 쌀, 보리, 토마토와 같은 다양한 식물에서 발견되었다.녹스 유사 유전자는 일부 조류, 이끼, 양치식물, 나체식물에도 존재한다.이러한 유전자의 양성애 억제는 흥미로운 형태학적 특징의 형성을 이끈다.예를 들어, Antirrhinae의 종들 중에서 Antirrhinum의 종들만이 꽃 지역에서 spur라고 불리는 구조를 가지고 있지 않다.자극은 꽃가루 매개자의 특이성과 매력을 정의하기 때문에 진화적 혁신으로 간주됩니다.연구진은 대마조스(Antirrhinum majus)에서 트랜스포존 돌연변이 발생을 실시했고, 일부 삽입이 대마조스(Antirhinum majus)의 다른 대마조스(Antirrhinae)[24]와 매우 유사한 박차를 형성하도록 하는 것을 발견했는데, 이는 야생 대마조류 개체군의 박동력 상실이 아마도 진화적 혁신일 수 있다는 것을 보여준다.
KNOX 패밀리는 잎 모양의 진화에도 관여하고 있습니다(자세한 내용은 아래 참조).한 연구는 단순한 잎을 가진 A. 탈리아나와 복잡한 잎을 가진 식물인 카다민 히르수타의 녹스 유전자 발현 패턴을 조사했다.A. 탈리아나에서는 잎에서는 녹스 유전자가 완전히 꺼지지만, C.hirsuta에서는 그 표현이 계속되어 복잡한 [25]잎이 생성된다.또한 KNOX 발현과 복잡한 잎 형태학 [26]사이에는 밀접한 상관관계가 있기 때문에 KNOX 유전자 작용의 메커니즘이 모든 혈관 식물에 걸쳐 보존되어야 한다고 제안되어 왔다.
프라이머리 메리트
첨단의 메리스템은 3종류의 프라이머리 메리스템으로 구분할 수 있습니다.
- 원표피: 줄기 바깥쪽에 있고 표피로 발달합니다.
- 프로캄비움: 원배엽 바로 안에 있으며 1차 목질부와 1차 인골로 발달합니다.그것은 또한 혈관 캠비움, 2차 순환인 코르크 캠비움도 생산한다.코르크 캠비움(cark cambium)은 껍질(안쪽)과 껍질(chellem) 또는 코르크(cork)로 더욱 구별됩니다.이들 3층(코크 캠비움, 펠렘, 필로더피)은 모두 주피를 구성한다.뿌리에서, 프로캄비움은 또한 에우디코트에서 [27]측면 뿌리를 생성하는 주변 자전거를 발생시킬 수 있습니다.
- 그라운드 메리스템: 피질과 요철로 발달합니다.실질 조직,[27] 결장 조직 및 조직 조직 세포로 구성됩니다.
이러한 메리스템은 과학자 조셉 D에 의해 발견된 1차 성장, 즉 길이 또는 높이의 증가에 책임이 있다.1943년 [citation needed]노스 캐롤라이나의 카.
이차 수명
2차 연골에는 두 가지 유형이 있는데, 이것들은 식물의 확립된 줄기를 둘러싸고 가로로 자라게 하기 때문에 가로 연골이라고도 불린다(즉, 지름이 더 크다.
- 2차 목질과 2차 인골을 생성하는 혈관 캠비움.이는 플랜트의 수명 내내 계속될 수 있는 프로세스입니다.이것이 식물에서 목재를 발생시키는 원인이다.그러한 식물은 수목과라고 불린다.이것은 2차 성장을 거치지 않는 식물에서는 일어나지 않는다.
- 코르크 캠비움, 표피를 대체하는 주피를 발생시킵니다.
미스테름의 무한 성장
비록 각각의 식물은 일정한 규칙에 따라 자라지만, 각각의 새로운 뿌리와 새싹은 살아있는 한 계속 자랄 수 있다.많은 식물에서, 간헐적 성장은 잠재적으로 불확실하므로, 식물의 전체적인 모양이 미리 결정되지 않는다.이것이 주된 성장입니다.1차 성장은 식물의 몸체와 장기 형성을 연장시킨다.모든 식물 장기는 궁극적으로 정점 연골의 세포 분열로부터 발생하며, 그 뒤에 세포의 팽창과 분화가 뒤따른다.1차 성장은 많은 식물의 꼭대기 부분을 발생시킨다.
질소 고정 뿌리의 대두, 완두 콩 같은 콩과 식물 식물의 성장 또는 불확정한 한정된다.따라서, 대두(이나 콩, 로터스의 절지 동물.)(구면),branched 혈관 시스템은 중앙 감염된 지역 주변으로 한정된 결절을 생산한다.종종, 뿌리혹 박테리아 감염된 세포는 오직 작은 액포가 있다.대조적으로, 완두 콩, 클로버, 개자리 속 truncatula에 결절(시간이 좀 적어도)는 뿌리혹 박테리아 감염으로 새로운 세포를 산출하는 적극적인 분열을 유지하기 위해 불확정하고 있다.그 소절에 그러므로 성숙함의 구역이 존재해요.Infected 세포는 보통 큰 액포를 가지고 있습니다.그 공장은 혈관계 및 주변 분지다.
클로닝
적절한 조건 하에 각 촬영 경정의 완전한 새로운 식물이나 복제에서 발전할 수 있습니다그러한 새 식물는 생장점이 포함된 촬영 꽃꽂이로 성장할 수 있습니다.뿌리 끝 meristems 쉽게 그러나 복제되지 않고 있다.이 복제와 널리 원예학에 바람직한 유전자 타입의 식물을 대량 생산하기 위해 행해진다 무성 생식 또는 영양 생식이라 불린다.이 과정 또한 mericloning으로 알려져 있다.
영양 번식의 이차 분열 조직 형성층의. 세포로부터 뿌리나 쏘생산 시작을 오려낸 것을 통해 Propagating 다른 형태이다.왜 기초'shoot-borne 벌채 'wounding 자주 뿌리 형성 보조 장치다.[28]
유도 meristems
콩, 연꽃, 완두콩, 그리고 메디카고 트랑카툴라 같은 콩과 같은 콩 뿌리에서 흔히 [citation needed]루조비아라고 불리는 토양 박테리아에 감염된 후 메리스템이 유도될 수도 있습니다.발달하는 뿌리 끝 바로 뒤에 있는 소위 "결절의 창"에 있는 내피질 또는 외피질의 세포들이 분열하도록 유도된다.중요한 신호 물질은 상호 작용의 특이성을 허용하기 위해 사이드 그룹으로 장식된 리포-올리고당 노드 인자입니다.Nod factor 수용체 단백질 NFR1과 NFR5는 Lotus Japonicus, Medicago Truncatula 및 콩(Glycine max)을 포함한 여러 콩류에서 복제되었다.결절 경구 조절은 AON(Auto Regulation of Nodulation)으로 알려진 장거리 조절을 사용합니다.이 과정은 LRR 수용체 키나아제(LjHAR1, GmNARCK 및 MtSUNN), CLV1, 2, 3 시스템에서 볼 수 있는 것과 유사한 CLE 펩타이드 신호 전달 및 KAPP 상호작용을 포함한다.LjKLAVIER는 또한 결절 조절 표현형을 나타내지만, 이것이 다른 AON 수용체 키나아제들과 어떻게 관련이 있는지는 아직 알려져 있지 않다.
「 」를 참조해 주세요.
레퍼런스
- ^ Galun, Esra(2007)식물 패턴 형성: 구조 및 분자 유전학적 측면.세계과학출판사, 페이지 333 ISBN9789812704085
- ^ a b c d Fletcher, J. C. (2002). "Shoot and Floral Meristem Maintenance in Arabidopsis". Annu. Rev. Plant Biol. 53: 45–66. doi:10.1146/annurev.arplant.53.092701.143332. PMID 12221985.
- ^ Clark SE, Williams RW, Meyerowitz E (1997). "The CLAVATA1 gene encodes a putative receptor kinase that controls shoot and floral meristem size in Arabidopsis". Cell. 89 (4): 575–85. doi:10.1016/S0092-8674(00)80239-1. PMID 9160749. S2CID 15360609.
- ^ Jeong S, Trotochaud AE, Clark S (1999). "The Arabidopsis CLAVATA2 gene encodes a receptor-like protein required for the stability of the CLAVATA1 receptor-like kinase". Plant Cell. 11 (10): 1925–33. doi:10.1105/tpc.11.10.1925. PMC 144110. PMID 10521522.
- ^ Fletcher JC, Brand U, Running MP, Simon R, Meyerowitz EM (1999). "Signaling of cell fate decisions by CLAVATA3 in Arabidopsis shoot meristems". Science. 283 (5409): 1911–14. Bibcode:1999Sci...283.1911F. doi:10.1126/science.283.5409.1911. PMID 10082464.
- ^ a b J. Mark Cock; Sheila McCormick (July 2001). "A Large Family of Genes That Share Homology with CLAVATA3". Plant Physiology. 126 (3): 939–942. doi:10.1104/pp.126.3.939. PMC 1540125. PMID 11457943.
- ^ a b Karsten Oelkers, Nicolas Goffard, Georg F Weiller, Peter M Gresshoff, Ulrike Mathesius and Tancred Frickey (3 January 2008). "Bioinformatic Analysis of the CLE signalling peptide family". BMC Plant Biology. 8: 1. doi:10.1186/1471-2229-8-1. PMC 2254619. PMID 18171480.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Valster, A. H.; et al. (2000). "Plant GTPases: the Rhos in bloom". Trends in Cell Biology. 10 (4): 141–146. doi:10.1016/s0962-8924(00)01728-1. PMID 10740268.
- ^ a b Stone, J. M.; et al. (1998). "Control of meristem development by CLAVATA1 receptor kinase and kinase-associated protein phosphatase interactions". Plant Physiology. 117 (4): 1217–1225. doi:10.1104/pp.117.4.1217. PMC 34886. PMID 9701578.
- ^ a b Mayer, K. F. X; et al. (1998). "Role of WUSCHEL in Regulating Stem Cell Fate in the Arabidopsis Shoot Meristem". Cell. 95 (6): 805–815. doi:10.1016/S0092-8674(00)81703-1. PMID 9865698. S2CID 18995751.
- ^ Sheen, Jen; Hwang, Ildoo (September 2001). "Two-component circuitry in Arabidopsis cytokinin signal transduction". Nature. 413 (6854): 383–389. Bibcode:2001Natur.413..383H. doi:10.1038/35096500. ISSN 1476-4687. PMID 11574878. S2CID 4418158.
- ^ Lohmann, Jan U.; Kieber, Joseph J.; Demar, Monika; Andreas Kehle; Stehling, Sandra; Busch, Wolfgang; To, Jennifer P. C.; Leibfried, Andrea (December 2005). "WUSCHEL controls meristem function by direct regulation of cytokinin-inducible response regulators". Nature. 438 (7071): 1172–1175. Bibcode:2005Natur.438.1172L. doi:10.1038/nature04270. ISSN 1476-4687. PMID 16372013. S2CID 2401801.
- ^ Kieber, Joseph J.; Ecker, Joseph R.; Alonso, Jose M.; Schaller, G. Eric; Mason, Michael G.; Deruère, Jean; Ferreira, Fernando J.; Haberer, Georg; To, Jennifer P. C. (2004-03-01). "Type-A Arabidopsis Response Regulators Are Partially Redundant Negative Regulators of Cytokinin Signaling". The Plant Cell. 16 (3): 658–671. doi:10.1105/tpc.018978. ISSN 1040-4651. PMC 385279. PMID 14973166.
- ^ Jurgens, G.; Berger, J.; Mayer, K. F.; Laux, T. (1996-01-01). "The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis". Development. 122 (1): 87–96. doi:10.1242/dev.122.1.87. ISSN 0950-1991. PMID 8565856.
- ^ Jackson, David; Simon, Rüdiger; Je, Byoung Il; Somssich, Marc (2016-09-15). "CLAVATA-WUSCHEL signaling in the shoot meristem". Development. 143 (18): 3238–3248. doi:10.1242/dev.133645. ISSN 0950-1991. PMID 27624829.
- ^ Gordon, S. P.; Chickarmane, V. S.; Ohno, C.; Meyerowitz, E. M. (2009-08-26). "Multiple feedback loops through cytokinin signaling control stem cell number within the Arabidopsis shoot meristem". Proceedings of the National Academy of Sciences. 106 (38): 16529–16534. Bibcode:2009PNAS..10616529G. doi:10.1073/pnas.0908122106. ISSN 0027-8424. PMC 2752578. PMID 19717465.
- ^ Sebastian, Jose; Lee, Ji-Young (2013). "Root Apical Meristems". eLS. doi:10.1002/9780470015902.a0020121.pub2. ISBN 978-0470016176.
- ^ Bennett, Tom; Scheres, Ben (2010). "Root development-two meristems for the price of one?". Current Topics in Developmental Biology. 91: 67–102. doi:10.1016/S0070-2153(10)91003-X. ISBN 9780123809100. PMID 20705179.
- ^ Heidstra, Renze; Sabatini, Sabrina (2014). "Plant and animal stem cells: similar yet different". Nature Reviews Molecular Cell Biology. 15 (5): 301–12. doi:10.1038/nrm3790. PMID 24755933. S2CID 34386672.
- ^ a b c 로만, J. U. 등(2001) Arabidopsis Cell 105의 줄기세포 조절과 꽃무늬의 분자적 연관성: 793-803
- ^ "Branching out: new class of plant hormones inhibits branch formation". Nature. 455 (7210). 2008-09-11. Retrieved 2009-04-30.
- ^ Taguchi-Shiobara; Yuan, Z; Hake, S; Jackson, D; et al. (2001). "The fasciated ear2 gene encodes a leucine-rich repeat receptor-like protein that regulates shoot meristem proliferation in maize". Genes & Development. 15 (20): 2755–2766. doi:10.1101/gad.208501. PMC 312812. PMID 11641280.
- ^ a b Suzaki T.; Toriba, T; Fujimoto, M; Tsutsumi, N; Kitano, H; Hirano, HY (2006). "Conservation and Diversification of Meristem Maintenance Mechanism in Oryza sativa: Function of the FLORAL ORGAN NUMBER2 Gene". Plant and Cell Physiol. 47 (12): 1591–1602. doi:10.1093/pcp/pcl025. PMID 17056620.
- ^ Golz J.F.; Keck, Emma J.; Hudson, Andrew (2002). "Spontaneous Mutations in KNOX Genes Give Rise to a Novel Floral Structure in Antirrhinum". Curr. Biol. 12 (7): 515–522. doi:10.1016/S0960-9822(02)00721-2. PMID 11937019. S2CID 14469173.
- ^ Hay and Tsiantis; Tsiantis, M (2006). "The genetic basis for differences in leaf form between Arabidopsis thaliana and its wild relative Cardamine hirsuta". Nat. Genet. 38 (8): 942–947. doi:10.1038/ng1835. PMID 16823378. S2CID 5775104.
- ^ Bharathan G, et al. (2002). "Homologies in Leaf Form Inferred from KNOXI Gene Expression During Development". Science. 296 (5574): 1858–1860. Bibcode:2002Sci...296.1858B. doi:10.1126/science.1070343. PMID 12052958. S2CID 45069635.
- ^ a b 에버트, 레이, 그리고 수잔 아이히혼.까마귀의 식물 생물학.뉴욕: W. H. Freeman and Company, 2013.인쇄.
- ^ Mackenzie, K.A.D; Howard, B.H (1986). "The Anatomical Relationship Between Cambial Regeneration and Root Initiation in Wounded Winter Cuttings of the Apple Rootstock M.26". Annals of Botany. 58 (5): 649–661. doi:10.1093/oxfordjournals.aob.a087228.
각주
- 텍사스 대학의 식물 해부학 연구소, JD 마우스의 연구실.식물 세포와 조직의 현미경 사진, 설명 텍스트 포함.
- Schoof, Heiko; Lenhard, M; Haecker, A; Mayer, KF; Jürgens, G; Laux, T (2000). "Arabidopsis shoot meristems is maintained by a regulatory loop between Clavata and Wuschel genes". Cell. 100 (6): 635–644. doi:10.1016/S0092-8674(00)80700-X. PMID 10761929. S2CID 8963007.
- 스코필드와 머레이(2006).진화하는 메리스템의 개념.식물 분자생물학 60:v~viii
- Meristemania.org 메리스템 조사