녹색황세균
Green sulfur bacteria| 녹색황세균 | |
|---|---|
 | |
| Winogradsky 기둥에 있는 녹색 유황 박테리아 | |
| 과학적 분류 | |
| 도메인: | 박테리아 |
| (순위 미지정): | 박테로이드타-클로로비오타군 |
| 문: | 클로로비오타 이리노 외 2021년[3] |
| 클래스: | '염소공포증' 개리티 앤 홀트 2001[2] |
| 주문: | 클로로비알레스 Gibbons and Murray 1978(1980년 [1]승인 리스트) |
| 패밀리와 속 | |
| 동의어 | |
| |
녹색 유황 박테리아는 [4]유황을 대사하는 필수 혐기성 광자영양균의 문이다.
녹색 유황 박테리아는 (활공할 수 있는 클로로헤르페톤 탈칼륨 제외) 비운동성이며, 비산소 [4][5]광합성을 할 수 있습니다.그들은 혐기성 수중 [6]환경에서 산다.식물과 달리 녹황세균은 주로 황화이온을 [7]전자공여체로 사용한다.이들은 역트리카르본산 회로를 이용해 탄소고정을 [8]하는 자가영양동물이다.그들은 또한 혼합영양이고 [9][10]질소를 감소시킨다.
특성.
녹색 유황세균은 그램 음성균 또는 구형균이다.녹색 유황 박테리아의 어떤 종류는 움직임을 허용하는 가스 액포를 가지고 있다.이들은 광석 자동영양체로 빛에너지와 환원된 유황화합물을 [11]전자원으로 사용한다.전자공여체에는 H, HS2, S가 포함된다2.이 박테리오클로로필스의 주요 광합성 색소는 녹색종에서는 박테리오클로로필스 c 또는 d, 갈색종에서는 e이며 클로로솜과 혈장막에 [6]위치한다.클로로솜은 조도가 낮은 [12]조건에서도 빛을 포착할 수 있게 해주는 독특한 특징입니다.
서식지
녹황세균의 대부분은 중온성이고 모두 수생환경에서 산다.그것들은 혐기성 조건과 감소된 유황을 필요로 한다; 그것들은 보통 침전물의 꼭대기 밀리미터에서 발견된다.그들은 낮은 조도 [6]조건에서도 광합성을 할 수 있다.
극도의 무독성 환경인 흑해에는 수심 약 100m의 녹색 유황 박테리아가 서식하고 있는 것으로 밝혀졌다.바다의 이 지역에서 이용할 수 있는 빛의 부족으로 인해, 대부분의 박테리아는 광합성적으로 활동을 하지 않았다.황화물 화학선에서 검출된 광합성 활동은 박테리아가 세포 [13]유지를 위해 에너지를 거의 필요로 하지 않는다는 것을 암시한다.
멕시코 앞바다의 2,500미터 깊이의 흑연가 근처에서 살고 있는 녹색 유황 박테리아가 발견되었다.이 깊이에서 GSB1로 명명된 박테리아는 햇빛이 그 [14]깊이까지 침투할 수 없기 때문에 열 통풍구의 희미한 빛을 기반으로 살아갑니다.
녹색 유황 박테리아는 대만의 산호초 군락에서도 발견되었는데, 이 군락의 "녹색층"의 대부분을 차지하고 있습니다.그들은 산호계에서 역할을 하고 박테리아와 산호 [15]숙주 사이에 공생 관계가 있을 수 있습니다.그 산호는 박테리아에게 혐기성 환경과 탄소의 원천을 제공할 수 있다.이 박테리아는 [16]황화물을 산화시킴으로써 영양분을 공급하고 산호를 해독할 수 있다.
유황샘에서 녹황세균인 클로로비움 티피덤이 발견됐다.이 유기체들은 대부분의 다른 녹색 유황 [6]박테리아와 달리 온열성이 있다.
계통발생학
| 16S rRNA 기반 LTP_12_2021[17][18][19] | 게놈 분류[20][21][22] 데이터베이스에 의한 GTDB 07-RS207 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
분류 법은
- 가족 ChlorobiaceaeCopeland 1956년["Chlorobacteriaceae" Geitler &, Pascher 1925년].
- ?Ancalochloris Gorlenko과 Lebedeva 1971년.
- Chlorobaculum 임호프 2003년
- 클로로 비움 Nadson 1906년
- ?"Chloroplana"Dubinina과 Gorlenko 1975년.
- ?"Clathrochloris"Geitler 1925년
- Prosthecochloris Gorlenko 1970년
- 테르모클로로박테리아과(Thermochlorobacteriaceae)의 코리그. 류 외 2012년 ["Cloroherpetonaceae" Bello 외 2022년]
- 클로로헤르페톤 깁슨 외 연구진 1985
- 'Ca. Thermochlorobacter' Liu 등
속 고유의 특성
녹황세균은 클로로비과이다.클로로헤르페톤, 프로스테코클로리스, 클로로비움, 클로로바큘럼의 4개 속입니다.이들 속을 구별하는 데 사용되는 특성에는 대사 특성, 색소, 세포 형태학 및 흡수 스펙트럼이 포함된다.그러나 이러한 성질을 구별하는 것은 어렵기 때문에 분류학적 구분이 [23]불분명할 수 있다.
일반적으로 클로로비움은 막대 또는 바이브로이드 모양이며 일부 종은 가스 소포를 포함합니다.단일 세포 또는 집합 세포로 발달할 수 있습니다.그것들은 녹색이거나 어두운 갈색일 수 있다.녹색 변종은 클로로박틴 카로티노이드와 함께 광합성 색소 Bchl c 또는 d를 사용하고 갈색 변종은 이소렌에라틴 카로티노이드와 함께 광합성 색소 Bchl e를 사용합니다.성장을 [23]위해서는 적은 양의 소금이 필요하다.
프로스테코클로리스는 바이브로이드, 난형 또는 막대 모양의 세포로 구성되어 있습니다.그것들은 가지를 치지 않는 부속지를 형성하는 단일 세포로 시작하는데, 이것은 비가지형 보철물이라고 불립니다.그들은 또한 가스 소포를 형성할 수 있다.존재하는 광합성 색소는 Bchl c, d 또는 e를 포함한다.게다가,[23] 소금은 성장을 위해 필요하다.
클로로바큘럼은 단일 세포로 발달하며 일반적으로 진동체 또는 막대 모양입니다.이들 중 일부는 가스 소포를 형성할 수 있다.이 속의 광합성 색소는 Bchl c, d 또는 e이다.어떤 종들은 성장을 위해 NaCl (염화나트륨)이 필요합니다.이 속은 클로로비움속에 속했지만, 다른 [23]혈통을 형성했다.
클로로헤르페톤속은 특이하다. 왜냐하면 클로로헤르페톤속은 운동성이 있기 때문이다.긴 막대기를 구부리고 활공하여 움직일 수 있습니다.그것들은 녹색이며 광합성 색소 Bchl c와 γ-카로틴을 함유하고 있다.소금은 [23]성장을 위해 필요하다.
대사
광합성
녹색 유황 박테리아는 광합성을 위해 제1형 반응 센터를 이용한다.I형 반응 센터는 식물과 시아노박테리아에 있는 광계 I(PSI)의 박테리아 상동체이다.GSB 반응 센터에는 박테리오클로로필 a가 포함되어 있으며, 전자의 흐름에 전원을 공급하는 840 nm의 들뜸 파장 때문에 P840 반응 센터로 알려져 있습니다.녹색 유황 박테리아에서 반응 중심은 클로로솜이라고 불리는 큰 더듬이 복합체와 연관되어 빛 에너지를 포착하고 반응 중심으로 흘려보냅니다.클로로솜은 박테리오클로로필 c, d, [24]e를 포함하고 있기 때문에 스펙트럼의 극적색 영역에서 720-750 nm의 피크 흡수를 가진다.페나-매튜스-올슨 복합체(FMO)라고 불리는 단백질 복합체는 클로로솜과 P840 RC 사이에 물리적으로 위치해 있다.FMO 복합체는 안테나가 흡수하는 에너지를 반응 중심으로 효율적으로 전달하는 데 도움이 됩니다.
PSI 및 Type I 반응 센터는 CO를
2 고정하고 NADPH를 감소시키는 데 사용할 수 있는 강력한 환원제인 페레독신(Fd)을 감소시킬 수 있습니다.반응 중심(RC)이 Fd에 전자를 주면 약 +300mV의 환원 전위를 가진 산화제(P840+)가 된다.이것은 물로부터 전자를 떼어내 O를
2 합성할 만큼 양성은 아니지만(E
0 = +820mV), HS, 티오황산염 또는2+
Fe [25]이온과 같은
2 다른 소스로부터 전자를 받아들일 수 있다.HS와 같은
2 공여체에서 수용체 Fd로 전자를 전달하는 것을 선형 전자 흐름 또는 선형 전자 이동이라고 합니다.황화물 이온의 산화는 막의 세포외 쪽에 구형으로 축적되는 노폐물로서의 황의 생성으로 이어진다.이 유황 덩어리들은 녹색 유황 박테리아에게 그들의 이름을 지어준다.황화물이 고갈되면 황구체가 소비되어 황산염으로 산화된다.그러나 황산화 경로는 [7]잘 알려져 있지 않다.
전자를 Fd에 전달하는 대신 P840 반응센터의 Fe-S 클러스터는 전자를 메나퀴논(MQ:MQH
2)으로 전송할 수 있으며, 메나퀴논은 전자전달사슬(ETC)을 통해 전자를 P840으로+ 되돌린다.RC로 돌아오는 길에 MQH2의 전자는 막을 가로질러 H 이온을 펌프하는+
시토크롬1 bc 복합체(미토콘드리아의 복합체 III와 유사)를 통과한다.막을 가로지르는 양성자의 전기화학적 전위는 FF ATP 합성효소에o1 의해 ATP를 합성하는데 사용된다.이 주기적인 전자 전달은 빛 에너지를 [24]ATP의 형태로 세포 에너지로 변환시키는 역할을 합니다.
황대사
녹색 황세균은 무기 황화합물을 산화시켜 혐기성 광합성을 위한 전자공여체, 특히 이산화탄소 고정체로서 사용한다.이들은 보통 황화합물보다 황화합물을 전자공여체로 사용하는 것을 선호하지만2 티오황산염이나 [26]H를 이용할 수 있다.중간체는 보통 [27]세포 외부에 축적된 황이고 최종 산물은 황산염이다.세포 밖으로 퇴적되는 유황은 나중에 완전히 [26]산화될 수 있는 유황 구형의 형태이다.
녹색 황세균의 황산화 메커니즘은 잘 알려져 있지 않다.황화물 산화에 관여하는 것으로 생각되는 효소로는 플라보시토크롬 c, 황화물:퀴논 산화환원효소 및 Sox 시스템이 있다.플라보시토크롬은 황화물로부터 시토크롬으로의 전자 전달을 촉매할 수 있고, 이러한 시토크롬은 광합성 반응 중심으로 전자를 이동할 수 있다.그러나 모든 녹색 황세균이 이 효소를 생성하는 것은 아니어서 황화물의 산화에 필요하지 않다는 것을 보여준다.황화물:퀴논산화환원효소(SQR)는 전자수송에도 도움이 되지만, 단독으로 황세균에서 황화물 산화율이 감소하는 것으로 밝혀져 다른 보다 효과적인 [26]메커니즘이 있음을 시사합니다.그러나 대부분의 녹색 유황 박테리아는 SQR [28]유전자의 상동성을 가지고 있다.티오황산염에서 황산염으로의 산화는 Sox 시스템의 [26]효소에 의해 촉매될 수 있다.
황대사와 관련된 효소와 유전자는 녹황세균의 [28]진화 과정에서 수평 유전자 이동을 통해 얻은 것으로 생각된다.
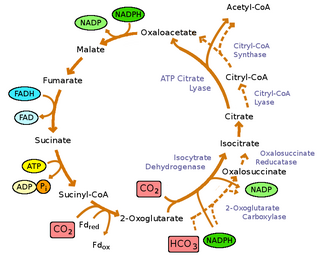
탄소 고정
녹색 유황 박테리아는 광자동영양동물이다: 그들은 빛으로부터 에너지를 얻을 뿐만 아니라 이산화탄소를 탄소의 유일한 공급원으로 사용하여 자랄 수 있다.그들은 피루브산과 아세테이트를 합성하기 위해 전방 TCA 사이클에서 [8]볼 수 있듯이 산화되지 않고 이산화탄소를 줄이기 위해 에너지가 소비되는 역트리카르본산 사이클(rTCA)을[8] 사용하여 이산화탄소를 고정한다.이 분자들은 세포가 고분자를 생성하는 데 필요한 모든 구성 요소를 합성하기 위한 원료로 사용됩니다.rTCA 사이클은 에너지 효율이 매우 높기 때문에 저조도 [29]조건에서 박테리아가 자랄 수 있습니다.그러나 그것은 산소 민감 효소를 가지고 있어 유산소 [29]조건에서의 효율을 제한한다.
산화성 트리카르본산 회로의 역전 반응은 네 가지 [8]효소에 의해 촉매된다.
- 피루브산:페레독신(Fd)산화환원효소:
- 아세틸-CoA+CO2+2Fdred+2H+γ피루브산+CoA+2Fdox
- ATP 구연산분해효소:
- ACL, 아세틸-CoA + 옥살아세트산염 + ADP + Pi δ 구연산염 + CoA + ATP
- α-케토-글루타르산:페레독신산화환원효소:
- 숙시닐-CoA+CO2+2Fred+2H+α-케토글루타르산+CoA+2Fdox
- 푸마라 환원효소
- 석신산염+수용체γ후마르산염+환원수용체
그러나 산화 TCA 사이클(OTCA)은 녹색 황세균에 여전히 존재한다.OTCA는 아세테이트를 흡수할 수 있지만, OTCA는 광영양 성장 [8]중 유전자의 위치와 하향 조절로 인해 녹색 황 박테리아에서 불완전하게 보입니다.
혼합 영양
녹황세균은 유기물을 [8][25]공급받아도 빛이 없으면 자랄 수 없기 때문에 흔히 필수 광자영양생물이라고 불린다.그러나 그들은 빛과2 [8]CO가 존재하는 상황에서 단순한 유기 화합물을 섭취할 수 있는 혼합 영양의 형태를 보인다.CO 또는 HCO의3− 존재2 하에서 일부 녹색 황세균은 아세테이트 또는 [8]피루브산을 이용할 수 있다.
녹색황세균의 혼합 영양은 대표적인 녹색황세균인 Clorobaculum [30]tepidum에 의해 가장 잘 모델링됩니다.혼합 영양은 아미노산 생합성/탄소 이용 및 에너지 [31]대사 중에 발생한다.이 박테리아는 유황의 산화로 생성된 전자와 빛에서 포착한 에너지를 사용하여 rTCA를 실행합니다.C. tepidum은 또한 유기 [31]탄소원으로서 피루브산과 아세테이트의 사용을 나타낸다.
자가영양과 헤테로영양을 결합하는 C. tepidum의 혼합영양의 예는 아세틸-CoA의 합성이다.C. tepidum은 rTCA 사이클을 통해 자율영양적으로 아세틸-CoA를 생성하거나 아세테이트의 흡수를 통해 이질영양적으로 생성할 수 있다.아미노산 생합성에 피루브산이 사용될 때도 유사한 혼합영양 활성이 발생하지만 아세테이트를 사용한 혼합영양성장은 더 높은 [30][31]성장률을 나타낸다.
에너지 대사에서 C. tepidum은 에너지 생성(산화 펜토오스 인산 경로 및 정상 TCA 회로)을 담당하는 경로가 부분적으로만 [31]기능하기 때문에 에너지(NADPH 및 NADH)를 생성하기 위해 빛 반응에 의존한다.빛으로부터 흡수된 광자는 에너지 대사의 보조 인자인 NADPH와 NADH를 생성하기 위해 사용됩니다.티피덤은 또한 황화물 [30]산화로부터 유도된 양성자 원동력을 이용하여 ATP의 형태로 에너지를 생성한다.황화물 산화 및 박테리오클로로필을 [31]통한 광자 흡수에 의한 에너지 생산.
질소 고정
녹색 유황 박테리아의 대부분은 디아조트로프이다: 그들은 아미노산을 [32]합성하는데 사용되는 암모니아로 질소를 감소시킬 수 있다.녹색 유황 박테리아 간의 질소 고정은 일반적으로 비산소 광영양체이며 빛의 존재를 필요로 한다.녹황세균은 제1형 분비계 및 페레독신-NADP+산화환원효소로부터 활성을 나타내 질소고정을 [33]지원하기 위해 진화한 특성인 환원철을 생성한다.보라색 유황 박테리아처럼, 그들은 암모니아 농도에 반응하여 번역 후 질소 분해 효소의 활성을 조절할 수 있습니다.그들의 nif 유전자의 소유는, 비록 진화적으로 구별되더라도, 그들의 질소 고정 능력은 두 개의 다른 사건에서 또는 공유된 매우 먼 [34]조상을 통해 일어났다는 것을 암시할 수 있다.
질소 고정성이 있는 녹색 유황세균의 예로는 P. phaeoclathratiforme를 제외한 Clorobium 및 Pelodiction속 등이 있다.프로스테코클로로아미우아리와 클로로헤르페톤탈칼륨도 이 [34]범주에 속한다.그들의2 N 고정은 널리 퍼지고 생태계의 전반적인 질소 가용성에 중요한 역할을 한다.산호초에 사는 프로스테코클로리스와 같은 녹색 유황 박테리아는 이미 영양소가 제한된 환경에서 [35]사용 가능한 질소를 생성하는데 매우 중요합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Gibbons NE, Murray RGE. (1978). "Proposals Concerning the Higher Taxa of Bacteria". International Journal of Systematic Bacteriology. 28: 1–6. doi:10.1099/00207713-28-1-1.
- ^ Garrity GM, Holt JG. (2001). "Phylum BXI. Chlorobi phy. nov.". In Boone DR, Castenholz RW, Garrity GM. (eds.). Bergey's Manual of Systematic Bacteriology. Vol. 1 (The Archaea and the deeply branching and phototrophic Bacteria) (2nd ed.). New York, NY: Springer–Verlag. pp. 601–623.
- ^ Oren A, Garrity GM (2021). "Valid publication of the names of forty-two phyla of prokaryotes". Int J Syst Evol Microbiol. 71 (10): 5056. doi:10.1099/ijsem.0.005056. PMID 34694987. S2CID 239887308.
- ^ a b Bryant DA, Frigaard NU (November 2006). "Prokaryotic photosynthesis and phototrophy illuminated". Trends in Microbiology. 14 (11): 488–96. doi:10.1016/j.tim.2006.09.001. PMID 16997562.
- ^ Green BR (2003). Light-Harvesting Antennas in Photosynthesis. p. 8. ISBN 0792363353.
- ^ a b c d Kushkevych, Ivan; Procházka, Jiří; Gajdács, Márió; Rittmann, Simon K.-M. R.; Vítězová, Monika (2021-06-15). "Molecular Physiology of Anaerobic Phototrophic Purple and Green Sulfur Bacteria". International Journal of Molecular Sciences. 22 (12): 6398. doi:10.3390/ijms22126398. ISSN 1422-0067. PMC 8232776. PMID 34203823.
- ^ a b Sakurai H, Ogawa T, Shiga M, Inoue K (June 2010). "Inorganic sulfur oxidizing system in green sulfur bacteria". Photosynthesis Research. 104 (2–3): 163–76. doi:10.1007/s11120-010-9531-2. PMID 20143161. S2CID 1091791.
- ^ a b c d e f g h Tang KH, Blankenship RE (November 2010). "Both forward and reverse TCA cycles operate in green sulfur bacteria". The Journal of Biological Chemistry. 285 (46): 35848–54. doi:10.1074/jbc.M110.157834. PMC 2975208. PMID 20650900.
- ^ Wahlund, Thomas (1993). "Nitrogen Fixation by the Thermophilic Green Sulfur Bacterium Chlorobium tepidum". Journal of Bacteriology. 175 (2): 474–478. doi:10.1128/jb.175.2.474-478.1993. PMC 196162. PMID 8093448.
- ^ Feng, Xueyang; Tang, Kuo-Hsiang; Blankenship, Robert E.; Tang, Yinjie J. (2010-12-10). "Metabolic Flux Analysis of the Mixotrophic Metabolisms in the Green Sulfur Bacterium Chlorobaculum tepidum*". Journal of Biological Chemistry. 285 (50): 39544–39550. doi:10.1074/jbc.M110.162958. ISSN 0021-9258. PMC 2998096. PMID 20937805.
- ^ "Green Sulfur Bacteria - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2022-04-22.
- ^ John Wiley & Sons, Ltd, ed. (2001-05-30). eLS (1 ed.). Wiley. doi:10.1002/9780470015902.a0000458.pub2. ISBN 978-0-470-01617-6.
- ^ Marschall E, Jogler M, Hessge U, Overmann J (May 2010). "Large-scale distribution and activity patterns of an extremely low-light-adapted population of green sulfur bacteria in the Black Sea". Environmental Microbiology. 12 (5): 1348–62. doi:10.1111/j.1462-2920.2010.02178.x. PMID 20236170.
- ^ Beatty JT, Overmann J, Lince MT, Manske AK, Lang AS, Blankenship RE, Van Dover CL, Martinson TA, Plumley FG (June 2005). "An obligately photosynthetic bacterial anaerobe from a deep-sea hydrothermal vent". Proceedings of the National Academy of Sciences of the United States of America. 102 (26): 9306–10. Bibcode:2005PNAS..102.9306B. doi:10.1073/pnas.0503674102. PMC 1166624. PMID 15967984.
- ^ Yang, Shan-Hua; Lee, Sonny T. M.; Huang, Chang-Rung; Tseng, Ching-Hung; Chiang, Pei-Wen; Chen, Chung-Pin; Chen, Hsing-Ju; Tang, Sen-Lin (2016-02-26). "Prevalence of potential nitrogen-fixing, green sulfur bacteria in the skeleton of reef-building coral Isopora palifera". Limnology and Oceanography. 61 (3): 1078–1086. Bibcode:2016LimOc..61.1078Y. doi:10.1002/lno.10277. ISSN 0024-3590. S2CID 87463811.
- ^ Cai, Lin; Zhou, Guowei; Tian, Ren-Mao; Tong, Haoya; Zhang, Weipeng; Sun, Jin; Ding, Wei; Wong, Yue Him; Xie, James Y.; Qiu, Jian-Wen; Liu, Sheng (2017-08-24). "Metagenomic analysis reveals a green sulfur bacterium as a potential coral symbiont". Scientific Reports. 7 (1): 9320. Bibcode:2017NatSR...7.9320C. doi:10.1038/s41598-017-09032-4. ISSN 2045-2322. PMC 5571212. PMID 28839161.
- ^ "The LTP". Retrieved 23 February 2021.
- ^ "LTP_all tree in newick format". Retrieved 23 February 2021.
- ^ "LTP_12_2021 Release Notes" (PDF). Retrieved 23 February 2021.
- ^ "GTDB release 07-RS207". Genome Taxonomy Database. Retrieved 20 June 2022.
- ^ "ar53_r207.sp_label". Genome Taxonomy Database. Retrieved 20 June 2022.
- ^ "Taxon History". Genome Taxonomy Database. Retrieved 20 June 2022.
- ^ a b c d e Bryantseva, Irina A.; Tarasov, Alexey L.; Kostrikina, Nadezhda A.; Gaisin, Vasil A.; Grouzdev, Denis S.; Gorlenko, Vladimir M. (2019-12-01). "Prosthecochloris marina sp. nov., a new green sulfur bacterium from the coastal zone of the South China Sea". Archives of Microbiology. 201 (10): 1399–1404. doi:10.1007/s00203-019-01707-y. ISSN 1432-072X. PMID 31338544. S2CID 198190182.
- ^ a b Hauska G, Schoedl T, Remigy H, Tsiotis G (October 2001). "The reaction center of green sulfur bacteria(1)". Biochimica et Biophysica Acta. 1507 (1–3): 260–77. doi:10.1016/S0005-2728(01)00200-6. PMID 11687219.
- ^ a b Ligrone, Roberto (2019). "Moving to the Light: The Evolution of Photosynthesis". In Roberto Ligrone (ed.). Biological Innovations that Built the World: A Four-billion-year Journey through Life and Earth History. Cham: Springer International Publishing. pp. 99–127. doi:10.1007/978-3-030-16057-9_4. ISBN 978-3-030-16057-9. S2CID 189992218. Retrieved 2021-01-29.
- ^ a b c d Frigaard, Niels-Ulrik; Dahl, Christiane (2008-01-01), Poole, Robert K. (ed.), "Sulfur Metabolism in Phototrophic Sulfur Bacteria", Advances in Microbial Physiology, Academic Press, vol. 54, pp. 103–200, retrieved 2022-04-22
- ^ van Gemerden, Hans (1986-10-01). "Production of elemental sulfur by green and purple sulfur bacteria". Archives of Microbiology. 146 (1): 52–56. doi:10.1007/BF00690158. ISSN 1432-072X. S2CID 30812886.
- ^ a b Gregersen, Lea; Bryant, Donald; Frigaard, Niels-Ulrik (2011). "Mechanisms and Evolution of Oxidative Sulfur Metabolism in Green Sulfur Bacteria". Frontiers in Microbiology. 2: 116. doi:10.3389/fmicb.2011.00116. ISSN 1664-302X. PMC 3153061. PMID 21833341.
- ^ a b Bar-Even, Arren; Noor, Elad; Milo, Ron (2012). "A survey of carbon fixation pathways through a quantitative lens". Journal of Experimental Botany. 63 (6): 2325–2342. doi:10.1093/jxb/err417. ISSN 1460-2431. PMID 22200662.
- ^ a b c Frigaard, Niels-Ulrik; Chew, Aline Gomez Maqueo; Li, Hui; Maresca, Julia A.; Bryant, Donald A. (2003). "Chlorobium Tepidum : Insights into the Structure, Physiology, and Metabolism of a Green Sulfur Bacterium Derived from the Complete Genome Sequence". Photosynthesis Research. 78 (2): 93–117. doi:10.1023/B:PRES.0000004310.96189.b4. ISSN 0166-8595. PMID 16245042. S2CID 30218833.
- ^ a b c d e Feng, Xueyang; Tang, Kuo-Hsiang; Blankenship, Robert E.; Tang, Yinjie J. (2010-12-10). "Metabolic Flux Analysis of the Mixotrophic Metabolisms in the Green Sulfur Bacterium Chlorobaculum tepidum*". Journal of Biological Chemistry. 285 (50): 39544–39550. doi:10.1074/jbc.M110.162958. ISSN 0021-9258. PMC 2998096. PMID 20937805.
- ^ Madigan, Michael T. (1995). "Microbiology of Nitrogen Fixation by Anoxygenic Photosynthetic Bacteria". In Robert E. Blankenship; Michael T. Madigan; Carl E. Bauer (eds.). Anoxygenic Photosynthetic Bacteria. Advances in Photosynthesis and Respiration. Vol. 2. Dordrecht: Springer Netherlands. pp. 915–928. doi:10.1007/0-306-47954-0_42. ISBN 978-0-306-47954-0.
- ^ Mus, Florence; Colman, Daniel R.; Peters, John W.; Boyd, Eric S. (2019-08-20). "Geobiological feedbacks, oxygen, and the evolution of nitrogenase". Free Radical Biology and Medicine. Early Life on Earth and Oxidative Stress. 140: 250–259. doi:10.1016/j.freeradbiomed.2019.01.050. ISSN 0891-5849. PMID 30735835. S2CID 73433517.
- ^ a b Madigan, Michael T. (1995), Blankenship, Robert E.; Madigan, Michael T.; Bauer, Carl E. (eds.), "Microbiology of Nitrogen Fixation by Anoxygenic Photosynthetic Bacteria", Anoxygenic Photosynthetic Bacteria, Advances in Photosynthesis and Respiration, Dordrecht: Springer Netherlands, vol. 2, pp. 915–928, doi:10.1007/0-306-47954-0_42, ISBN 978-0-306-47954-0, retrieved 2022-05-01
- ^ Yang, Shan-Hua; Lee, Sonny T. M.; Huang, Chang-Rung; Tseng, Ching-Hung; Chiang, Pei-Wen; Chen, Chung-Pin; Chen, Hsing-Ju; Tang, Sen-Lin (May 2016). "Prevalence of potential nitrogen-fixing, green sulfur bacteria in the skeleton of reef-building coral Isopora palifera: Endolithic bacteria in coral skeletons". Limnology and Oceanography. 61 (3): 1078–1086. doi:10.1002/lno.10277. S2CID 87463811.
외부 링크
- "The Family Chlorobiaceae". The Prokaryotes. Archived from the original on November 17, 2003. Retrieved July 5, 2005.