미생물 루프
Microbial loop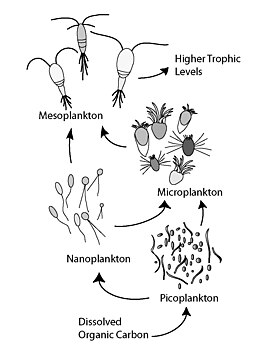
미생물 루프는 수생 시스템에서 녹은 유기 탄소(DOC)가 박테리아 바이오매스에 통합되어 더 높은 영양 수준으로 되돌아간 다음, 식물성 플랑크톤-조플랑크톤-네크톤에 의해 형성된 고전적인 먹이 사슬과 결합되는 영양 경로를 설명한다. 토양 시스템에서 미생물 순환은 토양 탄소를 가리킨다. 미생물 루프라는 용어는 1983년 [1]파루크 아잠, 톰 펜첼 등이 해양 환경의 탄소 및 영양분 순환에서 박테리아가 하는 역할을 포함시키기 위해 만들었다.
일반적으로 용해된 유기탄소(DOC)는 박테리아 용해, 식물성 플랑크톤으로부터 고정 탄소의 누출 또는 배출, 갑작스러운 세포 노화, 동물성 플랑크톤에 의한 엉성한 먹이, 수생동물에 의한 폐기물 배출, 분해 또는 해체로 인해 해양 환경에 도입된다. 지구상의 식물과 토양에서 나오는 유기 입자의.[2] 미생물 순환에 있는 박테리아는 에너지를 많이 쓰는 물질을 성장시키기 위해 이 입자 디트리투스를 분해한다. 해양생태계 유기물질의 95% 이상이 고분자, 고분자량(HMW) 화합물(예: 단백질, 다당류, 지질)으로 구성되기 때문에 총 용존 유기물질(DOM)의 극히 일부만이 영양 수준이 높은 대부분의 해양생물에 쉽게 활용 가능하다. 이것은 용해된 유기 탄소가 대부분의 해양 유기체에게 직접 공급되지 않는다는 것을 의미한다; 해양 박테리아는 이 유기 탄소를 먹이 그물에 도입하여 영양 수준이 더 높은 추가 에너지를 공급하게 된다. 최근 '미생물 먹이사슬'이라는 용어가 '미생물 루프'라는 용어로 대체되고 있다.
역사
| 다음 시리즈의 일부 |
| 탄소 순환 |
|---|
 |
미생물 고리가 발견되기 전, 해양 먹이사슬의 고전적인 모습은 식물성 플랑크톤에서 네크톤에 이르는 선형 체인 중 하나였다. 일반적으로 해양세균은 존재한다고 알려졌지만, 유기물(탄소 포함)의 유의미한 소비자는 아니라고 생각되었다. 그러나 1970년대와 1980년대에 포메로이와 아잠은 박테리아에서 원생대, 메타조아에 이르는 탄소 흐름의 대체 경로를 제시하면서 해양 펠로릭 푸드웹의 시야에 도전장을 던졌다.[3][1]
해양환경에서 박테리아의 역할을 조사한 해양생태학의 초기 연구는 그들의 역할이 매우 미미하다고 결론지었다. 전통적인 박테리아 계수법(예: 한천판 배양법)은 바닷물에서 진정한 주변 풍부함보다 훨씬 작은 수의 박테리아만 생산했다. 박테리아 수를 세는 기술의 발전은 해양 환경에서 해양 박테리아의 중요성에 대한 이해로 이어졌다.
1970년대에는 프란시스코 외 연구진(1973년)과 호비 외 연구진(1977년)에 의해 현미경 직접 계산의 대체 기법이 개발되었다. 박테리아 세포를 에피플루오렌지 현미경으로 세어 '아크리딘 오렌지 직접 계수'(AODC)라고 불리는 것을 생산했다. 이를 통해 바닷물 속 세균의 대량 농도를 재평가했는데, 이는 예상보다 많은 것으로 밝혀졌다(일반적으로 밀리미터당 100만 마리 순이다). 또한, 「박테리아 생산성 측정」의 개발에서는, 순 1차 생산(NPP)의 상당 부분(즉, 50%)이 해양 박테리아에 의해 처리되는 것으로 나타났다.
1974년 래리 포머로이는 '바다의 먹이 웹: 변화하는 패러다임'이라는 제목의 논문을 바이오 사이언스에 발표했는데, 이 논문에서 해양 생산성에 있어 미생물의 핵심적인 역할이 강조되었다.[3] 1980년대 초 아잠과 최고의 해양과학자 패널은 '바다의 물기둥 미생물의 생태학적 역할'이라는 제목의 학술지 '해양생태 진보 시리즈'에 토론의 종합을 게재했다. 이 논문에서 '미생물 루프'라는 용어가 소개되었는데, 이는 박테리아를 많이 섭취하는 원생물이 식물성 플랑크랑크톤과 같은 크기였으며 플랑크톤 갑각류 식단의 중요한 구성 요소일 가능성이 있다고 언급했다.[1]
이 시기 이후 축적된 증거에 따르면 이러한 박테리아 원생들 중 일부(예: ciliates)는 실제로 이들 복엽류에 의해 선택적으로 먹잇감이 된다. 1986년, 바다의 과두영역에서 많이 발견되는 프로클로로코쿠스가 살리에 W에 의해 발견되었다. 치솔름, 로버트 J. 올슨, 그리고 다른 협력자들 (프로클로로코쿠스[4][5] 해양에서 엽록소 b를 함유한 매우 작은 시아노박테리아에 대한 이전 기록은 1986년에[6] 여러 번 발견되었었다.[7] 이 발견에서 기인하여, 연구원들은 해양의 영양소 구배를 따라 해양 박테리아의 역할 변화를 관찰했다.
미생물 루프 제어 요인
| 다음에 대한 시리즈 일부 |
| 바이오게화학주기 |
|---|
 |
미생물 루프의 효율성은 그 안에 있는 해양 박테리아의 밀도에 의해 결정된다.[8] 박테리아 밀도는 주로 작은 원생대의 방목 활동과 여러 가지 분류학 그룹의 플라겔류에 의해 조절된다는 것이 분명해졌다. 또한 바이러스 감염은 박테리아 용융을 유발하여 용해된 유기물(DOM) 풀로 세포 내용물을 다시 방출하여 미생물 루프의 전반적인 효율을 떨어뜨린다. 바이러스 감염에 의한 사망률은 원생동물 방목과 거의 같은 규모를 가지고 있다. 그러나 원생식 방목과 비교해 볼 때, 유석은 각 해양세균에 대한 숙주특성이 매우 높기 때문에 바이러스 투석 효과는 매우 다를 수 있다. 원생동물 방목과 바이러스 감염 모두 박테리아 성장의 주요 부분을 균형 있게 한다. 게다가, 미생물 고리는 영양소 공급의 빈번한 신규 공급으로 인해, 영양소가 아닌 과두영역에서 지배한다. - 고전적인 플랑크톤 먹이 사슬이 지배적이다. 미생물 루프 효율의 크기는 방사상 기판(삼중수소 티미딘 또는 류신 등)의 박테리아 결합을 측정하여 결정할 수 있다.
해양 생태계에서
미생물 루프는 대부분의 해양 생물이 일반적으로 이용할 수 없는 용해된 유기물(DOM)의 활용을 통해 해양 먹이 거미줄의 효율성을 높이는데 특히 중요하다. 이런 의미에서 이 과정은 유기 물질과 영양소의 재활용을 돕고 열선 위의 에너지 전달을 매개한다. 박테리아에 통합된 용해된 유기 탄소(DOC)의 30% 이상이 재생산되어 이산화탄소로 방출된다. 물기둥에 있는 미생물 루프의 또 다른 주된 효과는 영양소 제한 환경(예: 과두농축수)에서 생성을 재생시켜 광물화를 가속화한다는 것이다. 일반적으로 전체 미생물 루프는 해양 생태계에 있는 모든 다세포 해양 유기체의 질량의 5배에서 10배 정도 된다. 해양세균은 대부분의 해양환경에서 먹이 그물의 기초가 되며, 해양식품 거미줄과 중요한 수산과정(어업의 생산성, 해저로 수출되는 탄소의 양 등)의 영양효율을 향상시킨다. 따라서 미생물 고리는 1차 생산과 함께 해양 시스템의 생산성을 제어한다.
많은 플랑크토닉 박테리아는 운동성 세균으로, 분자 전파를 위해 플라겔럼을 사용하고, 빠르게 성장하는 세포가 입자의 전부 또는 일부를 소화하는 용해된 유기 물질(DOM)의 점원을 찾아 이동하고 부착하기 위해 케모탁스를 사용한다. 그러한 패치에서는 단 몇 분 안에 축적되는 것을 직접 관찰할 수 있다. 따라서 물기둥은 완전히 혼합된 시스템이라기 보다는 작은 규모로 공간적으로 정리된 장소라고 어느 정도 생각할 수 있다. 이 패치 형성은 미생물 루프에서 물질과 에너지의 생물학적으로 매개된 전달에 영향을 미친다.
더 현재, 미생물 루프는 더 확장된 것으로 간주된다.[9] 대표적인 박테리아(DNA, 지질, 당류 등)의 화학적 화합물 및 입자당 C:N 비율의 유사한 값이 교전적으로 형성된 미세입자에서 발견된다. 미세입자는 박테리아 플랑크톤에 잠재적으로 매력적인 식품원이다. 이 경우 미생물 루프는 아바이오틱한 미세입자 형성을 통해 용해된 유기물(DOM)을 보다 높은 영양 수준으로 직접 이전하는 경로에 의해 확장될 수 있다. 이것은 두 가지 면에서 생태학적 중요성을 가지고 있다. 첫째, 탄소 손실 없이 발생하며, 이질성 박테리아만이 아니라, 유기물을 보다 효율적으로 이용할 수 있게 한다. 더욱이 확장된 미생물 루프에서 생물학적 변환은 온도와 집적할 DOM의 용량에만 의존하는 반면, 생물학적 변환은 생물학적 가용성에 의존한다.[9]
육지생태계에서는
토양 생태계는 매우 복잡하고 토양 탄소가 대기 중으로 유지되는지 방출되는지를 결정하는 다른 경치 규모의 동요를 겪게 된다.[11] 토양 유기탄소의 궁극적인 운명은 토양 미생물을 포함한 식물과 지하 유기체의 결합 활동의 함수다. 토양 미생물이 탄소 순환과 관련된 다수의 생물 지질화학 기능을 지원하는 것으로 알려져 있지만,[12] 토양 마이크로바이옴의 대다수는 미개간 상태로 남아 있고 대체로 암호화된 기능을 가지고 있다.[13] 비록 새로운 토양 미생물과 바이러스가 점점 더 발견되고 있지만, 현재까지 토양 미생물 생물의 극히 일부만이 목록화되었다.[14] 이러한 지식 부족은 토양 유기 탄소 순환에 대한 토양 미생물의 기여의 불확실성을 초래하고 기후 변화 하에서 지구 탄소 유량에 대한 정확한 예측 모델 구축을 방해한다.[15][10]
토양 미생물 대사 잠재력에 관한 정보가 부족하기 때문에 환경 변화에 대응하여 발생하는 미생물 활동의 변화를 정확히 설명하기가 특히 어렵다. 예를 들어, 식물에서 파생된 탄소 입력은 미생물 활동을 프라이밍하여 기존 토양 유기 탄소를 모델 기대치보다 높은 속도로 분해하여 탄소 플럭스의 예측 모델 내에서 오류를 발생시킬 수 있다.[16][10]
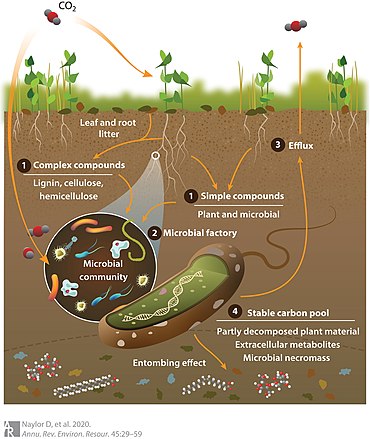
이를 감안하여 오른쪽의 도표에서 도해한 미생물 탄소펌프로 알려진 개념모델을 개발하여 토양 미생물이 토양 유기물을 어떻게 변형하고 안정화시키는지를 정의하였다.[17] 도표에서 보듯이 대기 중의 이산화탄소는 식물(또는 자생 미생물)에 의해 고정되고 (1) 저분자 중량의 뿌리 배출 단순 탄소 화합물 또는 복잡한 식물 다당체의 축적을 초래하는 잎과 뿌리 쓰레기의 퇴적과 같은 과정을 통해 토양에 첨가된다. (2) 이러한 과정을 통해 자동차는bon은 미생물 대사물에 "생물학적으로 이용가능하게" 만들어지며, 그 후 (3) 대기 중으로 다시 이동하거나 (4) 미생물 네크로마스로서 안정적인 탄소 풀에 들어간다. 탄소 배출 대 지속성의 정확한 균형은 지상 식물 공동체 구성과 뿌리 배출 프로파일, 환경 변수, 집단 미생물 표현형(즉 메타페놈)을 포함한 여러 요인의 함수다.[18][10]
이 모델에서 탄소 이전을 위한 미생물 대사 활동은 세포외 효소에 의한 식물 유래 탄소의 변형을 참조하는 체외 수정과 미생물 바이오매스 이전에 사용되거나 죽은 미생물 바이오매스(necromass)로 침전된 체내 탄소의 체내 이직의 두 가지 범주로 구분된다. 토양 유기 탄소를 이산화탄소(CO2
)로 배출하는 카타볼릭 활동과 안정적인 탄소 화합물을 생산하는 아나볼릭 활동의 대조적인 영향은 순 탄소 보유율을 제어한다. 특히 미생물 탄소 분리법은 미생물 탄소 펌프 모델이 다루려고 하는 토양 탄소 흐름의 과소표시 측면을 나타낸다.[17] 불확실성의 관련 영역은 식물에서 유래된 탄소의 유형이 어떻게 미생물 토양 유기 탄소 저장을 강화시키거나 또는 토양 유기 탄소 분해를 가속화하는가이다.[19] 예를 들어, 나뭇잎 쓰레기와 바늘 쓰레기는 숲 토양에서 미생물 성장을 위한 탄소의 원천으로 작용하지만, 쓰레기 화학 물질과 pH는 식물의 종류에 따라 다르다[예: 뿌리 및 모낭 쓰레기 사이 또는 낙엽성 및 침엽수 숲 쓰레기 사이 (14)]. 결국 이러한 생화학적 차이는 분해 역학 변화를 통해 토양 유기 탄소 수준에 영향을 미친다.[21] 또한, 식물 집단의 다양성이 증가하면, 토양은 결국 추가적인 탄소를 저장할 수 없는 포화점에 도달하지만,[22] 이산화질소의 비율을 증가시켜 미생물 활동을 자극하고 토양 유기 탄소 저장량을 증가시킨다.[23][10]
참고 항목
참조
- ^ a b c Azam, Farooq; Fenchel, Tom; Field, J.G.; Gray, J.S.; Meyer-Reil, L.A.; Thingstad, F. (1983). "The Ecological Role of Water-Column Microbes in the Sea". Marine Ecology Progress Series. 10: 257–263. Bibcode:1983MEPS...10..257A. doi:10.3354/meps010257.
- ^ Van den Meersche, Karel; Middelburg, Jack J.; Soetaert, Karline; van Rijswijk, Pieter; Boschker, Henricus T. S.; Heip, Carlo H. R. (2004). "Carbon-nitrogen coupling and algal-bacterial interactions during an experimental bloom: Modeling a13C tracer experiment". Limnology and Oceanography. 49 (3): 862–878. Bibcode:2004LimOc..49..862V. doi:10.4319/lo.2004.49.3.0862. hdl:1854/LU-434810. ISSN 0024-3590.
- ^ a b Pomeroy, Lawrence R. (1974). "The Ocean's Food Web, A Changing Paradigm". BioScience. 24 (9): 499–504. doi:10.2307/1296885. ISSN 0006-3568. JSTOR 1296885.
- ^ Johnson, P. W.; Sieburth, J. M. (1979). "Chroococcoid cyanobacteria in the sea: a ubiquitous and diverse phototrophic biomass". Limnology and Oceanography. 24 (5): 928–935. Bibcode:1979LimOc..24..928J. doi:10.4319/lo.1979.24.5.0928.
- ^ Gieskes, W. W. C.; Kraay, G. W. (1983). "Unknown chlorophyll a derivatives in the North Sea and the tropical Atlantic Ocean revealed by HPLC analysis". Limnology and Oceanography. 28 (4): 757–766. Bibcode:1983LimOc..28..757G. doi:10.4319/lo.1983.28.4.0757.
- ^ Chisholm, S. W.; Olson, R. J.; Zettler, E. R.; Waterbury, J.; Goericke, R.; Welschmeyer, N. (1988). "A novel free-living prochlorophyte occurs at high cell concentrations in the oceanic euphotic zone". Nature. 334 (6180): 340–343. Bibcode:1988Natur.334..340C. doi:10.1038/334340a0. S2CID 4373102.
- ^ Chisholm, Sallie W.; Frankel, Sheila L.; Goericke, Ralf; Olson, Robert J.; Palenik, Brian; Waterbury, John B.; West-Johnsrud, Lisa; Zettler, Erik R. (1992). "Prochlorococcus marinus nov. gen. nov. sp.: an oxyphototrophic marine prokaryote containing divinyl chlorophyll a and b". Archives of Microbiology. 157 (3): 297–300. doi:10.1007/bf00245165. ISSN 0302-8933. S2CID 32682912.
- ^ Taylor, AH; Joint, I (1990). "A steady-state analysis of the 'microbial loop' in stratified systems". Marine Ecology Progress Series. Inter-Research Science Center. 59: 1–17. Bibcode:1990MEPS...59....1T. doi:10.3354/meps059001. ISSN 0171-8630.
- ^ a b Kerner, Martin; Hohenberg, Heinz; Ertl, Siegmund; Reckermann, Marcus; Spitzy, Alejandro (2003). "Self-organization of dissolved organic matter to micelle-like microparticles in river water". Nature. Springer Science and Business Media LLC. 422 (6928): 150–154. Bibcode:2003Natur.422..150K. doi:10.1038/nature01469. ISSN 0028-0836. PMID 12634782. S2CID 4380194.
- ^ a b c d e 네일러 댄, 새들러, 나탈리. 노력 중이라고 Bhattacharjee, Arunima, 그레이엄, 에밀리 B;.앤더튼 크리스토퍼, 맥 클러 라이언, 립턴, 메리, Hofmockel, 시르 스텐 S.;얀손, 자넷. K.(2020년)."토양 Microbiomes 기후 변화와 시사점에 따라 탄소 사이클에".연간 검토 환경과 자원.45:29–59. doi:10.1146/annurev-environ-012320-082720.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Jansson, Janet K.; Hofmockel, Kirsten S. (2020). "Soil microbiomes and climate change". Nature Reviews Microbiology. 18 (1): 35–46. doi:10.1038/s41579-019-0265-7. OSTI 1615017. PMID 31586158. S2CID 203658781.
- ^ Thompson, Luke R.; et al. (2017). "A communal catalogue reveals Earth's multiscale microbial diversity". Nature. 551 (7681): 457–463. Bibcode:2017Natur.551..457T. doi:10.1038/nature24621. PMC 6192678. PMID 29088705.
- ^ a b Goel, Reeta; Kumar, Vinay; Suyal, Deep Chandra; Narayan; Soni, Ravindra (2018). "Toward the Unculturable Microbes for Sustainable Agricultural Production". Role of Rhizospheric Microbes in Soil. pp. 107–123. doi:10.1007/978-981-10-8402-7_4. ISBN 978-981-10-8401-0.
- ^ Schulz, Frederik; Alteio, Lauren; Goudeau, Danielle; Ryan, Elizabeth M.; Yu, Feiqiao B.; Malmstrom, Rex R.; Blanchard, Jeffrey; Woyke, Tanja (2018). "Hidden diversity of soil giant viruses". Nature Communications. 9 (1): 4881. Bibcode:2018NatCo...9.4881S. doi:10.1038/s41467-018-07335-2. PMC 6243002. PMID 30451857.
- ^ Zeng, N.; Yoshikawa, C.; Weaver, A. J.; Strassmann, K.; Schnur, R.; Schnitzler, K.-G.; Roeckner, E.; Reick, C.; Rayner, P.; Raddatz, T.; Matthews, H. D.; Lindsay, K.; Knorr, W.; Kawamiya, M.; Kato, T.; Joos, F.; Jones, C.; John, J.; Bala, G.; Fung, I.; Eby, M.; Doney, S.; Cadule, P.; Brovkin, V.; von Bloh, W.; Bopp, L.; Betts, R.; Cox, P.; Friedlingstein, P. (2006). "Climate–Carbon Cycle Feedback Analysis: Results from the C4MIP Model Intercomparison". Journal of Climate. 19 (14): 3337–3353. Bibcode:2006JCli...19.3337F. doi:10.1175/JCLI3800.1.
- ^ Kuzyakov, Yakov; Horwath, William R.; Dorodnikov, Maxim; Blagodatskaya, Evgenia (2019). "Review and synthesis of the effects of elevated atmospheric CO2 on soil processes: No changes in pools, but increased fluxes and accelerated cycles". Soil Biology and Biochemistry. 128: 66–78. doi:10.1016/j.soilbio.2018.10.005.
- ^ a b Liang, Chao; Schimel, Joshua P.; Jastrow, Julie D. (2017). "The importance of anabolism in microbial control over soil carbon storage". Nature Microbiology. 2 (8): 17105. doi:10.1038/nmicrobiol.2017.105. PMID 28741607. S2CID 9992380.
- ^ Bonkowski, Michael (2004). "Protozoa and plant growth: The microbial loop in soil revisited". New Phytologist. 162 (3): 617–631. doi:10.1111/j.1469-8137.2004.01066.x. PMID 33873756.
- ^ Sulman, Benjamin N.; Phillips, Richard P.; Oishi, A. Christopher; Shevliakova, Elena; Pacala, Stephen W. (2014). "Microbe-driven turnover offsets mineral-mediated storage of soil carbon under elevated CO2". Nature Climate Change. 4 (12): 1099–1102. Bibcode:2014NatCC...4.1099S. doi:10.1038/nclimate2436.
- ^ Harmon, Mark E.; Silver, Whendee L.; Fasth, Becky; Chen, HUA; Burke, Ingrid C.; Parton, William J.; Hart, Stephen C.; Currie, William S. (2009). "Long-term patterns of mass loss during the decomposition of leaf and fine root litter: An intersite comparison". Global Change Biology. 15 (5): 1320–1338. Bibcode:2009GCBio..15.1320H. doi:10.1111/j.1365-2486.2008.01837.x. hdl:2027.42/74496.
- ^ Qualls, Robert (2016). "Long-Term (13 Years) Decomposition Rates of Forest Floor Organic Matter on Paired Coniferous and Deciduous Watersheds with Contrasting Temperature Regimes". Forests. 7 (12): 231. doi:10.3390/f7100231.
- ^ Lange, Markus; Eisenhauer, Nico; Sierra, Carlos A.; Bessler, Holger; Engels, Christoph; Griffiths, Robert I.; Mellado-Vázquez, Perla G.; Malik, Ashish A.; Roy, Jacques; Scheu, Stefan; Steinbeiss, Sibylle; Thomson, Bruce C.; Trumbore, Susan E.; Gleixner, Gerd (2015). "Plant diversity increases soil microbial activity and soil carbon storage". Nature Communications. 6: 6707. Bibcode:2015NatCo...6.6707L. doi:10.1038/ncomms7707. PMID 25848862.
- ^ Stewart, Catherine E.; Paustian, Keith; Conant, Richard T.; Plante, Alain F.; Six, Johan (2007). "Soil carbon saturation: Concept, evidence and evaluation". Biogeochemistry. 86: 19–31. doi:10.1007/s10533-007-9140-0. S2CID 97153551.
참고 문헌 목록
- 펜첼, T. (1988) 해양 플랑크토닉 푸드 체인. 생태학 및 체계학 연례검토
- 펜첼, T. (2008) 미생물 루프 – 25년 후 [논문초록] 실험해양생물생태학 저널
- 푸어만, J.A., 아잠, F. (1982) 해양 표면 해역에서 이질성 박테리아 소플랑크톤 생산의 척도로 티미딘 결합. 해양생물학
- 케르너, M, 호엔버그, H, 에르틀, S, 레커만크, M, 스피티, A.(2003) 용존된 유기 물질을 강물 속 미켈과 같은 미세입자에 자가 조직한다. 자연
- Kirchman, D, Sigda, J, Kapusinski, R, Mitchell, R. (1982) 박테리아를 열거하기 위한 직접 계수 방법에 대한 통계 분석. 응용 및 환경미생물학
- 마인하르트, S, Azam F. (1989) 플랑크톤 해양세균의 단백질 함량과 단백질 합성률. 해양생태프로세서 시리즈
- Muenster, V.U. (1985) Lake Plussee의 DOM에 있는 서로 다른 유기 기판의 구조, 분포 및 역학에 대한 조사. 하이드로바이올로지
- 포머로이, L.R., 윌리엄스, P.J.leB, 아잠, F., 호비, J.E(2007) 「미생물 루프」. 해양학, 20(2): 28–33. doi:10.4319/lo. 2004.49.3.0862.
- Stodereger, K, Herndl, G.J.(1998) 박테리아 캡슐 물질의 생산 및 방출과 해양 박테리오플랭크톤에 의한 후속 활용. 림놀로지 & 해양학




