헥소스
Hexose화학에서, 헥소스는 6개의 탄소 [1][2]원자를 가진 단당류이다.모든 헥소스의 화학식은 CHO이며6126 분자량은 180.156 g/[3]mol이다.
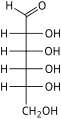
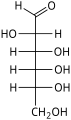
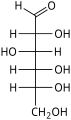
헥소스는 수용액에서 [4]쉽게 서로 변환되는 개방사슬 또는 고리형태의 두 가지 형태로 존재한다.일반적으로 용액에서 선호되는 헥소스의 개방사슬 형태는 일반 구조 H–(CHOH)–n−1C(=O)–4−nH이며, 여기서 n은 1, 2, 또는 3이다.즉, 5개의 탄소는 각각 1개의 수산기(–OH)를 가지며, 1개는 옥소기(=O)를 가지며 카르보닐기(C=O)를 형성한다.탄소 원자의 나머지 결합은 7개의 수소 원자에 의해 충족된다.일반적으로 카보닐에 가장 가까운 끝에서 시작하여 탄소 번호는 1~6입니다.
헥소스는 생화학에서 분리된 분자(예: 포도당, 과당)와 녹말, 셀룰로오스, 그리고 글리코시드와 같은 다른 화합물의 구성 요소로서 매우 중요하다.헥소스는 1,6-글리코시드 결합을 만드는 축합 반응에 의해 디헥소스(sucrose와 같은)를 형성할 수 있다.
카르보닐이 포밀기(–CH=O)를 형성하면서 위치 1에 있을 때, 당은 알도헥소스라고 불리며, 알도스의 특별한 경우이다.또는 카르보닐 위치가 2 또는 3이면 당은 케톤의 유도체이며 케토스의 특수한 경우인 케토헥소스,[1][2] 구체적으로는 n-케토헥소스라고 불린다.그러나 3-케토헥소스는 자연에서 관찰되지 않았고 합성하기 [5]어려우며, 따라서 "케토헥소스"라는 용어는 보통 2-케토헥소스를 의미한다.
직선형태에서는 히드록실기의 공간위치가 다른 16개의 알도헥소스와 8개의 2-케토헥소스가 있다.이 종들은 광학 이성질체 쌍으로 발생한다.각 쌍은 ('포도당' 또는 '과당'과 같은) 관례적인 이름을 가지며, 두 개의 부재는 분자의 피셔 투영에서 위치 5의 수산기가 각각 축의 오른쪽에 있는지 왼쪽에 있는지에 따라 "D-" 또는 "L-"로 표기된다.이러한 라벨은 이성체의 광학 활성과는 무관합니다.일반적으로 두 가지 에난티오머 중 하나만 자연적으로 발생하며(예를 들어 D-포도당), 동물에 의해 대사되거나 효모에 의해 발효될 수 있다.
"헥소스"라는 용어는 종종 푸코스 및 람노스 같은 디옥시헥소스를 포함하는 것으로 가정된다. 즉, 하나 이상의 수산기를 수소 원자로 치환함으로써 육탄당으로부터 파생된 것으로 설명될 수 있는 일반적인 공식
6
12
6-y CHO를 가진 화합물이다.
분류
알도헥소스속
알도헥소스는 탄소 1에서 카르보닐을 갖는 육탄당의 하위 등급으로 구조 H–C(=O)–(CHOH)–5H의 [1][2]알데히드 유도체를 형성한다.가장 중요한 예는 포도당이다.
선형 형태에서 알도헥소스는 4개의 키랄 중심을 가지며, 이는 8쌍의 에난티오머로 이루어진 16개의 가능한 알도헥소스 입체 이성질체(2)를4 제공한다.피셔 투영법에서 8개의 D-알도헥소스의 선형 형태는
이 D-이성체들 중 D-알트로스를 제외한 모든 것이 생물에서 발생하지만, D-포도당, D-갈락토스, D-만노스 세 가지만이 공통적이다.L-이성체는 일반적으로 살아있는 유기체에 존재하지 않지만 L-알트로스는 부티리비브리오 [6]섬유소벤스균의 변종에서 분리되었다.
이 순서로 그린 D-aldohexoses의 Fischer 투영법은 0에서 7까지의 3자리 이진수, 즉 000, 001, 010, 011, 100, 101, 110, 111로 식별할 수 있습니다.왼쪽에서 오른쪽으로 3비트는 각각 카본 4, 3, 2의 하이드록실 위치를 나타냅니다.비트 값이 0이면 오른쪽, 값이 1이면 왼쪽입니다.
화학자 Emil Fischer는 위에 주어진 순서를 기억하기 위해 다음과 같은 니모닉 장치를 고안했다고 합니다[citation needed]. 이것은 3비트 이진 문자열로 정렬되었을 때 키랄 중심에 대한 구성에 해당합니다.
- 모든 이타주의자들은 기꺼이 갤런 탱크에서 껌을 만든다.
알로스, 알트로오스, 포도당, 만노스, 굴로스, 이도스, 갈락토스, 탈로스.
8개의 L-aldohexoses의 Fischer 다이어그램은 대응하는 D-이성체의 거울 이미지이며, 탄소 5의 히드록실기를 포함하여 모든 히드록실기가 반전됩니다.
케토헥소스
케토헥소스는 케톤 함유 [1][2][7]헥소스이다.생물학적으로 가장 중요한 예는 과당이다.
선형 형태에서 2-케토헥소스는 3개의 키랄 중심을 가지며, 따라서 4쌍의 에난티오머를 포함한 8개의 가능한 입체 이성질체(2)를3 가진다.4개의 D-이성체는 다음과 같습니다.
대응하는 L형식은 3, 4, 5의 히드록실기가 거꾸로 되어 있다.다음은 8가지 이성질체를 다른 스타일로 나타낸 것입니다.
3-케토헥소스
이론상 케토헥소스는 카르보닐을 3위, 즉 H-(CHOH)-2C(=O)-(CHOH)-3H로 하는 3-케토헥소스를 포함한다.그러나 이들 화합물은 자연에서 발생하는 것으로 알려져 있지 않아 [5]합성하기가 어렵다.
1897년 과당을 염기로 처리함으로써 얻은 발효 불가능한 제품(특히 납)II) 수산화물은 포도당과 과당의 합성물인 글루토스(glutose)[12][13]라는 이름으로 불리며 3-케토헥소스라고 주장되었다.하지만, 후속 연구는 그 물질이 다양한 다른 [13][14]화합물들의 혼합물이라는 것을 보여주었다.
다소 복잡한 경로를 통해 3-케토헥소스인 xylo-3-hexulos의 명확한 합성 및 분리는 G에 의해 1961년에 처음 보고되었다. 유엔과 J. [5]스기하라
순환형식
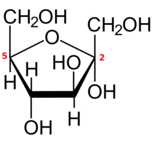
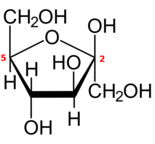
5개 이상의 탄소를 가진 대부분의 단당류와 마찬가지로 각 알도헥소스 또는 2-케토헥소스도 카르보닐기와 하이드록실기 중 하나의 내부 재배치에 의해 개방사슬형에서 파생된 하나 이상의 고리형(폐쇄) 형태로 존재한다.
이 반응은 =O기를 수산화기로, 수산화기를 두 탄소 원자 사이의 에테르 브리지(-O-)로 변화시켜 산소 원자 1개와 탄소 4개 또는 5개를 가진 고리를 형성한다.
사이클에 탄소 원자가 5개(총 6개)이면 닫힌 형태는 같은 고리를 가진 순환 에테르테트라히드로피란의 이름을 따서 피라노스라고 불린다.사이클에 탄소 원자가 4개(총 5개)이면 테트라히드로프랑 [4]화합물의 이름을 따서 푸라노스라고 한다.닫힌 형태의 탄소 번호는 개방 사슬 형태와 동일하다.
만약 그 당은 알도 헥소 오스, 위치 1에 카르보닐과, 탄소 4또는 탄소 5또는 6살부터 열두 반지로 각각 hemiacetal를 만드는 것이 수산기 포함할지도 모릅니다.만약 그 당은 2-ketohexose만 탄소 5에서 5인으로 반지를 지닌 hemiketal을 만들 것은 수산기 포함할 수 있다.
폐쇄는 그 새로운 수산기의 위치에 따라 두개의 구성을 갖고 있는 비대칭 중심,에 카르복시기를 함유한 탄소.따라서, 선형 형태로 각 hexose 두개의 뚜렷한 닫힌 형태, 접두사로 식별되"α"과"β"생산할 수 있다.
그것은 1926년 이후 결정성 고체 상태에서 hexoses 순환 형태라고 가정한다고 알려져 있다.이 아닌 enantiomers 그"α"과"β"의 형태는은 보통 개별적으로 별개의 인종으로서 확고해 질 것이다.예를 들어, 포도당은 146°C의 +112°고 융점 고유 광회 전도뿐만 아니라 150°C의 +19°고 융점 선강도 가진 β 결정을 가지고 있는 α 결정을 이루고 있다.[4]
선형 형태, 그리고 밀폐된 양식과 평형 상태에 있는 물 해결책에 작은 양만 존재하는 것이 단단해지지 않는다.[4]그럼에도 불구하고, 그 중간 단계로 그 닫힌 형태의 필수적인 역할을 한다.
특히"α"과"β"형태에 대한 서로에 열린 사슬 형태로. 그리고 정반대의 구성에 문을 닫는데 대중적으로 변환할 수 있습니다.이 과정 변광 회전 현상이라고 불린다.
화학적 성질
모든 헥소스는 유사한 구조를 가지고 있고 몇 가지 일반적인 특성을 공유하지만, 각각의 에난티오머 쌍은 그들만의 화학작용을 가지고 있다.과당은 물, 알코올, [9]에테르에 녹는다.각 쌍의 두 개의 에난티오머는 일반적으로 매우 다른 생물학적 특성을 가지고 있다.
2-케토헥소스는 넓은 pH 범위에 걸쳐 안정적이며, 1차a pK가 10.28이면 높은 pH에서만 탈양성자가 되므로 용액 중 알도헥소스에 비해 안정성이 약간 떨어진다.
자연발생 및 용도
생화학에서 가장 중요한 알도헥소스는 D-포도당인데, 이것은 많은 생물에서 신진대사를 위한 주요 "연료"입니다.
2-케토헥소스 Psicose, 과당 및 타가토스는 D-이성체로서 자연적으로 발생하며, 소르보스는 L-이성체로서 자연적으로 발생한다.
D-소르보스는 아스코르브산의 [10]상업적 합성에 일반적으로 사용된다.D-Tagatose는 음식에서 [11]소량 발견되는 희귀한 천연 케토헥소스입니다.D-프룩토스는 많은 과일의 단맛에 책임이 있고 일반적인 설탕인 수크로스의 구성 요소이다.
디옥시헥소스
"헥소스"라는 용어는 수소 원자(–H)로 치환된 하나 이상의 히드록실(–OH)을 가진 디옥시얄독소스를 포함하기 위해 가끔 사용될 수 있다.이는 부모 헥소스로 명명되며 접두사 "x-deoxy-"는 영향을 받은 수산기를 가진 탄소를 나타낸다.생물학적 관심의 몇 가지 예는 다음과 같습니다.
- L-푸코스(6-디옥시-L-갈락토스)
- L-람노스(6-디옥시-L-만노스)
- 술폴리피드 술포키노보실 디아실글리세롤(SQDG)의 일부로 발견되는 D-퀴노보스(6-데옥시-D-글루코스)
- L-Pneumose(6-deoxy-L-탈로스)
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d Thisbe K. Lindhorst (2007). Essentials of Carbohydrate Chemistry and Biochemistry (1 ed.). Wiley-VCH. ISBN 3-527-31528-4.
- ^ a b c d John F. Robyt (1997). Essentials of Carbohydrate Chemistry (1 ed.). Springer. ISBN 0-387-94951-8.
- ^ Pubchem. "D-Psicose". pubchem.ncbi.nlm.nih.gov. Retrieved 2018-04-26.
- ^ a b c d 로버트 손턴 모리슨과 로버트 닐슨 보이드(1998):유기화학, 제6판ISBN 9780138924645
- ^ a b c 조지 U. 유엔과 제임스 M.스기하라(1961) : 『유기화학 저널』 제26권 제5호, 1598-1601쪽. doi:10.1021/jo01064a070
- ^ 미국 특허 4966845, Stack; Robert J., "L-altrose의 Microbial production of L-altrose", 1990-10-30 발행, 미국 정부, 농무부 장관에게 할당
- ^ Milton Orchin, ed. (1980). The vocabulary of organic chemistry. Wiley. ISBN 978-0-471-04491-8.
- ^ Pubchem. "D-Psicose". pubchem.ncbi.nlm.nih.gov. Retrieved 2018-04-26.
- ^ a b Pubchem. "Fructose". pubchem.ncbi.nlm.nih.gov. Retrieved 2018-04-26.
- ^ a b Pubchem. "Sorbose, D-". pubchem.ncbi.nlm.nih.gov. Retrieved 2018-04-26.
- ^ a b Pubchem. "Tagatose". pubchem.ncbi.nlm.nih.gov. Retrieved 2018-04-26.
- ^ C. A. Lobry de Bruyn과 W. Alberta van Ekenstein (1897): "Action des alcalis sur les sucres.VI: La glutose et la pseudo fructose.Requeueil des Travaux Chimiques des Pays-Bas et de la Belgique, 16권, 제9호, 274-281쪽. doi: 10.1002/recl.18970160903
- ^ a b George L. Clark, Hung Kao, Louis Sattler, F.W. Zerban(1949) : "글루토스의 화학적 성질"공업 및 엔지니어링 화학, 제41, 제3호, 530-533쪽.doi:10.1021/ie50471a020
- ^ 세라 아키라(1962) : "단당의 화학적 분해에 관한 연구"13. 이른바 글루토스(3-케토헥소스)의 분리.일본화학회보 제35권 제12호, 2031-2033쪽.doi:10.1246/bcsj.35.2031
외부 링크
 Wikimedia Commons의 Aldohexoses 관련 매체
Wikimedia Commons의 Aldohexoses 관련 매체 Wikimedia Commons의 Ketohexoses 관련 매체
Wikimedia Commons의 Ketohexoses 관련 매체







![D-Psicose[8]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7c/DPsicose_Fischer.svg/62px-DPsicose_Fischer.svg.png)
![D-Fructose[9]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/D-Fructose.svg/72px-D-Fructose.svg.png)
![D-Sorbose[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d6/DSorbose_Fischer.svg/70px-DSorbose_Fischer.svg.png)
![D-Tagatose[11]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6c/DTagatose_Fischer.svg/70px-DTagatose_Fischer.svg.png)