리간드 게이트 이온 채널
Ligand-gated ion channel| 신경전달물질-게이트 이온채널-막 통과영역 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 리간드 게이트 이온 채널 | |||||||||
| 식별자 | |||||||||
| 기호. | Neur_chan_memb | ||||||||
| 팜 | PF02932 | ||||||||
| 인터프로 | IPR006029 | ||||||||
| 프로 사이트 | PDOC00209 | ||||||||
| SCOP2 | 1cek/SCOPe/SUPFAM | ||||||||
| TCDB | 1. A.9 | ||||||||
| OPM 슈퍼 패밀리 | 14 | ||||||||
| OPM단백질 | 2/9 | ||||||||
| |||||||||
리간드게이트이온채널(LICs, LGIC)은 일반적으로 이온방향수용체라고도 불리며, 신경전달물질과 같은 화학적 메신저(즉 리간드)[1][2][3]의 결합에 반응하여 Na, K+, Ca2+ 및/또는− Cl 등의+ 이온이 막을 통과할 수 있도록 개방되는 트랜스막 이온채널 단백질의 그룹이다.
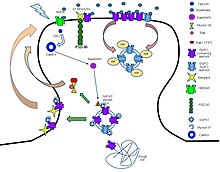
시냅스 전 뉴런이 흥분하면 소포에서 시냅스 틈으로 신경전달물질을 방출한다.신경전달물질은 시냅스 후 뉴런에 위치한 수용체에 결합한다.이러한 수용체가 리간드 게이트 이온 채널일 경우, 그 결과로 나타나는 구조 변화는 이온 채널을 열어 세포막을 가로질러 이온의 흐름을 이끈다.이는 결국 흥분성 수용체 반응에 대한 탈분극 또는 억제 반응에 대한 과분극으로 귀결된다.
이러한 수용체 단백질은 전형적으로 적어도 두 개의 다른 도메인으로 구성되어 있다. 이온 기공을 포함하는 트랜스막 도메인과 리간드 결합 위치(알로스테릭 결합 부위)를 포함하는 세포 외 도메인이다.이러한 모듈화는 단백질의 구조를 찾는 '분할 및 정복' 접근법을 가능하게 했다(각 도메인을 개별적으로 결정).시냅스에 위치한 그러한 수용체의 기능은 시냅스 전 방출된 신경전달물질의 화학신호를 직접적이고 매우 빠르게 시냅스 후 전기신호로 변환하는 것이다.많은 LICs는 알로스테릭 배위자, 채널 차단제, 이온 또는 막 전위에 의해 추가로 조절됩니다.LIC는 진화 관계가 없는 세 개의 슈퍼 패밀리, 즉 cys-loop 수용체, 이온 자극성 글루탐산 수용체 및 ATP 게이트 채널로 분류됩니다.
시스루프수용체
cys-loop 수용체는 N 말단 세포외 도메인에 있는 두 시스테인 잔류물 사이의 디술피드 결합에 의해 형성된 특성 루프의 이름을 따서 명명되었다.이들은 일반적으로 이황화 결합이 없는 펜타미 리간드 게이트 이온 채널의 큰 패밀리의 일부이며, 따라서 잠정적인 이름은 "프로루프 수용체"[4][5]이다.세포외 N말단 리간드 결합 도메인 내의 결합 부위는 척추동물의 (1)아세틸콜린(AcCh), (2)세로토닌, (3)글리신, (4)글루탐산 및 (5)γ-아미노부틸산(GABA)에 대한 수용체 특이성을 제공한다.수용체는 그들이 전도하는 이온의 종류(음이온성 또는 양이온성)에 따라 세분되며, 내인성 배위자에 의해 정의된 패밀리로 더 세분화된다.이들은 보통 트랜스막 도메인을 구성하는 4개의 트랜스막 헬리클과 베타 시트 샌드위치 유형, 세포외, N 말단, 리간드 [6]결합 도메인을 포함하는 각 서브유닛에 5대 미국형이다.또한 일부는 이미지에 표시된 것처럼 세포 내 도메인을 포함합니다.
대표적인 리간드 개폐 이온 채널은 니코틴성 아세틸콜린 수용체이다.단백질 서브유닛(일반적으로 αβγ) 펜타머와 아세틸콜린(각 서브유닛의 계면에 하나씩)에 대한 두 개의 결합 부위로 구성됩니다.아세틸콜린이 결합하면 수용체의 구성이 변화하고(모공을 차단하는 류신 잔기를 채널 경로 밖으로 이동시키는 T2 나선과 반대로), 이온이 통과할 수 있도록 약 3 앵스트롬의 모공의 협착이 약 8 앵스트롬으로 넓어진다.이 모공은 Na 이온이 세포로 전기 화학적 구배를 따라 흐를 수 있게+ 해줍니다.충분한 수의 채널이 동시에 열리면 Na 이온에 의해+ 운반되는 양전하의 내향 흐름이 시냅스 후막을 충분히 탈분극시켜 활동 전위를 개시한다.
LIC에 대한 박테리아 상동체가 확인되었으며, 그럼에도 불구하고 화학수용체 [4]역할을 한다는 가설이 있다.이 원핵생물 nACHR 변이는 GLIC 수용체로 알려져 있으며, 이는 확인된 종인 Gloeobacter Ligand-gated Ion Channel의 이름을 따왔다.
구조.
Cys-loop 수용체는 잘 보존된 구조 요소를 가지고 있으며, 큰 세포외 도메인(ECD)은 알파 나선과 10개의 베타 가닥을 가지고 있다.ECD에 이어 세포내 및 세포외 루프 [7]구조에 의해 4개의 막간 세그먼트(TMS)가 접속된다.TMS 3-4 루프를 제외하고 길이는 7-14개밖에 남지 않습니다.TMS 3-4 루프는 세포내 도메인(ICD)의 가장 큰 부분을 형성하고 이러한 모든 상동 수용체 사이에서 가장 가변적인 영역을 나타낸다.ICD는 TMS 3-4 루프와 TMS 1-2 루프에 의해 이온 채널 구멍 [7]앞에 정의됩니다.결정화는 가족의 일부 구성원에 대한 구조를 밝혀냈지만, 결정화를 허용하기 위해 세포 내 루프는 보통 원핵생물 cys-loop 수용체에 존재하는 짧은 링커로 대체되었고, 그래서 그들의 구조는 알려지지 않았다.그럼에도 불구하고, 이 세포 내 루프는 탈감작, 약리 물질에 의한 채널 생리의 변조 및 번역 후 변형에서 기능하는 것으로 보인다.밀매에 중요한 모티브가 포함되어 있으며 ICD는 억제 시냅스 [7]형성을 가능하게 하는 발판 단백질과 상호작용한다.
양이온성 카이스루프 수용체
| 유형 | 학급 | IUPHAR 권장 단백질명 | 진 | 이전 이름 |
|---|---|---|---|---|
| 세로토닌 (5-HT) | 5-HT3 | 5-HT3A 5-HT3B 5-HT3C 5-HT3D 5-HT3E | HTR3A HTR3B HTR3C HTR3D HTR3E | 5-HT3A 5-HT3B 5-HT3C 5-HT3D 5-HT3E |
| 니코틴 아세틸콜린 (nACHR) | 알파 | α1 α2 α3 α4 α5 α6 α7 α9 α10 | CHRNA1 CHRNA2 CHRNA3 CHRNA4 CHRNA5 CHRNA6 CHRNA7 CHRNA9 CHRNA10 | ACHRA, ACHRD, CHRNA, CMS2A, FCCMS, SCCMS |
| 베타. | β1 β2 β3 β4 | CHRNB1 CHRNB2 CHRNB3 CHRNB4 | CMS2A, SCCM, ACHRB, CHRNB, CMS1D EFNL3, nAChRb2 | |
| 감마 | γ | 크릉크 | ACHRG | |
| 델타 | δ | 크랏도 | ACHRD, CMS2A, FCCMS, SCCMS | |
| 엡실론 | ε | 크린 | ACHRE, CMS1D, CMS1E, CMS2A, FCCMS, SCCMS | |
| 아연활성 이온 채널 (ZAC) | ZAC | ZACN | ZAC1, L2m LICZ, LICZ1 |
음이온성 시스루프 수용체
| 유형 | 학급 | IUPHAR 권장 단백질명[8] | 진 | 이전 이름 |
|---|---|---|---|---|
| 가바A | 알파 | α1 α2 α3 α4 α5 α6 | GABRA1 가브라2 가브라3 가브라4 가브라5 GABRA6 | EJM, ECA4 |
| 베타. | β1 β2 β3 | GABRB1 GABRB2 GABRB3 | ECA5 | |
| 감마 | 11 22 33 | GABRG1 GABRG2 GABRG3 | CAE2, ECA2, GEFSP3 | |
| 델타 | δ | 개버드 | ||
| 엡실론 | ε | 가브리 | ||
| 파이 | π | GABRP | ||
| 세타 | θ | GABRQ | ||
| 로 | 11 22 33 | GABRR1 GABRR2 GABR3 | 가바C[9] | |
| 글리신 (GlyR) | 알파 | α1 α2 α3 α4 | GLRA1 GLRA2 GLRA3 GLRA4 | 스테 |
| 베타. | β | GLRB |
글루탐산이온수용체
이오노트로픽 글루탐산 수용체는 신경전달물질 글루탐산염과 결합한다.이들은 세포외 아미노 말단 도메인(ATD, 테트라머 어셈블리를 포함), 세포외 리간드 결합 도메인(LBD, 글루타메이트를 결합하는 LBD) 및 이온 채널을 형성하는 TMD(Transmembrane Domain)로 구성된 각 서브유닛과 함께 테트라머를 형성한다.각 서브유닛의 막 통과 도메인은 3개의 막 통과 나선과 재진입 루프가 있는 반막 나선을 포함한다.단백질의 구조는 N 말단의 ATD에서 시작하여 TMD의 나선 1, 2, 3에 의해 중단되는 LBD의 전반부에서 시작하여 LBD의 마지막 절반으로 계속된 후 C 말단에서 TMD의 나선 4로 종료된다.즉, TMD와 세포외 도메인 사이에는 3개의 링크가 있습니다.테트라머의 각 서브유닛은 클램셸 형상의 2개의 LBD 단면에 의해 형성된 글루탐산염의 결합부위를 가진다.이온 채널을 열려면 테트라머에 있는 이 사이트 중 두 곳만 점유하면 됩니다.모공은 반전 칼륨 채널과 유사한 방식으로 주로 하프나선 2에 의해 형성됩니다.
| 유형 | 학급 | IUPHAR 권장 단백질명 | 진 | 이전 이름 |
|---|---|---|---|---|
| AMPA | 글루아 | GluA1 GluA2 GluA3 GluA4 | GRIA1 GRIA2 GRIA3 GRIA4 | GLUA1, GluR1, GluRA, GluR-A, GluR-K1, HBGR1 GLUA2, GluR2, GluRB, GluR-B, GluR-K2, HBGR2 GLUA3, GluR3, GluRC, GluR-C, GluR-K3 GLUA4, GluR4, GluRD, GluR-D |
| 카이나테 | GluK | GluK1 GluK2 GluK3 GluK4 GluK5 | GRIK1 GRIK2 GRIK3 GRIK4 GRIK5 | GLUK5, GluR5, GluR-5, EAA3 GLUK6, GluR6, GluR-6, EAA4 GLUK7, GluR7, GluR-7, EAA5 GLUK1, KA1, KA-1, EAA1 GLUK2, KA2, KA-2, EAA2 |
| NMDA | GLUN | GluN1 NRL1A NRL1B | 그린 1 히죽히죽 히루 | GLUN1, NMDA-R1, NR1, GluR11 |
| GluN2A GluN2B GluN2C GluN2D | 그린2A 그린2B 그린2C 그린2D | GLUN2A, NMDA-R2A, NR2A, GluR11 GLUN2B, NMDA-R2B, NR2B, hNR3, GluR22 GLUN2C, NMDA-R2C, NR2C, GluR33 GLUN2D, NMDA-R2D, NR2D, GluR44 | ||
| GluN3A GluN3B | 그린 3A 그린3B | GLUN3A, NMDA-R3A, NMDAR-L, chi-1 GLU3B, NMDA-R3B | ||
| '오르판' | (GluD) | GluD1 GluD2 | 그리드 1 그리드 2 | GluR1 1 GluR22 |
AMPA수용체
α-아미노-3-히드록시-5-메틸-4-이소옥사졸프로피온산 수용체(AMPA 수용체 또는 퀴스칼레이트 수용체라고도 함)는 중추신경계(CNS)에서 빠른 시냅스 전달을 매개하는 글루탐산용 비NMDA형 이온성 트랜스막 수용체이다.이것의 이름은 인공 글루탐산 아날로그 AMPA에 의해 활성화되는 능력에서 유래되었다.이 수용체는 자연적으로 발생하는 작용제 퀴스칼레이트 이후 왓킨스와 동료들에 의해 "퀴스칼레이트 수용체"로 처음 명명되었고,[10] 후에 코펜하겐에 있는 덴마크 왕립 약학교의 Tage Honore와 동료들에 의해 개발된 선택적 작용제 이후에야 "AMPA 수용체"라는 라벨이 붙여졌다.AMPAR은 뇌의 많은 부분에서 발견되고 신경계에서 가장 흔하게 발견되는 수용체이다.AMPA 수용체 GluA2(GluR2) 테트라머는 결정화된 최초의 글루탐산 수용체 이온 채널이었다.리간드는 다음과 같습니다.
- 작용제: 글루탐산, AMPA, 5-플루오로윌라딘, 도모산, 퀴스퀼산 등
- 길항제: CNQX, Kynurenic acid, NBQX, Perampanel, Piracetam 등
- 양극 알로스테릭 변조기:아니라세탐, 사이클로티아지드, CX-516, CX-614 등
- 음극 알로스테릭 변조기:에탄올, 페람파넬, 탈람파넬, GYKI-52,466 등
NMDA수용체
N-메틸-D-아스파르트산 수용체(NMDA 수용체)는 글루타메이트와 공동고니스트(D-serine 또는 글리신)[11]의 동시 결합에 의해 게이트되는 리간드 게이트 이온 채널이다.연구에 따르면 NMDA 수용체는 시냅스 가소성과 [12][13]기억력을 조절하는 데 관여한다.
"NMDA 수용체"라는 이름은 리간드 N-메틸-D-아스파르트산염(NMDA)에서 유래되었으며, 리간드 N-메틸-D-아스파르트산염(NMDA)은 이러한 수용체에서 선택적 작용제로 작용한다.NMDA 수용체가 두 개의 공동 작용제의 결합에 의해 활성화되면, 양이온 채널이 열리고, Na와2+ Ca가 세포로 흘러 들어가 세포의+ 전위를 상승시킵니다.따라서 NMDA 수용체는 흥분성 수용체이다.휴지 전위에서는 수용체상의 세포외 결합부위에서의 Mg 또는 Zn의2+ 결합은2+ NMDA 수용체 채널을 통한 이온 플럭스를 차단한다.그러나 뉴런이 탈분극되면 예를 들어 Colocalized Post Synaptic AMPA 수용체의 강력한 활성화에 의해 Mg에 의한2+ 전압의존 블록이 부분적으로 완화되어 활성화된 NMDA 수용체를 통한 이온 유입이 허용된다.결과적으로 발생하는2+ Ca 유입은 다양한 세포 내 신호 전달을 촉발할 수 있으며, 이는 궁극적으로 다양한 키나아제 및 포스파타아제 활성화를 통해 신경 기능을 변화시킬 수 있다."[14]리간드는 다음과 같습니다.
- 주요 내인성 공동작용제: 글루탐산염과 D-세린 또는 글리신 중 하나
- 기타 작용제 : 아미노시클로프로판카르복실산, D-시클로세린, L-아스파르트산, 퀴놀산 등
- 부분작용제 : N-메틸-D-아스파르트산(NMDA), NRX-1074, 3,5-디브로모-L-페닐알라닌 [15]등
- 길항제: 케타민, PCP, 덱스트로폭시펜, 케토베미돈, 트라마돌, 키누렌산(내생) 등
ATP 게이트 채널
ATP 게이트 채널은 뉴클레오티드 ATP 결합에 반응하여 열립니다.이들은 서브유닛당 2개의 막 통과 나선형 및 세포내측 C 및 N 말미니를 가진 삼량체를 형성한다.
| 유형 | 학급 | IUPHAR 권장 단백질명 | 진 | 이전 이름 |
|---|---|---|---|---|
| P2X | 없음 | P2X1 P2X2 P2X3 P2X4 P2X5 P2X6 P2X7 | P2RX1 P2RX2 P2RX3 P2RX4 P2RX5 P2RX6 P2RX7 | P2X1 P2X2 P2X3 P2X4 P2X5 P2X6 P2X7 |
임상 관련성
리간드 게이트 이온 채널은 마취제와 에탄올이 영향을 미치는 주요 부위가 될 가능성이 높지만 이에 대한 명확한 증거는 아직 [16][17]확립되지 않았다.특히 GABA 수용체와 NMDA 수용체는 임상마취에 [18]사용되는 것과 유사한 농도로 마취제의 영향을 받는다.
메커니즘을 이해하고 이러한 수용체에 기능할 수 있는 화학/생물/물리적 성분을 조사함으로써, 점점 더 많은 임상적 응용이 예비 실험 또는 FDA에 의해 증명된다.메만틴은 미국 식품의약국의 승인을 받았다.A와 유럽약국(European Medicine Agency)은 중증에서 중증 알츠하이머병 [19]치료를 담당하며 영국 국립건강관리연구소(National Institute for Health and Care Excellence)로부터 다른 치료 [20]방법에서 실패하는 환자에 대한 제한적 권고를 받았다.아고멜라틴은 이중 멜라토네르기-세로토네르기 경로에 작용하는 약물의 일종으로 임상시험 [21][22]중 불안한 [23]우울증을 치료하는 데 효과가 있다는 연구 결과도 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Gene Family: Ligand gated ion channels". HUGO Gene Nomenclature Committee.
- ^ Dorland's Medical Dictionary의 "리간드 게이트 채널"
- ^ Purves, Dale, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White (2008). Neuroscience. 4th ed. Sinauer Associates. pp. 156–7. ISBN 978-0-87893-697-7.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ a b Tasneem A, Iyer LM, Jakobsson E, Aravind L (2004). "Identification of the prokaryotic ligand-gated ion channels and their implications for the mechanisms and origins of animal Cys-loop ion channels". Genome Biology. 6 (1): R4. doi:10.1186/gb-2004-6-1-r4. PMC 549065. PMID 15642096.
- ^ Jaiteh M, Taly A, Hénin J (2016). "Evolution of Pentameric Ligand-Gated Ion Channels: Pro-Loop Receptors". PLOS ONE. 11 (3): e0151934. Bibcode:2016PLoSO..1151934J. doi:10.1371/journal.pone.0151934. PMC 4795631. PMID 26986966.
- ^ Cascio M (May 2004). "Structure and function of the glycine receptor and related nicotinicoid receptors". The Journal of Biological Chemistry. 279 (19): 19383–6. doi:10.1074/jbc.R300035200. PMID 15023997.
- ^ a b c Langlhofer G, Villmann C (2016-01-01). "The Intracellular Loop of the Glycine Receptor: It's not all about the Size". Frontiers in Molecular Neuroscience. 9: 41. doi:10.3389/fnmol.2016.00041. PMC 4891346. PMID 27330534.
- ^ a b c d Collingridge GL, Olsen RW, Peters J, Spedding M (January 2009). "A nomenclature for ligand-gated ion channels". Neuropharmacology. 56 (1): 2–5. doi:10.1016/j.neuropharm.2008.06.063. PMC 2847504. PMID 18655795.
- ^ Olsen RW, Sieghart W (September 2008). "International Union of Pharmacology. LXX. Subtypes of gamma-aminobutyric acid(A) receptors: classification on the basis of subunit composition, pharmacology, and function. Update". Pharmacological Reviews. 60 (3): 243–60. doi:10.1124/pr.108.00505. PMC 2847512. PMID 18790874.
- ^ Honoré T, Lauridsen J, Krogsgaard-Larsen P (January 1982). "The binding of [3H]AMPA, a structural analogue of glutamic acid, to rat brain membranes". Journal of Neurochemistry. 38 (1): 173–8. doi:10.1111/j.1471-4159.1982.tb10868.x. PMID 6125564. S2CID 42753770.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 5: Excitatory and Inhibitory Amino Acids". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. pp. 124–125. ISBN 9780071481274.
At membrane potentials more negative than approximately −50 mV, the Mg2+ in the extracellular fluid of the brain virtually abolishes ion flux through NMDA receptor channels, even in the presence of glutamate. ... The NMDA receptor is unique among all neurotransmitter receptors in that its activation requires the simultaneous binding of two different agonists. In addition to the binding of glutamate at the conventional agonist-binding site, the binding of glycine appears to be required for receptor activation. Because neither of these agonists alone can open this ion channel, glutamate and glycine are referred to as coagonists of the NMDA receptor. The physiologic significance of the glycine binding site is unclear because the normal extracellular concentration of glycine is believed to be saturating. However, recent evidence suggests that D-serine may be the endogenous agonist for this site.
- ^ Li F, Tsien JZ (July 2009). "Memory and the NMDA receptors". The New England Journal of Medicine. 361 (3): 302–3. doi:10.1056/NEJMcibr0902052. PMC 3703758. PMID 19605837.
- ^ Cao X, Cui Z, Feng R, Tang YP, Qin Z, Mei B, Tsien JZ (March 2007). "Maintenance of superior learning and memory function in NR2B transgenic mice during ageing". The European Journal of Neuroscience. 25 (6): 1815–22. doi:10.1111/j.1460-9568.2007.05431.x. PMID 17432968. S2CID 15442694.
- ^ Dingledine R, Borges K, Bowie D, Traynelis SF (March 1999). "The glutamate receptor ion channels". Pharmacological Reviews. 51 (1): 7–61. PMID 10049997.
- ^ Yarotskyy V, Glushakov AV, Sumners C, Gravenstein N, Dennis DM, Seubert CN, Martynyuk AE (May 2005). "Differential modulation of glutamatergic transmission by 3,5-dibromo-L-phenylalanine". Molecular Pharmacology. 67 (5): 1648–54. doi:10.1124/mol.104.005983. PMID 15687225. S2CID 11672391.
- ^ Krasowski MD, Harrison NL (August 1999). "General anaesthetic actions on ligand-gated ion channels". Cellular and Molecular Life Sciences. 55 (10): 1278–303. doi:10.1007/s000180050371. PMC 2854026. PMID 10487207.
- ^ Dilger JP (July 2002). "The effects of general anaesthetics on ligand-gated ion channels". British Journal of Anaesthesia. 89 (1): 41–51. doi:10.1093/bja/aef161. PMID 12173240.
- ^ Harris RA, Mihic SJ, Dildy-Mayfield JE, Machu TK (November 1995). "Actions of anesthetics on ligand-gated ion channels: role of receptor subunit composition" (abstract). FASEB Journal. 9 (14): 1454–62. doi:10.1096/fasebj.9.14.7589987. PMID 7589987. S2CID 17913232.
- ^ Mount C, Downton C (July 2006). "Alzheimer disease: progress or profit?". Nature Medicine. 12 (7): 780–4. doi:10.1038/nm0706-780. PMID 16829947.
- ^ NICE 기술평가 2011년 1월 18일 아즈하이머병 - 도네페질, 갈란타민, 리바스티그민, 메만틴 (검토) : 최종평가 결정
- ^ Heun, R; Coral, RM; Ahokas, A; Nicolini, H; Teixeira, JM; Dehelean, P (2013). "1643 – Efficacy of agomelatine in more anxious elderly depressed patients. A randomized, double-blind study vs placebo". European Psychiatry. 28 (Suppl 1): 1. doi:10.1016/S0924-9338(13)76634-3. S2CID 144761669.
- ^ Brunton, L; Chabner, B; Knollman, B(2010).Goodman and Gilman's The Pharmacological Basis of Therapeutics (제12호).뉴욕: 맥그로-힐 프로페셔널.ISBN 978-0-07-162442-8.
- ^ Avedisova, A; Marachev, M (2013). "2639 – The effectiveness of agomelatine (valdoxan) in the treatment of atypical depression". European Psychiatry. 28 (Suppl 1): 1. doi:10.1016/S0924-9338(13)77272-9. S2CID 145014277.
외부 링크
- 유럽생물정보학연구소의 리간드 게이트 이온 채널 데이터베이스.2007년 4월 11일 이용 가능 여부 확인.
- "Revised Recommendations for Nomenclature of Ligand-Gated Ion Channels". IUPHAR Database of Receptors and Ion Channels. International Union of Basic and Clinical Pharmacology.
- www.esf.edu
- www.genenames.org
- www.guidetopharmacology.org
이 편집 시점에서는, 이 기사는, 다음의 컨텐츠를 사용하고 있습니다."1.A.9 신경전달물질 수용체, Cys 루프, 리간드 게이트 이온 채널(LIC)Creative Commons Attribution-Share Alike 3.0 Unported License(GFDL)에서는 재사용할 수 있지만 GFDL에서는 재사용할 수 없습니다.모든 관련 조건을 따라야 합니다.