칼륨 채널
Potassium channel칼륨 채널은 이온 채널의 가장 널리 분포된 유형으로 거의 모든 살아있는 [1]유기체에서 발견됩니다.그들은 세포막을 가로지르는 칼륨 선택성 모공을 형성한다.칼륨 채널은 대부분의 세포 유형에서 발견되며 다양한 세포 [2][3]기능을 제어합니다.
기능.
칼륨 채널은 칼륨 이온을 전기화학적 구배 아래로 전도하는 기능을 하며, 칼륨 이온을 빠르게(벌크워터의 K 이온 확산+ 속도까지) 그리고 선택적으로(가장 주목할 만한 것은 이온 [4]반지름의 아항스트롬 차이에도 불구하고 나트륨 제외) 한다.생물학적으로, 이러한 채널은 많은 세포에서 휴식 전위를 설정하거나 재설정하는 역할을 합니다.뉴런과 같은 흥분성 세포에서는 칼륨 이온의 지연 역류가 활동 전위를 형성합니다.
심근의 심장 활동 전위 지속 시간 조절에 기여함으로써 칼륨 채널의 오작동은 생명을 위협하는 부정맥을 유발할 수 있습니다.칼륨 채널은 혈관 긴장 유지에도 관여할 수 있습니다.
그들은 또한 호르몬의 분비와 같은 세포 과정을 조절하기 때문에 (예를 들어, 췌장의 베타 세포에서 인슐린이 분비됨) 그들의 오작동이 질병으로 이어질 수 있습니다 (당뇨병과 같은.
덴드로톡신과 같은 일부 독소는 칼륨 [5]채널을 차단하기 때문에 강력합니다.
종류들
칼륨 채널에는 크게 4가지 종류가 있습니다.
- 칼슘 활성 칼륨 채널 - 칼슘 이온 또는 기타 신호 분자의 존재에 따라 열립니다.
- 칼륨 채널을 내부로 정류 - 전류(양전하)를 내부 방향으로(셀로) 더 쉽게 통과시킵니다.
- 탠덤 모공 도메인 칼륨 채널 - 뉴런의 음의 막 전위를 설정하는 "휴면 칼륨 채널" 또는 "누출 채널"과 같이 구성적으로 개방되거나 높은 기저 활성화가 있다.
- 전압 게이트 칼륨 채널 - 막 통과 전압의 변화에 따라 열리거나 닫히는 전압 게이트 이온 채널입니다.
다음 표는 칼륨 채널의 메이저클래스와 대표적인 예를 비교한 것입니다(각 클래스 내의 채널 전체 목록은 각 클래스 페이지를 참조하십시오).
칼륨 채널의 약리학적 변조제의 자세한 예는 칼륨 채널 차단제 및 칼륨 채널 오프너를 참조하십시오.
| 학급 | 서브클래스 | 기능. | 블로커 | 액티베이터 |
|---|---|---|---|---|
| 칼슘활성화 6 T 및 1 P |
| [필요한 건] | ||
| 내부 수정 2T 및 1P |
|
| ||
|
| |||
|
| |||
| [필요한 건] | |||
| 탠덤 기공 영역 4T 및 2P | [필요한 건] | |||
| 전압 게이트 6 T 및 1 P |
구조.
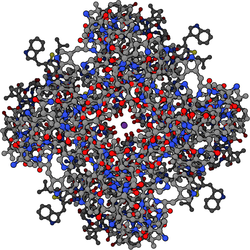
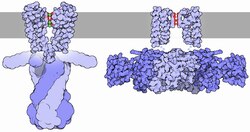
칼륨 채널은 4개의 동일한 단백질 서브유닛이 결합하여 중심 이온 전도공(즉 호모테트라머) 주위에 배치된 4중 대칭(C4) 복합체를 형성하는 4중체 구조를 가진다.또는 서로 관련되지만 동일하지 않은 4개의 단백질 서브유닛이 결합해 의사4 C대칭의 헤테로전자복합체를 형성할 수 있다.모든 칼륨 채널 서브유닛은 모공의 상부에 선을 그은 독특한 모공 루프 구조를 가지며 칼륨 선택적 투과성을 담당합니다.
칼륨 채널 서브유닛을 코드하는 포유류의 유전자는 80개가 넘는다.그러나 박테리아에서 발견되는 칼륨 채널은 분자 구조 측면에서 가장 많이 연구된 이온 채널 중 하나이다.X선 결정학을 [55][56]사용하여 칼륨 이온이 어떻게 이러한 채널을 통과하는지 그리고 왜 (작은) 나트륨 이온이 통과하지 [57]않는지에 대한 심오한 통찰력을 얻었습니다.2003년 노벨 화학상은 이 [58]분야의 선구적인 업적으로 로드 맥키넌에게 수여되었다.
선택 필터
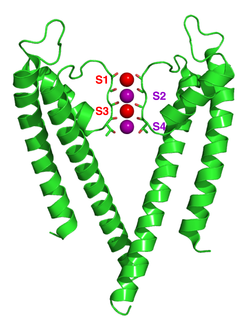
칼륨 이온 채널은 이온이 선택성 필터에 들어갈 때 이온에서 수화 셸을 제거합니다.선택성 필터는 4개의 서브유닛 각각 내에서 시그니처 시퀀스라고 불리는 5개의 잔류 시퀀스인 TVGYG에 의해 형성됩니다.이 시그니처 시퀀스는 모공 나선과 TM2/6 사이의 루프 내에 있으며, 이는 역사적으로 P 루프라고 불립니다.원핵 칼륨 채널의 발린 잔기가 진핵 생물 채널의 이소류신 잔기로 종종 대체되는 것을 제외하고, 이 시그니처 배열은 매우 보존되어 있다.이 배열은 구조적으로 네스트 단백질 구조 모티브와 유사한 독특한 주쇄 구조를 채택한다.네 세트의 전기음성 카르보닐 산소 원자는 필터 모공의 중앙을 향해 정렬되어 각 칼륨 결합 부위 주위에 수용성 셸과 유사한 정사각형 반프리즘을 형성합니다.선택성 필터의 결합 부위의 카르보닐 옥시겐과 칼륨 이온의 거리는 제1 수화 셸의 물 옥시겐과 수용액의 칼륨 이온의 거리와 동일하여 이온의 탈용해에 에너지적으로 유리한 경로를 제공한다.그러나 나트륨 이온은 너무 작아서 카르보닐 산소 원자 사이의 공간을 채울 수 없습니다.따라서 나트륨 이온은 칼륨 선택 이온 [60]세공을 통과하는 것보다 세포외 공간에서 물 분자와 결합되어 있는 것이 에너지적으로 유리하다.이 폭은 선택성 [55][61]필터를 둘러싼 방향족 아미노산 잔류물 시트 내에서 수소 결합 및 반데르발스 힘에 의해 유지되는 것으로 보입니다.선택성 필터는 세포외 용액 쪽으로 열려 글리신 잔기(KcsA의 경우 Gly79)에 있는 4개의 카르보닐 옥시겐을 노출합니다.단백질의 세포외측으로 향하는 다음 잔류물은 음전하를 띤 Asp80(KcsA)이다.이 잔류물은 5개의 필터 잔류물과 함께 단백질의 중심에 있는 물로 채워진 공동과 세포외 [62]용액을 연결하는 모공을 형성합니다.
선택 메커니즘
칼륨 채널 선택성의 메커니즘은 계속 논의되고 있다.카르보닐 옥시겐은 전기 음성이 강하고 양이온 흡인력이 강하다.필터는 보통 S1에서 S4로 표시된 4개의 부위에서 세포외측에서 시작하여 칼륨 이온을 수용할 수 있습니다.또한 SC라고 불리는 부위의 캐비티 내에 1개의 이온이 결합하거나 S0 또는 Sext라고 불리는 다소 명확한 부위의 세포외 측에 1개 이상의 이온이 결합할 수 있다.이러한 사이트에는 몇 가지 다른 점유자가 있을 수 있습니다.그러나 X선 구조는 많은 분자에 대한 평균이기 때문에 이러한 구조에서 직접 실제 점유율을 추론하는 것은 불가능하다.일반적으로 이온에 의해 두 개의 인접 부위가 점유되는 정전기 반발로 인해 일부 단점이 있다.선택성 메커니즘에 대한 제안은 분자 역학 시뮬레이션,[63] 이온 [64]결합 완구 모델, 열역학 계산,[65] 위상학적 [66][67]고려사항 및 선택적 채널과 비선택적 채널 간의 구조적 차이를[68] 바탕으로 이루어졌다.
KcsA에서 이온 전위를 위한 메커니즘은 이론적인 계산과 [62][69]시뮬레이션을 통해 광범위하게 연구되어 왔다.두 개의 이중 점유 상태(S1, S3)와 (S2, S4)가 필수적인 역할을 하는 이온 전도 메커니즘의 예측은 두 가지 기술로 확인되었다.분자역학(MD) 시뮬레이션에 따르면 필터에 들어오고 나가는 이온을 반영하는 두 개의 세포외 상태ext S와0 S도 이온 전도에서 중요한 역할을 합니다.
소수성 지역
이 영역은 칼륨 이온 주변의 환경을 중화시켜 어떤 전하에도 끌리지 않도록 합니다.차례로, 그것은 반응을 가속화한다.
중앙 공동
10Ω 폭의 중앙 기공이 막 통과 채널의 중심 근처에 있으며, 채널 벽의 소수성 때문에 횡단 이온에 대한 에너지 장벽이 가장 높습니다.모공 나선형의 극성 C 말단과 물로 채워진 공동은 이온에 대한 에너지 장벽을 완화합니다.복수의 칼륨 이온에 의한 반발은 이온의 throughput에 도움이 된다고 생각됩니다.공동의 존재는 K이온을+ 수분이 많고 높은 유전체 환경에 유지함으로써 유전체 장벽 또는 저유전막에 의한 반발을 극복하기 위한 채널의 메커니즘 중 하나로 직관적으로 이해할 수 있다.
규정
칼륨 채널 기공을 통과하는 이온의 플럭스는 게이트와 불활성화라는 두 가지 관련 프로세스에 의해 조절됩니다.게이트는 자극에 반응하여 채널을 열거나 닫는 것이며, 불활성화는 열린 칼륨 채널에서 전류가 빠르게 정지하고 채널의 전도 재개를 억제하는 것입니다.두 프로세스 모두 채널 컨덕턴스를 조절하는 역할을 하지만 각 프로세스는 여러 메커니즘에 의해 조정될 수 있습니다.
일반적으로, 게이트는 자극을 감지하고 채널 기공을 여는 추가적인 구조적 영역에 의해 매개되는 것으로 생각됩니다.이러한 도메인에는 BK [70][71][72]채널의 RCK 도메인과 전압 게이트+ K 채널의 전압 센서 도메인이 포함됩니다.이러한 도메인은 모공 도메인의 세포 내 게이트를 물리적으로 열어 칼륨 이온이 막을 통과할 수 있도록 함으로써 자극에 반응하는 것으로 생각된다.일부 채널은 자극에 대한 반응을 조절하는 역할을 하는 여러 조절 영역 또는 보조 단백질을 가지고 있습니다.메커니즘이 계속 논의되는 동안, 원핵[73][74][75] 및 진핵[70][71][72] 채널의 RCK 도메인, KcsA의 [76]pH 게이트 도메인, 고리형 뉴클레오티드 게이트 [77]도메인 및 전압 게이트 칼륨 [78][79]채널을 포함한 이러한 조절 도메인의 알려진 구조가 있다.
N형 불활성화는 일반적으로 더 빠른 불활성화 메커니즘으로, "볼 앤 체인"[80] 모델이라고 불립니다.N형 불활성화는 모공 도메인과 상호작용하고 "공"처럼 이온 전도 경로를 차단하는 채널의 N 말단 또는 관련 단백질의 상호작용을 포함한다.또는 C형 불활성화는 선택성 필터 자체 내에서 발생하는 것으로 간주되며 필터 내의 구조적 변화가 C형 불활성화를 비전도성으로 만든다.C형 불활성화+ K채널 [81][82][83]필터에는 많은 구조 모델이 있으나 정확한 메커니즘은 불분명하다.
약리학
블로커
칼륨 채널 차단제는 채널을 통한 칼륨 이온의 흐름을 억제합니다.선택성 필터 내의 칼륨 결합과 경쟁하거나 필터 외부의 결합을 통해 이온 전도를 차단합니다.이러한 경쟁 제품 중 하나는 채널의 [86]세포외면[84][85] 또는 중앙 공동에 결합하는 4차 암모늄 이온입니다.중심강 4차 암모늄 이온을 차단하기 위해 일반적으로 결합을 위해서는 세포질 [87]게이트의 사전 개방이 필요하기 때문에 개방 채널 차단제로도 알려져 있습니다.
또한 바륨 이온은 선택성 [90][91][92][93]필터 내에서 높은 친화력으로 결합함으로써 칼륨 채널 [88][89]전류를 차단할 수 있습니다.이 엄격한 결합은 흥분성 세포에서 칼륨 채널 활동을 억제함으로써 바륨 독성의 기초가 되는 것으로 생각됩니다.
4-아미노피리딘 및 3,4-디아미노피리딘과 같은 칼륨 채널 차단제는 다발성 경화증과 같은 [49]질환의 치료를 위해 연구되었다.표적에서 벗어난 약물 효과는 잠재적으로 생명을 위협하는 상태인 약물 유도 롱 QT 증후군을 초래할 수 있습니다.이것은 가장 자주 심장의 hERG 칼륨 채널에 작용하기 때문입니다.따라서 모든 신약은 심장 안전성 검사를 사전에 실시한다.
액티베이터
무스카린 칼륨 채널
칼륨 채널의 일부 유형은 무스카린 수용체에 의해 활성화되고 이것들은 무스카린 칼륨 채널이라고KACh 불립니다.이들 채널은 2개의 GIRK1 서브유닛과2개의 GIRK4 서브유닛으로 [94][95]구성된 헤테로테트라머입니다예를 들어, 심장의 칼륨 채널은 M2 무스카린 수용체를 통한 부교감 신호에 의해 활성화될 때,[96][97] 심박수를 느리게 하는 칼륨의 외부 전류를 유발합니다.
미술에 있어서
로데릭 맥키넌은 KcsA 칼륨 [98]채널을 기반으로 한 5피트(1.5m) 높이의 조각품인 '아이디어의 탄생'을 의뢰했다.아트워크에는 채널 내부를 나타내는 와이어 오브젝트와 채널 구조의 메인 캐비티를 나타내는 송풍 유리 오브젝트가 포함되어 있습니다.
「 」를 참조해 주세요.
- 칼슘 채널 – 칼슘 이온이 통과하는 이온 채널 복합체
- 내향-정류기 칼륨 이온 채널
- 생물학의 칼륨 – 생물에 의한 칼륨 사용
- 칼륨수송체(Trk) 패밀리– 수송단백질 패밀리
- 칼륨흡수투과효소
- 나트륨 이온 채널
레퍼런스
- ^ Littleton JT, Ganetzky B (April 2000). "Ion channels and synaptic organization: analysis of the Drosophila genome". Neuron. 26 (1): 35–43. doi:10.1016/S0896-6273(00)81135-6. PMID 10798390. S2CID 5694563.
- ^ Hille, Bertil (2001). "Chapter 5: Potassium Channels and Chloride Channels". Ion channels of excitable membranes. Sunderland, Mass: Sinauer. pp. 131–168. ISBN 978-0-87893-321-1.
- ^ Jessell TM, Kandel ER, Schwartz JH (2000). "Chapter 6: Ion Channels". Principles of Neural Science (4th ed.). New York: McGraw-Hill. pp. 105–124. ISBN 978-0-8385-7701-1.
- ^ Lim C, Dudev T (2016). Sigel A, Sigel H, Sigel RK (eds.). "Chapter 10. Potassium Versus Sodium Selectivity in Monovalent Ion Channel Selectivity Filters". The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences. Springer. 16: 325–347. doi:10.1007/978-3-319-21756-7_9. PMID 26860305.
- ^ 간접 Rehm H, Lazdunski M(7월 1988년)에서 참조 번호 3,4,5,6에서 언급했다."정화와 추정 상의 K+-channel 단백질 바인딩 속성으로dendrotoxin을 위한 실시된 서브 유닛 구조".미국 국립 과학 아카데미의 아메리카 미국의 회보. 85(13):4919–4923.Bibcode:1988PNAS...85.4919R. doi:10.1073/pnas.85.13.4919. 1.280549.PMID 2455300.
- ^ a b c d e f g h i j k l m n Rang, HP (2015). Pharmacology (8 ed.). Edinburgh: Churchill Livingstone. p. 59. ISBN 978-0-443-07145-4.
- ^ Thompson J, Begenisich T (May 2000). "Electrostatic interaction between charybdotoxin and a tetrameric mutant of Shaker K(+) channels". Biophysical Journal. 78 (5): 2382–2391. Bibcode:2000BpJ....78.2382T. doi:10.1016/S0006-3495(00)76782-8. PMC 1300827. PMID 10777734.
- ^ Naranjo D, Miller C (January 1996). "A strongly interacting pair of residues on the contact surface of charybdotoxin and a Shaker K+ channel". Neuron. 16 (1): 123–130. doi:10.1016/S0896-6273(00)80029-X. PMID 8562075. S2CID 16794677.
- ^ Yu M, Liu SL, Sun PB, Pan H, Tian CL, Zhang LH (January 2016). "Peptide toxins and small-molecule blockers of BK channels". Acta Pharmacologica Sinica. 37 (1): 56–66. doi:10.1038/aps.2015.139. PMC 4722972. PMID 26725735.
- ^ Candia S, Garcia ML, Latorre R (August 1992). "Mode of action of iberiotoxin, a potent blocker of the large conductance Ca(2+)-activated K+ channel". Biophysical Journal. 63 (2): 583–590. Bibcode:1992BpJ....63..583C. doi:10.1016/S0006-3495(92)81630-2. PMC 1262182. PMID 1384740.
- ^ Stocker M, Krause M, Pedarzani P (April 1999). "An apamin-sensitive Ca2+-activated K+ current in hippocampal pyramidal neurons". Proceedings of the National Academy of Sciences of the United States of America. 96 (8): 4662–4667. Bibcode:1999PNAS...96.4662S. doi:10.1073/pnas.96.8.4662. PMC 16389. PMID 10200319.
- ^ McLeod JF, Leempoels JM, Peng SX, Dax SL, Myers LJ, Golder FJ (November 2014). "GAL-021, a new intravenous BKCa-channel blocker, is well tolerated and stimulates ventilation in healthy volunteers". British Journal of Anaesthesia. 113 (5): 875–883. doi:10.1093/bja/aeu182. PMID 24989775.
- ^ Dopico AM, Bukiya AN, Kuntamallappanavar G, Liu J (2016). "Modulation of BK Channels by Ethanol". International Review of Neurobiology. 128: 239–279. doi:10.1016/bs.irn.2016.03.019. ISBN 9780128036198. PMC 5257281. PMID 27238266.
- ^ a b Patnaik, Pradyot (2003). Handbook of inorganic chemicals. McGraw-Hill. pp. 77–78. ISBN 978-0-07-049439-8.
- ^ Sackin H, Syn S, Palmer LG, Choe H, Walters DE (February 2001). "Regulation of ROMK by extracellular cations". Biophysical Journal. 80 (2): 683–697. Bibcode:2001BpJ....80..683S. doi:10.1016/S0006-3495(01)76048-1. PMC 1301267. PMID 11159436.
- ^ Dhamoon AS, Jalife J (March 2005). "The inward rectifier current (IK1) controls cardiac excitability and is involved in arrhythmogenesis". Heart Rhythm. 2 (3): 316–324. doi:10.1016/j.hrthm.2004.11.012. PMID 15851327.
- ^ a b c d e f Swale DR, Kharade SV, Denton JS (April 2014). "Cardiac and renal inward rectifier potassium channel pharmacology: emerging tools for integrative physiology and therapeutics". Current Opinion in Pharmacology. 15: 7–15. doi:10.1016/j.coph.2013.11.002. PMC 4097192. PMID 24721648.
- ^ Xynogalos P, Seyler C, Scherer D, Koepple C, Scholz EP, Thomas D, et al. (December 2014). "Class III antiarrhythmic drug dronedarone inhibits cardiac inwardly rectifying Kir2.1 channels through binding at residue E224". Naunyn-Schmiedeberg's Archives of Pharmacology. 387 (12): 1153–1161. doi:10.1007/s00210-014-1045-6. PMID 25182566. S2CID 10575229.
- ^ Koepple C, Scherer D, Seyler C, Scholz E, Thomas D, Katus HA, Zitron E (May 2017). "Dual Mechanism for Inhibition of Inwardly Rectifying Kir2.x Channels by Quinidine Involving Direct Pore Block and PIP2-interference". The Journal of Pharmacology and Experimental Therapeutics. 361 (2): 209–218. doi:10.1124/jpet.116.238287. PMID 28188270. S2CID 206502631.
- ^ Caballero R, Dolz-Gaitón P, Gómez R, Amorós I, Barana A, González de la Fuente M, et al. (August 2010). "Flecainide increases Kir2.1 currents by interacting with cysteine 311, decreasing the polyamine-induced rectification". Proceedings of the National Academy of Sciences of the United States of America. 107 (35): 15631–15636. doi:10.1073/pnas.1004021107. PMC 2932566. PMID 20713726.
- ^ Kobayashi T, Washiyama K, Ikeda K (March 2006). "Inhibition of G protein-activated inwardly rectifying K+ channels by ifenprodil". Neuropsychopharmacology. 31 (3): 516–524. doi:10.1038/sj.npp.1300844. PMID 16123769.
- ^ Soeda F, Fujieda Y, Kinoshita M, Shirasaki T, Takahama K (May 2016). "Centrally acting non-narcotic antitussives prevent hyperactivity in mice: Involvement of GIRK channels". Pharmacology, Biochemistry, and Behavior. 144: 26–32. doi:10.1016/j.pbb.2016.02.006. PMID 26892760. S2CID 30118634.
- ^ Yamamoto G, Soeda F, Shirasaki T, Takahama K (April 2011). "[Is the GIRK channel a possible target in the development of a novel therapeutic drug of urinary disturbance?]". Yakugaku Zasshi. 131 (4): 523–532. doi:10.1248/yakushi.131.523. PMID 21467791.
- ^ Kawaura K, Honda S, Soeda F, Shirasaki T, Takahama K (May 2010). "[Novel antidepressant-like action of drugs possessing GIRK channel blocking action in rats]". Yakugaku Zasshi. 130 (5): 699–705. doi:10.1248/yakushi.130.699. PMID 20460867.
- ^ Jin W, Lu Z (September 1998). "A novel high-affinity inhibitor for inward-rectifier K+ channels". Biochemistry. 37 (38): 13291–13299. doi:10.1021/bi981178p. PMID 9748337.
- ^ Kawaura K, Ogata Y, Inoue M, Honda S, Soeda F, Shirasaki T, Takahama K (December 2009). "The centrally acting non-narcotic antitussive tipepidine produces antidepressant-like effect in the forced swimming test in rats". Behavioural Brain Research. 205 (1): 315–318. doi:10.1016/j.bbr.2009.07.004. PMID 19616036. S2CID 29236491.
- ^ Kaufmann K, Romaine I, Days E, Pascual C, Malik A, Yang L, et al. (September 2013). "ML297 (VU0456810), the first potent and selective activator of the GIRK potassium channel, displays antiepileptic properties in mice". ACS Chemical Neuroscience. 4 (9): 1278–1286. doi:10.1021/cn400062a. PMC 3778424. PMID 23730969.
- ^ Serrano-Martín X, Payares G, Mendoza-León A (December 2006). "Glibenclamide, a blocker of K+(ATP) channels, shows antileishmanial activity in experimental murine cutaneous leishmaniasis". Antimicrobial Agents and Chemotherapy. 50 (12): 4214–4216. doi:10.1128/AAC.00617-06. PMC 1693980. PMID 17015627.
- ^ Lawrence CL, Proks P, Rodrigo GC, Jones P, Hayabuchi Y, Standen NB, Ashcroft FM (August 2001). "Gliclazide produces high-affinity block of KATP channels in mouse isolated pancreatic beta cells but not rat heart or arterial smooth muscle cells". Diabetologia. 44 (8): 1019–1025. doi:10.1007/s001250100595. PMID 11484080.
- ^ a b c d e f Enyedi P, Czirják G (April 2010). "Molecular background of leak K+ currents: two-pore domain potassium channels". Physiological Reviews. 90 (2): 559–605. doi:10.1152/physrev.00029.2009. PMID 20393194. S2CID 9358238.
- ^ a b c d e f Lotshaw DP (2007). "Biophysical, pharmacological, and functional characteristics of cloned and native mammalian two-pore domain K+ channels". Cell Biochemistry and Biophysics. 47 (2): 209–256. doi:10.1007/s12013-007-0007-8. PMID 17652773. S2CID 12759521.
- ^ Fink M, Lesage F, Duprat F, Heurteaux C, Reyes R, Fosset M, Lazdunski M (June 1998). "A neuronal two P domain K+ channel stimulated by arachidonic acid and polyunsaturated fatty acids". The EMBO Journal. 17 (12): 3297–3308. doi:10.1093/emboj/17.12.3297. PMC 1170668. PMID 9628867.
- ^ Goldstein SA, Bockenhauer D, O'Kelly I, Zilberberg N (March 2001). "Potassium leak channels and the KCNK family of two-P-domain subunits". Nature Reviews. Neuroscience. 2 (3): 175–184. doi:10.1038/35058574. PMID 11256078. S2CID 9682396.
- ^ Sano Y, Inamura K, Miyake A, Mochizuki S, Kitada C, Yokoi H, et al. (July 2003). "A novel two-pore domain K+ channel, TRESK, is localized in the spinal cord". The Journal of Biological Chemistry. 278 (30): 27406–27412. doi:10.1074/jbc.M206810200. PMID 12754259.
- ^ Czirják G, Tóth ZE, Enyedi P (April 2004). "The two-pore domain K+ channel, TRESK, is activated by the cytoplasmic calcium signal through calcineurin". The Journal of Biological Chemistry. 279 (18): 18550–18558. doi:10.1074/jbc.M312229200. PMID 14981085.
- ^ Kindler CH, Yost CS, Gray AT (April 1999). "Local anesthetic inhibition of baseline potassium channels with two pore domains in tandem". Anesthesiology. 90 (4): 1092–1102. doi:10.1097/00000542-199904000-00024. PMID 10201682.
- ^ a b c Meadows HJ, Randall AD (March 2001). "Functional characterisation of human TASK-3, an acid-sensitive two-pore domain potassium channel". Neuropharmacology. 40 (4): 551–559. doi:10.1016/S0028-3908(00)00189-1. PMID 11249964. S2CID 20181576.
- ^ Kindler CH, Paul M, Zou H, Liu C, Winegar BD, Gray AT, Yost CS (July 2003). "Amide local anesthetics potently inhibit the human tandem pore domain background K+ channel TASK-2 (KCNK5)". The Journal of Pharmacology and Experimental Therapeutics. 306 (1): 84–92. doi:10.1124/jpet.103.049809. PMID 12660311. S2CID 1621972.
- ^ Punke MA, Licher T, Pongs O, Friederich P (June 2003). "Inhibition of human TREK-1 channels by bupivacaine". Anesthesia and Analgesia. 96 (6): 1665–1673. doi:10.1213/01.ANE.0000062524.90936.1F. PMID 12760993. S2CID 39630495.
- ^ Lesage F, Guillemare E, Fink M, Duprat F, Lazdunski M, Romey G, Barhanin J (March 1996). "TWIK-1, a ubiquitous human weakly inward rectifying K+ channel with a novel structure". The EMBO Journal. 15 (5): 1004–1011. doi:10.1002/j.1460-2075.1996.tb00437.x. PMC 449995. PMID 8605869.
- ^ Duprat F, Lesage F, Fink M, Reyes R, Heurteaux C, Lazdunski M (September 1997). "TASK, a human background K+ channel to sense external pH variations near physiological pH". The EMBO Journal. 16 (17): 5464–5471. doi:10.1093/emboj/16.17.5464. PMC 1170177. PMID 9312005.
- ^ Reyes R, Duprat F, Lesage F, Fink M, Salinas M, Farman N, Lazdunski M (November 1998). "Cloning and expression of a novel pH-sensitive two pore domain K+ channel from human kidney". The Journal of Biological Chemistry. 273 (47): 30863–30869. doi:10.1074/jbc.273.47.30863. PMID 9812978.
- ^ Meadows HJ, Benham CD, Cairns W, Gloger I, Jennings C, Medhurst AD, et al. (April 2000). "Cloning, localisation and functional expression of the human orthologue of the TREK-1 potassium channel". Pflügers Archiv. 439 (6): 714–722. doi:10.1007/s004240050997. PMID 10784345.
- ^ "UniProtKB - Q9NPC2 (KCNK9_HUMAN)". Uniprot. Retrieved 2019-05-29.
- ^ a b Kennard LE, Chumbley JR, Ranatunga KM, Armstrong SJ, Veale EL, Mathie A (March 2005). "Inhibition of the human two-pore domain potassium channel, TREK-1, by fluoxetine and its metabolite norfluoxetine". British Journal of Pharmacology. 144 (6): 821–829. doi:10.1038/sj.bjp.0706068. PMC 1576064. PMID 15685212.
- ^ Patel AJ, Honoré E, Lesage F, Fink M, Romey G, Lazdunski M (May 1999). "Inhalational anesthetics activate two-pore-domain background K+ channels". Nature Neuroscience. 2 (5): 422–426. doi:10.1038/8084. PMID 10321245. S2CID 23092576.
- ^ Gray AT, Zhao BB, Kindler CH, Winegar BD, Mazurek MJ, Xu J, et al. (June 2000). "Volatile anesthetics activate the human tandem pore domain baseline K+ channel KCNK5". Anesthesiology. 92 (6): 1722–1730. doi:10.1097/00000542-200006000-00032. PMID 10839924. S2CID 45487917.
- ^ Kirsch GE, Narahashi T (June 1978). "3,4-diaminopyridine. A potent new potassium channel blocker". Biophysical Journal. 22 (3): 507–512. Bibcode:1978BpJ....22..507K. doi:10.1016/s0006-3495(78)85503-9. PMC 1473482. PMID 667299.
- ^ a b Judge SI, Bever CT (July 2006). "Potassium channel blockers in multiple sclerosis: neuronal Kv channels and effects of symptomatic treatment". Pharmacology & Therapeutics. 111 (1): 224–259. doi:10.1016/j.pharmthera.2005.10.006. PMID 16472864.
- ^ Tiku PE, Nowell PT (December 1991). "Selective inhibition of K(+)-stimulation of Na,K-ATPase by bretylium". British Journal of Pharmacology. 104 (4): 895–900. doi:10.1111/j.1476-5381.1991.tb12523.x. PMC 1908819. PMID 1667290.
- ^ Hille B (May 1967). "The selective inhibition of delayed potassium currents in nerve by tetraethylammonium ion". The Journal of General Physiology. 50 (5): 1287–1302. doi:10.1085/jgp.50.5.1287. PMC 2225709. PMID 6033586.
- ^ Armstrong CM (October 1971). "Interaction of tetraethylammonium ion derivatives with the potassium channels of giant axons". The Journal of General Physiology. 58 (4): 413–437. doi:10.1085/jgp.58.4.413. PMC 2226036. PMID 5112659.
- ^ "Amiodarone". Drugbank. Retrieved 2019-05-28.
- ^ Rogawski MA, Bazil CW (July 2008). "New molecular targets for antiepileptic drugs: alpha(2)delta, SV2A, and K(v)7/KCNQ/M potassium channels". Current Neurology and Neuroscience Reports. 8 (4): 345–352. doi:10.1007/s11910-008-0053-7. PMC 2587091. PMID 18590620.
- ^ a b Doyle DA, Morais Cabral J, Pfuetzner RA, Kuo A, Gulbis JM, Cohen SL, et al. (April 1998). "The structure of the potassium channel: molecular basis of K+ conduction and selectivity". Science. 280 (5360): 69–77. Bibcode:1998Sci...280...69D. doi:10.1126/science.280.5360.69. PMID 9525859.
- ^ MacKinnon R, Cohen SL, Kuo A, Lee A, Chait BT (April 1998). "Structural conservation in prokaryotic and eukaryotic potassium channels". Science. 280 (5360): 106–109. Bibcode:1998Sci...280..106M. doi:10.1126/science.280.5360.106. PMID 9525854. S2CID 33907550.
- ^ Armstrong C (April 1998). "The vision of the pore". Science. 280 (5360): 56–57. doi:10.1126/science.280.5360.56. PMID 9556453. S2CID 35339674.
- ^ "The Nobel Prize in Chemistry 2003". The Nobel Foundation. Retrieved 2007-11-16.
- ^ Zhou Y, Morais-Cabral JH, Kaufman A, MacKinnon R (November 2001). "Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 A resolution". Nature. 414 (6859): 43–48. Bibcode:2001Natur.414...43Z. doi:10.1038/35102009. PMID 11689936. S2CID 205022645.
- ^ Lodish H, Berk A, Kaiser C, Krieger M, Bretscher A, Ploegh H, et al. (2016). Molecular Cell Biology (8th ed.). New York, NY: W. H. Freeman and Company. p. 499. ISBN 978-1-4641-8339-3.
- ^ Sauer DB, Zeng W, Raghunathan S, Jiang Y (October 2011). "Protein interactions central to stabilizing the K+ channel selectivity filter in a four-sited configuration for selective K+ permeation". Proceedings of the National Academy of Sciences of the United States of America. 108 (40): 16634–16639. Bibcode:2011PNAS..10816634S. doi:10.1073/pnas.1111688108. PMC 3189067. PMID 21933962.
- ^ a b Hellgren M, Sandberg L, Edholm O (March 2006). "A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study". Biophysical Chemistry. 120 (1): 1–9. doi:10.1016/j.bpc.2005.10.002. PMID 16253415.
- ^ Noskov SY, Roux B (February 2007). "Importance of hydration and dynamics on the selectivity of the KcsA and NaK channels". The Journal of General Physiology. 129 (2): 135–143. doi:10.1085/jgp.200609633. PMC 2154357. PMID 17227917.
- ^ Noskov SY, Bernèche S, Roux B (October 2004). "Control of ion selectivity in potassium channels by electrostatic and dynamic properties of carbonyl ligands". Nature. 431 (7010): 830–834. Bibcode:2004Natur.431..830N. doi:10.1038/nature02943. PMID 15483608. S2CID 4414885.
- ^ Varma S, Rempe SB (August 2007). "Tuning ion coordination architectures to enable selective partitioning". Biophysical Journal. 93 (4): 1093–1099. arXiv:physics/0608180. Bibcode:2007BpJ....93.1093V. doi:10.1529/biophysj.107.107482. PMC 1929028. PMID 17513348.
- ^ Thomas M, Jayatilaka D, Corry B (October 2007). "The predominant role of coordination number in potassium channel selectivity". Biophysical Journal. 93 (8): 2635–2643. Bibcode:2007BpJ....93.2635T. doi:10.1529/biophysj.107.108167. PMC 1989715. PMID 17573427.
- ^ Bostick DL, Brooks CL (May 2007). "Selectivity in K+ channels is due to topological control of the permeant ion's coordinated state". Proceedings of the National Academy of Sciences of the United States of America. 104 (22): 9260–9265. Bibcode:2007PNAS..104.9260B. doi:10.1073/pnas.0700554104. PMC 1890482. PMID 17519335.
- ^ Derebe MG, Sauer DB, Zeng W, Alam A, Shi N, Jiang Y (January 2011). "Tuning the ion selectivity of tetrameric cation channels by changing the number of ion binding sites". Proceedings of the National Academy of Sciences of the United States of America. 108 (2): 598–602. Bibcode:2011PNAS..108..598D. doi:10.1073/pnas.1013636108. PMC 3021048. PMID 21187421.
- ^ Morais-Cabral JH, Zhou Y, MacKinnon R (November 2001). "Energetic optimization of ion conduction rate by the K+ selectivity filter". Nature. 414 (6859): 37–42. Bibcode:2001Natur.414...37M. doi:10.1038/35102000. PMID 11689935. S2CID 4429890.
- ^ a b Yuan P, Leonetti MD, Pico AR, Hsiung Y, MacKinnon R (July 2010). "Structure of the human BK channel Ca2+-activation apparatus at 3.0 A resolution". Science. 329 (5988): 182–186. Bibcode:2010Sci...329..182Y. doi:10.1126/science.1190414. PMC 3022345. PMID 20508092.
- ^ a b Wu Y, Yang Y, Ye S, Jiang Y (July 2010). "Structure of the gating ring from the human large-conductance Ca(2+)-gated K(+) channel". Nature. 466 (7304): 393–397. Bibcode:2010Natur.466..393W. doi:10.1038/nature09252. PMC 2910425. PMID 20574420.
- ^ a b Jiang Y, Pico A, Cadene M, Chait BT, MacKinnon R (March 2001). "Structure of the RCK domain from the E. coli K+ channel and demonstration of its presence in the human BK channel". Neuron. 29 (3): 593–601. doi:10.1016/S0896-6273(01)00236-7. PMID 11301020. S2CID 17880955.
- ^ Jiang Y, Lee A, Chen J, Cadene M, Chait BT, MacKinnon R (May 2002). "Crystal structure and mechanism of a calcium-gated potassium channel". Nature. 417 (6888): 515–522. Bibcode:2002Natur.417..515J. doi:10.1038/417515a. PMID 12037559. S2CID 205029269.
- ^ Kong C, Zeng W, Ye S, Chen L, Sauer DB, Lam Y, et al. (December 2012). "Distinct gating mechanisms revealed by the structures of a multi-ligand gated K(+) channel". eLife. 1: e00184. doi:10.7554/eLife.00184. PMC 3510474. PMID 23240087.
- ^ Cao Y, Jin X, Huang H, Derebe MG, Levin EJ, Kabaleeswaran V, et al. (March 2011). "Crystal structure of a potassium ion transporter, TrkH". Nature. 471 (7338): 336–340. Bibcode:2011Natur.471..336C. doi:10.1038/nature09731. PMC 3077569. PMID 21317882.
- ^ Uysal S, Cuello LG, Cortes DM, Koide S, Kossiakoff AA, Perozo E (July 2011). "Mechanism of activation gating in the full-length KcsA K+ channel". Proceedings of the National Academy of Sciences of the United States of America. 108 (29): 11896–11899. Bibcode:2011PNAS..10811896U. doi:10.1073/pnas.1105112108. PMC 3141920. PMID 21730186.
- ^ Clayton GM, Silverman WR, Heginbotham L, Morais-Cabral JH (November 2004). "Structural basis of ligand activation in a cyclic nucleotide regulated potassium channel". Cell. 119 (5): 615–627. doi:10.1016/j.cell.2004.10.030. PMID 15550244. S2CID 14149494.
- ^ Jiang Y, Lee A, Chen J, Ruta V, Cadene M, Chait BT, MacKinnon R (May 2003). "X-ray structure of a voltage-dependent K+ channel". Nature. 423 (6935): 33–41. Bibcode:2003Natur.423...33J. doi:10.1038/nature01580. PMID 12721618. S2CID 4347957.
- ^ Long SB, Campbell EB, Mackinnon R (August 2005). "Crystal structure of a mammalian voltage-dependent Shaker family K+ channel". Science. 309 (5736): 897–903. Bibcode:2005Sci...309..897L. doi:10.1126/science.1116269. PMID 16002581. S2CID 6072007.
- ^ Antz C, Fakler B (August 1998). "Fast Inactivation of Voltage-Gated K(+) Channels: From Cartoon to Structure". News in Physiological Sciences. 13 (4): 177–182. doi:10.1152/physiologyonline.1998.13.4.177. PMID 11390785. S2CID 38134756.
- ^ Cheng WW, McCoy JG, Thompson AN, Nichols CG, Nimigean CM (March 2011). "Mechanism for selectivity-inactivation coupling in KcsA potassium channels". Proceedings of the National Academy of Sciences of the United States of America. 108 (13): 5272–5277. Bibcode:2011PNAS..108.5272C. doi:10.1073/pnas.1014186108. PMC 3069191. PMID 21402935.
- ^ Cuello LG, Jogini V, Cortes DM, Perozo E (July 2010). "Structural mechanism of C-type inactivation in K(+) channels". Nature. 466 (7303): 203–208. Bibcode:2010Natur.466..203C. doi:10.1038/nature09153. PMC 3033749. PMID 20613835.
- ^ Cuello LG, Jogini V, Cortes DM, Pan AC, Gagnon DG, Dalmas O, et al. (July 2010). "Structural basis for the coupling between activation and inactivation gates in K(+) channels". Nature. 466 (7303): 272–275. Bibcode:2010Natur.466..272C. doi:10.1038/nature09136. PMC 3033755. PMID 20613845.
- ^ Luzhkov VB, Aqvist J (February 2005). "Ions and blockers in potassium channels: insights from free energy simulations". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1747 (1): 109–120. doi:10.1016/j.bbapap.2004.10.006. PMID 15680245.
- ^ Luzhkov VB, Osterberg F, Aqvist J (November 2003). "Structure-activity relationship for extracellular block of K+ channels by tetraalkylammonium ions". FEBS Letters. 554 (1–2): 159–164. doi:10.1016/S0014-5793(03)01117-7. PMID 14596932. S2CID 32031835.
- ^ Posson DJ, McCoy JG, Nimigean CM (February 2013). "The voltage-dependent gate in MthK potassium channels is located at the selectivity filter". Nature Structural & Molecular Biology. 20 (2): 159–166. doi:10.1038/nsmb.2473. PMC 3565016. PMID 23262489.
- ^ Choi KL, Mossman C, Aubé J, Yellen G (March 1993). "The internal quaternary ammonium receptor site of Shaker potassium channels". Neuron. 10 (3): 533–541. doi:10.1016/0896-6273(93)90340-w. PMID 8461140. S2CID 33361945.
- ^ Piasta KN, Theobald DL, Miller C (October 2011). "Potassium-selective block of barium permeation through single KcsA channels". The Journal of General Physiology. 138 (4): 421–436. doi:10.1085/jgp.201110684. PMC 3182450. PMID 21911483.
- ^ Neyton J, Miller C (November 1988). "Potassium blocks barium permeation through a calcium-activated potassium channel". The Journal of General Physiology. 92 (5): 549–567. doi:10.1085/jgp.92.5.549. PMC 2228918. PMID 3235973.
- ^ Lockless SW, Zhou M, MacKinnon R (May 2007). "Structural and thermodynamic properties of selective ion binding in a K+ channel". PLOS Biology. 5 (5): e121. doi:10.1371/journal.pbio.0050121. PMC 1858713. PMID 17472437.
- ^ Jiang Y, MacKinnon R (March 2000). "The barium site in a potassium channel by x-ray crystallography". The Journal of General Physiology. 115 (3): 269–272. doi:10.1085/jgp.115.3.269. PMC 2217209. PMID 10694255.
- ^ Lam YL, Zeng W, Sauer DB, Jiang Y (August 2014). "The conserved potassium channel filter can have distinct ion binding profiles: structural analysis of rubidium, cesium, and barium binding in NaK2K". The Journal of General Physiology. 144 (2): 181–192. doi:10.1085/jgp.201411191. PMC 4113894. PMID 25024267.
- ^ Guo R, Zeng W, Cui H, Chen L, Ye S (August 2014). "Ionic interactions of Ba2+ blockades in the MthK K+ channel". The Journal of General Physiology. 144 (2): 193–200. doi:10.1085/jgp.201411192. PMC 4113901. PMID 25024268.
- ^ Krapivinsky G, Gordon EA, Wickman K, Velimirović B, Krapivinsky L, Clapham DE (March 1995). "The G-protein-gated atrial K+ channel IKACh is a heteromultimer of two inwardly rectifying K(+)-channel proteins". Nature. 374 (6518): 135–141. Bibcode:1995Natur.374..135K. doi:10.1038/374135a0. PMID 7877685. S2CID 4334467.
- ^ Corey S, Krapivinsky G, Krapivinsky L, Clapham DE (February 1998). "Number and stoichiometry of subunits in the native atrial G-protein-gated K+ channel, IKACh". The Journal of Biological Chemistry. 273 (9): 5271–5278. doi:10.1074/jbc.273.9.5271. PMID 9478984.
- ^ Kunkel MT, Peralta EG (November 1995). "Identification of domains conferring G protein regulation on inward rectifier potassium channels". Cell. 83 (3): 443–449. doi:10.1016/0092-8674(95)90122-1. PMID 8521474. S2CID 14720432.
- ^ Wickman K, Krapivinsky G, Corey S, Kennedy M, Nemec J, Medina I, Clapham DE (April 1999). "Structure, G protein activation, and functional relevance of the cardiac G protein-gated K+ channel, IKACh". Annals of the New York Academy of Sciences. 868 (1): 386–398. Bibcode:1999NYASA.868..386W. doi:10.1111/j.1749-6632.1999.tb11300.x. PMID 10414308. S2CID 25949938. Archived from the original on 2006-01-29.
- ^ Ball P (March 2008). "The crucible: Art inspired by science should be more than just a pretty picture". Chemistry World. 5 (3): 42–43. Retrieved 2009-01-12.
외부 링크
- 프로테피디아 채널 칼륨 채널(3D
- 미국 국립 의학 도서관(MeSH)의 칼륨+채널
- Neuromuscular Disease Center (2008-03-04). "Potassium Channels". Washington University in St. Louis. Retrieved 2008-03-10.