롱 QT 증후군
Long QT syndrome| 롱 QT 증후군 | |
|---|---|
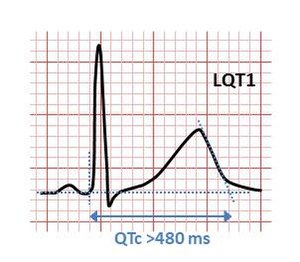 | |
| 유전성 롱 QT 증후군(LQT1)의 전형적인 패턴을 나타내는 심전도. QT 간격이 480밀리초 이상이면 비정상적으로 긴 것으로 간주됩니다. | |
| 전문 | 심장학 |
| 증상 | 실신, 난청, 발작[1] |
| 합병증 | 돌연사[1] |
| 원인들 | 유전자, 특정 약물, 저혈중 칼륨, 저혈중 칼슘, 심부전[2] |
| 위험요소 | 돌연사[3] 가족력 |
| 진단 방법 | 심전도(EKG), 임상 소견, 유전자 검사 |
| 차동 진단 | 브루가다 증후군, 부정맥 유발 우심실 이형성[3] |
| 치료 | 격렬한 운동 피, 충분한 칼륨 섭취, 베타 차단제, 삽입식 심장 제세동기[6] |
| 빈도수. | § 7,000분의[6] 1 |
| 사망. | 연간 3,500엔 (미국)[6] |
롱 QT 증후군(LQTS)은 심장 박동 후 심장의 재분극(완화)에 영향을 미치는 질환으로 비정상적으로 긴 QT [7]간격을 일으킨다.그것은 실신, 익사, 발작 또는 돌연사를 [1]초래할 수 있는 불규칙한 심장 박동의 위험을 증가시킨다.이러한 증상들은 운동이나 [6]스트레스에 의해 유발될 수 있다.몇몇 희귀한 형태의 LQTS는 청각 장애와 근육 [1]약화 기간을 포함한 다른 증상들과 징후들과 관련이 있다.
긴 QT 증후군은 태어날 때 나타날 수도 있고 [1]나중에 발병할 수도 있다.유전 형태는 그 자체로 발생하거나 더 큰 유전 질환의 [1]일부로 발생할 수 있다.만년에 발병하는 것은 특정 약물, 저혈중 칼륨, 저혈중 칼슘 또는 [2]심부전으로 인해 발생할 수 있습니다.관련된 약물에는 특정 항부정맥제, 항생제, 항정신병 [2]약물 등이 포함된다.480~500밀리초 이상의 보정 QT 간격이 발견되면 심전도(EKG)를 사용하여 LQTS를 진단할 수 있지만 임상 소견, 기타 EKG 특징 및 유전자 검사를 통해 짧은 QT [4][5]간격으로 진단을 확인할 수 있다.
및 관리는 식단에서 충분한 칼륨, 과격한 운동은 베타 수용체 차단제는, 또는, 이식 가능한 심장 제세 동기 사용이 방지 포함될 수 있다.[6]LQTS과 함께 처리되지 않은 남아 심장 마비에서 살아남을 사람들에게, 죽음의 15년 안에 있는 위험은 50%.[8][6]적절한 치료로 이 20년 동안 1%미만으로 감소한다.[3]
롱 QT증후군 7,000명 이상의 사람들에 1에 영향을 미칠 것으로 추정된다.[6]암컷은 더 자주 수컷보다 영향을 받는다.[6]전에 40세 조건에 대부분의 사람들은 증세를 나타내다[6]갑작스런 죽음의 그것은 상대적으로 흔한 원인 브루가 다 증후군과 함께, 오른쪽 심실 형성 장애 arrhythmogenic.[3]미국에서 약 3,500명으로 사망을 초래합니다.[6]조건은 먼저 명확하게 1957년에 기술되었다.[9]
징후 및 증상
긴 QT 증후군을 가진 많은 사람들은 증상이나 징후가 없다.증상이 발생할 때, 그것들은 일반적으로 비정상적인 심장 박동에 의해 발생하는데, 가장 일반적으로 Torsades de pointes라고 불리는 심실 빈박의 한 형태이다.부정맥이 자연스럽게 정상적인 리듬으로 돌아오면 영향을 받는 사람은 현기증(전동기라고 함) 또는 실신할 수 있으며,[6] 이는 가슴에서 설레임과 함께 나타날 수 있습니다.부정맥이 계속되면 심장마비를 일으켜 치료하지 않으면 [10]돌연사로 이어질 수 있다.LQTS를 가진 사람들은 또한 [11][12]부정맥 동안 뇌로 가는 혈류 감소의 결과로 발작과 같은 활동을 경험할 수 있다.간질은 또한 특정 유형의 긴 QT [12]증후군과 관련이 있다. 뇌전증
실신이나 돌연사로 이어지는 부정맥은 어떤 유전적 변이가 존재하는지에 따라 결정되는 특정한 상황에서 발생할 가능성이 더 높다.부정맥은 언제든지 발생할 수 있지만, 어떤 형태의 LQTS 부정맥은 운동이나 정신적 스트레스(LQT1)에 대한 반응으로 더 흔하게 볼 수 있고, 다른 형태에서는 갑작스러운 큰 소음(LQT2), 그리고 어떤 형태에서는 수면 중이나 잠에서 깨자마자 바로 볼 수 있습니다.[10][13]
일부 희귀한 형태의 긴 QT 증후군은 신체의 다른 부분에 영향을 미쳐 저벨과 랑게닐슨 형태의 난청, 그리고 안데르센-타윌(LQT7)[4] 형태의 주기적 마비로 이어진다.
arrhythmias의 위험
긴 QT 증후군을 가진 사람들은 비정상적인 심장 박동에 걸릴 위험이 증가하는 반면, 부정맥의 절대 위험은 매우 [14]가변적이다.누군가가 TdP에 걸릴지에 대한 가장 강력한 예측 변수는 그들이 과거에 [15]부정맥이나 다른 형태의 심장 마비를 경험했는지 여부이다.당시 심전도 없이 실신을 경험한 LQTS는 기록되지 않은 자가종단 [15]부정맥에 의해 실신이 발생하는 경우가 많기 때문에 더 높은 위험도 있다.
부정맥의 이력과 더불어 QT가 장기화되는 정도는 [16][17]위험을 예측합니다.QT 간격이 매우 긴 것도 있습니다만, QT의 연장이나 정지 상태의 통상적인 QT 간격(폐쇄형 LQTS)도 있는 것도 있습니다.QT 간격이 가장 긴 경우 TdP가 발생할 가능성이 높으며 500밀리초를 초과하는 보정된QT 간격은 위험이 [18]높은 것으로 생각됩니다.그럼에도 불구하고, 미묘한 QT 연장이나 숨겨진 LQTS를 가진 사람들은 여전히 부정맥의 [10]위험이 있다.전체적으로 보정된 QT 간격이 10ms 증가할 때마다 부정맥 [17]위험이 15% 증가합니다.
유전 변종과 LQTS의 후천적 원인 모두 QT 연장 효과가 가법적이기 때문에 유전 LQTS를 가진 사람들은 QT 연장 약물을 투여받거나 낮은 칼륨의 저혈액(하이포칼라혈증)과 같은 전해질 문제를 겪을 경우 TdP를 경험할 가능성이 높다.마찬가지로 QT 연장 약물을 복용하는 사람은 QT 간격이 길어지는 유전적 성향이 있으면 [14]TdP를 경험할 가능성이 더 높다.부정맥은 해당 약물이 정맥에 빠르게 투여되거나 사람의 [18]혈액에 고농도의 약물이 존재할 경우 약물유발 LQTS에서 더 흔하게 발생한다.부정맥의 위험성은 또한 약을 복용하는 사람이 심부전을 앓고 있거나 디지탈리스를 복용하고 있거나 최근 심방세동으로 [18]인해 심방세동에 걸린 경우 더 높다.LQTS를 가진 사람들 사이에서 비틀림 발생의 다른 위험 요소에는 여성, 나이 증가, 기존 심혈관 질환, 그리고 비정상적인 간 또는 신장 [19]기능이 포함된다.
원인들
긴 QT 증후군에는 몇 가지 아형이 있다.이는 영향을 받은 사람이 태어나 평생 지속되고 자녀에게 유전될 수 있는 유전자 돌연변이에 의해 야기되는 것과 유전될 수 없고 종종 되돌릴 수 있는 다른 요인에 의해 야기되는 것으로 크게 나눌 수 있다.[citation needed]
적용되
유전되거나 선천적으로 긴 QT 증후군은 유전적 이상에 의해 발생한다.LQTS는 여러 유전자의 변종에서 발생할 수 있으며, 경우에 따라 상당히 다른 특징을 [20]가지고 있습니다.이러한 변형을 연결하는 공통점은 하나 이상의 이온 전류에 영향을 미쳐 심실 활동 전위가 연장되어 QT [7]간격이 길어지는 것입니다.분류 시스템은 임상적 특징(및 상태를 처음 기술한 사람들의 이름을 따서 명명)에 기초한 조건의 하위 유형을 구별하고 기초 유전자 [21]변이체로 세분화하기 위해 제안되었다.사례의 99%를 차지하는 가장 흔한 것은 로마노-워드 증후군(유전자적으로 LQT1-6 및 LQT9-16)으로, 다른 장기를 포함하지 [10]않고 심장의 전기 활동에 영향을 미치는 상염색체 우성 형태이다.덜 흔히 볼 수 있는 형태는 저벨과 랑게-닐슨 증후군이다. 이것은 긴 QT 간격과 선천성 [22]난청을 결합한 LQTS의 상염색체 열성 형태이다.다른 희귀한 형태로는 장기 QT 간격, 주기적 마비 및 얼굴과 골격의 이상을 포함한 특징을 가진 Anderson-Tawil 증후군(LQT7)과 장기 QT 간격이 심장 구조의 이상과 관련이 [4]있는 Timothy 증후군(LQT8)이 있다.
로마노-워드 증후군
LQT1은 로마노-워드 증후군의 가장 일반적인 아형이며,[23] 모든 사례의 30 - 35%를 차지한다.KCNQ1은 11p15.5 염색체로 분리돼 KvLQT1 칼륨 채널의 알파 서브유닛을 암호화한다.이 서브유닛은 다른 단백질(특히 minK 베타 서브유닛)과 상호작용하여 채널을 생성하며, 채널은 심장 활동 [23]전위의 재분극 단계를 담당하는 지연 칼륨 정류기 전류Ks I을 전달한다.KCNQ1에서 I(기능 상실 변형)를Ks 감소시키는 변형은 활동 전위의 재분극을 늦춘다.이것은 변종의 단일 복사본이 유전될 때 로마노-워드 증후군의 LQT1 아형을 유발한다(헤테로 접합, 상염색체 우성 유전).두 개의 변형체(호모 접합, 상염색체 열성 유전)를 유전하면 더 심각한 저벨 증후군과 랑게-닐슨 [23]증후군으로 이어진다.반대로, I을 증가시키는Ks KCNQ1의 변종은 보다 빠른 재분극과 짧은 QT [24]증후군을 초래한다.
LQT2 아형은 로마노-워드 증후군의 두 번째로 흔한 형태이며, 모든 사례의 25~[23]30%를 차지한다.이것은 빠른 내부 정류 전류Kr [23]I을 전달하는 칼륨 채널을 코드하는 염색체 7의 KCNH2 유전자(hERG라고도 함)의 변형에 의해 발생한다.이 전류는 심장 활동 전위의 재분극 말기 단계에 기여하고, 따라서 QT [23]간격의 길이에 기여합니다.
로마노-워드 증후군의 LQT3 아형은 염색체 3p21-24에 위치한 SCN5A 유전자의 변종에 의해 발생한다.SCN5A는 활동 [23]전위 시작 시 심장 세포를 탈분극시키는 나트륨 전류Na I을 담당하는 심장 나트륨 채널의 알파 서브 유닛 Na1V.5를 코드한다.심장 나트륨 채널은 일반적으로 빠르게 비활성화되지만, LQT3와 관련된 돌연변이는 비활성화를 느리게 하여 지속되는 '늦은' 나트륨 전류를 발생시킵니다.이 계속된 내부 전류에 의해 동작 전위가 연장되어 QT [23]간격이 길어집니다.SCN5A의 일부 변형은 LQT3를 발생시키지만 다른 변형은 전혀 다른 상태를 발생시킬 수 있습니다.초기 피크 전류 감소를 일으키는 변종은 브루가다 증후군과 심장 전도 질환을 일으킬 수 있으며, 다른 변종은 확장된 심근증과 관련이 있다.초기 나트륨 전류와 후기 나트륨 전류 모두에 영향을 미치는 일부 변종들은 LQT3와 브루가다 [10]증후군의 양상을 결합하는 중복 증후군을 일으킬 수 있다.
희귀한 Romano–Ward(LQT4-6과 LQT9-16)subtypes.
LQT5는 칼륨 채널 베타 서브유닛 MinK를 담당하는 KCNE1 유전자의 변종에 의해 발생합니다.이 서브유닛은 KCNQ1에 의해 암호화되는 알파 서브유닛과 함께 LQTS에서 [23]감소하는 칼륨 전류Ks I의 원인이 됩니다.LQT6은 칼륨 채널Kr 베타 서브유닛 MiRP1을 담당하는 KCNE2 유전자의 변이에 의해 발생합니다.[23]이 전류를 감소시키는 변종은 QT [22]간격의 연장과 관련되어 있습니다.그러나 긴 QT 증후군이 없는 사람들의 유전자 내 변이체의 비교적 일반적인 발견, QT 연장을 밝히기 위해 저칼라혈증과 같은 제2의 스트레스 인자가 존재해야 하는 일반적인 필요성과 같은 후속 증거는 이 유전자가 QT [21]연장에 대한 민감성에 대한 수식자를 대신 나타낸다는 것을 시사했다.따라서 일부에서는 KCNE2의 변종들이 로마노-워드 증후군을 [21]스스로 일으키기에 충분한지에 대해 이의를 제기하고 있다.
LQT9는 막구조단백질인 caveolin-3의 [23]변종에 의해 발생한다.카볼린은 카볼레라고 불리는 특정한 막 도메인을 형성하는데, 이 도메인에는 전압 게이트 나트륨 채널이 있습니다.LQT3와 마찬가지로, 이러한 카보올린 변종은 늦게 지속되는 나트륨 전류를 증가시켜 세포 [23]재분극을 손상시킵니다.
LQT10은 SCN4B 유전자의 변종에 의해 발생하는 극히 드문 아형입니다.이 유전자의 산물은 심장 나트륨 채널을 형성하는 보조 베타 서브유닛(Naβ4V)으로, 늦게 지속된 나트륨 [23]전류를 증가시키는 변종이다.LQT13은 [23]심장의 부교감 조절에 관여하는 단백질인 GIRK4의 변종에 의해 발생한다.임상적으로 환자들은 약간의 QT 연장에 그치고 심방 부정맥에 대한 성향이 증가하는 것이 특징이다.LQT14, LQT15, LQT16은 [23]칼모듈린(CALM1, CALM2, CALM3)을 담당하는 유전자의 변이에 의해 발생한다.칼모듈린은 여러 이온채널과 상호작용하며, 그 역할은 칼슘 농도에 따라 L형 칼슘전류를 조절하고, KCNQ1에 의해 생성된 단백질을 운반하여 칼륨전류에 [23]영향을 준다.이러한 유전적 변이가 QT 간격을 연장하는 정확한 메커니즘은 여전히 [23]불확실하다.
Jervell과 Lange–Nielsen 증후군
저벨과 랑게-닐슨 증후군(JLNS)은 상염색체 열성 방식으로 유전되는 희귀한 형태의 LQTS이다.QT 간격의 심각한 연장 외에도, 영향을 받는 사람들은 양쪽 귀에 영향을 미치는 심각한 감각성 난청을 가지고 태어난다.이 증후군은 KCNE1 또는 KCNQ1 유전자의 특정 변종 두 개를 물려받음으로써 발생한다.동일한 유전적 변이체는 변이체의 단일 복사본만 [10]유전되는 경우 LQT1과 LQT5 형태의 로마노-워드 증후군으로 이어진다.JLNS는 일반적으로 대부분의 다른 형태의 [4]LQTS보다 부정맥에 걸릴 위험이 높습니다.
Andersen–Tawil 증후군(LQT7)
Andersen-Tawil 증후군으로 알려진 LQT7은 세 가지 특징에 의해 특징지어진다. 장기 QT 간격 외에도, 영향을 받는 사람들은 종종 혈중 칼륨 농도가 낮을 때(최고칼륨 정기 마비), 그리고 스멀과 같은 특징적인 얼굴 및 골격 이상을 경험할 수 있다.l 아래턱(마이크로그나티아), 낮은 귀, 융해되거나 비정상적으로 각진 손가락과 발가락(불확실하고 임상적으로).[25]이 상태는 상염색체 우위적 방식으로 유전되며 칼륨 채널 단백질ir K2.[26]1을 코드하는 KCNJ2 유전자의 돌연변이에 의해 발생한다.
티모시 증후군(LQT8)
티모시 증후군이라고도 알려진 LQT8은 긴 QT 간격과 결합된 손가락 또는 발가락(신디악틱하게)을 결합한다.심실중격결손, 팔로 4중격증, 비대성 심근증 [27][28]등 심장 구조의 이상이 흔히 나타난다.이 질환은 초기에 나타나며 평균 수명은 2.5세이며 심실 부정맥에 의한 사망이 가장 흔하다.티모시 증후군을 가진 많은 어린이들이 자폐 스펙트럼 장애를 가지고 있다.티모시 증후군은 CACNA1c [29]유전자에 의해 암호화된 칼슘 채널 Cav1.2의 변종에 의해 발생한다.
관련된 유전자의 표
다음은 롱 QT 증후군과 관련된 유전자 목록입니다.
| 유형 | 옴 | 진 | 메모들 |
| LQT1 | 192500 | KCNQ1 | 칼륨 전류Ks [21]I을 운반하는 느린 지연 정류 칼륨 채널V K7.1의 α-서브유닛을 부호화합니다. |
| LQT2 | 152427 | KCNH2 | hERG라고도 합니다.칼륨 전류Kr [21]I을 운반하는 고속 지연 정류 칼륨 채널V K11.1의 α-서브유닛을 부호화합니다. |
| LQT3 | 603830 | SCN5A | 나트륨 전류Na [21]I을 운반하는 심장 나트륨V 채널 Na1.5의 α-서브유닛을 부호화합니다. |
| LQT4 | 600919 | ANC2 | 셀의 이온 채널을 고정하는 Ankyrin B를 인코딩합니다.진정한 질병 유발 유전자와 경미한 QT 감수성 [21]유전자의 차이. |
| LQT5 | 176261 | KCNE1 | 칼륨 채널β-서브유닛인 MinK를 부호화합니다.헤테로 접합 유전은 로마노-워드, 호모 접합 유전은 저벨과 랑게-닐슨 [21]증후군을 일으킨다. |
| LQT6 | 603796 | KCNE2 | 칼륨 채널β 서브유닛인 MiRP1을 부호화합니다.진정한 질병 유발 유전자와 경미한 QT 감수성 [21]유전자의 차이. |
| LQT7 | 170390 | KCNJ2 | 칼륨 전류K1 I을 운반하는 내부 정류 칼륨 전류ir K2.1을 인코딩합니다.Andersen-Tawil [21]증후군을 일으킵니다. |
| LQT8 | 601005 | CACNA1c | 칼슘 전류Ca(L). I Causes Timothy [21]증후군을 일으키는 칼슘 채널 Cav1.2의 α-서브유닛 Ca1V.2를 암호화합니다. |
| LQT9 | 611818 | CAV3 | Caveolin-3을 암호화하여 Caveolae로 알려진 막 주머니를 형성합니다.이 유전자의 돌연변이는 늦은 나트륨 전류Na [21]I을 증가시킬 수 있다. |
| LQT10 | 611819 | SCN4B | 심장 나트륨 채널의 [21]β4 서브유닛을 인코딩합니다. |
| LQT11 | 611820 | AKAP9 | K7V.[21]1과 상호작용하는 A-키나아제 관련 단백질을 암호화합니다. |
| LQT12 | 601017 | SNTA1 | 신트로핀α1을 부호화합니다.이 유전자의 돌연변이는 늦은 나트륨 전류Na [21]I을 증가시킬 수 있다. |
| LQT13 | 600734 | KCNJ5 | GIRK4라고도 알려진 G 단백질 민감성 내부 정류 칼륨 채널(K3ir.4)을 암호화하여 칼륨 전류K(ACh) [21]I을 운반합니다. |
| LQT14 | 616247 | 잔잔하다 | 칼슘 전류Ca(L) [21]I과 상호작용하는 칼슘 결합 메신저 단백질인 칼모듈린-1을 암호화합니다. |
| LQT15 | 616249 | 잔잔하다 | 칼슘 전류Ca(L) [21]I과 상호작용하는 칼슘 결합 메신저 단백질인 칼모듈린-2를 암호화한다. |
| LQT16 | 114183 | 잔잔하다 | 칼슘 전류Ca(L) [21]I과 상호작용하는 칼슘 결합 메신저 단백질인 칼모듈린-3를 암호화합니다. |
획득한
비록 긴 QT 증후군이 종종 유전적 질환이지만, 비정상 심장 박동의 위험 증가와 관련된 긴 QT 간격은 일반적으로 약물의 부작용으로 인해 유전적 이상이 없는 사람들에게도 발생할 수 있습니다.약물 유도 QT 연장은 종종 아미오다론, 소탈롤과 같은 항부정맥 약물, 에리트로마이신과 같은 항생제 또는 테르페나딘과 [19]같은 항히스타민에 의한 치료의 결과이다.QT 간격을 연장하는 다른 약물로는 할로페리돌, 지프라시돈 등의 항정신병 약물 및 항우울제 시탈로프람이 [30][18]있다.QT 간격 연장과 관련된 의약품 목록(예: CreditableMeds 데이터베이스)은 [31]온라인에서 확인할 수 있습니다.
후천성 LQTS의 다른 원인으로는 혈액 내 칼륨(저칼라혈증) 또는 마그네슘(고마그네슘혈증)이 비정상적으로 낮다.이것은 심장으로의 혈액 공급의 갑작스러운 감소, 낮은 수준의 갑상선 호르몬, 그리고 느린 심장 [32]박동수에 따라 악화될 수 있습니다.
거식증은 아마도 QT 연장으로 인한 갑작스러운 죽음과 관련이 있다.이 상태에서 나타나는 영양실조는 때때로 칼륨과 같은 염류의 혈중 농도에 영향을 미쳐 후천성 장기 QT 증후군을 일으킬 수 있으며, 이는 다시 갑작스런 심장사를 야기한다.영양실조와 염분균형의 관련 변화는 장기간에 걸쳐 발생하며, 빠른 참조는 염분 불균형을 더욱 교란시켜 부정맥의 위험을 증가시킨다.따라서 레피딩 [33]증후군의 합병증을 피하기 위해 전해질 수치를 모니터링하는 데 주의를 기울여야 합니다.
QT 간격을 연장하는 요인은 첨가제이며, 즉, QT 연장 약물을 복용하고 낮은 수준의 칼륨을 갖는 등 여러 요인의 조합이 각 요인보다 QT 연장을 더 크게 일으킬 수 있습니다.이것은 또한 그 자체로 QT 간격을 최소로 연장할 뿐이지만, 약물에 의해 유발되는 QT [32]연장에 더 민감하게 만들 수 있는 일부 유전자 변형에도 적용된다.
메커니즘
선천적으로나 후천적으로나 다양한 형태의 긴 QT 증후군은 각각의 심장 세포를 조정하는 데 사용되는 전기 신호에 영향을 줌으로써 비정상적인 심장 리듬을 만들어냅니다.공통적인 주제는 심장 활동 전위의 연장입니다. 즉, 각 심장 [10]박동에 따라 일어나는 세포막 전체의 전압 변화 패턴입니다.심장 세포는 이완될 때 보통 세포막의 안쪽에 양극화되는 세포막이라고 불리는 바깥쪽에 보다 적은 양의 이온을 가지고 있습니다.심장 세포가 수축할 때 나트륨과 칼슘과 같이 양전하를 띤 이온이 세포로 들어가 이 극성을 같게 하거나 역전시키거나 세포를 탈분극시킨다.수축이 일어난 후, 세포는 칼륨과 같이 양전하를 띤 이온이 세포 밖으로 나갈 수 있게 함으로써 극성을 회복한다.장기 QT 증후군에서는 이러한 재분극이 발생하는 데 시간이 더 오래 걸리며, 개별 세포에서는 장기 활동 전위로 나타나며, 표면 심전도에서는 장기 QT [10]간격으로 표시된다.
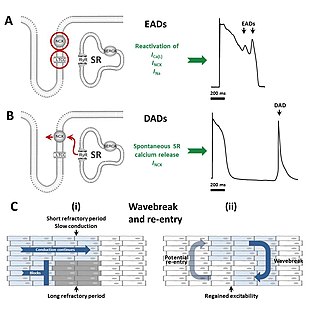
장기간에 걸친 활동전위는 여러 가지 메커니즘을 통해 부정맥을 일으킬 수 있다.장기 QT 증후군인 Torsades de Pointes의 부정맥 특성은 초기 활동 전위가 후분극의 형태로 추가적인 이상 활동 전위를 트리거할 때 시작된다.세포가 완전히 재분극되기 전에 발생하는 초기 후분극은 활동 전위가 길어질 때 특히 나타날 가능성이 높으며, 다음 심장 [34]박동까지 정상적으로 꺼지는 칼슘과 나트륨 채널의 재활성화로 인해 발생한다.적절한 조건에서 나트륨-칼슘 교환기에 의해 촉진되는 이러한 전류의 재활성화는 [34]세포의 추가적인 탈분극을 야기할 수 있다.장기 QT 증후군에서 부정맥을 유발하는 초기 후분극은 심장 전도 시스템의 [35]Purkinje 섬유에서 발생하는 경향이 있다.초기 후분극은 단일 사건으로 발생할 수 있지만,[34] 반복적으로 일어나 세포의 여러 가지 빠른 활성화를 초래할 수 있다.
일부 연구에 따르면 재분극이 완료된 후 발생하는 지연된 후분극은 장기 QT [35]증후군에도 영향을 미칠 수 있다.이러한 형태의 후분극은 석소체라고 알려진 세포 내 칼슘 저장소에서 칼슘이 자발적으로 방출되어 나트륨과 교환되는 나트륨 칼슘 교환기를 통해 칼슘을 세포 밖으로 밀어내고 순 내부 전류를 [34]발생시키는 것에서 비롯됩니다.
Torsades de Pointes의 트리거가 후분극에서 온다는 강력한 증거가 있지만 무엇이 이 부정맥을 유지하는지 확실하지 않다.몇몇 증거들은 많은 원천으로부터 반복되는 후분극이 지속적인 부정맥의 [35]원인이 된다는 것을 시사한다.하지만, 어떤 사람들은 부정맥이 재진입이라고 알려진 메커니즘을 통해 지속된다고 제안한다.이 모델에 따르면, 활동 전위 연장은 심장 근육의 다른 층에서 다른 [35]층보다 더 긴 활동 전위를 가진 다양한 정도로 발생한다.자극 자극에 반응하여, 탈분극의 물결은 활동 전위가 짧은 영역으로 확산되지만 활동 전위가 긴 영역에서는 차단된다.이를 통해 탈분극 파면이 블록 영역 주위로 휘어져 완전한 루프를 형성하고 스스로 영구화할 수 있습니다.심전도의 비틀림 패턴은 굽이치는 [35]나선형 파형의 형태로 재진입 회로의 코어가 움직이는 것으로 설명할 수 있습니다.
진단.
긴 QT 증후군을 진단하는 것은 어렵다.LQTS의 특징은 QT 인터벌의 연장입니다만, QT 인터벌은 건강한 사람과 LQTS를 가지고 있는 사람 모두에게 매우 가변적입니다.이는 LQTS가 있는 사람과 없는 사람의 QT 간격 사이에 중복을 초래한다. 유전적으로 입증된 LQTS를 가진 사람의 2.5%는 정상 [22]범위 내에서 QT 간격을 가진다.반대로 QT 간격의 정규 분포를 고려할 때 건강한 사람의 비율은 임의의 [22]컷오프보다 QT 간격이 길어집니다.따라서 진단 시 QT 간격을 벗어난 다른 요소들을 고려해야 하며, 그 중 일부는 채점 [4]시스템에 통합되었다.
심전도
롱 QT 증후군은 주로 심박수(QTc)에 대해 보정된 QT 간격을 12 유도 심전도(ECG)로 측정함으로써 진단된다.긴 QT 증후군은 유전적으로 입증된 일부 LQTS의 경우 숨겨진 LQTS로 [22]알려져 있지만 QTc의 장기화와 관련이 있습니다.QTc는 정상 남성의 95%에서 450ms 미만, 정상 여성의 95%에서 460ms 미만입니다.QTc가 이들 컷오프보다 긴 경우 LQTS가 권장됩니다.그러나 정상인의 5%도 이 범주에 속하므로 일부는 정상값의 [22]99번째 센티(cm)에 해당하는 470ms와 480ms의 컷오프를 제안한다.
상속된 LQTS의 주요 하위 유형은 특정 심전도 기능과 관련이 있습니다.LQT1은 일반적으로 광대역 T파와 관련되지만 LQT2의 T파는 절단되어 진폭이 작은 반면, LQT3에서는 T파가 종종 늦게 시작되어 긴 등전 [22]세그먼트가 선행됩니다.
슈워츠 점수
Schwartz 점수는 개인이 유전적인 형태의 LQTS를 [7]가질 가능성을 평가하기 위해 임상 및 심전도 인자를 결합하는 방법으로 제안되었다.다음 표에는 점수 계산에 사용되는 기준이 나와 있습니다.
| 수정된 QT 간격(QTc) | § 480 밀리초 | 3점 | Bazett의 보정에 따라 정의된 QTc |
| 460 ~ 460 밀리초 | 2점 | ||
| 450 ms 및 남성 | 1점 | ||
| 비틀림점 | 2점 | ||
| T파 교류전 | 1점 | ||
| 최소 3개의 리드에 T파가 노치 있음 | 1점 | ||
| 연령 대비 낮은 심박수(어린이) | 0.5점 | ||
| 실신 | 스트레스를 받아 | 2점 | 실신과 비틀림 모두에 대해 포인트를 받을 수 없습니다. |
| 스트레스 없이 | 1점 | ||
| 선천성 난청 | 0.5점 | ||
| 가족력 | LQTS가 확인된 다른 가족 구성원 | 1점 | 동일 가족 구성원은 LQTS 및 돌연사로 계산될 수 없습니다. |
| 30세 미만 직계 가족 돌연사 | 0.5점 | ||
| 점수 : 0 ~ 1 : LQTS 낮은 확률, 2 ~ 3 : LQTS 중간 확률, 4 4 : LQTS 높은 확률 | |||
기타 조사
진단이 불확실한 경우 다른 조사를 통해 장기 QT의 마스크를 벗기는 데 도움이 될 수 있습니다.휴식 QT 간격을 연장할 뿐만 아니라, LQTS는 아드레날린과 같은 카테콜아민에 의한 운동과 자극에 반응하여 QT가 어떻게 변화하는지 영향을 미칠 수 있다.운동 내성 테스트 또는 아드레날린의 직접 주입 형태의 도발 테스트는 이러한 이상 [37]반응을 감지하는 데 사용될 수 있다.이러한 조사는 정상 QT 간격이 정지되어 있는 숨겨진 선천성 타입 1 LQTS 1(LQT1)을 식별하는 데 가장 유용합니다.건강한 사람은 운동 중 QT 간격이 짧아지는 반면, 숨겨진 LQT1 운동이나 아드레날린 주입을 하는 사람은 QT 간격이 역설적으로 연장되어 근본적인 상태를 [22]드러낼 수 있다.
가이드라인 컷오프
국제적인 합의 지침은 LQTS 진단에 필요한 QT 연장 정도에 따라 다르다.유럽심장학회(European Society of Cardiology)는 증상이나 기타 조사 유무에 관계없이 수정된 QT 간격이 480ms 이상일 경우 LQTS를 진단할 수 있도록 권장합니다.그들은 원인을 알 수 없는 실신이 [4]발생한 경우 460ms 이상의 QTC가 있을 때 진단을 고려할 수 있다고 권고한다.심장 박동 협회의 지침은 보다 엄격하며, QT를 연장하는 다른 요인이 없는 경우 QTC 컷오프를 500밀리초 이상,[5] 또는 실신의 경우 480밀리초 이상으로 권장하고 있습니다.두 가지 가이드라인 모두 개인이 Schwartz 점수가 3보다 크거나 [4][5]QT 간격에 관계없이 LQTS와 관련된 병원성 유전자 변이가 확인되면 LQTS도 진단할 수 있다는 데 동의한다.
치료
LQTS로 진단된 사람들은 일반적으로 QT 간격을 더 연장하거나 TDP의 임계값을 낮출 수 있는 약물을 피하도록 권고된다. 이 약물의 목록은 공공 접근 온라인 데이터베이스에서 [38]찾을 수 있다.이와 더불어 LQTS를 가진 개인에게는 부정맥 예방과 부정맥 [citation needed]종료라는 두 가지 중재 옵션이 알려져 있습니다.
부정맥 예방
부정맥 억제는 LQTS와 관련된 부정맥의 근본적인 원인을 공격하는 약이나 외과적 시술의 사용을 포함한다.LQTS에서의 부정맥의 원인은 조기 후분극(EAD)이며, 아드레날린 자극 상태에서 증가하므로 이러한 개인에서 아드레날린 자극을 둔화하는 조치를 취할 수 있다.여기에는 스트레스 유발 부정맥의 위험을 감소시키는 베타 수용체 차단제 투여가 포함된다.강력한 비선택적 베타 차단제인 나돌롤은 세 가지 주요 유전자형(LQT1, LQT2, LQT3)[17] 모두에서 부정맥 위험을 감소시키는 것으로 나타났다.
유전자형과 QT 간격 지속 시간은 베타 차단제 치료 [17]중 생명을 위협하는 사건의 재발을 예측하는 독립적인 예측 변수이다.구체적으로는 QTc > 500 ms, LQT2 및 LQT3 유전자형의 존재는 가장 높은 [4][17]재발률과 관련이 있다.이러한 환자에서는 이식형 심장제거기를 사용한 일차적인 예방을 [7]고려할 수 있다.
- 칼륨 보충:혈중 칼륨 함량이 올라가면 활동전위가 짧아지기 때문에 칼륨 농도를 높이면 부정맥 발생을 최소화할 수 있다.hERG 채널은 칼륨 농도에 특히 민감하기 때문에 LQT2에서 가장 잘 작동해야 하지만, 사용은 실험적인 것이며 증거에 기초하지 않습니다.
- 긴 QT 증후군의 [39]부정맥을 예방하기 위해 멕실레틴과 같은 나트륨 채널 차단제가 사용되어 왔다.긴 QT 증후군이 나트륨 채널의 결함으로 인해 지속적 지연 전류(LQT3)[39]를 생성하는 사람들에게 가장 설득력 있는 징후인 반면, 멕실레틴은 LQT1, LQT2, LQT8을 [40]포함한 다른 형태의 긴 QT 증후군에서도 QT 간격을 단축시킨다.멕실레틴의 주요 작용은 초기 피크 나트륨 전류이기 때문에 라놀라진과 같은 후기 나트륨 전류를 우선적으로 억제하는 약물이 더 효과적일 수 있는 이론적 이유가 있지만, 실제는 제한적이다.[40]
- 경부 교감 사슬 절단(좌측 경골 절제술).이 치료법은 일반적으로 JLNS에 [7]의해 야기되는 LQTS를 위해 예약되어 있지만, 특정 경우에는 베타 차단제에 대한 추가 치료법으로 사용될 수 있습니다.대부분의 경우 베타 차단제 치료가 실패하면 ICD 이식을 선호한다.
- 생명을 위협하는 부정맥 [17][41]사건의 위험이 높은 환자들의 경우, ICD 주입은 예방 [4]단계로 간주될 수 있습니다.
부정맥 종료
부정맥의 종료는 생명을 위협하는 부정맥이 이미 발생한 후 멈추는 것을 포함한다.LQTS를 가진 개인에게 부정맥 종단의 한 가지 효과적인 형태는 이식 가능한 심장-제세동기(ICD)를 배치하는 것이다.또한 외부 제세동을 사용하여 부비강 리듬을 회복할 수 있습니다.ICD는 베타 차단제 치료에도 불구하고 실신 증세를 보이는 환자나 심장마비를 [4]경험한 환자에게 흔히 사용된다.앞서 언급한 바와 같이 ICD는 생명을 위협하는 부정맥 [4][17][41]사건의 위험이 높은 환자에게도 사용될 수 있습니다.
LQTS의 기초가 되는 유전학에 대한 더 나은 지식으로, 더 정밀한 치료법이 [42]제공되기를 바란다.
결과
유전자형과 QT 간격 지속 시간은 LQTS 환자에게 [16][17]가장 강력한 결과 예측 변수입니다.이 두 가지가 결합되어 각 환자의 5년 위험을 추정하는 외부에서 검증된 위험 점수 계산기를 만들었습니다. 이 계산기는 의사가 생명을 위협하는 부정맥 [41]사건의 위험이 가장 높은 환자를 식별하는 데 도움이 될 수 있습니다.
LQTS로 인한 심장마비 또는 실신을 경험하고 치료를 받지 않은 사람의 경우, 15년 이내에 사망할 위험은 [8]약 50%입니다.주의 깊게 치료하면 20년 [3]동안 1% 미만으로 감소합니다.18세 이전에 증상을 보이는 사람들은 심장 마비를 [22][43]겪을 가능성이 더 높다.
역학
유전성 LQTS는 2,500~[7]7,000명 중 1명꼴로 영향을 받는 것으로 추정된다.
역사
LQTS의 첫 번째 문서화된 사례는 1856년 라이프치히에서 마이스너에 의해 기술되었는데, 그 때 귀머거리 소녀가 선생님에게 소리를 지른 후 사망했다.통지를 받은 직후, 소녀의 부모는 귀가 먼 그녀의 오빠가 이전에 끔찍한 [44]공포로 인해 사망했다고 보고했다.이것은 심전도가 발명되기 수십 년 전의 일이지만, 저벨과 랑게닐슨 증후군의 첫 번째 사례일 것이다.1957년, 심전도(ECG)에 의해 기록된 첫 번째 사례는 노르웨이 [45]ø스베르크에서 일하는 안톤 저벨과 프레드 랑게 닐슨이 기술되었다.1963년 [46]이탈리아 소아과 의사 체사리노 로마노와 [47]1964년 아일랜드 소아과 의사 오웬 코너 워드는 나중에 로마노-워드 증후군이라고 불리는 정상적인 청력을 가진 LQTS의 더 흔한 변종을 따로 설명했습니다.1979년 국제장기QT증후군등록소(International Long-QT Syndrome Registry)의 설립으로 수많은 혈통을 종합적으로 평가할 수 있게 되었다.이것은 [48]관련된 수많은 유전자들을 발견하는데 도움을 주었다.LQTS의 트랜스제닉 동물 모델은 관련된 [49][50]다양한 유전자와 호르몬의 역할을 정의하는데 도움을 주었고, 최근 동물의 비정상적인 재분극을 정상화하기 위한 실험적인 약리 치료법이 발표되었다.[51][52]
레퍼런스
- ^ a b c d e f "Long QT syndrome". Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. 2017. Retrieved 14 December 2017.
- ^ a b c Morita H, Wu J, Zipes DP (August 2008). "The QT syndromes: long and short". Lancet. 372 (9640): 750–63. doi:10.1016/S0140-6736(08)61307-0. PMID 18761222. S2CID 41181673.
- ^ a b c d e Ferri FF (2016). Ferri's Clinical Advisor 2017 E-Book: 5 Books in 1. Elsevier Health Sciences. p. 736. ISBN 9780323448383.
- ^ a b c d e f g h i j k l Priori SG, Blomström-Lundqvist C, Mazzanti A, Blom N, Borggrefe M, Camm J, et al. (November 2015). "2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC)Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC)". Europace. 17 (11): 1601–87. doi:10.1093/europace/euv319. PMID 26318695.
- ^ a b c d Priori SG, Wilde AA, Horie M, Cho Y, Behr ER, Berul C, et al. (October 2013). "Executive summary: HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes". Europace. 15 (10): 1389–406. doi:10.1093/europace/eut272. PMID 23994779.
- ^ a b c d e f g h i j k "Long QT Syndrome". NHLBI, NIH. Retrieved 14 December 2017.
- ^ a b c d e f Levine E, Rosero SZ, Budzikowski AS, Moss AJ, Zareba W, Daubert JP (August 2008). "Congenital long QT syndrome: considerations for primary care physicians". Cleveland Clinic Journal of Medicine. 75 (8): 591–600. doi:10.3949/ccjm.75.8.591. PMID 18756841. S2CID 4237579.
- ^ a b Ackerman MJ, Priori SG, Dubin AM, Kowey P, Linker NJ, Slotwiner D, et al. (January 2017). "Beta-blocker therapy for long QT syndrome and catecholaminergic polymorphic ventricular tachycardia: Are all beta-blockers equivalent?". Heart Rhythm. 14 (1): e41–e44. doi:10.1016/j.hrthm.2016.09.012. PMID 27659101.
Among patients who have experienced a LQTS-triggered cardiac event (arrhythmic syncope, arrhythmic syncope followed by seizures, or aborted cardiac arrest), the untreated natural history is grim, with >50% mortality at 15 years.

- ^ Vincent J, Abraham E, Kochanek P, Moore FA, Fink MP (2011). Textbook of Critical Care E-Book. Elsevier Health Sciences. p. 578. ISBN 978-1437715682.
- ^ a b c d e f g h Tester DJ, Schwartz PJ, Ackerman MJ (2013). "Congenital Long QT Syndrome". In Gussak I, Antzelevitch C (eds.). Electrical Diseases of the Heart. London: Springer. pp. 439–468. doi:10.1007/978-1-4471-4881-4_27. ISBN 978-1-4471-4881-4.
- ^ McMillan JA, Feigin RD, DeAngelis C, Jones MD (2006). Oski's Pediatrics: Principles & Practice. Lippincott Williams & Wilkins. p. 1677. ISBN 978-0-7817-3894-1.
- ^ a b Madan N, Carvalho KS (February 2017). "Neurological Complications of Cardiac Disease". Seminars in Pediatric Neurology. 24 (1): 3–13. doi:10.1016/j.spen.2017.01.001. PMID 28779863.
Syncope can lead to convulsions and can easily be confused with epileptic seizures.
- ^ Nakajima T, Kaneko Y, Kurabayashi M (2015). "Unveiling specific triggers and precipitating factors for fatal cardiac events in inherited arrhythmia syndromes". Circulation Journal. 79 (6): 1185–92. doi:10.1253/circj.CJ-15-0322. PMID 25925977.
- ^ a b Trinkley KE, Page RL, Lien H, Yamanouye K, Tisdale JE (December 2013). "QT interval prolongation and the risk of torsades de pointes: essentials for clinicians". Current Medical Research and Opinion. 29 (12): 1719–26. doi:10.1185/03007995.2013.840568. PMID 24020938. S2CID 206967580.
- ^ a b Barsheshet A, Dotsenko O, Goldenberg I (November 2013). "Genotype-specific risk stratification and management of patients with long QT syndrome". Annals of Noninvasive Electrocardiology. 18 (6): 499–509. doi:10.1111/anec.12117. PMC 6932574. PMID 24206565.
- ^ a b Priori, Silvia G.; Schwartz, Peter J.; Napolitano, Carlo; Bloise, Raffaella; Ronchetti, Elena; Grillo, Massimiliano; Vicentini, Alessandro; Spazzolini, Carla; Nastoli, Janni; Bottelli, Georgia; Folli, Roberta (2003-05-08). "Risk Stratification in the Long-QT Syndrome". New England Journal of Medicine. 348 (19): 1866–1874. doi:10.1056/NEJMoa022147. ISSN 0028-4793. PMID 12736279.
- ^ a b c d e f g h Mazzanti, Andrea; Maragna, Riccardo; Vacanti, Gaetano; Monteforte, Nicola; Bloise, Raffaella; Marino, Maira; Braghieri, Lorenzo; Gambelli, Patrick; Memmi, Mirella; Pagan, Eleonora; Morini, Massimo (April 2018). "Interplay Between Genetic Substrate, QTc Duration, and Arrhythmia Risk in Patients With Long QT Syndrome". Journal of the American College of Cardiology. 71 (15): 1663–1671. doi:10.1016/j.jacc.2018.01.078. PMID 29650123.
- ^ a b c d Roden DM (March 2004). "Drug-induced prolongation of the QT interval". The New England Journal of Medicine. 350 (10): 1013–22. doi:10.1056/NEJMra032426. PMID 14999113. S2CID 15251057.
- ^ a b Thomson C, Wright P (2014-10-15). "Long QT syndrome". The Pharmaceutical Journal. 293 (7833). Retrieved 18 October 2014.
- ^ Hedley PL, Jørgensen P, Schlamowitz S, Wangari R, Moolman-Smook J, Brink PA, et al. (November 2009). "The genetic basis of long QT and short QT syndromes: a mutation update". Human Mutation. 30 (11): 1486–511. doi:10.1002/humu.21106. PMID 19862833. S2CID 19122696.
- ^ a b c d e f g h i j k l m n o p q r s Giudicessi JR, Wilde AA, Ackerman MJ (October 2018). "The genetic architecture of long QT syndrome: A critical reappraisal". Trends in Cardiovascular Medicine. 28 (7): 453–464. doi:10.1016/j.tcm.2018.03.003. PMC 6590899. PMID 29661707.
- ^ a b c d e f g h i Giudicessi JR, Ackerman MJ (October 2013). "Genotype- and phenotype-guided management of congenital long QT syndrome". Current Problems in Cardiology. 38 (10): 417–55. doi:10.1016/j.cpcardiol.2013.08.001. PMC 3940076. PMID 24093767.
- ^ a b c d e f g h i j k l m n o p q Bohnen MS, Peng G, Robey SH, Terrenoire C, Iyer V, Sampson KJ, Kass RS (January 2017). "Molecular Pathophysiology of Congenital Long QT Syndrome". Physiological Reviews. 97 (1): 89–134. doi:10.1152/physrev.00008.2016. PMC 5539372. PMID 27807201.
- ^ Bjerregaard P (August 2018). "Diagnosis and management of short QT syndrome". Heart Rhythm. 15 (8): 1261–1267. doi:10.1016/j.hrthm.2018.02.034. PMID 29501667. S2CID 4519580.
- ^ Mazzanti, Andrea; Guz, Dmitri; Trancuccio, Alessandro; Pagan, Eleonora; Kukavica, Deni; Chargeishvili, Tekla; Olivetti, Natalia; Biernacka, Elżbieta Katarzyna; Sacilotto, Luciana; Sarquella-Brugada, Georgia; Campuzano, Oscar (April 2020). "Natural History and Risk Stratification in Andersen-Tawil Syndrome Type 1". Journal of the American College of Cardiology. 75 (15): 1772–1784. doi:10.1016/j.jacc.2020.02.033. PMID 32299589. S2CID 215803995.
- ^ Nguyen HL, Pieper GH, Wilders R (December 2013). "Andersen-Tawil syndrome: clinical and molecular aspects". International Journal of Cardiology. 170 (1): 1–16. doi:10.1016/j.ijcard.2013.10.010. PMID 24383070.
- ^ Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJ, Stephens K, et al. (February 2006). "Timothy Syndrome". GeneReviews. Seattle (WA): University of Washington, Seattle. PMID 20301577.
- ^ Napolitano, C.; Timothy, K. W.; Bloise, R.; Priori, S. G.; Adam, M. P.; Ardinger, H. H.; Pagon, R. A.; Wallace, S. E.; Bean LJH; Mirzaa, G.; Amemiya, A. (1993). "Timothy Syndrome". PMID 20301577.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Tristani-Firouzi M, Etheridge SP (2013). Gussak I, Antzelevitch C (eds.). Andersen–Tawil and Timothy Syndromes. Electrical Diseases of the Heart. Springer London. pp. 561–567. doi:10.1007/978-1-4471-4881-4_32. ISBN 978-1-4471-4880-7.
- ^ Beach SR, Celano CM, Noseworthy PA, Januzzi JL, Huffman JC (January 2013). "QTc prolongation, torsades de pointes, and psychotropic medications". Psychosomatics. 54 (1): 1–13. doi:10.1016/j.psym.2012.11.001. PMID 23295003.
- ^ Woosley RL, Black K, Heise CW, Romero K (February 2018). "CredibleMeds.org: What does it offer?" (PDF). Trends in Cardiovascular Medicine. 28 (2): 94–99. doi:10.1016/j.tcm.2017.07.010. hdl:10150/627826. PMID 28801207.
- ^ a b El-Sherif N, Turitto G, Boutjdir M (April 2018). "Acquired long QT syndrome and torsade de pointes". Pacing and Clinical Electrophysiology. 41 (4): 414–421. doi:10.1111/pace.13296. PMID 29405316. S2CID 46795997.
- ^ Jáuregui-Garrido B, Jáuregui-Lobera I (February 2012). "Sudden death in eating disorders". Vascular Health and Risk Management. 8: 91–8. doi:10.2147/VHRM.S28652. PMC 3292410. PMID 22393299.
- ^ a b c d Wit AL (June 2018). "Afterdepolarizations and triggered activity as a mechanism for clinical arrhythmias". Pacing and Clinical Electrophysiology. 41 (8): 883–896. doi:10.1111/pace.13419. PMID 29920724. S2CID 49310809.
- ^ a b c d e El-Sherif N, Turitto G, Boutjdir M (May 2019). "Acquired Long QT Syndrome and Electrophysiology of Torsade de Pointes". Arrhythmia & Electrophysiology Review. 8 (2): 122–130. doi:10.15420/aer.2019.8.3. PMC 6528034. PMID 31114687.
- ^ Schwartz PJ, Moss AJ, Vincent GM, Crampton RS (August 1993). "Diagnostic criteria for the long QT syndrome. An update". Circulation. 88 (2): 782–4. doi:10.1161/01.CIR.88.2.782. PMID 8339437.
- ^ Obeyesekere MN, Klein GJ, Modi S, Leong-Sit P, Gula LJ, Yee R, et al. (December 2011). "How to perform and interpret provocative testing for the diagnosis of Brugada syndrome, long-QT syndrome, and catecholaminergic polymorphic ventricular tachycardia". Circulation: Arrhythmia and Electrophysiology. 4 (6): 958–64. doi:10.1161/CIRCEP.111.965947. PMID 22203660.
- ^ "QT Drug List by Risk Groups". Arizona Center for Education and Research on Therapeutics. Archived from the original on 2010-12-24. Retrieved 2010-07-04.
- ^ a b Mazzanti, Andrea; Maragna, Riccardo; Faragli, Alessandro; Monteforte, Nicola; Bloise, Raffaella; Memmi, Mirella; Novelli, Valeria; Baiardi, Paola; Bagnardi, Vincenzo; Etheridge, Susan P.; Napolitano, Carlo (March 2016). "Gene-Specific Therapy With Mexiletine Reduces Arrhythmic Events in Patients With Long QT Syndrome Type 3". Journal of the American College of Cardiology. 67 (9): 1053–1058. doi:10.1016/j.jacc.2015.12.033. PMC 4773513. PMID 26940925.
- ^ a b Li G, Zhang L (November 2018). "The role of mexiletine in the management of long QT syndrome". Journal of Electrocardiology. 51 (6): 1061–1065. doi:10.1016/j.jelectrocard.2018.08.035. PMID 30497731. S2CID 54167081.
- ^ a b c Mazzanti, Andrea; Trancuccio, Alessandro; Kukavica, Deni; Pagan, Eleonora; Wang, Meng; Mohsin, Muhammad; Peterson, Derick; Bagnardi, Vincenzo; Zareba, Wojciech; Priori, Silvia G (2022-04-05). "Independent validation and clinical implications of the risk prediction model for long QT syndrome (1-2-3-LQTS-Risk)". EP Europace. 24 (4): 614–619. doi:10.1093/europace/euab238. ISSN 1099-5129. PMID 34505884.
- ^ Compton SJ, Lux RL, Ramsey MR, Strelich KR, Sanguinetti MC, Green LS, et al. (September 1996). "Genetically defined therapy of inherited long-QT syndrome. Correction of abnormal repolarization by potassium". Circulation. 94 (5): 1018–22. doi:10.1161/01.CIR.94.5.1018. PMID 8790040.
- ^ "Genotype risk relationship".
- ^ Tranebjaerg L, Bathen J, Tyson J, Bitner-Glindzicz M (September 1999). "Jervell and Lange-Nielsen syndrome: a Norwegian perspective". American Journal of Medical Genetics. 89 (3): 137–46. doi:10.1002/(SICI)1096-8628(19990924)89:3<137::AID-AJMG4>3.0.CO;2-C. PMID 10704188.
- ^ Jervell A, Lange-Nielsen F (July 1957). "Congenital deaf-mutism, functional heart disease with prolongation of the Q-T interval and sudden death". American Heart Journal. 54 (1): 59–68. doi:10.1016/0002-8703(57)90079-0. PMID 13435203.
- ^ Romano C, Gemme G, Pongiglione R (September 1963). "[Arrythmias of the Pediatric Age. II. Syncopal Attacks Due to Paroxysmal Ventricular Fibrillation. Presentation of 1st Case in Italian Pediatric Literature]". La Clinica Pediatrica (in Italian). 45: 656–83. PMID 14158288.
- ^ Ward OC (April 1964). "A New Familial Cardiac Syndrome in Children". Journal of the Irish Medical Association. 54: 103–6. PMID 14136838.
- ^ Moss AJ, Schwartz PJ (March 2005). "25th anniversary of the International Long-QT Syndrome Registry: an ongoing quest to uncover the secrets of long-QT syndrome". Circulation. 111 (9): 1199–201. doi:10.1161/01.CIR.0000157069.91834.DA. PMID 15753228.
- ^ Brunner, Michael; Peng, Xuwen; Liu, Gong Xin; Ren, Xiao-Qin; Ziv, Ohad; Choi, Bum-Rak; Mathur, Rajesh; Hajjiri, Mohammed; Odening, Katja E.; Steinberg, Eric; Folco, Eduardo J. (June 2008). "Mechanisms of cardiac arrhythmias and sudden death in transgenic rabbits with long QT syndrome". The Journal of Clinical Investigation. 118 (6): 2246–2259. doi:10.1172/JCI33578. ISSN 0021-9738. PMC 2373420. PMID 18464931.
- ^ Hornyik, Tibor; Rieder, Marina; Castiglione, Alessandro; Major, Peter; Baczko, Istvan; Brunner, Michael; Koren, Gideon; Odening, Katja E. (10 May 2021). "Transgenic rabbit models for cardiac disease research" (PDF). British Journal of Pharmacology. 179 (5): 938–957. doi:10.1111/bph.15484. PMID 33822374. S2CID 233036129.
- ^ Bentzen, Bo Hjorth; Bahrke, Sophia; Wu, Kezhong; Larsen, Anders Peter; Odening, Katja E; Franke, Gerlind; van´s Gravesande, Karin Storm; Biermann, Jürgen; Peng, Xuwen; Koren, Gideon; Zehender, Manfred; Bode, Christoph; Grunnet, Morten; Brunner, Michael (February 2011). "Pharmacological Activation of Kv11.1 in Transgenic Long QT-1 Rabbits". Journal of Cardiovascular Pharmacology. 57 (2): 223–230. doi:10.1097/FJC.0b013e318203a44d. PMID 21135701. S2CID 3282707.
- ^ Castiglione, Alessandro; Hornyik, Tibor; Wülfers, Eike M; Giammarino, Lucilla; Edler, Iask; Jowais, Jessica J; Rieder, Marina; Perez-Feliz, Stefanie; Koren, Gideon; Bősze, Zsuzsanna; Varró, András; Zehender, Manfred; Brunner, Michael; Bode, Christoph; Liin, Sara I; Larsson, Hans Peter; Baczkó, István; Odening, Katja E (3 October 2021). "Docosahexaenoic acid normalizes QT interval in long QT type 2 transgenic rabbit models in a genotype-specific fashion". EP Europace. 24 (3): 511–522. doi:10.1093/europace/euab228. PMID 34601592.
- 메모들
- Goldman L (2011). Goldman's Cecil Medicine (24th ed.). Philadelphia: Elsevier Saunders. p. 1196. ISBN 978-1437727883.