심근
Cardiac muscle| 심근 | |
|---|---|
 | |
 | |
| 세부 사항 | |
| 일부 | 심장벽 |
| 식별자 | |
| 라틴어 | 심근원근 |
| TH | H2.00.05.2.02001, H2.00.05.2.00004 |
| FMA | 14068 |
| 해부학 용어 | |
심근은 척추동물 근육의 세 가지 유형 중 하나이며, 다른 두 가지는 골격근과 평활근이다.그것은 심장 벽의 주요 조직을 구성하는 비자발적인 줄무늬 근육이다.심근(심근)은 심장벽(심막)의 바깥쪽 층과 안쪽 층(심내막) 사이에 두꺼운 중간층을 형성하고 관상동맥 순환을 통해 혈액이 공급됩니다.이것은 개개의 심장 근육 세포로 구성되어 있으며, 인터칼레이션된 디스크로 결합되어 있으며, 콜라겐 섬유와 세포외 기질을 형성하는 다른 물질로 둘러싸여 있습니다.
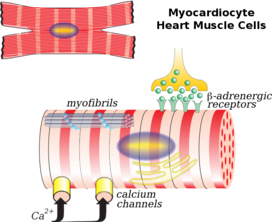
심장근육은 골격근과 비슷한 방식으로 수축하지만 몇 가지 중요한 차이점이 있다.심장 활동 전위 형태의 전기 자극은 세포의 내부 칼슘 저장소인 석회질 망막에서 칼슘의 방출을 유발합니다.칼슘의 증가는 세포의 근필라멘트가 흥분-수축 결합이라고 불리는 과정에서 서로 미끄러지게 만든다.심근증으로 알려진 심장근육 질환은 매우 중요하다.여기에는 협심증이나 심근경색 등 근육에 대한 혈액 공급이 제한됨으로써 발생하는 허혈성 질환이 포함된다.
구조.
그로스 해부학
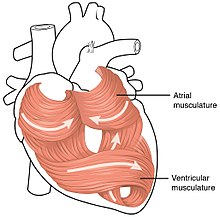
심근 조직이나 심근은 심장의 대부분을 형성한다.심장벽은 내심장과 외심외막 사이에 두꺼운 심근층이 끼어 있는 3층 구조입니다.내심내막은 심실, 심장 판막을 덮고 심장과 연결된 혈관을 연결하는 내피와 결합합니다.심근의 바깥쪽 측면에는 [1]심장을 둘러싸고 보호하며 윤활하는 심낭의 일부를 형성하는 심외막이 있다.
심근 내에는 심근 세포나 심근세포가 여러 장 있다.심내막에서 가장 가까운 좌심실을 감싸는 근육 시트는 심외막에서 가장 가까운 근육과 수직으로 방향을 잡습니다.이러한 시트가 조정된 방식으로 수축하면 심실이 여러 방향으로 동시에 압착할 수 있습니다. 즉, 세로 방향(첨단에서 베이스로 짧아짐), 방사 방향으로 좁아짐(가로로 좁아짐), 그리고 비틀림 동작(습한 천을 짜내는 것과 유사함)이 있습니다.심장 [2]박동마다 심박수가 올라가요
심장 근육을 수축시키는 것은 많은 에너지를 소비하기 때문에 산소와 영양분을 공급하기 위해 혈액의 지속적인 흐름을 필요로 한다.혈액은 관상동맥에 의해 심근으로 보내진다.이것들은 대동맥 뿌리에서 시작되어 심장의 바깥쪽이나 심외벽 표면에 있습니다.그리고 나서 혈액은 관상정맥에 의해 [1]우심방으로 배출된다.
미세해부술
심근세포라고도 불리는 심근세포는 심근의 수축성 근구이다.세포는 섬유아세포를 지지함으로써 생성된 세포외 기질로 둘러싸여 있다.심박조절기 세포로 알려진 특수 변형 심근세포는 심장 수축의 리듬을 설정합니다.심박조절기 세포는 약하게만 수축하며, 근방의 수축 세포와 갭 [3]접합을 통해 연결됩니다.이들은 우심방 벽에 위치한 동심방 결절(sinatrial node)[4]에 있습니다.
심박조절기 세포는 심장 박동을 일으키는 자극을 전달한다.그것들은 심장 전체에 분포되어 있고 몇 가지 기능을 담당합니다.첫째, 그들은 자발적으로 전기 자극을 발생시키고 내보낼 수 있는 책임이 있다.그들은 또한 뇌로부터 전기 자극을 받고 반응할 수 있어야 한다.마지막으로, 그들은 전기 충격을 세포에서 [5]세포로 전달할 수 있어야 한다.
심장 근육은 또한 전기 신호의 빠른 전도를 위한 Purkinje 섬유로 알려진 특수 세포, 근육 세포에 영양분을 공급하는 관상 동맥, 그리고 [6]노폐물을 제거하기 위한 정맥과 모세관 네트워크를 포함합니다.
심장근육세포는 심장이 펌프질을 할 수 있게 해주는 수축세포이다.각 심근세포는 심장에서 혈액을 효율적으로 펌프질하기 위해 기능적 합성세포로 알려진 인접 세포와 함께 수축해야 하며, 만약 이 배합이 무너진다면, 개별 세포가 수축하더라도 심실 같은 비정상적인 심장 박동 중에 발생할 수 있는 것과 같이 심장은 전혀 펌프질하지 않을 수 있습니다.섬유 [7]세동
현미경으로 볼 때 심장근육세포는 대략 직사각형으로 100~150μm x 30~[8]40μm이다.각각의 심장근육세포는 긴 섬유를 형성하기 위해 삽입된 디스크에 의해 그 끝에서 결합된다.각각의 세포는 서로 미끄러져 가는 악틴과 미오신의 특수 단백질 수축성 섬유인 근섬유, 근섬유를 포함합니다.이것들은 근육 세포의 기본 수축 단위인 육갑으로 구성되어 있다.근섬유의 규칙적인 구성은 골격근과 유사하게 현미경으로 보았을 때 심근 세포에 줄무늬 또는 줄무늬를 부여합니다.이러한 줄무늬는 주로 액틴으로 구성된 가벼운 I 밴드와 주로 [6]미오신으로 구성된 어두운 A 밴드에 의해 발생합니다.
심근세포는 T-튜브를 포함하고 있는데, T-튜브는 세포 표면에서 세포 내부로 이어지는 세포막 주머니로 수축의 효율성을 향상시키는데 도움을 준다.이 세포들의 대부분은 많은 핵을 포함하고 있는 골격근 세포와는 달리 오직 하나의 핵만을 가지고 있다.심장 근육 세포는 아데노신 삼인산(ATP)의 형태로 세포에 필요한 에너지를 공급하는 많은 미토콘드리아를 포함하고 있어 피로 [8][6]저항력이 매우 강하다.
T관
T-튜브는 세포 표면에서 세포 깊숙이 이어지는 미세한 관이다.그들은 세포막과 연속적이고, 동일한 인지질 이중층으로 구성되며, 세포 표면에서 세포를 둘러싼 세포 외 액체에 열려 있습니다.심근의 T튜브는 골격근보다 크고 넓지만 수는 적다.[8]셀의 중앙에서 이들은 합류하여 가로축 네트워크로서 셀에 진입하고 이를 따라 달립니다.세포 안에서 그들은 세포 내부의 칼슘 저장고인 석회질 망막 근처에 있다.여기서, 단일 튜브는 디아드로 [9]알려진 조합으로 말단 시스테라라고 불리는 석소체의 일부와 짝을 이룬다.
T-튜브의 기능은 활동 전위로 알려진 전기 자극을 세포 표면에서 세포 핵심으로 빠르게 전달하는 것과 들뜸-수축 [8]결합으로 알려진 과정에서 세포 내 칼슘 농도를 조절하는 것을 포함한다.그들은 또한 공초점 및 3D 전자 단층 촬영 [12]관찰에 의해 확인된 세포 수축 유도 T-튜브 내용 교환(이류 보조 확산)[11]에서 명백하게 기계적-전기 [10]피드백에 관여한다.
인터컬레이트된 디스크
심근합성세포는 네트워크를 통해 전기 충격을 빠르게 전달할 수 있는 인터컬레이션된 디스크에 의해 연결된 심근세포의 네트워크이며, 심근의 조정된 수축으로 작용합니다.심방합성세포와 심실합성세포는 심장연결섬유로 연결되어 [13]있다.인터컬레이션된 디스크를 통한 전기 저항이 매우 낮기 때문에 이온의 자유로운 확산이 가능합니다.심근 섬유 축을 따라 이온이 쉽게 이동하기 때문에 활동 전위가 한 심장 근육 세포에서 다른 심장 근육 세포로 이동할 수 있으며, 약간의 저항만 직면할 수 있습니다.각각의 합성은 전부 또는 전혀 [14]법칙을 따른다.
인터칼레이션 디스크는 단일 심근세포를 전기화학적 합성세포에 연결하는 복잡한 접착 구조입니다(골격근과는 대조적으로, 배아 발달 중에 다세포 합성세포가 됩니다).디스크는 주로 근육 수축 시 힘 전달을 담당합니다.인터컬레이션 디스크는 세 가지 다른 유형의 세포 세포 접합으로 구성됩니다: 액틴 필라멘트 고정 근막 접합, 중간 필라멘트 고정 데스모솜 및 갭 [15]접합.그들은 세포들 사이에 이온의 통과를 허용함으로써 심장 세포들 사이에 활동 전위가 퍼지게 하고, 심장 근육의 분극이 제거되도록 합니다.세 가지 유형의 접합부가 단일 면적 복합체로 [15][16][17][18]함께 작용합니다.
라이트 현미경 검사에서 인터컬레이션된 디스크는 일반적으로 인접한 심장 근육 세포를 나누는 얇고 어두운 색상의 선으로 나타납니다.삽입된 디스크는 근섬유의 방향에 대해 수직으로 실행됩니다.전자현미경 검사에서, 중간 원반의 경로는 더 복잡해 보입니다.저배율에서는, 이것은 가려진 Z라인의 위치 위에 있는 복잡한 전자 밀도 구조로 보일 수 있다.고배율에서는, 종방향 영역과 횡방향 영역이 모두 종방향 [19]단면에 나타나면서, 인터컬레이션된 디스크의 경로가 훨씬 더 복잡해 보입니다.
섬유아세포
심장섬유아세포는 심장근육을 지탱하는 중요한 세포이다.그들은 심근세포와 같은 강제적인 수축을 제공할 수 없지만, 대신에 심근세포를 [6]둘러싼 세포외 기질을 만들고 유지하는 데 큰 책임이 있다.섬유아세포는 심근경색과 같은 부상에 대한 반응에서 중요한 역할을 한다.부상 후, 섬유아세포는 활성화되어 근섬유아세포로 변할 수 있습니다.근섬유아세포는 섬유아세포와 평활근세포 사이 어딘가에서 행동을 보입니다.이 용량에서 섬유아세포는 콜라겐을 생성하면서 상처 부위를 부드럽게 수축시켜 상처를 [20]치유할 수 있습니다.
섬유아세포는 심근세포보다 작지만 수가 많고, 여러 섬유아세포를 동시에 심근세포에 부착할 수 있다.심근세포에 부착되면 근육세포 표면막을 통과하는 전류에 영향을 줄 수 있으며, 이 맥락에서 1960년대 [22]체외에서 보여진 것처럼 전기적으로 [21]결합되어 광유전학적 [23]기술의 도움으로 궁극적으로 자연 심장 조직에서 확인된다.섬유아세포의 다른 잠재적 역할로는 심장전도계의 전기적 절연과 심근세포 [20]및 지방세포를 포함한 다른 세포 유형으로 변환하는 능력이 있다.
세포외 매트릭스
세포외 매트릭스(ECM)는 심근세포와 섬유아세포를 둘러싸고 있습니다.ECM은 글리코사미노글리칸으로 [6]알려진 다당류(당쇄)와 함께 콜라겐과 엘라스틴을 포함한 단백질로 구성되어 있습니다.함께, 이 물질들은 근육 세포에 지지와 힘을 주고, 심장 근육에 탄력을 만들고, 물 분자와 결합함으로써 근육 세포에 수분을 공급합니다.
근육 세포와 직접적으로 접촉하는 매트릭스는 기저막이라고 불리며, 주로 타입 IV 콜라겐과 라미닌으로 구성됩니다.심근세포는 인테그린이라고 [24]불리는 특화된 당단백질을 통해 기저막과 연결되어 있다.
발전
인간은 심장 근육 세포, 즉 심장근육세포를 가지고 태어나는데, 심장근육세포는 소아 발달 기간 동안 심장이 커짐에 따라 크기가 커진다.증거는 노화 중에 심근세포가 서서히 뒤집힌다는 것을 나타내지만, 태어날 때 존재하는 심근세포의 50% 미만이 정상적인 [25]수명 동안 교체된다.개별 심근세포의 성장은 정상적인 심장 발달 중에 발생할 뿐만 아니라, 심근경색 후와 같은 광범위한 운동(운동성 심장 증후군), 심장 질환 또는 심장 근육 손상에도 반응하여 발생합니다.건강한 성인 심근세포는 길이 약 100μm, 직경 약 10~25μm의 원통형이다.심근세포비대증은 세포에서 새로운 육종단위의 생성인 육종생성을 통해 발생한다.심장용량 과부하 동안 심근세포는 편심비대를 [26]통해 성장한다.심근세포는 세로로 늘어나지만 지름이 같아 심실확장이 일어난다.심장압력 과부하 동안, 심근세포는 동심원 [26]비대를 통해 성장한다.심근세포는 지름은 커지지만 길이는 같아져 심장벽이 두꺼워진다.
생리학
이 섹션은 어떠한 출처도 인용하지 않습니다. 2021년 6월 (이를 에 대해 설명합니다) |
심장근육의 생리학은 골격근과 많은 유사점을 가지고 있다.두 근육의 주요 기능은 수축하는 것이고, 두 가지 경우 모두 활동 전위로 알려진 세포막을 가로지르는 이온의 특징적인 흐름에서 수축이 시작됩니다.심장 활동 전위는 세포 내 칼슘 농도를 높임으로써 근육 수축을 유발한다.
심장 주기
심장 주기는 한 심장 박동의 시작부터 다음 심장 박동의 시작까지 인간의 심장의 성능을 말합니다.그것은 두 개의 시기로 구성되어 있다: 심장 근육이 수축기라고 불리는 혈액의 강력한 수축기와 펌핑기를 거쳐 확장기라고 불리는 혈액으로 이완되고 다시 채워지는 시기다.비운 후에, 심장은 즉시 이완되고 팽창하여 폐와 몸의 다른 시스템으로부터 돌아오는 혈액의 유입을 받고, 다시 폐와 그 시스템들에 혈액을 공급하기 위해 수축합니다.정상적으로 작동하는 심장은 효율적으로 다시 펌핑하기 전에 완전히 확장되어야 합니다.
나머지 단계는 편광으로 간주됩니다.이 비트 단계 동안의 정지 전위는 나트륨, 칼륨, 칼슘과 같은 이온을 분리시킵니다.심근세포는 자동 또는 자발적 탈분극의 특성을 가지고 있다.이것은 나트륨 이온이 탈분극 임계치에 도달할 때까지 세포로 천천히 들어갈 수 있도록 하는 막의 직접적인 결과입니다.칼슘 이온은 따라서 탈분극을 더욱 확장시킨다.칼슘이 안쪽으로 이동하지 않게 되면, 칼륨 이온은 천천히 이동해 재분극을 일으킨다.CMC막의 매우 느린 재분극은 장기 내화기간의 [27][28]원인이 된다.
그러나 세포 내 칼슘 농도가 상승하는 메커니즘은 골격근과 심장근 사이에 다르다.심장근육에서 활동전위는 나트륨 및 칼슘 이온의 내향 흐름을 포함한다.나트륨 이온의 흐름은 빠르지만 매우 짧은 반면 칼슘의 흐름은 지속되며 심장 근육 활동 전위의 특징인 고원 단계를 제공합니다.L형 칼슘 채널을 통한 칼슘의 비교적 적은 흐름은 칼슘 유도 칼슘 방출로 알려진 현상으로 석소체 망막에서 칼슘의 훨씬 더 많은 방출을 유발합니다.이와는 대조적으로 골격근에서는 활동전위 중에 최소한의 칼슘이 세포로 유입되고 대신 이들 세포 내의 석소체 망막은 표면막에 직접 결합된다.이러한 차이는 심근 섬유가 세포 주변 용액에 칼슘이 있어야 수축하는 반면 골격근 섬유는 세포 외 칼슘이 없으면 수축한다는 관찰로 입증될 수 있다.
심장 근육 세포의 수축 동안, 세포의 길이에 따라 배향된 긴 단백질 근필라멘트는 슬라이딩 필라멘트 이론으로 알려진 서로 미끄러집니다.근필라멘트는 단백질 미오신으로 이루어진 두꺼운 필라멘트와 액틴, 트로포닌, 트로포미오신 단백질로 이루어진 얇은 필라멘트의 두 종류가 있다.두꺼운 필라멘트와 얇은 필라멘트가 서로 미끄러지면서 세포는 더 짧고 뚱뚱해진다.교차교 사이클링으로 알려진 메커니즘에서 칼슘 이온은 트로포닌과 함께 단백질 트로포닌에 결합하고, 트로포미오신과 함께 액틴의 주요 결합 부위를 발견합니다.두꺼운 필라멘트에서 미오신은 얇은 필라멘트를 따라 두꺼운 필라멘트를 당기면서 액틴과 결합할 수 있습니다.세포 내 칼슘 농도가 떨어지면 트로포닌과 트로포미오신이 다시 액틴의 결합 부위를 덮고 세포가 이완된다.
재생
심장 근육 세포는 재생되지 않는다고 일반적으로 믿어졌다.그러나 [29]이는 2009년에 발표된 보고서와 모순된다.스톡홀름에 있는 카롤린스카 연구소의 올라프 버그만과 그의 동료들은 1955년 이전에 태어난 심장 주위에 심장 근육이 거의 없는 사람들의 심장 근육 샘플을 실험했는데, 많은 사람들이 이 기형으로 인해 장애를 가지고 있는 것으로 나타났다.많은 심장의 DNA 샘플을 사용하여, 연구원들은 4살짜리 아이가 매년 심장 근육 세포의 약 20%를 갱신하고,[29] 50살짜리 아이의 심장 근육 세포의 약 69%가 태어난 후에 생성된 것으로 추정했다.
심근세포 재생이 일어나는 한 가지 방법은 정상적인 노화 [30]과정 동안 기존의 심근세포의 분열을 통해서이다.
2000년대에는 성인 내인성 심장줄기세포의 발견이 보고되었고, 골수줄기세포를 포함한 다양한 줄기세포 계통이 심근세포로 분화할 수 있고 [31][32]심부전 치료에 사용될 수 있다는 연구들이 발표되었습니다.그러나 다른 팀들은 이러한 발견을 복제할 수 없었고, 원래의 연구들 중 많은 것들이 후에 과학적 [33][34]사기 때문에 철회되었다.
심방과 심실의 차이
심근은 심장의 심방과 심실을 형성한다.이 근육 조직은 심장실 간에 매우 유사하지만 몇 가지 차이가 있습니다.심실에 있는 심근은 강압적인 수축을 가능하게 하기 위해 두껍고, 반면 심방의 심근은 훨씬 얇다.심근을 구성하는 개별 근구 또한 심장실마다 다르다.심실 심근세포는 더 길고 넓으며 T-튜브 네트워크가 더 촘촘하다.칼슘 처리의 기본 메커니즘은 심실 및 심방 심근세포와 유사하지만 칼슘 과도성은 심방근세포에서 더 작고 더 빠르게 부패하며 그에 따라 칼슘 완충능력이 [35]증가한다.이온 채널의 보완은 챔버마다 다르므로 활동 전위 지속 시간이 길어지고 심실의 효과적인 내화 기간이 길어집니다.I와 같은K(UR) 특정 이온 전류는 심방 심근세포에 매우 특이적이므로 심방 [36]세동의 치료 대상이 될 수 있습니다.
임상적 의의
심장근병이라고 알려진 심장근육에 영향을 미치는 질병은 [37]선진국에서 주요 사망 원인이다.가장 흔한 질환은 심장으로의 혈액 공급이 감소하는 관상동맥 질환이다.동맥경화성 [38]플라크의 형성에 의해 관상동맥이 좁아진다.만약 이러한 협착이 혈류를 부분적으로 제한할 정도로 심각해지면 협심증 증후군이 [38]발생할 수 있다.이것은 일반적으로 운동 중에 가슴 통증을 유발하고 휴식에 의해 완화된다.관상동맥이 갑자기 매우 좁아지거나 완전히 막히거나 혈관을 통과하는 혈류를 방해하거나 심각하게 감소시키면 심근경색이나 심장마비가 발생한다.[39]약물, 경피적 관상동맥 개입 또는 수술로 폐색이 즉시 완화되지 않으면 심장 근육 부위가 영구적으로 흉터가 생기고 [40]손상될 수 있습니다.특정 심근증은 심장 근육이 비정상적으로 두꺼워지거나(고영양성 [41]심근증), 비정상적으로 커지거나(희박성 [42]심근증), 또는 비정상적으로 딱딱해지는(제한성 심근증)[43] 원인이 될 수 있습니다.이 질환들 중 일부는 유전자 돌연변이에 의해 발생하며 [44]유전될 수 있다.
정상적인 혈액 공급에도 불구하고 심장 근육은 손상될 수 있다.심장 [45]근육은 심근염이라고 불리는 상태에서 염증을 일으킬 수 있는데, 가장 일반적으로는 바이러스[46] 감염에 의해 발생하지만 때로는 몸의 자체 면역 [47]체계에 의해 발생한다.심장 근육은 또한 알코올, 오래 지속된 고혈압이나 고혈압, 또는 지속적인 비정상적인 심장 [48]박동과 같은 약물에 의해 손상될 수 있습니다.이러한 조건들 중 상당수는, 충분히 심각하다면, 심장의 펌프 기능이 저하될 정도로 심장에 손상을 줄 수 있습니다.만약 심장이 신체의 요구를 충족시키기 위해 충분한 혈액을 더 이상 펌프질 할 수 없다면, 이것은 심부전으로 [48]묘사된다.
심장근육세포의 현저한 손상은 근세포분해라고 불리며, 이는 응고성 또는 [49][50]유화성으로 정의되는 세포괴사의 한 종류로 간주된다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b S., Sinnatamby, Chummy (2006). Last's anatomy : regional and applied. Last, R. J. (Raymond Jack) (11th ed.). Edinburgh: Elsevier/Churchill Livingstone. ISBN 978-0-443-10032-1. OCLC 61692701.
- ^ Stöhr, Eric J.; Shave, Rob E.; Baggish, Aaron L.; Weiner, Rory B. (2016-09-01). "Left ventricular twist mechanics in the context of normal physiology and cardiovascular disease: a review of studies using speckle tracking echocardiography". American Journal of Physiology. Heart and Circulatory Physiology. 311 (3): H633–644. doi:10.1152/ajpheart.00104.2016. hdl:10369/9408. ISSN 1522-1539. PMID 27402663.
- ^ Neil A. Campbell; et al. (2006). Biology : concepts & connections (5th ed.). San Francisco: Pearson/Benjamin Cummings. pp. 473. ISBN 0-13-193480-5.
- ^ Kashou AH, Basit H, Chhabra L (January 2020). "Physiology, Sinoatrial Node (SA Node)". StatPearls. PMID 29083608. Retrieved 10 May 2020.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ "Anatomy and Physiology of the Heart".
- ^ a b c d e (Pathologist), Stevens, Alan (1997). Human histology. Lowe, J. S. (James Steven), Stevens, Alan (Pathologist). (2nd ed.). London: Mosby. ISBN 978-0723424857. OCLC 35652355.
- ^ The ESC textbook of cardiovascular medicine. Camm, A. John., Lüscher, Thomas F. (Thomas Felix), Serruys, P. W., European Society of Cardiology (2nd ed.). Oxford: Oxford University Press. 2009. ISBN 9780199566990. OCLC 321015206.
{{cite book}}: CS1 유지보수: 기타 (링크) - ^ a b c d M., Bers, D. (2001). Excitation-contraction coupling and cardiac contractile force (2nd ed.). Dordrecht: Kluwer Academic Publishers. ISBN 978-0792371588. OCLC 47659382.
- ^ Hong, TingTing; Shaw, Robin M. (January 2017). "Cardiac T-Tubule Microanatomy and Function". Physiological Reviews. 97 (1): 227–252. doi:10.1152/physrev.00037.2015. ISSN 1522-1210. PMC 6151489. PMID 27881552.
- ^ Quinn, T. Alexander; Kohl, Peter (2021-01-01). "Cardiac Mechano-Electric Coupling: Acute Effects of Mechanical Stimulation on Heart Rate and Rhythm". Physiological Reviews. 101 (1): 37–92. doi:10.1152/physrev.00036.2019. ISSN 0031-9333. PMID 32380895. S2CID 218554597.
- ^ Rog-Zielinska, Eva A.; Scardigli, Marina; Peyronnet, Remi; Zgierski-Johnston, Callum M.; Greiner, Joachim; Madl, Josef; O’Toole, Eileen T.; Morphew, Mary; Hoenger, Andreas; Sacconi, Leonardo; Kohl, Peter (2021-01-22). "Beat-by-Beat Cardiomyocyte T-Tubule Deformation Drives Tubular Content Exchange". Circulation Research. 128 (2): 203–215. doi:10.1161/CIRCRESAHA.120.317266. ISSN 0009-7330. PMC 7834912. PMID 33228470.
- ^ Kohl, Peter; Greiner, Joachim; Rog-Zielinska, Eva A. (2022-04-08). "Electron microscopy of cardiac 3D nanodynamics: form, function, future". Nature Reviews Cardiology: 1–13. doi:10.1038/s41569-022-00677-x. ISSN 1759-5010. PMID 35396547. S2CID 248004338.
- ^ Jahangir Moini; Professor of Allied Health Everest University Indialantic Florida Jahangir Moini (2011). Anatomy and Physiology for Health Professionals. Jones & Bartlett Publishers. pp. 213–. ISBN 978-1-4496-3414-8.
- ^ Khurana (2005). Textbook Of Medical Physiology. Elsevier India. p. 247. ISBN 978-81-8147-850-4.
- ^ a b Zhao, G; Qiu, Y; Zhang, HM; Yang, D (January 2019). "Intercalated discs: cellular adhesion and signaling in heart health and diseases". Heart Failure Reviews. 24 (1): 115–132. doi:10.1007/s10741-018-9743-7. PMID 30288656. S2CID 52919432.
- ^ Franke WW, Borrmann CM, Grund C, Pieperhoff S (February 2006). "The area composita of adhering junctions connecting heart muscle cells of vertebrates. I. Molecular definition in intercalated disks of cardiomyocytes by immunoelectron microscopy of desmosomal proteins". Eur. J. Cell Biol. 85 (2): 69–82. doi:10.1016/j.ejcb.2005.11.003. PMID 16406610.
- ^ Goossens S, Janssens B, Bonné S, et al. (June 2007). "A unique and specific interaction between alphaT-catenin and plakophilin-2 in the area composita, the mixed-type junctional structure of cardiac intercalated discs". J. Cell Sci. 120 (Pt 12): 2126–2136. doi:10.1242/jcs.004713. PMID 17535849.
- ^ Pieperhoff S, Barth M, Rickelt S, Franke WW (2010). Mahoney MG, Müller EJ, Koch PJ (eds.). "Desmosomes and Desmosomal Cadherin Function in Skin and Heart Diseases-Advancements in Basic and Clinical Research". Dermatol Res Pract. 2010: 1–3. doi:10.1155/2010/725647. PMC 2946574. PMID 20885972.
- ^ 조직 이미지: 22501loa에서
- ^ a b Ivey, Malina J.; Tallquist, Michelle D. (2016-10-25). "Defining the Cardiac Fibroblast". Circulation Journal. 80 (11): 2269–2276. doi:10.1253/circj.CJ-16-1003. ISSN 1347-4820. PMC 5588900. PMID 27746422.
- ^ Rohr, Stephan (June 2009). "Myofibroblasts in diseased hearts: new players in cardiac arrhythmias?". Heart Rhythm. 6 (6): 848–856. doi:10.1016/j.hrthm.2009.02.038. ISSN 1556-3871. PMID 19467515.
- ^ Goshima K, Tonomura Y. "단층 배양에서 FL세포에 의해 매개되는 배아쥐 심근세포의 동기 박동"Exp Cell Res. 1969/56:387–392.doi:10.1016/0014-4827(69)90029-9.https://pubmed.ncbi.nlm.nih.gov/5387911/
- ^ Quinn, T. Alexander; Camelliti, Patrizia; Rog-Zielinska, Eva A.; Siedlecka, Urszula; Poggioli, Tommaso; O'Toole, Eileen T.; Knöpfel, Thomas; Kohl, Peter (2016-12-20). "Electrotonic coupling of excitable and nonexcitable cells in the heart revealed by optogenetics". Proceedings of the National Academy of Sciences. 113 (51): 14852–14857. doi:10.1073/pnas.1611184114. ISSN 0027-8424. PMC 5187735. PMID 27930302.
- ^ Horn, Margaux A.; Trafford, Andrew W. (April 2016). "Aging and the cardiac collagen matrix: Novel mediators of fibrotic remodelling". Journal of Molecular and Cellular Cardiology. 93: 175–185. doi:10.1016/j.yjmcc.2015.11.005. ISSN 1095-8584. PMC 4945757. PMID 26578393.
- ^ Bergmann, O.; Bhardwaj, R. D.; Bernard, S.; Zdunek, S.; Barnabe-Heider, F.; Walsh, S.; Zupicich, J.; Alkass, K.; Buchholz, B. A.; Druid, H.; Jovinge, S.; Frisen, J. (3 April 2009). "Evidence for cardiomyocyte renewal in humans". Science. 324 (5923): 98–102. Bibcode:2009Sci...324...98B. doi:10.1126/science.1164680. PMC 2991140. PMID 19342590.
- ^ a b Göktepe, S; Abilez, OJ; Parker, KK; Kuhl, E (2010-08-07). "A multiscale model for eccentric and concentric cardiac growth through sarcomerogenesis". Journal of Theoretical Biology. 265 (3): 433–442. Bibcode:2010JThBi.265..433G. doi:10.1016/j.jtbi.2010.04.023. PMID 20447409.
- ^ Klabunde, Richard. "Cardiovascular Physiology= Cardiac muscle Concept".
- ^ "Cells Alive: Pumping Myocytes".
- ^ a b Bergmann O, Bhardwaj RD, Bernard S, et al. (April 2009). "Evidence for cardiomyocyte renewal in humans". Science. 324 (5923): 98–102. Bibcode:2009Sci...324...98B. doi:10.1126/science.1164680. PMC 2991140. PMID 19342590.
- ^ Senyo SE, Steinhauser ML, Pizzimenti CL, Yang VK, Cai L, Wang M, Wu TD, Guerguin-Kern JL, Lechene CP, Lee RT (January 2013). "Mammalian heart renewal by pre-existing cardiomyocytes". Nature. 493 (7432): 433–436. Bibcode:2013Natur.493..433S. doi:10.1038/nature11682. PMC 3548046. PMID 23222518.
- ^ Orlic D, Kajstura J, Chimenti S, Jakoniuk I, Anderson SM, Li B, Pickel K, McKay R, Nadal-Ginard B, Bodine DM, Anversa P (April 2001). "Bone marrow cells regenerate infarcted myocardium". Nature. 410 (6829): 701–705. Bibcode:2001Natur.410..701O. doi:10.1038/35070587. PMID 11287958. S2CID 4424399.
- ^ Bolli R, Chugh AR, D'Amario D, Loughran JH, Stoddard MF, Ikram S, et al. (2011). "Cardiac stem cells in patients with ischaemic cardiomyopathy (SCIPIO): initial results of a randomised phase 1 trial". The Lancet. 378 (9806): 1847–1857. doi:10.1016/S0140-6736(11)61590-0. PMC 3614010. PMID 22088800.
- ^ Maliken B, Molkentin J (2018). "Undeniable Evidence That the Adult Mammalian Heart Lacks an Endogenous Regenerative Stem Cell". Circulation. 138 (8): 806–808. doi:10.1161/CIRCULATIONAHA.118.035186. PMC 6205190. PMID 30359129.
- ^ 지나 콜라타(2018년 10월 29일), 그는 손상된 심장을 회복하겠다고 약속했다. 하버드, 실험실 조작 연구 발표"뉴욕타임스
- ^ Walden, A. P.; Dibb, K. M.; Trafford, A. W. (April 2009). "Differences in intracellular calcium homeostasis between atrial and ventricular myocytes". Journal of Molecular and Cellular Cardiology. 46 (4): 463–473. doi:10.1016/j.yjmcc.2008.11.003. ISSN 1095-8584. PMID 19059414.
- ^ Ravens, Ursula; Wettwer, Erich (2011-03-01). "Ultra-rapid delayed rectifier channels: molecular basis and therapeutic implications". Cardiovascular Research. 89 (4): 776–785. doi:10.1093/cvr/cvq398. ISSN 1755-3245. PMID 21159668.
- ^ Lozano, Rafael; Naghavi, Mohsen; Foreman, Kyle; Lim, Stephen; Shibuya, Kenji; Aboyans, Victor; Abraham, Jerry; Adair, Timothy; Aggarwal, Rakesh (2012-12-15). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2095–2128. doi:10.1016/S0140-6736(12)61728-0. hdl:10536/DRO/DU:30050819. ISSN 1474-547X. PMID 23245604. S2CID 1541253.
- ^ a b Kolh, Philippe; Windecker, Stephan; Alfonso, Fernando; Collet, Jean-Philippe; Cremer, Jochen; Falk, Volkmar; Filippatos, Gerasimos; Hamm, Christian; Head, Stuart J. (October 2014). "2014 ESC/EACTS Guidelines on myocardial revascularization: the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI)". European Journal of Cardio-Thoracic Surgery. 46 (4): 517–592. doi:10.1093/ejcts/ezu366. ISSN 1873-734X. PMID 25173601.
- ^ Smith, Jennifer N.; Negrelli, Jenna M.; Manek, Megha B.; Hawes, Emily M.; Viera, Anthony J. (March 2015). "Diagnosis and management of acute coronary syndrome: an evidence-based update". Journal of the American Board of Family Medicine. 28 (2): 283–293. doi:10.3122/jabfm.2015.02.140189. ISSN 1558-7118. PMID 25748771.
- ^ Roffi, Marco; Patrono, Carlo; Collet, Jean-Philippe; Mueller, Christian; Valgimigli, Marco; Andreotti, Felicita; Bax, Jeroen J.; Borger, Michael A.; Brotons, Carlos (2016-01-14). "2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC)". European Heart Journal. 37 (3): 267–315. doi:10.1093/eurheartj/ehv320. ISSN 1522-9645. PMID 26320110.
- ^ Liew, Alphonsus C.; Vassiliou, Vassilios S.; Cooper, Robert; Raphael, Claire E. (2017-12-12). "Hypertrophic Cardiomyopathy-Past, Present and Future". Journal of Clinical Medicine. 6 (12): 118. doi:10.3390/jcm6120118. ISSN 2077-0383. PMC 5742807. PMID 29231893.
- ^ Japp, Alan G.; Gulati, Ankur; Cook, Stuart A.; Cowie, Martin R.; Prasad, Sanjay K. (2016-06-28). "The Diagnosis and Evaluation of Dilated Cardiomyopathy". Journal of the American College of Cardiology. 67 (25): 2996–3010. doi:10.1016/j.jacc.2016.03.590. ISSN 1558-3597. PMID 27339497.
- ^ Garcia, Mario J. (2016-05-03). "Constrictive Pericarditis Versus Restrictive Cardiomyopathy?". Journal of the American College of Cardiology. 67 (17): 2061–2076. doi:10.1016/j.jacc.2016.01.076. ISSN 1558-3597. PMID 27126534.
- ^ Towbin, Jeffrey A. (2014). "Inherited cardiomyopathies". Circulation Journal. 78 (10): 2347–2356. doi:10.1253/circj.CJ-14-0893. ISSN 1347-4820. PMC 4467885. PMID 25186923.
- ^ Cooper, Leslie T. (2009-04-09). "Myocarditis". The New England Journal of Medicine. 360 (15): 1526–1538. doi:10.1056/NEJMra0800028. ISSN 1533-4406. PMC 5814110. PMID 19357408.
- ^ Rose, Noel R. (July 2016). "Viral myocarditis". Current Opinion in Rheumatology. 28 (4): 383–389. doi:10.1097/BOR.0000000000000303. ISSN 1531-6963. PMC 4948180. PMID 27166925.
- ^ Bracamonte-Baran, William; Čiháková, Daniela (2017). Cardiac Autoimmunity: Myocarditis. Advances in Experimental Medicine and Biology. Vol. 1003. pp. 187–221. doi:10.1007/978-3-319-57613-8_10. ISBN 978-3-319-57611-4. ISSN 0065-2598. PMC 5706653. PMID 28667560.
- ^ a b Ponikowski, Piotr; Voors, Adriaan A.; Anker, Stefan D.; Bueno, Héctor; Cleland, John G. F.; Coats, Andrew J. S.; Falk, Volkmar; González-Juanatey, José Ramón; Harjola, Veli-Pekka (August 2016). "2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC". European Journal of Heart Failure. 18 (8): 891–975. doi:10.1002/ejhf.592. hdl:2434/427148. ISSN 1879-0844. PMID 27207191. S2CID 221675744.
- ^ Baroldi, Giorgio (2004). The Etiopathogenesis of Coronary Heart Disease: A Heretical Theory Based on Morphology, Second Edition. CRC Press. p. 88. ISBN 9781498712811.
- ^ Olsen, E. G. (2012). Atlas of Cardiovascular Pathology. Springer Science & Business Media. p. 48. ISBN 9789400932098.