분자역학
Molecular dynamics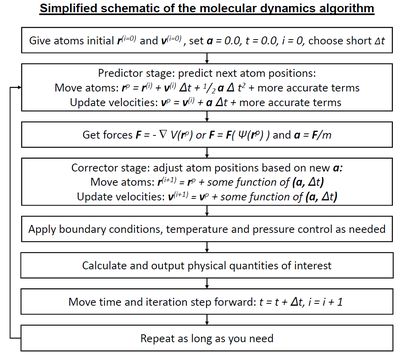
분자역학(MD)은 원자와 분자의 물리적 움직임을 분석하기 위한 컴퓨터 시뮬레이션 방법입니다.원자와 분자는 일정한 시간 동안 상호작용하도록 허용되어 시스템의 동적 "진화"에 대한 관점을 제공합니다.가장 일반적인 버전에서, 원자와 분자의 궤적은 상호작용하는 입자 시스템에 대한 뉴턴의 운동 방정식을 수치적으로 풀어서 결정되는데, 여기서 입자와 그들의 잠재 에너지 사이의 힘은 종종 원자간 전위 또는 분자 역학 힘장을 사용하여 계산된다.이 방법은 주로 화학물리학, 재료과학, 생물물리학에 적용된다.
분자 시스템은 일반적으로 방대한 수의 입자로 구성되기 때문에 이러한 복잡한 시스템의 특성을 분석적으로 결정하는 것은 불가능하다. MD 시뮬레이션은 수치적 방법을 사용하여 이 문제를 회피한다.그러나 긴 MD 시뮬레이션은 수학적으로 조건이 맞지 않아 알고리즘과 파라미터를 적절히 선택하여 최소화할 수 있지만 완전히 제거되지는 않는 수치 통합에 누적 오류가 발생합니다.
에르고드 가설을 따르는 시스템의 경우, 하나의 분자 역학 시뮬레이션의 진화는 시스템의 거시적 열역학 특성을 결정하기 위해 사용될 수 있다: 에르고드 시스템의 시간 평균은 마이크로 카노닉 앙상블 평균에 해당한다.MD는 또한 "숫자에 의한 통계역학"과 "뉴턴 역학에 대한 라플레이스의 비전"으로 불리며 자연의 힘을[1] 활성화하고 원자 규모의 분자 운동을 통찰함으로써 미래를 예측합니다.
역사
MD는 원래 1950년대 초에 개발되었으며, 몬테카를로 시뮬레이션의 초기 성공에 이어, 그 자체는 18세기까지 거슬러 올라가며, 예를 들어 부폰의 바늘 문제에서, 오늘날 메트로폴리탄으로 알려진 로젠블루스와 메트로폴리스에 의해 로스앨러모스 국립 연구소에서 통계 역학을 위해 대중화되었습니다.lis: 해스팅 알고리즘.N-물체계의 시간 진화에 대한 관심은 뉴턴을 시작으로 17세기 이전으로 거슬러 올라가며, 주로 천체 역학과 태양계의 안정성과 같은 문제에 초점을 맞추면서 다음 세기로 이어졌다.오늘날 사용되는 많은 수치적 방법들은 컴퓨터 사용 이전의 이 시기에 개발되었습니다. 예를 들어, 오늘날 사용되는 가장 일반적인 통합 알고리즘인 Verlet 통합 알고리즘은 1791년 Jean Batiste Joseph Delambre에 의해 사용되었습니다.이러한 알고리즘을 사용한 수치 계산은 "수동으로" MD로 간주할 수 있습니다.
1941년에 다체 운동 방정식의 통합이 아날로그 컴퓨터로 수행되었다.일부는 예를 들어 거시적 구를 사용하여 물리적 모델을 구성함으로써 원자 운동을 모델링하는 노동 집약적인 작업을 수행했다.그 목적은 액체의 구조를 복제하고 그 동작을 조사하기 위해 이것을 사용하는 것이다.J.D. 버널은 1962년에 다음과 같이 말했다. 고무공을 여러 개 가져다가 2.75인치에서 4인치 길이의 막대기로 붙였습니다. 애초에 가능한 한 편하게 하려고 했어요.직장 내 사무실에서 5분 간격으로 방해받고 [2]방해받기 전에 무엇을 했는지 기억나지 않아요.
미세한 입자의 발견과 컴퓨터의 발달에 따라, 관심은 중력계의 증명 범위를 넘어 물질의 통계적 특성으로 확대되었다.시도 비가역성의 기원을 이해하기, 페르미는 1953년과 1955,[3]에 MANIAC 1세, 로스 알라모스 국립 연구소'은,를 사용하여 다체 시스템 힘의 법 몇가지 선택 사항에 의거한 동작의 방정식을 시간 진화를 해결하기 위해 출판된 오늘 날, 논문 작품은 Fermi–Pasta–Ulam–Ts으로 알려져 있고 제안했다.에서gou 문제원작을 통한 에너지의 시간 진화는 오른쪽 그림에 나타나 있습니다.
1957년 Alder와 Wainwright는[4] IBM 704 컴퓨터를 사용하여 단단한 [4]구간의 완벽한 탄성 충돌을 시뮬레이션했습니다.1960년, 아마도 물질의 최초의 사실적 시뮬레이션에서 깁슨 외 연구진은 응집 표면력과 [5]함께 Born-Mayer 유형의 반발 상호작용을 사용하여 고체 구리의 방사선 손상을 시뮬레이션했다.1964년, Rahman은[6] Lennard-Jones 전위를 사용한 액체 아르곤의 시뮬레이션을 발표했다; 자가 확산 계수와 같은 시스템 특성 계산은 실험 [6]데이터와 잘 비교되었다.
응용 분야 및 제한 사항
이론물리학에서 처음 사용된 MD법은 그 직후 재료과학에서 인기를 끌었고 1970년대 이후 생화학 및 생물물리학에서도 보편화됐다.MD는 X선 결정학 또는 NMR 분광학으로부터의 실험적 제약에 기초하여 단백질 및 기타 고분자의 3차원 구조를 정제하기 위해 자주 사용된다.물리학에서 MD는 박막 성장이나 이온 서브이식 등 직접 관찰할 수 없는 원자 수준의 현상의 역학을 조사하거나 아직 생성되지 않았거나 생성되지 않은 나노기술 장치의 물리적 특성을 조사하기 위해 사용된다.생물물리학 및 구조생물학에서 이 방법은 단백질 및 핵산과 같은 고분자의 움직임을 연구하기 위해 자주 적용되며, 이는 배위자 도킹과 같이 특정 생물물리학 실험의 결과를 해석하고 다른 분자와의 상호작용을 모델링하는 데 유용할 수 있다.폴리펩타이드 사슬의 랜덤 코일 접힘을 시뮬레이션함으로써 단백질 구조의 초기 예측에 MD를 원칙적으로 사용할 수 있다.
MD 시뮬레이션의 결과는 분자역학을 측정하는 실험과 비교를 통해 시험할 수 있으며, 그 중 인기 있는 방법이 NMR 분광법이다.MD 유래의 구조 예측은 CASP(Critical Assessment of Protein Structure Prediction)에서 커뮤니티 전체의 실험을 통해 테스트할 수 있지만, 이 방법은 역사적으로 이 분야에서 제한적인 성공을 거두었습니다.단백질에 MD를 적용한 공로로 노벨상을 공동 수상한 마이클 레빗은 1999년에 CASP 참가자들이 보통 이 방법을 사용하지 않는 이유는... 분자 역학의 중심적인 당혹감, 즉 에너지 최소화 또는 분자 역학이 일반적으로 실험 구조와 [7]덜 유사한 모델로 이어진다는 점 때문이라고 썼다.점점 더 긴 MD 궤적을 허용하는 계산 자원의 개선과 힘장 매개변수의 품질 개선의 현대적 개선은 구조 예측과 호몰로지 모델 개선 모두에서 일부 개선을 가져왔으며, 이러한 영역에서 실질적인 효용에 도달하지 못했다. 많은 이들이 힘장 매개변수를 식별한다.rs는 향후 [8][9][10]개발을 위한 핵심 영역이다.
MD 시뮬레이션은 약초점 개발과 약물 [11]설계를 위해 보고되었다.예를 들어 Pinto 등은 Bcl-Xl 복합체의 MD 시뮬레이션을 실시하여 리간드 [12]결합에 관여하는 중요 아미노산의 평균 위치를 계산하였다.한편, 칼슨 외 연구진은 활성 부위의 형태와 유연성의 교란을 최소화하면서 수용체를 보완하는 화합물을 식별하기 위해 분자 역학 시뮬레이션을 구현했다.시뮬레이션 중 일정한 시간 간격으로 단백질의 스냅샷을 중첩하여 약초 발달을 위해 보존된 결합 영역(11프레임 중 최소 3프레임에서 보존됨)을 식별했다.Spyrakis 등은 MD 시뮬레이션, 리간드 및 단백질(FLAP)에 대한 지문 및 선형 판별 분석의 흐름에 의존하여 결과 약소세포의 ROC 분석을 기반으로 약소세포 템플릿 역할을 하는 최적의 배위자 단백질 구조를 식별했다.많은 모델링된 화합물의 필요성에 대해 구조 기반 약물 발견 모델링을 개선하기 위한 시도로, Hatmal 등은 MD 시뮬레이션과 리간드 수용체 간 분자 접촉 분석의 조합을 제안하여 단일 리간드-단백질 복합체의 분자간 접촉(결합 상호작용)에서 중요한 분자간 접촉(결합 상호작용)을 구별했다.그런 다음 중요 접점을 [13]가상 선별에 사용할 수 있는 약초 모델로 변환할 수 있다.
방법의 한계는 사용되는 파라미터 세트 및 기초 분자역학력장과 관련이 있다.의사 면허 시뮬레이션의 하나, 이 단백질 구조의 열역학적 안정에 모든 엔트로피의 공헌은 폴리 펩티드 체인(단백질 구조 destabilizes의 주된 요인)과 hyd의 형태 엔트로피 등 음지에 있으며 protein[의심스러운 –을 논의하]의 자유로운 에너지보다는 위치 에너지, 최적화한다.rophobic 효과(t단백질 [14]접힘의 주요 원동력)이다.또 다른 중요한 인자는 분자 내 [15]수소 결합으로, 현대 힘의 장에 명시적으로 포함되지 않지만 원자점 전하의 쿨롱 상호작용으로 설명된다.수소 결합은 부분적으로 양자역학적, 화학적 성질을 가지고 있기 때문에 이것은 대략적인 근사치이다.또한 주변 수용액의 유전율이 훨씬 높지만 정전 상호작용은 진공의 유전율을 사용하여 계산된다.짧은 원자간 거리에서 거시적 유전 상수를 사용하는 것은 의문이다.마지막으로 MD에서의 반데르발스 상호작용은 일반적으로 진공상태에서만 적용되는 프리츠 런던 이론에 기초한 레너드-존스 잠재력에 의해 설명된다.그러나 모든 유형의 반데르발스 힘은 궁극적으로 정전기 발생원이기 때문에 환경의 [16]유전 특성에 의존합니다.서로 다른 물질들 사이의 흡인력을 직접 측정하면(Hamaker 상수로서) "물을 가로지르는 탄화수소 간의 상호작용은 [16]진공에 걸친 탄화수소 간의 상호작용의 약 10%"를 알 수 있습니다.판데르발스 힘의 환경 의존성은 표준 시뮬레이션에서는 무시되지만 분극 가능한 힘장을 개발함으로써 포함될 수 있다.
설계상의 제약
분자역학 시뮬레이션의 설계는 사용 가능한 계산 능력을 설명해야 한다.합리적인 시간 내에 계산이 완료될 수 있도록 시뮬레이션 크기(n = 입자 수), 시간 단계 및 총 시간 지속 시간을 선택해야 합니다.그러나 시뮬레이션은 연구 중인 자연 과정의 시간 척도와 관련이 있을 정도로 충분히 길어야 한다.시뮬레이션에서 통계적으로 유효한 결론을 내리려면 시뮬레이션된 시간 범위가 자연 과정의 역학과 일치해야 한다.그렇지 않으면, 한 발짝도 안 되는 것을 볼 때 인간이 어떻게 걷는지에 대한 결론을 내리는 것과 유사하다.단백질과[17][18] DNA의 역학에 관한 대부분의 과학 출판물은 나노초(10초−9)에서 마이크로초(10초−6)까지의 시뮬레이션 데이터를 사용한다.이러한 시뮬레이션을 실시하려면 , CPU 일수부터 CPU 년수까지의 시간이 필요합니다.병렬 알고리즘을 사용하면 부하를 CPU 간에 분산할 수 있습니다.예를 들어 공간 또는 [19]힘 분해 알고리즘이 있습니다.
기존의 MD 시뮬레이션에서 가장 CPU를 많이 사용하는 작업은 입자의 내부 좌표 함수로서의 가능성을 평가하는 것입니다.이 에너지 평가에서 가장 비싼 것은 결합되지 않은 부품 또는 비공유 부품입니다.Big O 표기법에서는 모든 쌍별 정전 및 판데르발스 상호작용을 명시적으로 설명해야 하는 경우 공통 분자역학 시뮬레이션은O (2) O 스케일링된다.이 계산 비용은 입자 메쉬 Ewald 합계( ( log ()\ ) ) 、 입자-입자-mesh ( P3M ) 、 또는 양호한 구면 방법( n ) \ ( n [citation needed]) )와 같은 정전 방법을 사용하여 절감할 수 있습니다.
시뮬레이션에 필요한 총 CPU 시간에 영향을 미치는 또 다른 요인은 통합 시간 단계의 크기입니다.이것은 잠재력 평가 사이의 시간 길이입니다.시간 단계는 이산화 오류를 방지할 수 있을 정도로 작게 선택해야 합니다(즉, 시스템에서 가장 빠른 진동 주파수와 관련된 주기보다 작음).고전적인 MD의 일반적인 시간 단계는 1펨토초(10초)입니다−15.이 값은 가장 빠른 원자(예를 들어 수소)의 진동을 제자리에 고정하는 SHEC 구속 알고리즘과 같은 알고리즘을 사용하여 확장할 수 있다.느린 장거리 [20][21][22]힘의 업데이트 사이에 시간을 연장할 수 있는 여러 시간 척도 방법도 개발되었다.
용매 내 분자를 시뮬레이션하려면 명시적 용매와 암묵적 용매 중 하나를 선택해야 한다.명시적 용제 입자(예: TIP3P, SPC/E 및 SPC-f 물 모델)는 힘 장에 의해 비용이 많이 들도록 계산되어야 하며, 암묵적 용제는 평균장 접근법을 사용합니다.명시적 용제를 사용하는 것은 계산 비용이 많이 들기 때문에 시뮬레이션에 약 10배 이상의 입자를 포함해야 합니다.그러나 용질 분자의 특정 특성을 재현하기 위해서는 명시적 용제의 입도와 점도가 필수적이다.이것은 화학 동역학을 재현하기 위해 특히 중요하다.
모든 종류의 분자 역학 시뮬레이션에서 시뮬레이션 상자의 크기는 경계 조건 아티팩트를 피할 수 있을 정도로 커야 합니다.경계 조건은 종종 가장자리에서 고정된 값을 선택하거나(아파트를 일으킬 수 있음), 또는 시뮬레이션의 한쪽이 반대쪽으로 루프하는 주기적인 경계 조건을 사용하여(아파트를 일으킬 수도 있음) 벌크 위상을 모방하여 처리됩니다.
마이크로캐노닉 앙상블(NVE)
마이크로캐논ical 앙상블에서 시스템은 몰(N), 볼륨(V) 및 에너지(E)의 변화로부터 격리됩니다.열교환이 없는 단열 프로세스에 해당합니다.마이크로캐논컬 분자역학 궤적은 총 에너지가 보존되면서 전위와 운동에너지의 교환으로 보일 수 있다. X X와 V(\ V를 갖는 N개의 입자로 이루어진 시스템의 경우, 다음과 같은 1차 미분 방정식 쌍은 뉴턴의 표기법으로 작성될 수 있다.
시스템의 퍼텐셜 에너지 UX)})는입자 좌표 X({X의 함수이며, 물리학에서는 퍼텐셜, 화학에서는 힘장이라고 합니다.첫 번째 방정식은 뉴턴의 운동 법칙에서 나온 것입니다. 시스템의 각 입자에 작용하는 힘(\F는 U의 음의 기울기로 계산할 수 있습니다.
모든 단계마다 입자의X(\ 및 V(\ V를 Verlet 통합과 같은 심플렉틱 적분기 방법으로 통합할 수 있습니다.디스플레이 스타일 X와 V 의 시간 진화를 궤도라고 합니다.초기 위치(예: 이론적 지식)와 속도(예: 무작위화된 가우스)를 고려하여 모든 미래(또는 과거) 위치와 속도를 계산할 수 있다.
MD에 있어서의 온도의 의미에 대해서, 자주 혼란의 원인이 되고 있습니다.일반적으로 우리는 대량의 입자를 수반하는 거시적인 온도에 대한 경험이 있습니다.하지만 온도는 통계적인 수치입니다.원자가 충분히 많으면 순간온도로부터 통계온도를 추정할 수 있다.순간온도는 시스템의 운동에너지를 nkTB/2로 하고 여기서 n은 시스템의 자유도이다.
MD 시뮬레이션에 사용되는 원자의 수가 적기 때문에 온도 관련 현상이 발생합니다.예를 들어, 500개의 원자를 포함한 기판과 100eV의 증착 에너지로 시작하는 구리막의 성장을 시뮬레이션하는 것을 고려해 보십시오.실제 환경에서는 퇴적된 원자로부터 100 eV가 빠르게 전달되어 많은 (10\ 10} 이상) 간에 온도 변화 없이 공유됩니다.그러나 원자가 500개밖에 없을 때 기판은 증착에 의해 거의 즉시 기화된다.생물물리 시뮬레이션에서도 비슷한 일이 일어난다.NVE의 시스템 온도는 단백질과 같은 고분자가 발열 구조 변화와 결합을 겪을 때 자연스럽게 상승한다.
표준 앙상블(NVT)
본 발명의 표준 앙상블에서는 물질량(N), 부피(V) 및 온도(T)가 보존되어 있다.그것은 때때로 항온 분자 역학(CTMD)이라고도 불린다. NVT에서는 흡열과 발열 과정의 에너지가 온도 조절기와 교환된다.
MD 시뮬레이션의 경계에서 에너지를 다소 현실적인 방법으로 추가 및 제거하기 위해 다양한 서모스탯 알고리즘을 사용할 수 있으며, 이는 표준 앙상블에 근접합니다.일반적인 온도 제어 방법으로는 속도 재스케일링, Nosé-가 있습니다.후버 서모스탯, 노세-후버 체인, 베렌센 서모스탯, 안데르센 서모스탯, 랑게뱅 다이내믹스.베렌센 서모스탯은 비행 얼음 큐브 효과를 도입하여 시뮬레이션 시스템의 비물리적 변환과 회전을 초래할 수 있다.
이러한 알고리즘을 사용하여 구성 및 속도의 표준 앙상블 분포를 얻는 것은 간단한 일이 아닙니다.시스템 크기, 서모스탯 선택, 서모스탯 파라미터, 시간 스텝 및 인테그레이터에 따라 이것이 어떻게 달라지는지는지는 이 분야의 많은 기사의 주제입니다.
등온-등압(NPT) 앙상블
등온 등압 앙상블은 물질량(N), 압력(P), 온도(T)가 보존되어 있다.온도조절기 외에 바로스탯도 필요합니다.주변 온도와 압력에 대해 개방된 플라스크가 있는 실험실 조건에 가장 근접합니다.
생체막 시뮬레이션에서 등방압 제어는 적절하지 않다.지질 이중층의 경우, 압력 제어는 일정한 막 영역(NPAT) 또는 일정한 표면 장력 "감마"(NPtT) 아래에서 발생합니다.
일반화 앙상블
복제품 교환 방법은 일반화된 앙상블입니다.그것은 원래 무질서한 스핀 시스템의 느린 역학을 다루기 위해 만들어졌다.병렬 템퍼링이라고도 합니다.Replica Exchange MD(REMD; 레플리카 익스체인지 MD)의[23] 공식은 여러 온도에서 동작하는 시스템의 인터랙티브하지 않은 레플리카의 온도를 교환함으로써 멀티 미니마 문제를 해결하려고 합니다.
MD 시뮬레이션의 가능성
분자역학 시뮬레이션은 잠재적 함수의 정의 또는 시뮬레이션의 입자가 상호작용하는 항에 대한 설명을 필요로 합니다.화학과 생물학에서는 이것을 보통 힘장이라고 하고 재료 물리학에서는 원자간 전위라고 합니다.잠재력은 물리적인 정확도의 많은 수준에서 정의될 수 있습니다; 화학에서 가장 일반적으로 사용되는 것은 분자역학에 기초하고 구조적인 그리고 구조적인 변화를 재현할 수 있지만 보통 화학 반응을 재현할 수 없는 입자-입자 상호작용의 고전적인 역학 처리를 구현합니다.
완전 양자 기술에서 고전적 전위로의 감소는 두 가지 주요 근사치를 수반한다.첫 번째는 Born-Oppenheimer 근사치로, 전자의 역학은 매우 빨라서 원자핵의 움직임에 즉각적으로 반응하는 것으로 간주될 수 있다.그 결과, 개별적으로 취급될 수 있습니다.두 번째는 전자보다 훨씬 무거운 원자핵을 고전 뉴턴 역학을 따르는 점 입자로 취급한다.고전 분자 역학에서 전자의 효과는 하나의 잠재적 에너지 표면으로 근사되며, 일반적으로 지면 상태를 나타냅니다.
보다 상세한 디테일이 필요한 경우, 양자역학에 기초한 전위가 사용됩니다. 어떤 방법들은 시스템의 대부분이 고전적으로 취급되지만 작은 영역은 양자 시스템으로 취급되어 대개 화학적 변환이 이루어지는 하이브리드 고전/양자 전위를 생성하려고 시도합니다.
경험적 잠재력
화학에서 사용되는 경험적 전위는 종종 힘장이라고 불리는 반면, 재료 물리학에서 사용되는 것은 원자간 전위라고 불립니다.
화학에서 대부분의 힘의 장은 경험적이며 화학 결합, 결합 각도 및 결합 변형과 관련된 결합 힘과 판데르발스 힘과 정전하와 관련된 비결합 힘의 합계로 구성됩니다.경험적 전위는 특별한 함수 근사치를 통해 제한된 방식으로 양자 역학적 효과를 나타낸다.이러한 전위는 원자 전하, 원자 반지름의 추정치를 반영하는 반데르발스 매개변수, 평형 결합 길이, 각도 및 이면체와 같은 자유 매개변수를 포함한다. 이것들은 상세한 전자 계산(양자 화학 시뮬레이션) 또는 탄성 상수, 래티컬과 같은 실험적인 물리적 특성에 대해 적합함으로써 얻어진다.e 매개변수와 스펙트럼 분석 측정.
결합되지 않은 상호작용의 비국소적 특성 때문에, 그것들은 적어도 시스템 내의 모든 입자 사이의 약한 상호작용을 수반한다.일반적으로 MD 시뮬레이션 속도의 병목현상이 계산됩니다.계산 비용을 낮추기 위해 힘 장은 시프트 컷오프 반지름, 반응장 알고리즘, 입자 메쉬 에발트 합산 또는 새로운 입자-입자-입자-메쉬(P3M)와 같은 수치 근사치를 사용한다.
화학력장은 일반적으로 사전 설정된 결합 배열(예외는 초기 역학)을 사용하므로 화학적 결합 파괴 및 반응 과정을 명시적으로 모델링할 수 없다.반면 결합 순서 형식주의에 기초한 것과 같은 물리학에서 사용되는 많은 잠재력은 시스템과 결합 [24][25]파괴의 여러 다른 배열을 설명할 수 있습니다.그러한 잠재력의 예로는 탄화수소에 대한 브레너[26] 잠재력 및 C-Si-H[27] 및 C-O-H[28] 시스템에 대한 추가 개발이 있다.ReaxFF[29] 전위는 결합 순서 전위와 화학력 장 사이의 완전 반응성 하이브리드로 간주할 수 있습니다.
전위와 다체 전위의 조합
비결합 에너지를 나타내는 잠재적 함수는 시스템의 입자 간의 상호작용에 대한 합으로 공식화됩니다.많은 인기 있는 힘의 장에서 사용되는 가장 간단한 선택은 "쌍 전위"이며, 여기서 총 잠재 에너지는 원자 쌍 사이의 에너지 기여의 합으로부터 계산될 수 있다.따라서 이러한 힘장을 "추가 힘장"이라고도 합니다.그러한 쌍 전위의 예로는 반데르발스 힘을 계산하는 데 사용되는 비결합 레나르-존스 전위(6-12 전위라고도 함)가 있다.
또 다른 예는 이온 격자의 Born(이온) 모형입니다.다음 방정식의 첫 번째 항은 한 쌍의 이온에 대한 쿨롱의 법칙이고, 두 번째 항은 파울리의 배타 원리에 의해 설명되는 단거리 반발이며, 마지막 항은 분산 상호작용 항입니다.보통 시뮬레이션에는 쌍극자 항만 포함되지만 때로는 4극자 항도 포함됩니다.[30][31]n = 6일 때l, 이 전위를 쿨롱-버킹엄 전위라고도 한다.
다체 전위에서는 세 개 이상의 입자가 [32]서로 상호작용하는 효과를 전위에 포함합니다.쌍별 전위가 있는 시뮬레이션에서는 시스템의 전역 교호작용도 존재하지만 쌍별 항을 통해서만 발생합니다.다체 전위에서는 이러한 상호작용이 고차항의 조합으로 명시적으로 계산되기 때문에 원자 쌍에 걸친 합계에 의해 잠재적 에너지를 찾을 수 없다.통계적 관점에서 변수 간의 의존성은 일반적으로 자유도의 쌍별 곱만을 사용하여 표현될 수 없다.예를 들어, Tersoff [33]전위는 원래 탄소, 실리콘 및 게르마늄을 시뮬레이션하기 위해 사용되었고 이후 광범위한 다른 물질에 사용되었습니다. 이 전위는 원자 사이의 각도가 전위의 중요한 요소인 3개의 그룹으로 이루어진 합계를 포함합니다.다른 예로는 임베디드 원자법(EAM),[34] EDIP [32]및 TBSMA(Tight-Binding Second Moment Absmission) [35]전위를 들 수 있다.여기서 원자 영역 내 상태의 전자밀도는 주변 원자로부터의 기여의 합계로부터 계산되며, 잠재 에너지 기여는 이 합계의 함수이다.
반경험적 잠재력
반경험적 전위는 양자역학의 행렬 표현을 이용한다.그러나 매트릭스 요소의 값은 특정 원자 궤도의 중첩 정도를 추정하는 경험적 공식을 통해 발견됩니다.행렬은 다른 원자 궤도의 점유율을 결정하기 위해 대각선화되고, 경험 공식을 다시 한 번 사용하여 궤도의 에너지 기여도를 결정한다.
밀착 전위라고 불리는 매우 다양한 반경험 전위가 있으며, 이는 모델링되는 원자에 따라 달라집니다.
분극성 전위
대부분의 고전적 힘의 장은 예를 들어 양자 화학 계산에서 얻은 부분 전하를 확장함으로써 편광성의 효과를 암묵적으로 포함한다.이러한 부분 전하는 원자의 질량에 대해 정지되어 있다.그러나 분자역학 시뮬레이션은 드루드 입자 또는 변동 전하와 같은 다른 방법을 통해 유도 쌍극자의 도입으로 분극성을 명시적으로 모델링할 수 있다.이를 통해 지역 화학 환경에 반응하는 원자 간에 전하의 동적 재분배가 가능합니다.
오랫동안 분극 가능한 MD 시뮬레이션은 차세대 MD 시뮬레이션으로 선전되어 왔습니다.물과 같은 균질 액체의 경우 분극성을 [36][37][38]포함함으로써 정확도가 향상되었습니다.단백질에 [39][40]대한 몇 가지 유망한 결과도 달성되었다.그러나 시뮬레이션에서 [citation needed]분극성을 가장 잘 근사하는 방법은 아직 불확실하다.입자가 시뮬레이션 궤적 중에 다른 환경을 경험할 때(예: 세포막을 [41]통한 약물 전위) 지점은 더욱 중요해진다.
ab initio 방법의 가능성
고전적인 분자역학에서는 하나의 잠재적 에너지 표면(일반적으로 지면 상태)이 힘 장에 표현된다.이것은 Born-Oppenheimer 근사치의 결과이다.들뜬 상태, 화학 반응 또는 더 정확한 표현이 필요할 때, 밀도 함수 이론과 같은 양자 역학 방법을 사용하여 첫 번째 원리에서 전자 거동을 얻을 수 있습니다.이것은 Ab Initio Molecular Dynamics(AIMD)라고 불립니다.전자 자유도 처리 비용 때문에, 이러한 시뮬레이션의 계산 부담은 고전적인 분자 역학보다 훨씬 높습니다.이러한 이유로 AIMD는 일반적으로 소규모 시스템과 짧은 시간으로 제한됩니다.
궤도의 배열을 위해 필요에 따라 시스템의 위치에너지를 계산하기 위해 ab initio 양자역학 및 화학적 방법을 사용할 수 있다.이 계산은 일반적으로 반응 좌표의 가까운 부근에서 이루어집니다.다양한 근사치를 사용할 수 있지만 이는 경험적 적합이 아닌 이론적 고려사항에 기초한다.ab initio 계산은 경험적 방법에서는 얻을 수 없는 방대한 양의 정보를 생성한다. 예를 들어 전자 상태 밀도 또는 기타 전자 특성.ab initio 방법을 사용하는 것의 중요한 장점은 여러 전자 상태에 해당하는 공유 결합의 파괴 또는 형성과 관련된 반응을 연구하는 능력이다.더욱이, ab initio 방법은 혼합 양자 고전 역학 같은 접근방식을 사용하여 Born-Oppenheimer 근사치 이상의 효과를 회복할 수 있다.
하이브리드 QM/MM
QM(Quantum-mechanical) 방식은 매우 강력합니다.그러나 MM(고전 또는 분자 역학) 방법은 빠르지만 여러 한계(광범위한 매개변수화 필요, 얻어진 에너지 추정치는 매우 정확하지 않음; 공유 결합이 끊어지거나 형성되는 경우 반응을 시뮬레이션하는 데 사용할 수 없으며, 프로비저닝에 대한 능력이 제한된다.화학적 환경에 대한 정확한 세부사항을 파악한다.)QM(정확도) 계산과 MM(속도) 계산의 장점을 결합한 새로운 종류의 방법이 등장했다.이러한 방법을 혼합 또는 하이브리드 양자역학 및 분자역학 방법(하이브리드 QM/MM)[42]이라고 합니다.
하이브리드 QM/MM 방식의 가장 중요한 장점은 속도다.가장 간단한 경우에서 고전 분자 역학(MM)을 수행하는 비용은 O(n2)로 측정됩니다. 여기서 n은 시스템의 원자 수입니다.이는 주로 정전 상호 작용 용어(모든 입자가 다른 모든 입자와 상호 작용함)에 기인합니다.그러나 컷오프 반지름, 주기적인 쌍 목록 업데이트 및 최근에는 입자 메쉬 에발트(PME) 방법의 변형으로 인해 O(n)에서 O(n2) 사이로 감소하였다.즉, 2배의 원자를 가진 시스템을 시뮬레이션하면 2배에서 4배의 컴퓨팅 파워를 필요로 합니다.한편, 가장 단순한 초기 계산은 일반적으로 O3(n) 또는 그 이상의 스케일(제한된 하트리-)을 갖는다.~O(n2.7)의 축척을 위해 Fock 계산이 제안되었습니다.한계를 극복하기 위해 시스템의 작은 부분을 양자역학적으로 처리하고(일반적으로 효소의 활성 부위), 나머지 시스템을 고전적으로 처리합니다.
보다 정교한 구현에서는 QM/MM 방법이 양자 효과(수소와 같은)에 취약한 광핵과 전자 상태를 모두 처리하기 위해 존재한다.이를 통해 수소파 함수를 생성할 수 있습니다(전자파 함수와 유사).이 방법론은 수소 터널링과 같은 현상을 조사하는 데 유용하게 사용되어 왔다.QM/MM 방법이 새로운 발견을 제공한 한 가지 예는 간 알코올 탈수소효소에서의 수소화물 전달 계산입니다.이 경우 양자 [43]터널링은 반응 속도를 결정하기 때문에 수소에 중요하다.
거칠게 구겨지고 축소된 표현
상세 척도의 다른 쪽 끝에는 거친 입자와 격자 모델이 있습니다.시스템의 모든 원자를 명시적으로 나타내는 대신, 원자의 그룹을 나타내기 위해 "의사 원자"를 사용합니다.대규모 시스템에서의 MD 시뮬레이션은 기존의 전체 원자 방식으로는 쉽게 연구할 수 없는 대규모 컴퓨터 자원을 필요로 할 수 있습니다.마찬가지로, 긴 시간 척도(약 1마이크로초 이상)의 프로세스 시뮬레이션은 너무 많은 시간 단계를 필요로 하기 때문에 엄청나게 많은 비용이 듭니다.이러한 경우 축소된 표현을 사용하여 문제를 해결할 수 있습니다. 축소 표현은 거친 세분화 [44]모델이라고도 합니다.
거친 격자(CG) 방법의 예로는 불연속 분자 역학(CG-DMD)[45][46]과 Go-model이 [47]있습니다.조잡한 그레이딩은 더 큰 의사 atom을 사용하여 수행되기도 합니다.그러한 통합된 원자 근사치는 생체막의 MD 시뮬레이션에 사용되어 왔다.전기 특성이 관심 있는 시스템에서 이러한 접근방식을 구현하는 것은 의사 [48]atom에서 적절한 전하 분포를 사용하는 것이 어렵기 때문에 어려울 수 있다.지질 지방족 꼬리는 2~4개의 메틸렌기를 각각의 의사 원자 안에 모아 몇 개의 의사 원자들로 표현된다.
이러한 매우 거친 모델의 매개 변수화는 모델의 동작을 적절한 실험 데이터 또는 전체 원자 시뮬레이션에 일치시킴으로써 경험적으로 수행되어야 합니다.이러한 매개변수는 암묵적인 방법으로 [49]자유 에너지에 대한 엔탈픽 및 엔트로픽 기여 모두를 고려해야 한다.조잡한 그레이닝이 높은 레벨에서 이루어지면 동적 설명의 정확도가 저하될 수 있습니다.그러나 매우 거친 입자의 모델은 구조 생물학, 액정 조직 및 고분자 유리 분야에서 광범위한 질문을 검토하는 데 성공적으로 사용되어 왔습니다.
조잡한 그레이딩의 적용 예:
- 단백질 접힘 및 단백질 구조 예측 연구는 아미노산당 [44]하나 또는 몇 개의 유사 결합을 사용하여 종종 수행된다.
- 이방성 종을 설명하는 Gay-Berne 전위를 사용하여 제한된 기하학 및/또는 흐름 중에 액정 위상 전이를 검사했다.
- 변형 중 폴리머 안경은 레너드-존스 전위로 기술된 구를 연결하기 위해 단순 고조파 또는 FENE 스프링을 사용하여 연구되었다.
- DNA 슈퍼코일은 염기쌍당 1-3개의 유사 atoms를 사용하여 더 낮은 분해능으로 조사되었다.
- 박테리오파지에 대한 이중나선 DNA의 패키징은 하나의 의사 원자가 이중나선의 1회전(약 10개의 염기쌍)을 나타내는 모델을 사용하여 조사되었다.
- 리보솜과 다른 큰 시스템의 RNA 구조는 뉴클레오티드 당 하나의 유사 원자로 모델링되었습니다.
- 세포와 다양한 [50]기질의 상호작용을 연구하기 위한 가상 세포 시뮬레이션.
가장 간단한 형태의 굵은 격자 모양은 통합된 원자이며 단백질, 지질, 핵산의 초기 MD 시뮬레이션에 사용되었습니다.예를3 들어 CH메틸기 4개의 원자(또는 CH메틸렌기 3개의2 원자 모두)를 명시적으로 처리하는 대신 1개의 의사 원자(pseudo-atom)로 전체 그룹을 나타낸다.물론 다른 그룹과의 반데르발스 상호작용이 적절한 거리 의존성을 가지도록 적절하게 매개변수를 지정해야 한다.유사 원자가 참여하는 결합, 각도 및 비틀림에도 유사한 고려사항이 적용됩니다.이런 종류의 통합된 원자 표현에서는 수소 결합(극성 수소)에 참여할 수 있는 능력을 가진 원자를 제외한 모든 명시적 수소 원자를 제거합니다.그 예로는 CHARMM 19의 힘장이 있습니다.
수소 결합의 적절한 처리에는 기증자와 수용체 그룹 간의 방향성과 정전 상호작용에 대한 상당히 정확한 설명이 필요하기 때문에 극성 수소는 일반적으로 모델에 유지됩니다.예를 들어 수산기는 수소결합 공여체 및 수소결합 수용체일 수 있으며, 이를 하나의 OH 의사원자로는 처리할 수 없다.단백질이나 핵산에 있는 원자의 약 절반은 비극성 수소가므로, 통합된 원자를 사용하면 컴퓨터 시간을 크게 절약할 수 있습니다.
용제 효과의 통합
용질-용제 시스템의 많은 시뮬레이션에서 주요 초점은 용질 [51]분자로부터 멀리 떨어진 영역에 존재하는 용제 분자의 용제 거동에 대한 관심이 거의 없는 용질의 거동에 있다.용제는 무작위 충돌과 용매를 통한 용질 운동에 마찰 항력을 가함으로써 용질의 동적 거동에 영향을 미칠 수 있습니다.비직사형 주기 경계 조건, 확률적 경계 및 용제 쉘을 사용하면 필요한 용매 분자의 수를 줄이고 용질을 시뮬레이션하는 대신 컴퓨팅 시간의 더 많은 부분을 사용할 수 있습니다.또한 명시적인 용제 분자가 없어도 용제의 효과를 통합할 수 있습니다.이 접근법의 한 예는 특정 좌표가 변화할 때 자유 에너지가 어떻게 변화하는지를 설명하는 잠재적 평균 힘(PMF)을 사용하는 것이다.PMF에 의해 설명된 자유 에너지 변화에는 용제의 평균 효과가 포함됩니다.
고분자(단백질 등)의 용매 시뮬레이션 효과를 통합하지 않으면 비현실적인 행동을 일으킬 수 있으며, 심지어 작은 분자라도 [52]용매 존재 시 감쇠될 수 있는 유리한 판데르발스 힘과 정전 상호작용으로 인해 보다 콤팩트한 형태를 채택할 수 있다.
장거리 전력
장거리 상호작용은 공간 상호작용이 r- {\ r보다 빠르지 않게 떨어지는 상호작용입니다. 서d {\ d는 시스템의 차원입니다.예를 들어 이온 간의 전하 상호작용과 분자 간의 쌍극자 쌍극자 상호작용이 포함된다.이러한 힘을 모델링하는 것은 수천 개의 입자의 시뮬레이션을 통해 박스 길이의 절반보다 클 수 있는 거리에 걸쳐 상당한 어려움이 따른다.한 가지 솔루션은 박스 길이의 크기를 크게 늘리는 것이지만 시뮬레이션 비용이 매우 많이 들기 때문에 이 무차별적인 접근 방식은 이상적이지 않습니다.거리가 컷오프 [53]거리에 가까울 때 비현실적인 동작이 관찰될 수 있기 때문에 전위를 구상적으로 잘라내는 것도 불가능하다.
조타분자역학(SMD)
조향 분자 역학(SMD) 시뮬레이션 또는 힘 프로브 시뮬레이션은 원하는 자유도에 따라 단백질의 구조를 조작하기 위해 단백질에 힘을 가합니다.이 실험들은 원자 수준에서 단백질의 구조적 변화를 밝히는데 사용될 수 있다.SMD는 종종 기계적 전개나 [54]스트레칭과 같은 이벤트를 시뮬레이션하기 위해 사용됩니다.
SMD에는 당기는 속도가 일정하게 유지되는 프로토콜과 가해지는 힘이 일정하게 유지되는 프로토콜 두 가지가 있습니다.전형적으로 연구된 시스템의 일부(예: 단백질의 원자)는 고조파 전위에 의해 억제된다.그런 다음 힘은 일정한 속도 또는 일정한 힘으로 특정 원자에 가해진다.엄브렐라 샘플링은 예를 들어 시뮬레이션에서 조작되는 힘, 거리 및 각도를 변화시킴으로써 원하는 반응 좌표를 따라 시스템을 이동하는 데 사용됩니다.포괄적 표본 추출을 통해 고에너지 및 저에너지 모두 시스템의 모든 구성을 적절하게 표본 추출한다.그러면 자유 에너지의 각 구성의 변화는 평균 [55]힘의 잠재력으로 계산될 수 있습니다.PMF를 계산하는 일반적인 방법은 일련의 포괄적 표본 추출 [56][57]시뮬레이션을 분석하는 가중 히스토그램 분석 방법(WHAM)을 사용하는 것입니다.
SMD의 많은 중요한 응용 분야는 약물 발견과 생체 분자 과학 분야이다.예를 들어 SMD는 알츠하이머 원섬유실의 [58]안정성을 조사하고, 사이클린 의존성 키나제[59] 5의 단백질 배위자 상호작용을 연구하며, 심지어 다른 많은 흥미로운 연구 중 트롬빈(단백질)과[60] 압타머(뉴클레오티드) 복합체에 대한 전장의 영향을 보여주기 위해 사용되었다.
응용 프로그램의 예

분자역학은 과학의 많은 분야에서 사용된다.
- 간소화된 생물학적 접힘 프로세스의 첫 번째 MD 시뮬레이션은 1975년에 발표되었다.Nature지에 게재된 시뮬레이션은 현대 컴퓨터 단백질 [61]접기의 광범위한 영역을 위한 길을 닦았습니다.
- 생물학적 과정에 대한 최초의 MD 시뮬레이션은 1976년에 출판되었습니다.Nature에 게재된 시뮬레이션은 단백질 운동을 단순한 [62]부속물이 아닌 기능에서 필수적인 것으로 이해할 수 있는 길을 열어주었다.
- MD는 열 스파이크 상태의 충돌 캐스케이드, 즉 에너지 중성자와 이온 조사가 고체 및 고체 [63]표면에 미치는 영향을 처리하는 표준 방법이다.
다음의 생물물리학적 예는 매우 큰 크기(전체 바이러스) 또는 매우 긴 시뮬레이션 시간(최대 1.112밀리초)의 시스템을 시뮬레이션하기 위한 주목할 만한 노력을 보여준다.
- 풀위성 담배 모자이크 바이러스(STMV)의 MD 시뮬레이션(2006년, 크기: 100만 원자, 시뮬레이션 시간: 50ns, 프로그램: NAMD) 담배 모자이크 바이러스(TMV)에 의한 감염 증상을 악화시키는 작은 20면체 식물 바이러스입니다.분자역학 시뮬레이션은 바이러스 집합의 메커니즘을 조사하기 위해 사용되었다.전체 STMV 입자는 바이러스 캡시드를 구성하는 하나의 단백질(코팅)과 1063 뉴클레오티드 단일 가닥 RNA 게놈의 60개의 동일한 복사본으로 구성됩니다.한 가지 중요한 발견은 내부에 RNA가 없을 때 캡시드가 매우 불안정하다는 것이다.이 시뮬레이션을 완료하려면 2006년 데스크톱 컴퓨터 1대가 35년 정도 걸립니다.따라서 많은 프로세서에서 병렬로 프로세서와 프로세서 [64]간의 지속적인 통신이 이루어졌습니다.
- 빌린 헤드피스의 전체 원자 상세 접기 시뮬레이션(2006, 크기: 20,000 원자, 시뮬레이션 시간: 500 μs= 500,000 ns, 프로그램:Folding@home)이 시뮬레이션은 전 세계 20만 대의 PC에서 실행되었습니다.이 컴퓨터에는 스탠포드 대학의 Vijay Pande가 조정한 대규모 분산 컴퓨팅 작업인 Folding@home 프로그램이 설치되어 있습니다.빌린 헤드피스 단백질의 운동학적 특성은 연속적인 실시간 통신 없이 CPU에 의해 실행되는 많은 독립적이고 짧은 궤적을 사용하여 조사되었다.채택된 한 가지 방법은 Pfold 값 분석으로, 특정 시동 구성을 전개하기 전에 접힐 확률을 측정하였다.Pfold는 전이 상태 구조와 접힘 경로를 따른 배치 순서에 대한 정보를 제공한다.Pfold 계산의 각 궤적은 상대적으로 짧을 수 있지만, 많은 독립적인 궤적이 필요하다.[65]
- D. E. Show Research에 의해 커스텀 애플리케이션 고유의 집적회로(ASIC)와 상호접속을 중심으로 설계 및 구축된 대규모 병렬 슈퍼컴퓨터 Anton에 대해 장시간 연속적인 시뮬레이션이 수행되었습니다.안톤을 사용하여 수행된 시뮬레이션의 가장 긴 공개 결과는 355K에서 NTL9의 1.112밀리초 시뮬레이션이다. 두 번째, 이 구성의 독립적인 1.073밀리초 시뮬레이션도 수행되었다(그리고 250μs 이상의 연속 화학 [66]시간에 대한 많은 다른 시뮬레이션).'단백질이 빠르게 접히는 방법'에서 연구원들은 크레스텐 린도르프-라센, 스테파노 피아나, 론 O. 드로르, 그리고 데이비드 E. 쇼는 "100μs에서 1ms 사이의 기간에 걸쳐 12개의 구조적으로 다양한 단백질의 접힘의 기초가 되는 일련의 공통 원리를 밝히는 원자 수준 분자 역학 시뮬레이션의 결과"에 대해 논한다.전문화된 맞춤형 하드웨어에 의해 가능하게 된 이러한 다양한 긴 궤적을 조사하면, "대부분의 경우, 접힘은 전개된 [66]상태에서 형성되는 성향과 높은 상관관계를 가진 순서의 네이티브 구조의 요소가 나타나는 단일 지배 경로를 따른다"는 결론을 내릴 수 있다.별도의 연구에서 안톤은 300K에서 [67]소 췌장 트립신 억제제(BPTI)의 고유 상태 역학을 1.013밀리초 시뮬레이션하는 데 사용되었다.
MD 방법의 또 다른 중요한 적용은 원자 규모의 미세 구조 진화의 3차원 특성화 및 분석 능력에서 이익을 얻는다.
- MD 시뮬레이션은 예를 들어 나노결정 Al 및 Al(Zr) [68]재료의 마모 및 마찰을 설명할 때 입도 진화의 특성화에 사용됩니다.이 시뮬레이션에서는 마찰 프로세스 중에 전위 진화와 입경 진화를 분석합니다.MD법은 미세구조의 모든 정보를 제공하므로 다면체 Template Matching,[69] Gran Segmentation,[70] Graph clustering[71] 방법을 사용하여 3D로 입자 크기 진화를 계산하였습니다.이러한 시뮬레이션에서 MD 방법은 입자의 크기를 정확하게 측정할 수 있었다.이러한 정보를 이용하여 실제 곡물 구조를 추출하고 측정하여 제시하였다.재료의 단일 2차원 슬라이스와 함께 SEM을 사용하는 기존 방법에 비해 MD는 원자 규모로 미세 구조 진화를 특징짓는 3차원적이고 정확한 방법을 제공합니다.
분자역학 알고리즘
인테그레이터
- 심플렉틱 적분자
- Verlet-Stoermer 통합
- 룽게-쿠타 통합
- 비만의 알고리즘
- 제약 알고리즘(제한된 시스템의 경우)
단거리 상호작용 알고리즘
장거리 상호작용 알고리즘
병렬화 전략
Ab-initio 분자역학
MD 시뮬레이션 전용 하드웨어
MD 시뮬레이션용 하드웨어로서의 그래픽 카드

GPU에서의 분자 모델링은 분자 [72]시뮬레이션에 그래픽 처리 장치(GPU)를 사용하는 기술입니다.
2007년에 NVIDIA는 그래픽 표시뿐만 아니라 과학적 계산에도 사용할 수 있는 비디오 카드를 발표했습니다.이 카드에는 병렬로 동작하는 많은 산술 유닛(2016년[update] 현재 Tesla P100에서는 최대 3,584개)이 포함되어 있습니다.이 이벤트가 발생하기 훨씬 전에 비디오 카드의 계산 능력은 그래픽 계산을 가속화하기 위해 순수하게 사용되었습니다.새로운 점은 NVIDIA가 CUDA라는 이름의 고급 애플리케이션 프로그래밍 인터페이스(API)에서 병렬 프로그램을 개발할 수 있게 했다는 것입니다.이 기술은 프로그램을 C/C++로 쓸 수 있게 함으로써 프로그래밍을 크게 간소화했습니다.최근에는 OpenCL을 통해 크로스 플랫폼 GPU를 가속할 수 있습니다.「 」를 참조해 주세요.
레퍼런스
- ^ Schlick, Tamar (1996). "Pursuing Laplace's Vision on Modern Computers". Mathematical Approaches to Biomolecular Structure and Dynamics. The IMA Volumes in Mathematics and its Applications. Vol. 82. pp. 219–247. doi:10.1007/978-1-4612-4066-2_13. ISBN 978-0-387-94838-6.
- ^ Bernal, J. D. (January 1997). "The Bakerian Lecture, 1962 The structure of liquids". Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences. 280 (1382): 299–322. Bibcode:1964RSPSA.280..299B. doi:10.1098/rspa.1964.0147. S2CID 178710030.
- ^ Fermi E., 파스타 J., Ulam S., Los Alamos가 LA-1940(1955)을 보고한다.
- ^ a b Alder, B. J.; Wainwright, T. E. (August 1959). "Studies in Molecular Dynamics. I. General Method". The Journal of Chemical Physics. 31 (2): 459–466. Bibcode:1959JChPh..31..459A. doi:10.1063/1.1730376.
- ^ Gibson, J B; Goland, A N; Milgram, M; Vineyard, G H (1960). "Dynamics of Radiation Damage". Phys. Rev. 120 (4): 1229–1253. Bibcode:1960PhRv..120.1229G. doi:10.1103/PhysRev.120.1229.
- ^ a b Rahman, A. (19 October 1964). "Correlations in the Motion of Atoms in Liquid Argon". Physical Review. 136 (2A): A405–A411. Bibcode:1964PhRv..136..405R. doi:10.1103/PhysRev.136.A405.
- ^ Koehl, P.; Levitt, Michael (1999). "A brighter future for protein structure prediction". Nature Structural Biology. 6 (2): 108–111. doi:10.1038/5794. PMID 10048917. S2CID 3162636.
- ^ Raval, A; Piana, S; Eastwood, MP; Dror, RO; Shaw, DE (August 2012). "Refinement of protein structure homology models via long, all-atom molecular dynamics simulations". Proteins. 80 (8): 2071–9. doi:10.1002/prot.24098. PMID 22513870. S2CID 10613106.
- ^ Beauchamp, KA; Lin, YS; Das, R; Pande, VS (10 April 2012). "Are Protein Force Fields Getting Better? A Systematic Benchmark on 524 Diverse NMR Measurements". Journal of Chemical Theory and Computation. 8 (4): 1409–1414. doi:10.1021/ct2007814. PMC 3383641. PMID 22754404.
- ^ Piana, S; Klepeis, JL; Shaw, DE (February 2014). "Assessing the accuracy of physical models used in protein-folding simulations: quantitative evidence from long molecular dynamics simulations". Current Opinion in Structural Biology. 24: 98–105. doi:10.1016/j.sbi.2013.12.006. PMID 24463371.
- ^ 마이코박테리아 시클로프로판 신타아제 친메이 츄드허리 등의 잠재적 억제제를 스크리닝하기 위한 역학 기반 약초 모델. J Chem Inf Model 2015년..
- ^ Bcl-xL 및 Bcl-2에 결합된 프로아포토시스 단백질 Bak, Bax, Bid 및 Hrk의 BH3 도메인의 펩타이드 세그먼트에 대한 분자역학 연구.
- ^ 분자역학 시뮬레이션과 리간드 수용체와의 결합은 약초단자 모델링을 위한 새로운 접근법으로서 분석: 사례 연구로서 베타-시크리테아제 1과 체크포인트 키나제 1, Ma'mon M Hatmal et al.J Compute Aided Mol Des 2016년 12월
- ^ 소수성 효과는 대부분 상온에서 엔트로피 성질에 기인한다.
- ^ Myers, J. K.; Pace, C. N. (1996). "Hydrogen bonding stabilizes globular proteins". Biophys. J. 71 (4): 2033–2039. Bibcode:1996BpJ....71.2033M. doi:10.1016/s0006-3495(96)79401-8. PMC 1233669. PMID 8889177.
- ^ a b 이스라엘, 제이콥(1992)분자간 및 표면력.샌디에이고의 학술 출판사입니다
- ^ Cruz, F.J.A.L.; de Pablo, J.J.; Mota, J.P.B. (2014), "Endohedral confinement of a DNA dodecamer onto pristine carbon nanotubes and the stability of the canonical B form", J. Chem. Phys., 140 (22): 225103, arXiv:1605.01317, Bibcode:2014JChPh.140v5103C, doi:10.1063/1.4881422, PMID 24929415, S2CID 15149133
- ^ Cruz, F.J.A.L.; Mota, J.P.B. (2016), "Conformational Thermodynamics of DNA Strands in Hydrophilic Nanopores", J. Phys. Chem. C, 120 (36): 20357–20367, doi:10.1021/acs.jpcc.6b06234
- ^ 플림튼, 스티브분자역학 - 병렬 알고리즘, 샌디아주지사
- ^ Streett WB, Tildesley DJ, Saville G; Tildesley; Saville (1978). "Multiple time-step methods in molecular dynamics". Mol Phys. 35 (3): 639–648. Bibcode:1978MolPh..35..639S. doi:10.1080/00268977800100471.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Tuckerman ME, Berne BJ, Martyna GJ; Berne; Martyna (1991). "Molecular dynamics algorithm for multiple time scales: systems with long range forces". J Chem Phys. 94 (10): 6811–6815. Bibcode:1991JChPh..94.6811T. doi:10.1063/1.460259.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Tuckerman ME, Berne BJ, Martyna GJ; Berne; Martyna (1992). "Reversible multiple time scale molecular dynamics". J Chem Phys. 97 (3): 1990–2001. Bibcode:1992JChPh..97.1990T. doi:10.1063/1.463137.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Sugita, Yuji; Okamoto, Yuko (November 1999). "Replica-exchange molecular dynamics method for protein folding". Chemical Physics Letters. 314 (1–2): 141–151. Bibcode:1999CPL...314..141S. doi:10.1016/S0009-2614(99)01123-9.
- ^ Sinnott, S. B.; Brenner, D. W. (2012). "Three decades of many-body potentials in materials research". MRS Bulletin. 37 (5): 469–473. doi:10.1557/mrs.2012.88.
- ^ Albe, K.; Nordlund, K.; Averback, R. S. (2002). "Modeling metal-semiconductor interaction: Analytical bond-order potential for platinum-carbon". Phys. Rev. B. 65 (19): 195124. Bibcode:2002PhRvB..65s5124A. doi:10.1103/physrevb.65.195124.
- ^ Brenner, Donald W. (15 November 1990). "Empirical potential for hydrocarbons for use in simulating the chemical vapor deposition of diamond films" (PDF). Physical Review B. 42 (15): 9458–9471. Bibcode:1990PhRvB..42.9458B. doi:10.1103/physrevb.42.9458. PMID 9995183. Archived from the original on September 22, 2017.
- ^ Beardmore, Keith; Smith, Roger (1996). "Empirical potentials for C-Si-H systems with application to C60 interactions with Si crystal surfaces". Philosophical Magazine A. 74 (6): 1439–1466. Bibcode:1996PMagA..74.1439B. doi:10.1080/01418619608240734.
- ^ Ni, Boris; Lee, Ki-Ho; Sinnott, Susan B (2004). "A reactive empirical bond order (rebo) potential for hydrocarbon oxygen interactions". Journal of Physics: Condensed Matter. 16 (41): 7261–7275. Bibcode:2004JPCM...16.7261N. doi:10.1088/0953-8984/16/41/008.
- ^ van Duin, Adri C. T.; Dasgupta, Siddharth; Lorant, Francois; Goddard, William A. (October 2001). "ReaxFF: A Reactive Force Field for Hydrocarbons". The Journal of Physical Chemistry A. 105 (41): 9396–9409. Bibcode:2001JPCA..105.9396V. CiteSeerX 10.1.1.507.6992. doi:10.1021/jp004368u.
- ^ Cruz, Fernando J. A. L.; Canongia Lopes, José N.; Calado, Jorge C. G.; Minas da Piedade, Manuel E. (December 2005). "A Molecular Dynamics Study of the Thermodynamic Properties of Calcium Apatites. 1. Hexagonal Phases". The Journal of Physical Chemistry B. 109 (51): 24473–24479. doi:10.1021/jp054304p. PMID 16375450.
- ^ Cruz, Fernando J.A.L.; Lopes, José N. Canongia; Calado, Jorge C.G. (March 2006). "Molecular dynamics simulations of molten calcium hydroxyapatite". Fluid Phase Equilibria. 241 (1–2): 51–58. doi:10.1016/j.fluid.2005.12.021.
- ^ a b Justo, J. F.; Bazant, M. Z.; Kaxiras, E.; Bulatov, V. V.; Yip, S. (1998). "Interatomic potential for silicon defects and disordered phases". Phys. Rev. B. 58 (5): 2539–2550. arXiv:cond-mat/9712058. Bibcode:1998PhRvB..58.2539J. doi:10.1103/PhysRevB.58.2539. S2CID 14585375.
- ^ Tersoff, J. (15 March 1989). "Modeling solid-state chemistry: Interatomic potentials for multicomponent systems". Physical Review B. 39 (8): 5566–5568. Bibcode:1989PhRvB..39.5566T. doi:10.1103/physrevb.39.5566. PMID 9948964.
- ^ Daw, Murray S.; Foiles, Stephen M.; Baskes, Michael I. (March 1993). "The embedded-atom method: a review of theory and applications". Materials Science Reports. 9 (7–8): 251–310. doi:10.1016/0920-2307(93)90001-U.
- ^ Cleri, Fabrizio; Rosato, Vittorio (1 July 1993). "Tight-binding potentials for transition metals and alloys". Physical Review B. 48 (1): 22–33. Bibcode:1993PhRvB..48...22C. doi:10.1103/physrevb.48.22. PMID 10006745.
- ^ Lamoureux G, Harder E, Vorobyov IV, Roux B, MacKerell AD; Harder; Vorobyov; Roux; MacKerell (2006). "A polarizable model of water for molecular dynamics simulations of biomolecules". Chem Phys Lett. 418 (1): 245–249. Bibcode:2006CPL...418..245L. doi:10.1016/j.cplett.2005.10.135.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Sokhan VP, Jones AP, Cipcigan FS, Crain J, Martyna GJ (2015). "Signature properties of water: Their molecular electronic origins". Proceedings of the National Academy of Sciences. 112 (20): 6341–6346. Bibcode:2015PNAS..112.6341S. doi:10.1073/pnas.1418982112. PMC 4443379. PMID 25941394.
- ^ Cipcigan FS, Sokhan VP, Jones AP, Crain J, Martyna GJ (2015). "Hydrogen bonding and molecular orientation at the liquid–vapour interface of water". Physical Chemistry Chemical Physics. 17 (14): 8660–8669. Bibcode:2015PCCP...17.8660C. doi:10.1039/C4CP05506C. PMID 25715668.
- ^ Mahmoudi, Morteza; Lynch, Iseult; Ejtehadi, Mohammad Reza; Monopoli, Marco P.; Bombelli, Francesca Baldelli; Laurent, Sophie (2011). "Protein−Nanoparticle Interactions: Opportunities and Challenges". Chemical Reviews. 111 (9): 5610–37. doi:10.1021/cr100440g. PMID 21688848.
- ^ Patel, S.; MacKerell, Jr. AD; Brooks III, Charles L (2004). "CHARMM fluctuating charge force field for proteins: II protein/solvent properties from molecular dynamics simulations using a nonadditive electrostatic model". J Comput Chem. 25 (12): 1504–1514. doi:10.1002/jcc.20077. PMID 15224394. S2CID 16741310.
- ^ Hosseini, Atiyeh Najla; Lund, Mikael; Ejtehadi, Mohammad Reza (2022). "Electronic polarization effects on membrane translocation of anti-cancer drugs". Physical Chemistry Chemical Physics. 24 (20): 12281–12292. doi:10.1039/D2CP00056C.
- ^ 이러한 방법의 방법론은 Warshel과 동료들에 의해 도입되었다.최근 몇 년 동안 다음과 같은 여러 그룹이 개척해 왔습니다.Arieh Warshel(남캘리포니아대), Weitao Yang(듀크대), Sharon Hammes-Sheiffer(펜실베이니아주립대), Donald Truhlar and Jiali Gao(미네소타대), Kenneth Merz(플로리다대).
- ^ Billeter, Salomon R.; Webb, Simon P.; Agarwal, Pratul K.; Iordanov, Tzvetelin; Hammes-Schiffer, Sharon (November 2001). "Hydride Transfer in Liver Alcohol Dehydrogenase: Quantum Dynamics, Kinetic Isotope Effects, and Role of Enzyme Motion". Journal of the American Chemical Society. 123 (45): 11262–11272. doi:10.1021/ja011384b. PMID 11697969.
- ^ a b Kmiecik, Sebastian; Gront, Dominik; Kolinski, Michal; Wieteska, Lukasz; Dawid, Aleksandra Elzbieta; Kolinski, Andrzej (22 June 2016). "Coarse-Grained Protein Models and Their Applications". Chemical Reviews. 116 (14): 7898–7936. doi:10.1021/acs.chemrev.6b00163. PMID 27333362.
- ^ Voegler Smith, Anne; Hall, Carol K. (15 August 2001). "?-Helix formation: Discontinuous molecular dynamics on an intermediate-resolution protein model". Proteins: Structure, Function, and Genetics. 44 (3): 344–360. doi:10.1002/prot.1100. PMID 11455608. S2CID 21774752.
- ^ Ding, F; Borreguero, JM; Buldyrey, SV; Stanley, HE; Dokholyan, NV (1 November 2003). "Mechanism for the alpha-helix to beta-hairpin transition". Proteins. 53 (2): 220–8. doi:10.1002/prot.10468. PMID 14517973. S2CID 17254380.
- ^ Paci, Emanuele; Vendruscolo, Michele; Karplus, Martin (December 2002). "Validity of Gō Models: Comparison with a Solvent-Shielded Empirical Energy Decomposition". Biophysical Journal. 83 (6): 3032–3038. Bibcode:2002BpJ....83.3032P. doi:10.1016/S0006-3495(02)75308-3. PMC 1302383. PMID 12496075.
- ^ Chakrabarty, Arnab; Cagin, Tahir (May 2010). "Coarse grain modeling of polyimide copolymers". Polymer. 51 (12): 2786–2794. doi:10.1016/j.polymer.2010.03.060.
- ^ Foley, Thomas T.; Shell, M. Scott; Noid, W. G. (2015-09-02). "The impact of resolution upon entropy and information in coarse-grained models". The Journal of Chemical Physics. 143 (24): 243104. doi:10.1063/1.4929836. ISSN 0021-9606. PMID 26723589.
- ^ Heydari, Tiam; Heidari, Maziar; Mashinchian, Omid; Wojcik, Michal; Xu, Ke; Dalby, Matthew John; Mahmoudi, Morteza; Ejtehadi, Mohammad Reza (2017). "Development of a Virtual Cell Model to Predict Cell Response to Substrate Topography". ACS Nano. 11 (9): 9084–9092. doi:10.1021/acsnano.7b03732. PMID 28742318.
- ^ Leach, Dr Andrew (30 January 2001). Molecular Modelling: Principles and Applications (2nd ed.). Harlow: Prentice Hall. ISBN 9780582382107. ASIN 0582382106.
- ^ Leach, Andrew R. (2001). Molecular modelling : principles and applications (2nd ed.). Harlow, England: Prentice Hall. p. 320. ISBN 0-582-38210-6. OCLC 45008511.
- ^ Allen, Michael P.; Tildesley, Dominic J. (2017-08-22). Computer Simulation of Liquids (2nd ed.). Oxford University Press. p. 216. ISBN 9780198803201. ASIN 0198803206.
- ^ Nienhaus, Gerd Ulrich (2005). Protein-ligand interactions: methods and applications. pp. 54–56. ISBN 978-1-61737-525-5.
- ^ Leszczyński, Jerzy (2005). Computational chemistry: reviews of current trends, Volume 9. pp. 54–56. ISBN 978-981-256-742-0.
- ^ Kumar, Shankar; Rosenberg, John M.; Bouzida, Djamal; Swendsen, Robert H.; Kollman, Peter A. (October 1992). "The weighted histogram analysis method for free-energy calculations on biomolecules. I. The method". Journal of Computational Chemistry. 13 (8): 1011–1021. doi:10.1002/jcc.540130812. S2CID 8571486.
- ^ Bartels, Christian (December 2000). "Analyzing biased Monte Carlo and molecular dynamics simulations". Chemical Physics Letters. 331 (5–6): 446–454. Bibcode:2000CPL...331..446B. doi:10.1016/S0009-2614(00)01215-X.
- ^ Lemkul, Justin A.; Bevan, David R. (4 February 2010). "Assessing the Stability of Alzheimer's Amyloid Protofibrils Using Molecular Dynamics". The Journal of Physical Chemistry B. 114 (4): 1652–1660. doi:10.1021/jp9110794. PMID 20055378.
- ^ Patel, Jagdish Suresh; Berteotti, Anna; Ronsisvalle, Simone; Rocchia, Walter; Cavalli, Andrea (28 January 2014). "Steered Molecular Dynamics Simulations for Studying Protein–Ligand Interaction in Cyclin-Dependent Kinase 5". Journal of Chemical Information and Modeling. 54 (2): 470–480. doi:10.1021/ci4003574. PMID 24437446.
- ^ Gosai, Agnivo; Ma, Xiao; Balasubramanian, Ganesh; Shrotriya, Pranav (22 November 2016). "Electrical Stimulus Controlled Binding/Unbinding of Human Thrombin-Aptamer Complex". Scientific Reports. 6 (1): 37449. Bibcode:2016NatSR...637449G. doi:10.1038/srep37449. PMC 5118750. PMID 27874042.
- ^ Levitt, Michael; Warshel, Arieh (1 February 1975). "Computer simulation of protein folding". Nature. 253 (5494): 694–698. Bibcode:1975Natur.253..694L. doi:10.1038/253694a0. PMID 1167625. S2CID 4211714.
- ^ Warshel, Arieh (April 1976). "Bicycle-pedal model for the first step in the vision process". Nature. 260 (5553): 679–683. Bibcode:1976Natur.260..679W. doi:10.1038/260679a0. PMID 1264239. S2CID 4161081.
- ^ Smith, R., ed. (1997). Atomic & ion collisions in solids and at surfaces: theory, simulation and applications. Cambridge, UK: Cambridge University Press.[페이지 필요]
- ^ Freddolino P, Arkhipov A, Larson SB, McPherson A, Schulten K. "Molecular dynamics simulation of the Satellite Tobacco Mosaic Virus (STMV)". Theoretical and Computational Biophysics Group. University of Illinois at Urbana Champaign.
- ^ Jayachandran, Guha; Vishal, V.; Pande, Vijay S. (28 April 2006). "Using massively parallel simulation and Markovian models to study protein folding: Examining the dynamics of the villin headpiece". The Journal of Chemical Physics. 124 (16): 164902. Bibcode:2006JChPh.124p4902J. doi:10.1063/1.2186317. PMID 16674165.
- ^ a b Lindorff-Larsen, Kresten; Piana, Stefano; Dror, Ron O.; Shaw, David E. (2011). "How Fast-Folding Proteins Fold". Science. 334 (6055): 517–520. Bibcode:2011Sci...334..517L. CiteSeerX 10.1.1.1013.9290. doi:10.1126/science.1208351. PMID 22034434. S2CID 27988268.
- ^ Shaw, David E.; Maragakis, Paul; Lindorff-Larsen, Kresten; Piana, Stefano; Dror, Ron O.; Eastwood, Michael P.; Bank, Joseph A.; Jumper, John M.; Salmon, John K.; et al. (2010). "Atomic-Level Characterization of the Structural Dynamics of Proteins". Science. 330 (6002): 341–346. Bibcode:2010Sci...330..341S. doi:10.1126/science.1187409. PMID 20947758. S2CID 3495023.
- ^ Shi, Yeqi; Szlufarska, Izabela (November 2020). "Wear-induced microstructural evolution of nanocrystalline aluminum and the role of zirconium dopants". Acta Materialia. 200: 432–441. Bibcode:2020AcMat.200..432S. doi:10.1016/j.actamat.2020.09.005. S2CID 224954349.
- ^ Larsen, Peter Mahler; Schmidt, Søren; Schiøtz, Jakob (1 June 2016). "Robust structural identification via polyhedral template matching". Modelling and Simulation in Materials Science and Engineering. 24 (5): 055007. arXiv:1603.05143. Bibcode:2016MSMSE..24e5007M. doi:10.1088/0965-0393/24/5/055007. S2CID 53980652.
- ^ Hoffrogge, Paul W.; Barrales-Mora, Luis A. (February 2017). "Grain-resolved kinetics and rotation during grain growth of nanocrystalline Aluminium by molecular dynamics". Computational Materials Science. 128: 207–222. arXiv:1608.07615. doi:10.1016/j.commatsci.2016.11.027. S2CID 118371554.
- ^ Bonald, Thomas; Charpentier, Bertrand; Galland, Alexis; Hollocou, Alexandre (22 June 2018). "Hierarchical Graph Clustering using Node Pair Sampling". arXiv:1806.01664 [cs.SI].
- ^ John E. Stone, James C. Phillips, Peter L. Freddolino, David J. Hardy 1, Leonardo G. Trabuco, Klaus Schulten (2007). "Accelerating molecular modeling applications with graphics processors". Journal of Computational Chemistry. 28 (16): 2618–2640. CiteSeerX 10.1.1.466.3823. doi:10.1002/jcc.20829. PMID 17894371.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크)
일반 참고 자료
- M. P. Allen, D. J. Tildesley(1989) 액체의 컴퓨터 시뮬레이션.옥스퍼드 대학 출판부ISBN 0-19-855645-4.
- J. A. McCammon, S. C. Harvey(1987) 단백질과 핵산의 역학.케임브리지 대학 출판부ISBN 0-521-30750-3(하드백).
- D. C. Rapport (1996) 분자역학 시뮬레이션의 예술.ISBN 0-521-44561-2.
- M. Griebel; S. Knapek; G. Zumbusch (2007). Numerical Simulation in Molecular Dynamics. Berlin, Heidelberg: Springer. ISBN 978-3-540-68094-9.
- Frenkel, Daan; Smit, Berend (2002) [2001]. Understanding Molecular Simulation : from algorithms to applications. San Diego: Academic Press. ISBN 978-0-12-267351-1.
- J. M. Haile(2001) 분자역학 시뮬레이션: 기본 메서드.ISBN 0-471-18439-X
- R. J. Sadus, 유체 분자 시뮬레이션: 이론, 알고리즘 및 객체 지향, 2002, ISBN 0-444-51082-6
- 오렌 M. 베커, 알렉산더 DMackerell, Jr., Benott Roux, 와타나베 마사카츠(2001) 컴퓨터 생화학 및 생물물리학.마르셀 데커ISBN 0-8247-0455-X
- 앤드류 리치(2001) 분자 모델링: 원칙과 응용(2판) 프렌티스 홀.ISBN 978-0-582-3821-7.
- Tamar Schlick (2002) 분자 모델링 및 시뮬레이션.스프링거.ISBN 0-387-95404-X.
- William Graham Hoover(1991) Elsevier, ISBN 0-444-88192-1.
- D. J. Evans and G. P. Morriss (2008) 비균형 액체의 통계역학, 제2판, 케임브리지 대학 출판부, ISBN 978-0-521-85791-8.
외부 링크
- GPUGRID.net 프로젝트(GPUGRID.net)
- 블루진 프로젝트(IBM) JawBreakers.org
- 재료 모델링 및 컴퓨터 시뮬레이션 코드
- 분자역학에 대한 몇 가지 팁은
- 물의 MD 시뮬레이션 동영상(유튜브)
- 초당 1프레임의 실시간 분자 역학 시뮬레이션













 U
U
![U(r) = 4\varepsilon \left[ \left(\frac{\sigma}{r}\right)^{12} - \left(\frac{\sigma}{r}\right)^{6} \right]](https://wikimedia.org/api/rest_v1/media/math/render/svg/374024e23ac5eb77e91b68ad9ba86ad3bbf5f113)

 빠르지 않게 떨어지는 상호작용입니다.
빠르지 않게 떨어지는 상호작용입니다.  시스템의 차원입니다.예를 들어 이온 간의 전하 상호작용과 분자 간의 쌍극자 쌍극자 상호작용이 포함된다.이러한 힘을 모델링하는 것은 수천 개의 입자의 시뮬레이션을 통해 박스 길이의 절반보다 클 수 있는 거리에 걸쳐 상당한 어려움이 따른다.한 가지 솔루션은 박스 길이의 크기를 크게 늘리는 것이지만 시뮬레이션 비용이 매우 많이 들기 때문에 이 무차별적인 접근 방식은 이상적이지 않습니다.거리가 컷오프
시스템의 차원입니다.예를 들어 이온 간의 전하 상호작용과 분자 간의 쌍극자 쌍극자 상호작용이 포함된다.이러한 힘을 모델링하는 것은 수천 개의 입자의 시뮬레이션을 통해 박스 길이의 절반보다 클 수 있는 거리에 걸쳐 상당한 어려움이 따른다.한 가지 솔루션은 박스 길이의 크기를 크게 늘리는 것이지만 시뮬레이션 비용이 매우 많이 들기 때문에 이 무차별적인 접근 방식은 이상적이지 않습니다.거리가 컷오프 

