활성화 에너지
Activation energy화학과 물리학에서 활성화 에너지는 화합물이 화학 [1]반응을 일으키기 위해 공급되어야 하는 최소한의 에너지 양입니다.반응의 활성화 에너지(Ea)는 몰당 줄(J/mol), 몰당 킬로줄(kJ/mol) 또는 몰당 킬로칼로리(kcal/mol)[2]로 측정된다.활성화 에너지는 초기 및 최종 열역학 상태와 관련된 잠재적 에너지 표면의 최소값을 분리하는 잠재적 장벽(에너지 장벽이라고도 함)의 크기로 생각할 수 있다.화학 반응이 적절한 속도로 진행되기 위해서는 시스템의 온도가 활성화 에너지 이상의 변환 에너지를 가진 상당한 수의 분자가 존재할 정도로 충분히 높아야 합니다.활성화 에너지라는 용어는 1889년 스웨덴의 과학자 스반테 아레니우스에 [3]의해 도입되었다.
기타 용도
덜 일반적으로 사용되긴 하지만 활성화[4] 에너지는 핵 반응 및 기타 다양한 물리적 [5][failed verification][6][7][8]현상에도 적용된다.
온도 의존성과 아레니우스 방정식과의 관계
아레니우스 방정식은 활성화 에너지와 반응이 진행되는 속도 사이의 관계에 대한 정량적 기초를 제공합니다.이 방정식에서 활성화 에너지는 다음 관계를 통해 찾을 수 있습니다.
여기서 A는 반응의 전지수 인자, R은 보편 가스 상수, T는 절대 온도(보통 켈빈 단위), k는 반응 속도 계수이다.A를a 몰라도 반응속도 계수의 변화로부터 온도 함수로서 E를 평가할 수 있다(아레니우스 방정식의 유효성 이내).
보다 고도의 수준에서 아레니우스 방정식의 순 아레니우스 활성화 에너지 항은 온도에 대한 반응 속도의 민감도를 나타내는 실험적으로 결정된 파라미터로 가장 잘 간주된다.이 활성화 에너지를 기초 반응에 대한 역치 장벽과 관련짓는 데는 두 가지 반대 의견이 있다.첫째, 반작용이 한 단계에서 진행되는지 여부가 불분명한 경우가 많다. 모든 기본 단계에 걸쳐 평균화된 임계 장벽은 이론적인 가치가 거의 없다.둘째, 연구 중인 반응이 기초적이더라도, 개별 충돌의 스펙트럼은 많은 다른 반응물 충돌 기하학과 각도, 다른 변환 및 (가능성이 있는) 진동 에너지를 포함한 수십억 개의 분자를 포함하는 벌크('구') 실험에서 얻은 속도 상수에 기여한다. 이 모든 것은 차이를 초래할 수 있다.현미경 반응 속도를 [citation needed]빌리다.
촉매

활성화 에너지를 낮추기 위해 전이 상태를 변화시키는 물질을 촉매라고 하며, 단백질과 (해당하는 경우) 소분자 보조인자로만 구성된 촉매를 효소라고 한다.촉매는 반응 [9]중에 소비되지 않고 반응 속도를 증가시킵니다.또한 촉매는 활성화 에너지를 낮추지만 원래 반응물이나 생성물의 에너지를 변화시키지 않으므로 [10]평형을 변화시키지 않는다.오히려 반응 에너지와 생성 에너지는 동일하게 유지되고 활성화 에너지만 변화(낮음)됩니다.
촉매는 보다 바람직한 전이 상태를 형성함으로써 활성화 에너지를 저감할 수 있다.촉매는 본질적으로 반응 기질이 전이 상태로 진행되는 데 더 "편안한" 적합성을 만듭니다.이는 기판이 촉매의 활성 부위에 결합할 때 발생하는 에너지 방출로 인해 발생할 수 있습니다.이 에너지는 결합 에너지로 알려져 있습니다.촉매에 결합하면 활성 부위 내에서 기판이 수많은 안정화 힘(즉, 수소 결합력, 판데르발스 힘)에 관여합니다.기판이 형성되어 고에너지 전이 상태가 될 때까지 활성 부위 내에서 특이하고 유리한 결합이 발생한다.활성 부위 내에서 양호한 안정화 상호작용이 에너지를 방출하기 때문에 전이 상태를 형성하는 것이 촉매에 더 유리하다.화학반응은 촉매 활성부위 내에 안정화 적합이 있을 때 고에너지 전이상태 분자를 보다 쉽게 제조할 수 있다.반응의 결합 에너지는 기질과 촉매 간의 양호한 상호작용이 발생할 때 방출되는 에너지입니다.방출되는 결합 에너지는 불안정한 전이 상태를 달성하는 데 도움이 됩니다.그렇지 않으면 촉매가 없는 반응은 전환 상태를 달성하기 위해 더 높은 에너지 입력이 필요합니다.비촉매 반응은 촉매 효소 [11]반응과 같은 활성 부위를 안정화시키는 상호작용으로부터 이용 가능한 자유 에너지를 가지고 있지 않다.
깁스 활성화 에너지와의 관계
아레니우스 방정식에서 활성화 에너지(Ea)라는 용어는 전이 상태에 도달하기 위해 필요한 에너지를 설명하기 위해 사용되며 지수 관계 k = A exp(-Ea/RT)가 유지된다.전이 상태 이론에서, 반응 속도와 전이 상태 사이의 관계에 대한 보다 정교한 모델인 표면적으로 유사한 수학적 관계인 Eyring 방정식은 반응 속도를 설명하기 위해 사용됩니다: k = (kTB / h)(EXP-CHG‡ / RT).그러나 Eyring 방정식은 반응 속도의 온도 의존성을 현상학적으로 모델링하는 대신 반응의 개별 기본 단계를 모델링합니다.따라서 다단계 공정의 경우 두 모델 사이에 직접적인 관계가 없습니다.그럼에도 불구하고, 아레니우스와 에링 방정식의 함수 형태는 유사하며, 1단계 공정의 경우, 아레니우스와 에링 매개변수 사이에 간단하고 화학적으로 의미 있는 대응관계를 그릴 수 있다.
Eyring 방정식은 E를 사용하는a 대신 Gibbs 에너지의 개념과 기호 δG를‡ 사용하여 전이 상태를 달성하기 위한 활성화의 Gibbs 에너지를 나타냅니다.식에서 k와B h는 각각 볼츠만과 플랑크 상수이다.방정식은 비슷해 보이지만 깁스 에너지는 엔탈픽 항 외에 엔트로픽 항을 포함하고 있다는 점에 유의해야 합니다.아레니우스 방정식에서, 이 엔트로픽 항은 사전 지수 계수 A에 의해 설명된다.보다 구체적으로, 우리는 활성화의 엔탈피 및 엔트로피의 관점에서 깁스 활성 자유 에너지를 쓸 수 있다: δG‡ = δH‡ - T δS‡.그리고 단분자 1단계 반응에 대해서는 E = δH‡ + RT 및 A = (kTB/h) exp(1 + δS‡/R)의 근사 관계가a 유지된다.그러나 Arrhenius 이론에서 A는 온도에 의존하지 않는 반면, 여기서는 T에 대한 선형 의존이 있다는 점에 유의하십시오.상온에서 반감기가 약 2시간인 1단계 단분자 공정의 경우 δG는‡ 약 23kcal/mol이다.이것은 또한 상온에서 몇 시간 동안 진행되는 반응에 대한 대략적인 E의 크기입니다a.대부분의 반응에 대해 상온에서 TΩS와‡ RT의 크기가 상대적으로 작기 때문에 엉성한 담화에서는 E, δG‡, δH는‡ 종종a 결합되어 "활성화 에너지"로 불린다.
활성화의 엔탈피, 엔트로피 및 깁스 에너지는 각각 δH‡o, δS‡o 및 δG로‡o 보다 정확하게 표기되며, 여기서 o는 표준 [12][13]상태 간에 평가된 양을 나타낸다.그러나 일부 저자는 표기법을 [14][15]단순화하기 위해 o를 생략합니다.
그러나 반응의 총 자유 에너지 변화는 활성화 에너지와 독립적입니다.물리적 및 화학적 반응은 발기성 또는 엔더곤성일 수 있지만 활성화 에너지는 반응의 자발성과 관련이 없습니다.전체적인 반응 에너지 변화는 활성화 에너지에 의해 변경되지 않습니다.
음의 활성화 에너지
온도가 상승하면 반응 속도가 감소하는 경우도 있습니다.환율 상수가 Arrhenius 식에 적합하도록 대략적인 지수 관계를 따를 경우 E의a 음수가 됩니다.
음의 활성화 에너지를 나타내는 기본 반응은 전형적으로 장벽 없는 반응이며, 반응 진행은 잠재적 우물에서 분자의 포획에 의존한다.온도를 높이면 충돌 분자가 서로 포착할 확률이 감소합니다(높은 운동량이 충돌 입자를 잠재적 우물 밖으로 운반하기 때문에 더 많은 반짝임 충돌이 반응으로 이어지지 않음). 이는 온도 상승에 따라 감소하는 반응 단면도로 표현됩니다.이러한 상황은 더 이상 잠재적인 [16]장벽의 높이로 직접적인 해석으로 이어지지 않는다.
일부 다단계 반응은 명백한 음의 활성화 에너지를 가질 수도 있습니다.예를 들어 2단계 반응 A δ B, B → C에 대한 전체 속도 상수 k는 k = kK로21 구한다.여기서2 k는 속도 변화 느린 2단계의 속도 상수, K는1 급속 1단계의 평형 상수이다.일부 반응에서 K는1 k가 증가하는 것보다2 온도와 함께 감소하기 때문에 실제로 k는 음의 관측된 활성화 [17][18][19]에너지에 대응하는 온도와 함께 감소한다.
일례로 산화질소는 + 이다.비율의 은 음의 활성화 [20][21]에너지를 갖는 v [ ] [ {{ v=k , \ left [ { { \ right} , \입니다.이는 에 의해 설명됩니다. O N 2 \ \ \ \ N } 、 2 2 + O \ _ {} + { 2 \ 2。
특정 양이온성 중합반응은 음의 활성화 에너지를 가지므로 온도에 따라 속도가 감소합니다.연쇄 성장 중합 시 전체 활성화 는 + - E \ i}+이다. 여기서 i, p 및 t는 각각 시작, 전파 및 종료 단계를 나타냅니다.전파 단계는 일반적으로 매우 작은 활성화 에너지를 가지므로 종단에 대한 활성화 에너지가 시작보다 클 경우 전체 값이 음수이다.양이온 중합에 대한 전체 활성화 에너지의 정상 범위는 =40 ~ +60 kJ/[22]mol이다.
2D 퍼텐셜 에너지 표면에서의 활성화 에너지
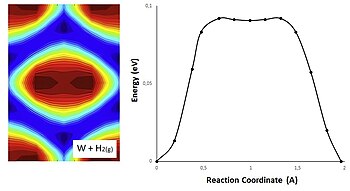
활성화 에너지는 2D PES(Potential Energy Surfaces)로 나타낼 수 있으며, 여기서 반응물질의 기하학적 구조와 관련된 에너지 사이의 관계는 지형도로서 표시됩니다.
다음 그림에서는 기체상의 수소와 금속인 텅스텐의 반응을 나타내고 있습니다.잠재 에너지는 PES 계산을 통해 얻으며, NEB 방법 계산에서 H의 위치와 일치합니다.스플라인법에 의한 2차원 보간법을 사용하여 이들 [23]위치에서의 퍼텐셜 에너지를 평가할 수 있다.생성물과 반응물은 파란색 표면에서 찾을 수 있지만 빨간색 표면은 정상 상태 근사치에 해당합니다.
디픽스는 궤적에 대응합니다.표면이 푸를수록 수소 결합이 강하기 때문에 파란색은 최소 에너지를 나타내고 빨간색은 최대 에너지를 나타냅니다.텅스텐의 PES는 대칭이며, 교량 위치에 침하가 있습니다. 이 침하량은 침하 중앙의 색 변화에 해당합니다.
에너지 최소값 사이의 표면이 푸를수록 에너지 장벽이 낮아지고 따라서 수소가 표면을 따라 더 쉽게 이동합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Activation Energy". www.chem.fsu.edu. Archived from the original on 2016-12-07. Retrieved 2017-01-13.
- ^ Espenson, James (1995). Chemical Kinetics and Reaction Mechanisms. McGraw-Hill. ISBN 0070202605.
- ^ "Activation Energy and the Arrhenius Equation – Introductory Chemistry- 1st Canadian Edition". opentextbc.ca. Archived from the original on 2017-07-08. Retrieved 2018-04-05.
- ^ Kagan, Harris; Barrett, Tom. "Energy in a Modern Society: XIV. Nuclear energy" (Course). Ohio State University. Retrieved 15 October 2021.
- ^ Pratt, Thomas H. "화재와 폭발의 정전 점화" Wiley-AICHE(1997년 7월 15일) 화학 공정 안전 센터
- ^ Wang, Jenqdaw; Raj, Rishi (1990). "Estimate of the Activation Energies for Boundary Diffusion from Rate-Controlled Sintering of Pure Alumina, and Alumina Doped with Zirconia or Titania". Journal of the American Ceramic Society. 73 (5): 1172. doi:10.1111/j.1151-2916.1990.tb05175.x.
- ^ Kiraci, A; Yurtseven, H (2012). "Temperature Dependence of the Raman Frequency, Damping Constant and the Activation Energy of a Soft-Optic Mode in Ferroelectric Barium Titanate". Ferroelectrics. 432: 14–21. doi:10.1080/00150193.2012.707592. S2CID 121142463.
- ^ Terracciano, Anthony C; De Oliveira, Samuel; Vazquez-Molina, Demetrius; Uribe-Romo, Fernando J; Vasu, Subith S; Orlovskaya, Nina (2017). "Effect of catalytically active Ce 0.8 Gd 0.2 O 1.9 coating on the heterogeneous combustion of methane within MgO stabilized ZrO 2 porous ceramics". Combustion and Flame. 180: 32–39. doi:10.1016/j.combustflame.2017.02.019.
- ^ "General Chemistry Online: FAQ: Chemical change: What are some examples of reactions that involve catalysts?". antoine.frostburg.edu. Retrieved 2017-01-13.
- ^ Bui, Matthew. "The Arrhenius Law: Activation Energies". Chemistry LibreTexts. UC Davis. Retrieved February 17, 2017.
- ^ Berg, Jeremy (2019). Biochemistry - Ninth Edition. New York, NY: WH Freeman and Company. pp. 240–244. ISBN 978-1-319-11467-1.
- ^ "Enthalpy of activation". IUPAC Gold Book (2nd edition, on-line version). IUPAC (International Union of Pure and Applied Chemistry). 2019. Retrieved 10 May 2020.
- ^ Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (1999). Chemical Kinetics and Dynamics (2nd ed.). Prentice Hall. p. 301. ISBN 0-13-737123-3.
- ^ Atkins, Peter; de Paula, Julio (2006). Atkins' Physical Chemistry (8th ed.). W.H.Freeman. p. 883. ISBN 0-7167-8759-8.
... but we shall omit the standard state sign to avoid overburdening the notation.
- ^ Laidler, Keith J.; Meiser, John H. (1982). Physical Chemistry. Benjamin/Cummings. p. 381. ISBN 0-8053-5682-7.
- ^ Mozurkewich, Michael; Benson, Sidney (1984). "Negative activation energies and curved Arrhenius plots. 1. Theory of reactions over potential wells". J. Phys. Chem. 88 (25): 6429–6435. doi:10.1021/j150669a073.
- ^ Espenson, James H. (1981). Chemical kinetics and reaction mechanisms. McGraw-Hill. p. 121. ISBN 0-07-019667-2.
- ^ Atkins, Peter; de Paula, Julio (2006). Atkins' Physical Chemistry (8th ed.). W. H. Freeman. p. 822. ISBN 0-7167-8759-8.
- ^ Kadir, Tamara (10 September 2020). "3.2.2: Pre-equilibrium Approximation". Chem Libre Texts. Retrieved 23 January 2022.
The overall activation energy is negative if Ea1 + Ea2 < Ea−1
- ^ Moore, John W.; Pearson, Ralph G. (1981). Kinetics and mechanism (3rd ed.). John Wiley and Sons. p. 316. ISBN 0-471-03558-0.
- ^ Engel, Thomas; Reid, Philip (2006). Physical Chemistry. Pearson. Benjamin-Cummings. p. *34. ISBN 0-8053-3842-X.
- ^ Cowie, J. M. G. (1991). Polymers: Chemistry and Physics of Modern Materials (2nd ed.). Blackie (USA: Chapman & Hall+). p. 88. ISBN 0-216-92980-6.
- ^ Kristinsdóttir, Lilja; Skúlason, Egill (2012-09-01). "A systematic DFT study of hydrogen diffusion on transition metal surfaces". Surface Science. 606 (17): 1400–1404. doi:10.1016/j.susc.2012.04.028. ISSN 0039-6028.





![{\displaystyle v=k\,\left[{\rm {NO}}\right]^{2}\,\left[{\rm {O_{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae77cc1d5a0ef31cc0ac2b83fbb421dcca3d9e68)