신경정신병리학
Neuropsychopharmacology신경심리학(의약품들이 정신에 어떤 영향을 미치는지)과 근본적인 신경과학과 관련된 학제간 과학인 신경심리학은 약물이 행동에 영향을 미치기 위해 작용하는 신경 메커니즘에 대한 연구다. 신경병리학, 약역학(약물 작용), 정신질환, 의식상태 등의 메커니즘 연구가 수반된다. 이러한 연구는 신경전달/수용체 활동, 생물화학 과정, 신경회로를 포함하는 세부적인 수준에서 선동된다. 신경정신병리학은 "어떻게"와 "왜"의 영역에서 정신의학보다 우선하며, 뇌 기능의 다른 문제를 추가로 다룬다. 이에 따라 이 분야의 임상적 측면에는 정신과(정신적)뿐만 아니라 신경학(비정신적) 약리학 기반 치료도 포함된다. 신경정신병리학의 발달은 불안장애, 정서장애, 정신장애, 퇴행성 장애, 식생활행동, 수면행동장애 연구에 직접적인 영향을 미칠 수 있다.
역사
아편, 술, 특정 식물과 같은 약물은 인간이 수 천년 동안 고통을 완화하거나 인식을 바꾸기 위해 사용해 왔지만, 그 물질이 실제로 어떻게 작용하는지에 대한 현대 과학 시대의 지식이 상당히 제한되기 전까지는 대부분의 약리학적 지식은 일관성 있는 모델이라기보다는 관찰의 연속이다. 20세기 전반에는 환자에게서 관찰된 행동이나 주제가 유아기 경험, 유전적 경향, 특정 뇌 영역의 부상과 같은 제한된 다양한 요인과 상관관계가 있을 수 있다는 점에서 심리학과 정신의학을 크게 현상학적으로 보았다. 정신적 기능과 기능 장애의 모델은 그러한 관찰에 근거했다. 실제로 심리학의 행동학과는 대부분의 정신적 기능 장애를 "소프트웨어" 오류라고 부를 수 있는 것으로 간주하면서 실제로 뇌 내부에서 일어난 일에 대해 완전히 분개했다. 같은 시대에는 신경계가 미미하고 화학적인 수준에서 점진적으로 연구되고 있었지만, 임상 분야와의 상호 이익은 사실상 없었다. 제2차 세계대전 이후의 여러 발전이 그들을 하나로 모으기 시작하기 전까지는 말이다. 신경정신병리학은 우울증이나 정신분열증 같은 정신질환에 대한 임상적 특수성을 어느 정도 보여준 MAO 억제제, 삼주기 항우울제, 토라진, 리튬 등의 약물이 발견되면서 1950년대 초에 시작된 것으로 볼 수 있다.[1] 그때까지만 해도 이런 복잡한 병을 실제로 대상으로 삼은 치료법은 사실상 존재하지 않았다. 뇌회로와 신경전달물질 수치에 직접적인 영향을 미칠 수 있는 두드러진 방법은 전두엽절제술과 전기충격요법이었는데, 그 중 후자는 근육 이완제 없이 시행되었고, 두 가지 모두 종종 환자의 신체적, 정신적 큰 부상을 초래했다.
현재 신경정신건강의학으로 알려진 이 분야는 정신과 의학의 핵심에서 만났던 많은 고립된 분야들이 성장하고 확장되면서 생겨났으며, 정신과 의사에서 유전학과 화학에 관한 연구자까지 폭넓은 전문직 종사자들이 종사하고 있다. 이 용어의 사용은 1990년 이후 헝가리 신경정신병리학대학과 같은 여러 학술지와 기관이 설립되면서 인기를 얻었다.[1] 연구 가설들이 종종 새로운 정보에 기초하여 재구성되기 때문에, 이 급속하게 성숙된 분야는 어느 정도 유동성을 보여준다.
개요
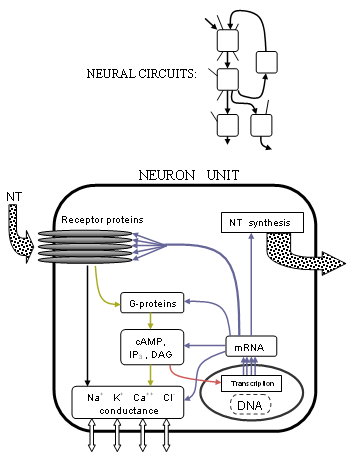
심리학적 측면에 관한 신경정신질환학에서 암묵적인 전제는 정상 및 약물에 의한 변화상태, 정신 또는 인지장애를 포함한 모든 정신상태는 근본적 수준에서 신경화학적 기초를 가지며, 중추신경계에서는 특정 회로경로를 보다 높게 갖는다는 것이다. 수평을 유지한다(참조항: 뉴런 교리) 따라서 뇌의 신경세포나 신경세포에 대한 이해는 마음을 이해하는 데 중심이 된다. 동물 피사체의 유전자 조작, 기능성 자기공명영상(fMRI) 등 영상기법, 살아있는 조직 배양에 대한 선택적 결합제를 이용한 체외 연구 등 현대 임상 및 연구 방법을 통해 관련 메커니즘을 규명할 수 있다는 판단이다. 이를 통해 다양한 시험 조건에 반응하여 신경 활동을 모니터링하고 측정할 수 있다. 그 밖의 중요한 관찰 도구로는 양전자 방출 단층 촬영(PET)과 같은 방사선 이미징과[2] 단일 광전자 방출 컴퓨터 단층 촬영(SPECT)이 있다. 이러한 영상 기술은 매우 민감하며 도파민용 가외 D 수용체를1 통해 발견되는 것과 같은 10−10 M의 순서로 미세한 분자 농도를 상상할 수 있다.
궁극적인 목표 중 하나는 다양한 신경병학적 조건과 정신 질환에 대한 치료 처방을 고안하고 개발하는 것이다. 그러나 더 심오하게는, 그러나, 습득한 지식은 인간의 사고의 본질, 학습과 기억과 같은 정신적 능력, 그리고 어쩌면 의식 그 자체에 대한 통찰력을 제공할 수도 있다. 신경심리학 연구의 직접적인 산물은 신경전달물질 시스템 내에서 매우 특정한 수용체에 작용하는 약물을 개발하는 데 필요한 지식 기반이다. 이러한 "초선택적 작용" 약물은 관련 신경 활동의 특정 부위를 직접 대상으로 할 수 있으므로 임상 대상 내에서 약물의 효능(또는 기술적으로 효력)을 극대화하고 부작용을 최소화할 수 있다. 그러나 어느 정도의 약리학적 난잡은 어느 정도 참을 만하고 심지어 바람직한 경우도 있는데, 이는 보다 선별적인 대리인이 할 수 있는 것보다 더 바람직한 결과를 낳는다. 그 예로는 세로토닌 재흡수 억제제로서 특별히 선택적이지 않고 세로토닌 조절 활성도가 유의하지만, 중단 증상 감소(그리고 재발 가능성 감소)와 성기능 장애 발생률을 크게 감소시켜 항우울제의 손실 없이 나타난 약물인 보르티오엑세틴이 있다.본질적인 효능
현재 차세대 약리학적 치료를 위한 기초가 마련되고 있는데, 이를 통해 효율성이 높아져 삶의 질이 향상될 것이다. 예를 들어, 이전의 생각과는 달리, 성인의 뇌는 어느 정도 새로운 뉴런을 성장시키는 것으로 알려져 있다. 즉, 신경퇴행성 요인에 더하여, 알츠하이머, 파킨슨병, ALS, 그리고 안무의 종류와 같은 신경퇴행성 질환에 대한 희망을 가질 수 있다. 신경전달에 관련된 모든 단백질은 뇌에 있는 10만개 이상의 단백질 중 극히 일부분이다. 따라서 신호 전달의 직접적인 경로에도 없는 많은 단백질들이 존재하며, 그 중 어떤 단백질도 여전히 특정 치료의 대상이 될 수 있다. 현재 질병이나 질환에 대한 새로운 약리학적 접근법은 거의 일주일에 한 가지 비율로 보고되고 있다.[3]
신경전달
우리가 아는 한, 우리가 인지하고 느끼고 생각하고 알고 하는 모든 것은 뉴런들이 발포하고 재설정한 결과물이다. 뇌의 세포가 발화할 때, 작용전위라고 불리는 작은 화학적, 전기적 그네는 신경전달이라고 불리는 과정에서 수천 개의 다른 뉴런들의 발화에 영향을 줄 수 있다. 이러한 방식으로 신호가 생성되고 뉴런 네트워크를 통해 전달되며, EEG 장치로 두피에 대한 대량 전기적 영향을 직접 측정할 수 있다.
20세기 마지막 10년이 되자 신경전달의 모든 중심적 특징에 대한 필수적인 지식이 얻어졌다.[4] 이러한 기능은 다음과 같다.
최근의 발전은 유기 분자 수준의 이해를 포함한다; 내생 리간드, 효소, 수용체 단백질 등의 생화학 작용. 세포 발화에 영향을 미치는 결정적인 변화는 리간드로 작용하는 한 뉴런에서 신호 전달되는 신경전달물질이 다른 뉴런의 수용체와 결합할 때 발생한다. 많은 신경전달물질 시스템과 수용체가 잘 알려져 있으며, 많은 수의 매우 구체적인 수용체 하위 유형의 식별과 특성화를 위한 연구가 계속되고 있다. 6개 이상의 중요한 신경전달물질인 글루, GABA, Ach, NE, DA 및 5HT(신경전달물질 목록)의 경우 최소 29개의 주요 수용체 아형이 있다. 추가 "하위형"은 변종과 함께 존재하며, 이 6개의 송신기에 대해서만 합계가 수백이다. - (예를 들어 세로토닌 수용체 참조) 수용체 아형이 차별화된 기능을 갖고 있다는 사실이 종종 발견되는데, 이는 원칙적으로 뇌 기능에 대한 정제된 의도적 통제 가능성을 열어준다.
이전에는 신경 세포의 막 전압이나 전위, 즉 세포의 발화에 대한 궁극적인 제어는 이온 K+, Na+, Ca를++ 통해 막 전류를 제어하는 투과성 이온 채널과 Mg와++ Cl이− 존재한다고 알려져 있었다. 세포 내부와 외부의 농도 차이가 막 전압을 결정한다.
정확히 어떻게 이러한 전류를 제어하는가는 수용체 구조와 G-단백질 결합 과정의 진보와 함께 훨씬 더 명확해졌다. 많은 수용체들은 5개의 투과성 단백질(필수적으로 동일한 것은 아님) 또는 수용체 서브유닛으로 이루어진 5개의 미국 성단으로 각각 많은 아미노산의 체인으로 발견된다. 전송기는 전형적으로 세포막에서 튀어나온 부분들, 이 두 단백질 사이의 접합점에서 결합한다. 수용체가 이온성형일 경우 단백질 가운데 있는 중심공극이나 채널이 기계적으로 움직여 특정 이온이 흐를 수 있도록 함으로써 이온 농도 차이를 변화시킨다. 수용체가 메타보틱성 유형이라면 G단백질은 세포 내부에서 신진대사를 일으켜 결국 다른 이온 채널을 바꿀 수 있다. 연구자들은 단백질 구조 형태와 화학적 특성에 기초하여 이러한 변화가 어떻게 발생하는지 더 정확하게 이해할 수 있다.
이 활동의 범위는 유전자 전사의 기초가 되는 메커니즘의 명확화 이후 바로 그 삶의 청사진까지 더욱 확대되어 왔다. 핵 DNA에서 나오는 세포 단백질의 합성은 모든 세포에 대해 동일한 기본 기계를[5] 가지고 있다; 비록 3만 5천 개로 추정되는 유전자의 많은 수가 확인되어야 하지만, 인간 DNA 서열을 전부 열거한 인간 게놈 프로젝트 덕분에 그것의 탐사는 이제 확고한 기반을 가지고 있다. 완전한 신경전달 과정은 유전적 수준까지 확장된다. 유전자 발현이 타입 II RNA 중합효소를 통해 단백질 구조를 결정한다. 그래서 신경전달물질, 수용체, 이온채널을 합성하거나 분해하는 효소는 각각 각각의 유전자나 유전자의 DNA 전사를 통해 mRNA로 만들어진다. 그러나 신경전달은 메타보틱스 공정을 통해 직접 또는 다른 방법으로 이온 채널을 제어하는 것 외에도 실제로 유전자 발현을 조절한다. 이는 수용체 활동에서 생성된 다양한 전사 인자에 의한 전사 개시 과정의 수정을 통해 가장 두드러지게 달성된다.
유전자 발현 경로의 중요한 약리학적 가능성 외에도, 유전자와 그 단백질의 대응은 유전자 녹아웃의 중요한 분석 도구를 가능하게 한다. 살아있는 표본은 특정 유전자가 발현될 수 없는 호몰로 재조합을 이용해 만들 수 있다. 그러면 그 유기체는 특정한 수용체일 수 있는 관련 단백질이 결핍될 것이다. 이 방법은 화학적 봉쇄를 방지하여 혼란스럽거나 모호한 2차 효과를 발생시켜 수용체 부족의 영향을 보다 순수한 의미로 연구할 수 있다.
마약
많은 종류의 약물의 시작은 원칙적으로 간단하다: 표적 단백질의 작용을 강화하거나 감소시킬 수 있는 모든 화학 물질은 그러한 사용을 위해 추가적으로 연구될 수 있다. 수용체별(cf) 그런 화학물질을 찾는 것이 요령이다. "약물을 복용하는 것") 및 안전함. 2005년 의사 탁상 참고문헌에는 1990년 버전의 처방약보다 두 배 많은 수의 약품이 수록되어 있다.[6] 현재 많은 사람들은 현대 의약품의 모범을 보이는 "선택적 세로토닌 재흡수 억제제" 즉 SSRI에 익숙하다. 팍실이나 프로작과 같은 이러한 SSRI 항우울제는 선택적으로, 따라서 시냅스의 활동을 연장시키는 세로토닌의 이동을 주로 억제한다. 선택약에는 수많은 범주가 있으며, 운송차단은 단지 하나의 행동방식에 불과하다. FDA는 NE reuptake 억제제 항우울제, DA blocker 항정신병 약물, GABA 작용제 신경안정제(벤조디아제핀) 등 주요 신경전달물질 각각에 선택적으로 작용하는 약물을 승인했다.
새로운 내생성 화학물질이 지속적으로 확인된다. 내생성 전송기 아난다미드 및 GHB와 [7]함께 약물 THC(카나비스)와 GHB에 대한 특정 수용체가 발견되었다. 또 다른 최근의 주요 발견은 1999년에 오레신 즉, 하이포크레틴 수용체의 부족이 기면증의 상태를 반영하기 때문에 흥분에서 역할을 하는 것으로 밝혀졌을 때 일어났다. 오레신 작용은 이미 1년 전에만 사용되었던 약물모다피닐의 항염화 작용을 설명할 수 있다.
주요 제약사들이 현재 개발에 공을 들이고 있는 다음 단계는 수용체 아형 특화 약품 등 특정 약품이다. GABAA(α2) 작용제, CRF1 길항제, 5HT2c 길항제를 기반으로 한 더 나은 항불안제(항염제) 추진이 대표적이다.[8] 또 다른 것은 글리신 리웁타케 억제제 같은 항정신병 약물들에 대한 새로운 탐색 경로 제안이다.[9] 수용체 특정 약물에 대한 기능이 존재하지만 약물 치료의 단점은 해부학적 특이성을 제공할 수 있는 능력이 부족하다는 것이다. 뇌의 한 부분에서 수용체 기능을 변화시킴으로써 같은 종류의 수용체 변화로 뇌의 다른 부분에서 비정상적인 활동을 유도할 수 있다. 흔히2 볼 수 있는 예가 정신분열증에는 도움이 되지만 운동피질에 작용해 다양한 이상기증을 일으키는 D변환제(신경절제)의 효과다.
현대 연구는 세포사멸(프로그램화된 세포사멸)과 자유방사선파괴와 같은 신경계 손상 메커니즘의 세부 사항을 밝혀내고 있다. 페실리딘은 선조체 살상세포에서 세포사멸을 일으키고 해마 등 뉴런에서 비정상적인 vacuolization을 일으키는 것으로 밝혀졌다. 후기 심리 인식 장애로도 알려진 환각제 지속 인식 장애(HPPD)는 LSD 사용 후 무려 26년이 지난 지금까지 환자에게서 관찰된 바 있다. HPPD의 타당한 원인은 시각 경로에 있는 억제 GABA 회로의 손상이다(미다졸람과 같은 GABA 작용제는 LSD 중독의 일부 영향을 감소시킬 수 있다). 이 손상은 5HT2 내부 동맥류의 흥분성 반응의 결과일 수 있다. [주: 대부분의 LSD 사용자는 HPPD를 경험하지 않는다. 그것의 발명은 약물 사용 자체와 마찬가지로 개별 뇌 화학에 의존할 수 있다.] MDMA의 경우, 5HT와 SERT의 지속적인 손실을 제외하고, 세로토닌 축과 단자의 장기적 감소가 단기간 사용에서 발견되며, 역행은 기능이 저하될 수 있다.
신경 회로
뇌의 많은 기능들이 운동과 언어 능력과 같은 관련 영역에 다소 국부적이라는 것은 그다지 최근의 발견이 아니다. 뇌 해부학의 기능적 연관성은 이제 신경 신호 전달의 지식을 완성하면서 수용체 작용의 임상적, 행동적, 유전적 상관관계로 보완되고 있다(또한: 인간 코냑 프로젝트). 뉴런의 신호 경로는 세포 척도를 넘어 종종 복잡한 신경 회로 경로로 지나치게 조직되어 있다. 이러한 경로에 대한 지식은 아마도 해석하기 가장 쉬우며, 시스템 분석의 관점에서 가장 인지도가 높으며, 다음과 같은 요약에서 볼 수 있다.
남용 가능성이 알려진 거의 모든 약물이 중뇌의 복측 테그먼트 영역을 해마, 내측전전뇌피질, 전뇌의 편도체와 더불어 복측스트롤라투의 핵도 포함, 연결시키는 중임브릭 도파민 계통의 활성(직접 또는 간접)을 조절하는 것으로 밝혀졌다.기초 갱단의 [2]m 특히 해마의 경험적 기억력, 편도체의 감정, PFC의 문맥적 정보를 통합하여 특정 자극이나 행동을 즐거움과 보상의 느낌과 연관시키는 데 도움을 주는 핵(NAC)은 중요한 역할을 한다; 중독성에 의한 이 보상 지표 시스템의 지속적인 활성화. 약물은 또한 이전에 중립적이었던 자극들이 뇌가 보상을 받으려고 하는 단서로 암호화되게 할 수 있다. 이것은 행복감과 쾌락의 감정을 담당하는 신경전달물질인 도파민의 선택적 방출을 통해 일어난다. 도파민성 약물의 사용은 중생방 전체에서 방출되는 도파민의 양을 변화시키고, 이 약을 규칙적으로 또는 과도하게 사용하면 개인이 그 약물을 섭취하는 것을 멈춘 후에도 도파민 신호의 장기적 하향 조절을 초래할 수 있다.[3] 이것은 뇌가 도파민의 증가된 존재와 행복감에 동반되는 감정을 규칙적으로 기대하기 시작함에 따라 개인은 온화하고 극단적인 약물추구 행위를 하게 할 수 있지만, 이것이 얼마나 문제가 되는지는 약물과 상황에 따라 크게 좌우된다.
특정 환각성 약물의 중심 메커니즘에 상당한 진전이 있었다. 현 시점에서 "클래식 환각제"라고도 불리는 광범위한 약리학적 환각제 집단의 일차적인 공유 효과는 크게 세로토닌 수용체의 작용에 기인할 수 있다는 것은 비교적 확실하게 알려져 있다. 동시에 궤적coeruleus한 감각적 정보에 있는 사이키델릭 한 활동에 가장 중요한 수용체 보이는 건5HT2A 수용체, 대부분의 환각 제지의 중요한 목표지만 hallucinogenesis에서 뚜렷한 역할을 맡고 있는5HT2C 수용체,, 이마 피질에서 글루타민산을 발표하면서 관련되어 있다. 그리고 자발적 활동은 감소한다. 5HT2A 활동은 순 프로-도파민성 효과를 가진다. 반면에 5HT2C 수용체 작용은 특히 전두엽 피질에서 도파민성 활동에 억제 효과를 가진다. 한 가설은 전두피질에서 5HT가2A 5HT1 수용체를 통해 세로토닌 자체에 의해 적대적인 과정인 후기 비동기 흥분성 후 전위를 촉진한다는 것을 암시하는데, 이것이 SSRIs와 다른 세로토닌에 영향을 주는 약물이 통상적으로 환각을 일으키지 않는 이유를 설명할 수 있을 것이다. 그러나 많은 고전적인 정신 분열증이 실제로 5HT1 수용체에 상당한 친화력을 가지고 있다는 사실은 이러한 주장을 의심케 한다. 설치류에서 고전적인 사이키델릭 활동을 평가하는 데 사용되는 시험인 머리 경련 반응은 오직 베타 아르레스틴이 존재하는 곳에서 세로토닌 자체에 의해 생성되지만 베타 아르레스틴 모집과는 무관한 고전적인 사이키델릭에 의해 촉발된다.[4] 이것은 세로토닌 신경전달의 약리학(SSRI와 같은 약물에 의해 촉진되더라도)과 고전적인 정신감응증의 약리학과의 차이를 더 잘 설명할 수 있을 것이다. 그러나, 새로운 발견은 고전적인 정신 분열증 활동에도 5HT-mGlu22A 이질결합기에 결합하는 것이 필요하다는 것을 보여준다.[5][6][7] 이것 역시 둘 사이의 약리학적 차이와 관련이 있을 수 있다. 환각제 연구 초기에는 이러한 환각들이 정신병에 의해 생성된 환각과 비교가 된다고 가정하여 고전적인 환각제가 정신병의 본보기가 될 수 있다고 가정했지만, 이때부터 현대적인 신경정신병학 지식은 상당히 진전되어 왔으며, 또한 정신병에 대한 지식도 크게 진전되어 왔음을 유념하는 것이 중요하다. 우리는 이제 정신병이 "정신병"의 표면적 유사성 외에도 메커니즘, 보고된 경험 또는 대부분의 다른 측면에서 고전적인 정신감응증의 영향과 거의 유사성을 보이지 않는다는 것을 안다.
순환 리듬(Circadian rhything, 즉 수면/웨이크 사이클링)은 시상하부 내에 있는 초거대성핵(SCN)을 중심으로 하며, 수면 중 멜라토닌 수치가 낮보다 2000~4,000% 높게 표시된다. 회로는 눈 속의 멜라노신 세포에서 시작하여 저체온성 신경세포의 글루탐산성 뉴런을 통해 SCN을 자극하는 것으로 알려져 있다. SCN에서 나오는 GABAERGIC 뉴런은 교감섬유를 통해 상경부경추강관(SCG)을 신호하는 심실핵을 억제한다. SCG의 출력은 N-acetyl transferase를 생성하는 소나무샘의 NE 수용체(β)를 자극하여 세로토닌으로부터 멜라토닌의 생성을 일으킨다. 그러면 SCN의 억제 멜라토닌 수용체는 양성 피드백 경로를 제공한다. 따라서 빛은 SCN 활동의 24시간 주기를 "입력"하는 멜라토닌의 생산을 억제한다.[10][11] SCN은 또한 뇌의 다른 부분으로부터 신호를 수신하며, 그것의 (대략) 24시간 주기는 빛 패턴에만 의존하지 않는다. 실제로, SCN의 분할된 조직은 여러 날 동안 체외에서 매일 순환을 보일 것이다. 또한 (도표에 표시되지 않음) 기저핵은 전방 시상하부(PAH)에 GABA-ergic 억제 입력을 제공한다. 하루 종일 ATP의 신진대사로 아데노신이 쌓이면 아데노신 수용체와 결합해 기저핵을 억제한다. 그런 다음 PAH가 활성화되어 저파수면 활동을 생성한다. 카페인은 아데노신 수용체를 차단하는 것으로 알려져 있어 무엇보다 수면을 억제한다.
리서치
신경정신병리학 분야의 연구는 광범위한 목표를 포괄한다. 여기에는 잠재적으로 유익한 인지적 또는 행동적 영향을 위한 새로운 화학적 화합물 연구 또는 세포 및 신경 회로 수준에서 작용 메커니즘을 더 잘 이해하기 위한 오래된 화학적 화합물 연구가 포함될 수 있다. 예를 들어, 중독성 흥분제 코카인은 뇌의 보상체계에 작용하여 도파민과 노르에피네프린 수치를 증가시키고 짧은 시간 동안 행복감을 유발하는 것으로 알려져 왔다. 그러나 더 최근에 발표된 연구들은 회로 수준보다 더 깊이 들어갔으며 A2AR-D2R-Sigma1R이라고 불리는 특정 G-단백 결합 수용체 복합체가 코카인 사용 후 NAc에서 형성된다는 것을 발견했다; 이 복합체는 중음부 경로에서 D2R 신호를 감소시키고 코카인 중독에 기여하는 요인이 될 수 있다.[8] 다른 첨단 연구들은 약물에 대한 개인의 특정한 반응이나 반응 정도 또는 미래에 중독이 생기는 경향을 예측할 수 있는 특정 생체지표를 식별하기 위해 유전학에 초점을 맞추었다.[9] 이러한 발견은 약물 사용에 관련된 신경 회로에 대한 상세한 통찰력을 제공하고 오래된 것을 정제하는 것은 물론 장애나 중독에 대한 새로운 치료 방법을 개발하는 데 도움을 주기 때문에 중요하다. 다른 치료 관련 연구들은 파킨슨병과 정신분열증을[10] 치료하는 데 펩타이드 핵산이 잠재적인 역할을 하고 있는 반면 다른 연구들은 이전에 알려지지 않았던 신경 상관관계를 특정 현상의 기저에 구축하려고 시도하고 있다.[11]
신경정신병리학에 대한 연구는 신경과학과 임상연구의 광범위한 활동에서 나온다. 이는 미국 신경정신병리학대학(ACNP), 유럽 신경정신병리학대학(ECNP), 콜레기움 국제신경정신병리학(CINP)과 같은 기관이 집중의 척도로 설립되도록 동기를 부여했다. ECNP는 유럽 신경정신병학(European Neurosychopharmacology)을 발행하고 있으며, 리드 엘스비에 그룹의 일부로서 ACNP는 신경정신병학(Neurosychopharmacology) 저널을 발행하고, CINP는 케임브리지대 프레스와 함께 국제 신경정신병학 저널을 발행한다. 2002년, ACNP의 최근 포괄적인 수집 작업, "Neuropsychopharmacology: '진보의 5세대'가 편찬되었다. 그것은 2002년의 지식 상태를 측정하는 척도 중 하나이며, 뇌의 작용을 지배하는 기본적인 신경생물학적 원리를 확립하려는 세기적 목표의 이정표를 나타낸다고 할 수 있다.
많은 다른 저널들이 신경과학과 같은 관련 정보를 포함하고 있다. 그들 중 일부는 브라운 대학 도서관에 등록되어 있다.
참고 항목
메모들
- ^ López-Muñoz, F.; Alamo, C. (2009). "Monoaminergic neurotransmission: the history of the discovery of antidepressants from 1950s until today". Current Pharmaceutical Design. 15 (14): 1563–1586. doi:10.2174/138161209788168001. PMID 19442174. S2CID 68586.
- ^ 피어스, R. C. & 쿠마레산, V. (2006) 중수임브 도파민 시스템: 남용 약물의 강화 효과를 위한 마지막 공통 경로? 신경과학 & 생물행동학 리뷰, 30(2), 215–238. doi:10.1016/j.neubiorev.2005.04.016
- ^ 바리, A, 디사레, J, 바바얀, D, 런시, M, 스파크스, H, & 윌슨, B. (2018) 인간 대상 물질 중독에 대한 신경 조절: 리뷰. 신경과학 & 생물행동학 리뷰,95, 33–43. doi:10.1016/j.neubiorev.2018.09.013
- ^ Schmid, C. L.; Raehal, K. M.; Bohn, L. M. (2008-01-14). "Agonist-directed signaling of the serotonin 2A receptor depends on -arrestin-2 interactions in vivo". Proceedings of the National Academy of Sciences. 105 (3): 1079–1084. doi:10.1073/pnas.0708862105. ISSN 0027-8424. PMC 2242710. PMID 18195357.
- ^ González-Maeso, Javier; Benson, Deanna L.; Meana, J. Javier; López-Giménez, Juan F.; Sealfon, Stuart C.; Milligan, Graeme; Neve, Rachael L.; Callado, Luis F.; Seto, Jeremy (2012-12-28). "Identification of Three Residues Essential for 5-Hydroxytryptamine 2A-Metabotropic Glutamate 2 (5-HT2A·mGlu2) Receptor Heteromerization and Its Psychoactive Behavioral Function". Journal of Biological Chemistry. 287 (53): 44301–44319. doi:10.1074/jbc.M112.413161. ISSN 0021-9258. PMC 3531745. PMID 23129762.
- ^ Sealfon, Stuart C.; Meana, J. Javier; Filizola, Marta; Gingrich, Jay A.; Milligan, Graeme; Callado, Luis F.; Yuuya Okawa; Zhou, Mingming; López-Giménez, Juan F. (March 2008). "Identification of a serotonin/glutamate receptor complex implicated in psychosis". Nature. 452 (7183): 93–97. doi:10.1038/nature06612. ISSN 1476-4687. PMC 2743172. PMID 18297054.
- ^ Moreno, José L.; Holloway, Terrell; Albizu, Laura; Sealfon, Stuart C.; González-Maeso, Javier (2011-04-15). "Metabotropic glutamate mGlu2 receptor is necessary for the pharmacological and behavioral effects induced by hallucinogenic 5-HT2A receptor agonists". Neuroscience Letters. 493 (3): 76–79. doi:10.1016/j.neulet.2011.01.046. ISSN 0304-3940. PMC 3064746. PMID 21276828.
- ^ 보로토에스쿠엘라, D. O., 와이드라, K., 필리핀, M. & Fuxe, K. (2018) 코카인 보상 및 중독에서 A2AR-D2R 헤테로수용체 복합체. 약리학의 경향. doi:10.1016/j.2018.10.007
- ^ 곽오, L. E., 비켈, W. K., & 골드만, D. (2018) 중독 바이오마커: 중독을 이해하기 위한 차원 접근법. 분자의학의 동향, 24(2), 121–128. doi:10.1016/j.molmed.2017.12.007
- ^ 신경심리학 연구실: 엘리엇 리첼슨 – Current Projects. (2013, 5월 23일). https://www.mayo.edu/research/labs/neuropsychopharmacology/projects에서 검색됨
- ^ 연구 프로젝트. (n.d.) http://caliparilab.com/research-projects/에서 검색됨
참조
- ("4세대" 및 "5세대" 참조) ACNP, 링크 참조)
- ^"HCNP의 역사: 정보 교환 및 개선 진행", ECNP 뉴스레터, N7 (2004)
- ^ Fujita, M., Innis, R. B., "Inbo Molecular Imaging: Ligand Development and Research Applications", (5세대) 프로그).
- ^ Tallman, J. F. "뉴 밀레니엄의 신경세포학: 신산업 방향" 신경심리학 20 (1999년)
- ^ 블룸, F. E, "전임상 신경정신병리학 입문", (4세대) 프로그).
- ^ 왓슨, S. J.와 컬리넌, W. E. "사이토리와 회로", (4세대) 프로그).
- ^ 의사 탁상 참조, 1990, 2005
- ^ 에로위드, "γ-hydroxybutyrate (GHB)의 신경세포학" (2004)
- ^ Tallman, J. F., Casseella, J., Kehne, J., "불안증 치료제의 작용 메커니즘", (5세대) 프로그).
- ^ Depoortere, R, 등, "글리신 트랜스포터-1 SSR504734, 잠재적인 새로운 유형의 항정신병 약물인 선택적 억제제의 뉴로케미컬, 전기생리학 및 약리학 프로파일", 신경정신병리학 30, pp1963–1985, (2005)
- ^ 아브라함, H.D., 맥캔, U.D., 리카우르테, G. A., "정신병 약물", (5세대) 프로그).
- ^ 콜웰, C. S. "서커스 리듬", (4세대) 프로그).
- ^ 르위, A. J. "서커스 위상 수면 및 기분 장애", (5세대) 프로그).
외부 링크
- ACNP 리소스
- 조직
- Collegium Internationale Neuro-sychopharmacologicalum 신경정신병리학 전문 글로벌 조직
- 유럽 신경정신병리학 대학
- 저널스
- 신경정신병리학 저널 – 미국 신경정신병리학 대학 공식 간행물
- 유럽 신경정신병리학 – An Esthervier 저널
- 국제 신경심리학 저널 - 케임브리지 대학교 출판물
- 아이보르 에베네저(2015년), 존 와일리 & 선스, 영국 치체스터, ISBN 978-1-118-38565-4의 신경심리학 및 치료법