비계단백질
Scaffold protein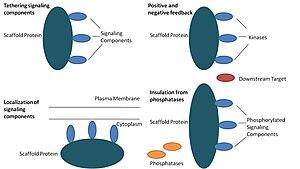
생물학에서, 골격 단백질은 많은 주요 신호 전달 경로의 중요한 조절제이다.스캐폴드는 기능적으로 엄격히 정의되지 않지만 신호 전달 경로의 여러 구성원과 상호 작용 및/또는 결합하여 복합체로 묶는 것으로 알려져 있다.이러한 경로에서, 그들은 신호 전달을 조절하고 혈장막, 세포질, 핵, 골지, 엔도솜, 그리고 미토콘드리아와 같은 세포의 특정 영역에 경로 구성요소를 위치시키는 것을 돕는다.
역사
최초로 발견된 시그널링 골격 단백질은 사카로미세스 세레비시아이 효모에서 나온 Ste5 단백질이었다.Ste5의 세 가지 도메인은 단백질 키나아제 Ste11, Ste7, Fus3와 결합하여 다중키나아제 [2]복합체를 형성하는 것으로 나타났다.
기능.
발판 단백질은 적어도 네 가지 방법으로 작용한다: 신호 성분을 테더링하고, 이러한 성분을 세포의 특정 영역에 위치시키고, 양성 및 음성 피드백 신호를 조정함으로써 신호 전달을 조절하고, 그리고 경쟁 [1]단백질로부터 올바른 신호 단백질을 절연한다.
테더링 시그널링 컴포넌트
이 특별한 기능은 비계의 가장 기본적인 기능으로 간주됩니다.스캐폴드는 캐스케이드의 신호 구성요소를 복합체로 조립합니다.본 어셈블리는 시그널링 단백질 간의 불필요한 상호작용을 방지함으로써 시그널링 특이성을 높이고, 비계 복합체 내 성분의 근접성과 유효 농도를 높여 시그널링 효율을 높일 수 있다.스캐폴드가 특이성을 높이는 방법의 일반적인 예는 단백질 키나제와 그 기질을 결합하는 스캐폴드이며, 이에 따라 특정 키나제 인산화효소가 보장된다.또한 일부 시그널링 단백질은 활성화를 위해 여러 상호작용을 필요로 하며, 발판 테더링은 이러한 상호작용을 여러 수정을 [3][4]초래하는 하나의 상호작용으로 변환할 수 있다.스캐폴드는 또한 시그널링 단백질과의 상호작용이 이러한 시그널링 [5]성분의 알로스테릭 변화를 초래할 수 있기 때문에 촉매가 될 수 있다.이러한 변화는 이러한 시그널링 단백질의 활성화를 강화하거나 억제할 수 있다.예를 들어 마이트젠 활성화 단백질 키나제(MAPK) 경로의 Ste5 골격이다.Ste5는 MAPKK Ste7에 [6]의한 활성화를 위해 이 특정 키나제를 촉매적으로 해제함으로써 Fus3 MAPK를 통해 짝짓기 신호를 유도하는 것이 제안되었다.
셀 내 시그널링 컴포넌트의 현지화
스캐폴드는 세포 내의 특정 영역에 대한 시그널링 반응을 국소화하는데, 이 과정은 시그널링 중간체의 국소 생산에 중요할 수 있다.이 과정의 특별한 예는 세포 [7]내의 다양한 부위에 고리형 AMP의존성 단백질인산화효소(PKA)를 표적으로 하는 골격인 A-키나아제 앵커 단백질(AKAPs)이다.이러한 국소화는 PKA를 국소적으로 조절할 수 있으며 기질의 PKA에 의한 국소적 인산화를 초래한다.
긍정적인 피드백과 부정적인 피드백 조정
스캐폴드가 어떻게 양의 피드백과 음의 피드백을 조정하는지에 대한 많은 가설은 공학적 스캐폴드와 수학적 모델링에서 비롯됩니다.3-키나아제 시그널링 캐스케이드에서 스캐폴드는 세 가지 키나아제 모두를 결합시켜 키나아제 특이성을 높이고 키나아제 인산화효소를 하나의 하류 [3][8][9]타겟으로만 제한함으로써 신호 증폭을 제한한다.이러한 능력은 발판과 키나아제 사이의 상호작용의 안정성, 세포 내 기본 포스파타아제 활성, 발판 위치 및 신호 구성요소의 [3][8]발현 수준과 관련이 있을 수 있습니다.
불활성화로부터 올바른 시그널링 단백질 절연
시그널링 경로는 활성화 상태를 역전시키거나 시그널링 성분의 분해를 유도하는 효소에 의해 종종 비활성화된다.스캐폴드는 활성화된 신호 분자를 불활성화 및/또는 열화로부터 보호하기 위해 제안되었다.수학적 모델링은 발판이 없는 캐스케이드 내 키나아제들이 하류 [8]표적을 인산화시키기도 전에 포스파타아제에 의해 탈인산될 확률이 더 높다는 것을 보여주었다.또한, 스캐폴드는 기질 및 ATP 경쟁 [10]억제제로부터 키나아제를 절연하는 것으로 나타났다.
발판단백질요약
| 비계단백질 | 경로 | 잠재적인 기능 | 묘사 |
|---|---|---|---|
| KSR | 맵 | RAS-ERK 경로의 조립 및 현지화 | 생물학에서 가장 잘 연구된 신호 경로 중 하나는 RAS G-단백질이 MAPKK RAF를 활성화하여 MAPKK MEK1(MAPK/ERK 키나제 1)을 활성화한 후 MAPK ERK를 활성화하는 RAS-ERK 경로이다.이 경로 및 기타 유사한 MAPK 경로에 관여하는 여러 발판 단백질이 확인되었다.그러한 골격 단백질 중 하나가 KSR이며, 이는 잘 연구된 효모 MAPK 골격 단백질 Ste5와 [11]가장 동등한 단백질이다.이것은 경로의 양성 조절제이며 [6]캐스케이드의 세 가지 키나아제 모두를 포함한 경로의 많은 단백질과 결합한다.KSR은 세포 활성화 중에 혈장막으로 국소화되어 ERK 경로의 구성 요소를 조립하고 활성화된 ERK를 혈장막으로 [12]국소화하는 역할을 하는 것으로 나타났다. |
| MEKK1 | 맵 | 사망 수용체 시그널로솜의 조립 및 위치 결정 | 다른 비계 단백질로는 B세포 림프종 10(BCL-10)과 MEK 키나제 1(MEK1)이 있으며, 이들은 JUN N 말단 키나제(JNK) 경로에서 역할을 한다. |
| BCL-10 | 맵 | JNK의 조립 및 특수성 | |
| AKAP | PKA 패스 | 다운스트림 타겟에 대한 PKA에 의한 인산화 조정 | 이 단백질 패밀리는 구조적으로만 PKA의 조절 서브유닛에 결합할 수 있지만 그렇지 않으면 매우 다양한 효소 및 기질 세트를 결합할 수 있다. |
| ANAK-1 | 칼슘 시그널링 | 칼슘 채널 조립 및 위치 확인 | 칼슘 시그널링은 면역세포의 적절한 기능을 위해 필수적이다.최근 연구에 따르면 비계 단백질인 ANAK1은 혈장막에서 칼슘 채널을 적절하게 위치시키는 능력을 통해 T세포에서 효율적인 칼슘 시그널링과 NFAT 활성화에 중요하다[14].비면역 세포에서 ANAK1은 칼슘 채널을 포스포리파아제 Cδ(PLC-γ) 및 [1]PKC와 결합하는 것으로 나타났다.칼슘 결합 단백질은 종종 유입되는 칼슘의 많은 부분을 완화시키므로, 이러한 칼슘 효과 인자를 연결하는 것은 약한 칼슘 유입에 의해 신호가 유도될 때 특히 중요합니다. |
| 호머 | 칼슘 시그널링 | NFAT 활성화 억제 | 칼슘 신호를 조절하는 비계 단백질의 또 다른 예는 HOMER 계열의 단백질이다.HOMER 단백질은 활성화된 T [13]세포에서 NFAT의 N 말단에 결합하기 위해 칼시뉴린과 경쟁하는 것으로 나타났다.이 경쟁을 통해 HOMER 단백질은 NFAT 활성화를 감소시킬 수 있으며, 이는 IL-2 사이토카인의 [13]생성을 감소시킨다.이와는 대조적으로 HOMER 단백질은 또한 글루탐산 수용체와 소포체 [14]내의 삼인산 수용체를 연결함으로써 뉴런의 칼슘 신호를 적극적으로 조절하는 것으로 나타났다. |
| 페리노 | 선천성 면역 시그널링 | TLR 시그널솜 조립체 | 펠리노 단백질이 중요한 선천성 면역 신호 경로인 Toll-like receptor(TLR) 경로에서 발판 단백질로 기능한다는 증거가 존재한다.많은 Pellino 기능은 추측이다. 그러나 Pellino 단백질은 IL-1R 활성화 후 IRAK1, TRAF6, TAK1과 결합할 수 있으며,[15][16] 이는 수용체 근처에 TLR 경로의 구성 요소를 조립하고 국부화할 수 있음을 나타낸다. |
| NLRP | 선천성 면역 시그널링 | 염증체 집합체 | NLR 패밀리는 선천적 면역에 관여하는 고도로 보존된 대규모 수용체 패밀리이다.NLRP(NLR 패밀리, 피린 도메인 포함) 수용체군은 IL-18 및 IL-1β와 [17]같은 소염성 사이토카인의 분비를 유도하는 복합체인 염증체를 조립함으로써 발판 역할을 한다. |
| DLG1 | T세포수용체신호전달 | TCR 시그널링 분자의 조립과 국재화, p38 활성화 | DLG1은 면역 세포에 고도로 보존되어 말초 T세포 활성화에 중요하다.면역학적 시냅스에 도입되어 T세포 수용체(TCR)의 γ-사슬을 CBL, WASP, p38, LCK, VAV1, ZAP70에 [18][19][20][21]연결한다.이 데이터는 DLG1이 TCR 신호 기계와 세포골격 조절기를 연결하는 역할을 하며 p38 경로를 대안적으로 활성화하는 역할도 시사한다.그러나 DLG1이 T세포 활성화를 긍정적으로 조절하는지 부정적으로 조절하는지는 명확하지 않다. |
| 스피노필린 | 수상 세포 신호 전달 | DC면역학적 시냅스단백질 집합체 | 스피노필린은 특히 면역학적 시냅스의 형성에 수지상 세포 기능에 관여한다.스피노필린은 T세포와의 수지상세포 접촉 후 시냅스에 도입된다.스피노필린이 없으면 수지상세포는 체외 또는 [22]체내 T세포를 활성화 시킬 수 없기 때문에 이 모집은 중요한 것으로 보인다.스피노필린이 시냅스에서 세포 접촉의 지속시간을 조절하거나 MHC [1]분자처럼 세포에서 공동 자극 분자의 재활용을 조절하는 것은 가능하지만, 이 경우 스피노필린이 항원 제시를 어떻게 촉진하는지는 여전히 알려져 있지 않다. |
| 식물 FLU 조절 단백질[23] | 원염화물 생합성 중 음성 피드백의 조정. | 클로로필의 전구체인 독성이 강한 원염화물의 합성을 바꾸는 경로의 조립과 국부화. | 엽록소로의 전환은 빛을 필요로 하기 때문에 원염화물의 합성은 엄격히 규제되어야 한다.FLU 조절 단백질은 틸라코이드 막에 위치하며 촉매 활성 없이 여러 단백질-단백질 상호작용 부위만 포함합니다.이 단백질이 부족한 돌연변이는 어둠 속에서 원클로로필라이드를 과도하게 축적한다.상호 작용 파트너를 알 수 없습니다.그 단백질은 진화 과정에서 단순화 과정을 거쳤다. |
헌팅틴단백질
헌팅틴 단백질은 DNA [24]손상 부위에서 ATM 복구 단백질과 함께 국소화된다.헌팅틴은 ATM 산화성 DNA 손상 반응 [24]복합체의 비계 단백질이다.헌팅턴병 환자들은 비정상적인 헌팅틴 단백질을 가지고 있는데 산화성 DNA 손상 복구가 부족하다.산화적 DNA 손상은 헌팅턴병의 병인성 [25]근저에 있는 것으로 보인다.헌팅턴병은 DNA 복구에서 돌연변이 헌팅틴 골격 단백질의 기능 장애로 인해 대사 활성 [24]세포의 산화적 DNA 손상이 증가하기 때문에 발생할 수 있다.
비계단백질이라는 용어의 기타 사용방법
생물학에서 몇몇 다른 경우들에서는 "스카폴드 단백질"이라는 용어가 넓은 의미로 사용되며, 여기서 단백질은 어떤 목적을 위해 여러 가지를 함께 고정시킨다.
- 염색체 접힘 시
- 염색체 골격은 염색질을 콤팩트 염색체로 고정시키는 중요한 역할을 한다.염색체 골격은 응축소, 토포이소머라아제 IIα 및 키네신 패밀리 멤버 4(KIF4)[26]를 포함한 단백질로 구성되어 있으며, 염색체 골격 구성 단백질은 골격 단백질이라고도 불린다.
- 효소 반응 시
- 공통 경로에서 일련의 반응 또는 연쇄 반응을 수행하는 큰 다기능 효소, 때로는 비계 [27]단백질이라고도 합니다.예를 들어 피루브산탈수소효소.
- 분자형성중
- 철황 클러스터 골격 [28][29]단백질과 같이 여러 분자를 적절한 공간 배열로 고정하는 효소 또는 구조 단백질입니다.
- 구조 비계
- 세포골격과 ECM에서 분자는 기계적 발판을 제공합니다.예를[30] 들어 4형 콜라겐
레퍼런스
- ^ a b c d Shaw, Andrey S.; Filbert, Erin L. (January 2009). "Scaffold proteins and immune-cell signalling". Nature Reviews Immunology. 9 (1): 47–56. doi:10.1038/nri2473. PMID 19104498. S2CID 13443447.
- ^ Choi, Kang-Yell; Satterberg, Brett; Lyons, David M.; Elion, Elaine A. (August 1994). "Ste5 tethers multiple protein kinases in the MAP kinase cascade required for mating in S. cerevisiae". Cell. 78 (3): 499–512. doi:10.1016/0092-8674(94)90427-8. PMID 8062390. S2CID 20541545.
- ^ a b c Levchenko, Andre; Bruck, Jehoshua; Sternberg, Paul W. (23 May 2000). "Scaffold proteins may biphasically affect the levels of mitogen-activated protein kinase signaling and reduce its threshold properties". Proceedings of the National Academy of Sciences. 97 (11): 5818–5823. Bibcode:2000PNAS...97.5818L. doi:10.1073/pnas.97.11.5818. PMC 18517. PMID 10823939.
- ^ Ferrell, James E. (3 October 2000). "What Do Scaffold Proteins Really Do?". Science Signaling. 2000 (52): pe1. doi:10.1126/stke.522000pe1. S2CID 219192522.
- ^ Burack, W Richard; Shaw, Andrey S (April 2000). "Signal transduction: hanging on a scaffold". Current Opinion in Cell Biology. 12 (2): 211–216. doi:10.1016/S0955-0674(99)00078-2. PMID 10712921.
- ^ a b Good, Matthew; Tang, Grace; Singleton, Julie; Reményi, Attila; Lim, Wendell A. (March 2009). "The Ste5 Scaffold Directs Mating Signaling by Catalytically Unlocking the Fus3 MAP Kinase for Activation". Cell. 136 (6): 1085–1097. doi:10.1016/j.cell.2009.01.049. PMC 2777755. PMID 19303851.
- ^ Wong, Wei; Scott, John D. (December 2004). "AKAP signalling complexes: focal points in space and time". Nature Reviews Molecular Cell Biology. 5 (12): 959–970. doi:10.1038/nrm1527. PMID 15573134. S2CID 15268680.
- ^ a b c Locasale, Jason W.; Shaw, Andrey S.; Chakraborty, Arup K. (14 August 2007). "Scaffold proteins confer diverse regulatory properties to protein kinase cascades". Proceedings of the National Academy of Sciences. 104 (33): 13307–13312. Bibcode:2007PNAS..10413307L. doi:10.1073/pnas.0706311104. PMC 1948937. PMID 17686969. S2CID 8907943.
- ^ Uhlik, Mark T; Abell, Amy N; Cuevas, Bruce D; Nakamura, Kazuhiro; Johnson, Gary L (1 December 2004). "Wiring diagrams of MAPK regulation by MEKK1, 2, and 3". Biochemistry and Cell Biology. 82 (6): 658–663. doi:10.1139/o04-114. PMID 15674433.
- ^ Greenwald, Eric C.; Redden, John M.; Dodge-Kafka, Kimberly L.; Saucerman, Jeffrey J. (24 January 2014). "Scaffold State Switching Amplifies, Accelerates, and Insulates Protein Kinase C Signaling". Journal of Biological Chemistry. 289 (4): 2353–2360. doi:10.1074/jbc.M113.497941. PMC 3900978. PMID 24302730.
- ^ Clapéron, A.; Therrien, M. (May 2007). "KSR and CNK: two scaffolds regulating RAS-mediated RAF activation". Oncogene. 26 (22): 3143–3158. doi:10.1038/sj.onc.1210408. PMID 17496912. S2CID 31061333.
- ^ Müller, Jürgen; Ory, Stéphane; Copeland, Terry; Piwnica-Worms, Helen; Morrison, Deborah K. (November 2001). "C-TAK1 Regulates Ras Signaling by Phosphorylating the MAPK Scaffold, KSR1". Molecular Cell. 8 (5): 983–993. doi:10.1016/S1097-2765(01)00383-5. PMID 11741534.
- ^ a b Huang, Guo N.; Huso, David L.; Bouyain, Samuel; Tu, Jianchen; McCorkell, Kelly A.; May, Michael J.; Zhu, Yuwen; Lutz, Michael; Collins, Samuel; Dehoff, Marlin; Kang, Shin; Whartenby, Katharine; Powell, Jonathan; Leahy, Daniel; Worley, Paul F. (25 January 2008). "NFAT Binding and Regulation of T Cell Activation by the Cytoplasmic Scaffolding Homer Proteins". Science. 319 (5862): 476–481. Bibcode:2008Sci...319..476H. doi:10.1126/science.1151227. PMC 3602998. PMID 18218901.
- ^ Xiao, Bo; Cheng Tu, Jian; Worley, Paul F (June 2000). "Homer: a link between neural activity and glutamate receptor function". Current Opinion in Neurobiology. 10 (3): 370–374. doi:10.1016/S0959-4388(00)00087-8. PMID 10851183. S2CID 8699597.
- ^ Jiang, Zhengfan; Johnson, H. Jan; Nie, Huiqing; Qin, Jinzhong; Bird, Timothy A.; Li, Xiaoxia (28 March 2003). "Pellino 1 Is Required for Interleukin-1 (IL-1)-mediated Signaling through Its Interaction with the IL-1 Receptor-associated Kinase 4 (IRAK4)-IRAK-Tumor Necrosis Factor Receptor-associated Factor 6 (TRAF6) Complex". Journal of Biological Chemistry. 278 (13): 10952–10956. doi:10.1074/jbc.M212112200. PMID 12496252. S2CID 10165785.
- ^ Yu, Kang-Yeol; Kwon, Hyung-Joo; Norman, David A. M.; Vig, Eva; Goebl, Mark G.; Harrington, Maureen A. (15 October 2002). "Cutting Edge: Mouse Pellino-2 Modulates IL-1 and Lipopolysaccharide Signaling". The Journal of Immunology. 169 (8): 4075–4078. doi:10.4049/jimmunol.169.8.4075. PMID 12370331. S2CID 25317655.
- ^ Pétrilli, Virginie; Dostert, Catherine; Muruve, Daniel A; Tschopp, Jürg (December 2007). "The inflammasome: a danger sensing complex triggering innate immunity". Current Opinion in Immunology. 19 (6): 615–622. doi:10.1016/j.coi.2007.09.002. PMID 17977705.
- ^ Xavier, Ramnik; Rabizadeh, Shahrooz; Ishiguro, Kazuhiro; Andre, Niko; Ortiz, J. Bernabe; Wachtel, Heather; Morris, David G.; Lopez-Ilasaca, Marco; Shaw, Albert C.; Swat, Wojciech; Seed, Brian (19 July 2004). "Discs large (Dlg1) complexes in lymphocyte activation". Journal of Cell Biology. 166 (2): 173–178. doi:10.1083/jcb.200309044. PMC 2172307. PMID 15263016.
- ^ Hanada, Toshihiko; Lin, Lunhui; Chandy, K. George; Oh, S. Steven; Chishti, Athar H. (24 October 1997). "Human Homologue of the Drosophila Discs Large Tumor Suppressor Binds to p56 lck Tyrosine Kinase and Shaker Type Kv1.3 Potassium Channel in T Lymphocytes". Journal of Biological Chemistry. 272 (43): 26899–26904. doi:10.1074/jbc.272.43.26899. PMID 9341123. S2CID 23446334.
- ^ Round, June L.; Humphries, Lisa A.; Tomassian, Tamar; Mittelstadt, Paul; Zhang, Min; Miceli, M. Carrie (February 2007). "Scaffold protein Dlgh1 coordinates alternative p38 kinase activation, directing T cell receptor signals toward NFAT but not NF-κB transcription factors". Nature Immunology. 8 (2): 154–161. doi:10.1038/ni1422. PMID 17187070. S2CID 11906543.
- ^ Round, June L.; Tomassian, Tamar; Zhang, Min; Patel, Viresh; Schoenberger, Stephen P.; Miceli, M. Carrie (7 February 2005). "Dlgh1 coordinates actin polymerization, synaptic T cell receptor and lipid raft aggregation, and effector function in T cells". Journal of Experimental Medicine. 201 (3): 419–430. doi:10.1084/jem.20041428. PMC 2213022. PMID 15699074.
- ^ Bloom, Ona; Unternaehrer, Julia J.; Jiang, Aimin; Shin, Jeong-Sook; Delamarre, Lélia; Allen, Patrick; Mellman, Ira (21 April 2008). "Spinophilin participates in information transfer at immunological synapses". Journal of Cell Biology. 181 (2): 203–211. doi:10.1083/jcb.200711149. PMC 2315669. PMID 18411312. S2CID 1717736.
- ^ Meskauskiene, Rasa; Nater, Mena; Goslings, David; Kessler, Felix; Camp, Roel op den; Apel, Klaus (23 October 2001). "FLU: A negative regulator of chlorophyll biosynthesis in Arabidopsis thaliana". Proceedings of the National Academy of Sciences. 98 (22): 12826–12831. Bibcode:2001PNAS...9812826M. doi:10.1073/pnas.221252798. PMC 60138. PMID 11606728.
- ^ a b c Maiuri, Tamara; Mocle, Andrew J.; Hung, Claudia L.; Xia, Jianrun; van Roon-Mom, Willeke M. C.; Truant, Ray (25 December 2016). "Huntingtin is a scaffolding protein in the ATM oxidative DNA damage response complex". Human Molecular Genetics. 26 (2): 395–406. doi:10.1093/hmg/ddw395. PMID 28017939.
- ^ Ayala-Peña, Sylvette (September 2013). "Role of oxidative DNA damage in mitochondrial dysfunction and Huntington's disease pathogenesis". Free Radical Biology and Medicine. 62: 102–110. doi:10.1016/j.freeradbiomed.2013.04.017. PMC 3722255. PMID 23602907.
- ^ Poonperm, Rawin; Takata, Hideaki; Hamano, Tohru; Matsuda, Atsushi; Uchiyama, Susumu; Hiraoka, Yasushi; Fukui, Kiichi (1 July 2015). "Chromosome Scaffold is a Double-Stranded Assembly of Scaffold Proteins". Scientific Reports. 5 (1): 11916. Bibcode:2015NatSR...511916P. doi:10.1038/srep11916. PMC 4487240. PMID 26132639.
- ^ 로디쉬의[full citation needed] 분자 세포 생물학
- ^ Ayala-Castro, Carla; Saini, Avneesh; Outten, F. Wayne (2008). "Fe-S Cluster Assembly Pathways in Bacteria". Microbiology and Molecular Biology Reviews. 72 (1): 110–125. doi:10.1128/MMBR.00034-07. PMC 2268281. PMID 18322036.
- ^ Adrover, Miquel; Howes, Barry D.; Iannuzzi, Clara; Smulevich, Giulietta; Pastore, Annalisa (1 June 2015). "Anatomy of an iron-sulfur cluster scaffold protein: Understanding the determinants of [2Fe–2S] cluster stability on IscU". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1853 (6): 1448–1456. doi:10.1016/j.bbamcr.2014.10.023. PMID 25447544.
- ^ Lodish 등의 분자 세포 생물학.에디션[page needed] 5


