Nav1.8
Nav1.8| SCN10A | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||||||||||||||||||
| 별칭 | SCN10A, FEPS2, Nav1.8, PN3, SNS, hPN3, 나트륨 전압 게이트 채널 알파 서브유닛 10 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 604427 MGI: 108029 호몰로진: 21300 GeneCard: SCN10A | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 3: 38.7 – 38.82Mb | Cr 9: 119.44 – 119.55Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Na1v.8은 인간에서 SCN10A 유전자에 의해 인코딩되는 나트륨 이온 채널 하위 유형이다.[5][6][7][8]
Na1v.8 포함 채널은 테트로도톡신(TTX) 내성 전압 게이트 채널이다.Na1v.8은 특히 등근성 골절(DRG)에 C-Fibres라 불리는 미침착, 소지름 감각 신경세포로 표현되며, nociception에 관여한다.[9][10]C-Fibre는 유해한 열 또는 기계적 자극에 의해 활성화될 수 있으므로 통증 메시지를 전달할 수 있다.
DRG의 감각 신경세포에서 Na1v.8의 특정 위치는 그것이 새로운 진통제의[11] 개발과 만성통증의 치료를 위한 핵심 치료 대상이 될 수 있다.[12]
함수
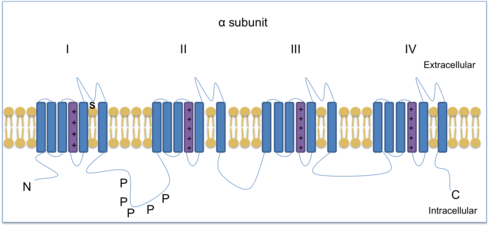
작용 전위를 생산하고 전파하는 데는 전압 게이트 나트륨 이온 채널(VGSC)이 필수적이다.복어에서 발견되는 독소인 테트로도톡신은 일부 VGSC를 차단할 수 있어 다른 아형을 구별하는 데 사용된다.TTX 내성 VGSC는 Na1v.5, Na1v.8, Na1v.9 등 3가지가 있다. Na1v.8과 Na1v.9는 모두 nociceptor(손상 감지 뉴런)로 표현된다.Na1v.7, Na1v.8 및 Na1v.9는 DRG에서 발견되며 만성 염증성 통증을 중재하는 데 도움이 된다.[13]Na1v.8은 4개의 동질 영역으로 구성된 α형 채널 서브 유닛으로, 각각 6개의 투과 영역으로 구성되며, 그 중 1개는 전압 센서다.
전압 클램프 방법은 나트륨 채널 중 Na1V.8이 상대적으로 탈극화된 정상 상태 비활성화를 보이는 데 있어 고유한 것임을 입증했다.따라서 Na1V.8은 뉴런이 다른 나트륨 채널을 비활성화하는 수준으로 탈분극화되었을 때 작동 가능한 상태를 유지한다.전압 클램프는 DRG 셀의 작용 전위가 TTX 내성 나트륨 채널에 의해 어떻게 형성되는지 보여주기 위해 사용되어 왔다.Na1v.8은 유해한 자극을 감지한 후 빠르게 활성화되고 활성 상태를 유지하기 때문에 noociceptive 감각 신경세포에서 반복적인 고주파 전위 작용의 탈극화 단계를 유지하는 데 가장 큰 기여를 한다.[14][15]따라서 Na1v.8은 만성 통증의 요소인 고농도증(통증에 대한 민감도 증가)과 알로디니아(보통 그것을 유발하지 않는 자극에서 오는 통증)에 기여한다.[16]Na1v.8 녹아웃 생쥐 연구는 이 채널이 염증성 및 신경성 통증과 관련이 있다는 것을 보여주었다.[9][17][18]더욱이 Na1v.8은 추운 통증에 결정적인 역할을 한다.[19]30°C에서 10°C로 온도를 낮추면 VGSC의 작동 속도가 느려져 전류가 감소한다.그러나 Na1v.8은 내한성이 있고 추위에 작용 전위를 생성하여 nocicipeptor에서 중추신경계(CNS)로 정보를 전달할 수 있다.더욱이 Na1v.8 Na1.8 null 생쥐는 작용 전위를 생성하지 못하여, Na1v.8이 추운 온도에서 통증에 대한 인식에 필수적이라는 것을 보여준다.[19]
Na1V.8 채널의 생물물리학에 대한 초기 연구가 설치류 채널에서 수행되었지만, 보다 최근의 연구는 인간 Na1V.8 채널의 특성을 조사하였다.특히 인간 Na1V.8 채널은 설치류보다 훨씬 더 탈극화된 불활성 전압 의존성을 보이며, 또한 더 큰 지속 전류를 보인다.[20]따라서 인간의 Na1V.8 채널이 감각 신경세포의 발화에 미치는 영향은 설치류 Na1V.8 채널보다 더 클 수 있다.
고통스러운 말초신경병 환자에서 확인된 Na1V.8의 기능상 돌연변이가 DRG 뉴런을 극도로 흥분시키는 것으로 밝혀져 고통의 원인이 되고 있다.[21][22]비록 NaV1.8 정상적으로 소뇌 안에 표기되지 않다, 그 표현 MS(다중 Sclerosis)의 동물 모델에 소뇌 푸르키네 세포는 인간 MS.[23]에서 그것이 어디에 있는지 정상적으로 제시한 이런 소뇌의 뉴런 내에서는 NaV1.8 채널의 존재와 그들의 작동 패턴을 바꾸어 놓으며 그들의 흥분성을 증가시키 up-regulated 있다.에서시험관 [24]및 MS의 모델인 실험 자가면역 뇌근막염을 가진 설치류에서.[25] 행동 수준에서 소뇌 푸르킨제 뉴런 내 Na1V.8의 외경적 표현은 유전자이전 모델에서 운동 성능을 손상시키는 것으로 나타났다.[26]
임상적 유의성
통증 신호 전달 경로
nociceptor는 활성화 문턱이 낮아서 결과적으로 지속적인 자극에 대한 반응을 증가시킨다는 점에서 다른 감각 신경세포와 다르다.따라서 조직 손상 부위에 분비되는 브래디키닌, 신경성장인자 등의 작용제에 의해 nociceptor가 쉽게 감작되어 결국 이온채널 전도성에 변화를 일으킨다.VGSC는 신경 손상 후 밀도가 증가하는 것으로 나타났다.[27]따라서 VGSC는 신경 손상 후 방출되는 많은 다른 고농축 물질에 의해 조절될 수 있다.추가적인 예로는 Na1v.8을 통해 전류를 증가시키는 작용을 하는 프로스타글란딘 E2(PGE2), 세로토닌, 아데노신이 있다.[28]
PGE와2 같은 프로스타글란딘은 열, 화학, 기계적 자극에 nociceptor를 감작할 수 있고 DRG 감각 뉴런의 흥분성을 높일 수 있다.이는 PGE가2 G-단백질 결합 EP2 수용체에 결합하여 Na1v.8의 밀매를 변조하고, 이는 다시 단백질 키나제 A를 활성화시키기 때문이다.[29][30]단백질 키노아제 A 인산염은 세포 내 부위에서v Na1.8을 생성하여 나트륨 이온 전류를 증가시킨다.PGE와2 초알레지아 사이의 연관성에 대한 증거는 쥐의 DRG에서 Na1v.8의 항이센스 디옥시뉴클레오티드 녹다운에서 나온다.[31]Na1v.8의 또 다른 모듈레이터는 PKC의 ε ISO 형식이다.이 등소형은 염증 매개체 브래디키닌과 인산염 Na1v.8에 의해 활성화되어 감각 신경세포에 나트륨 전류가 증가하여 기계적 고팔지시아를 촉진한다.[32]
브루가다 증후군
SCN10A의 돌연변이는 브루가다 증후군과 관련이 있다.[33][34][35]
막 매매
염증이 있거나 다친 조직에서 신경 성장 인자 수준이 증가하여 통증에 대한 민감도가 증가한다.[36]신경 성장 인자와 종양 괴사 인자 α(TNF-α)의 증가된 수준은 부속 단백질 p11(안넥신 II 라이트 체인)을 통해 감각 신경 뉴런에서 Na1v.8의 상향 조절을 유발한다.p11이 Na1v.8의 N 종단부에서 28-아미노산 조각에 결합하고 그 변환을 플라즈마 막으로 촉진하는 효모-2 잡종 선별법을 사용한 것으로 나타났다.이는 통증 중 감각 신경세포의 과대확산성에 기여한다.[37] Cre-loxP 재조합 시스템을 사용하여 생성된 생쥐의 p11-null nociceptive 감각 신경세포는 혈장 막에서 Na1v.8 발현이 감소하는 것을 보여준다.[38]따라서, p11과 Na1v.8 사이의 상호작용을 방해하는 것은 통증을 낮추는 좋은 치료 목표가 될 수 있다.
몰염색 섬유에서 VGSC는 란비에르 노드에 위치하지만, 몰염색 섬유에서는 정확한 VGSC 위치가 결정되지 않았다.미염색 섬유에서 Na1v.8은 체외 및 체내 DRG 섬유에 따른 지질 뗏목과 관련된 군집들에서 발견되었다.[39]지질 뗏목은 세포막을 조직하는데, 여기에는 인신매매와 국소화 이온 통로 등이 포함된다.혈장 막에서 콜레스테롤을 고갈시키는 MβCD를 이용하여 막내의 지질 래프트를 제거하면 막의 Na1v.8이 비기물 부분으로 이동하게 되어 작용전위 발화 및 전파를 감소시킨다.[39]
아픈 말초신경병
고통스러운 말초신경병증이나 소섬유신경병은 무염색성 nociciceptive c-fibres의 장애로 신경성 통증을 유발하는 질환으로, 어떤 경우에는 알려진 원인이 없다.[40]이러한 특발성 신경병 환자들에 대한 유전자 검사 결과 SCN9A 유전자의 돌연변이가 발견되어 관련 채널 Na1v.7을 인코딩하고 있다.DRG 감각 신경세포에 위치한 Na1v.7에서 기능상 변이가 30%의 환자에게서 발견되었다.[41]이러한 기능유발 돌연변이는 DRG 감각 신경세포의 흥분성(고확산성)의 증가와 그에 따른 고통의 증가를 유발한다.따라서 Na1v.7은 인간의 고통과 연관되어 있는 것으로 보여졌다; 대조적으로 Na1v.8은 최근까지 동물 연구에서의 고통에만 연관되어 있었다.Na1v.8 인코딩 SCN10A 유전자에서 고통스러운 말초 신경증을 가진 환자에게서 기능상 이득 돌연변이가 발견되었다.[21]SCN9A에 돌연변이가 없는 특발성 말초신경병 환자 104명을 대상으로 한 연구에서는 전압 클램프와 전류 클램프 방법을 예측 알고리즘과 함께 사용했으며, 3명의 환자에서 SCN10A에 두 가지 기능상 변이를 발생시켰다.두 돌연변이는 DRG 감각 신경세포에 흥분성을 증가시켜 고통에 기여하지만, 그렇게 하는 메커니즘은 이해되지 않는다.
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000185313 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000034533 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Entrez Gene: sodium channel".
- ^ Rabert DK, Koch BD, Ilnicka M, Obernolte RA, Naylor SL, Herman RC, Eglen RM, Hunter JC, Sangameswaran L (November 1998). "A tetrodotoxin-resistant voltage-gated sodium channel from human dorsal root ganglia, hPN3/SCN10A". Pain. 78 (2): 107–14. doi:10.1016/S0304-3959(98)00120-1. PMID 9839820. S2CID 45480324.
- ^ Plummer NW, Meisler MH (April 1999). "Evolution and diversity of mammalian sodium channel genes". Genomics. 57 (2): 323–31. doi:10.1006/geno.1998.5735. PMID 10198179.
- ^ Catterall WA, Goldin AL, Waxman SG (December 2005). "International Union of Pharmacology. XLVII. Nomenclature and structure-function relationships of voltage-gated sodium channels". Pharmacological Reviews. 57 (4): 397–409. doi:10.1124/pr.57.4.4. PMID 16382098. S2CID 7332624.
- ^ a b Akopian AN, Souslova V, England S, Okuse K, Ogata N, Ure J, Smith A, Kerr BJ, McMahon SB, Boyce S, Hill R, Stanfa LC, Dickenson AH, Wood JN (June 1999). "The tetrodotoxin-resistant sodium channel SNS has a specialized function in pain pathways". Nature Neuroscience. 2 (6): 541–8. doi:10.1038/9195. PMID 10448219. S2CID 17487906.
- ^ Akopian AN, Sivilotti L, Wood JN (January 1996). "A tetrodotoxin-resistant voltage-gated sodium channel expressed by sensory neurons". Nature. 379 (6562): 257–62. Bibcode:1996Natur.379..257A. doi:10.1038/379257a0. PMID 8538791. S2CID 4360775.
- ^ Cummins TR, Sheets PL, Waxman SG (October 2007). "The roles of sodium channels in nociception: Implications for mechanisms of pain". Pain. 131 (3): 243–57. doi:10.1016/j.pain.2007.07.026. PMC 2055547. PMID 17766042.
- ^ a b Swanwick RS, Pristerá A, Okuse K (December 2010). "The trafficking of Na(V)1.8". Neuroscience Letters. 486 (2): 78–83. doi:10.1016/j.neulet.2010.08.074. PMC 2977848. PMID 20816723.
- ^ Strickland IT, Martindale JC, Woodhams PL, Reeve AJ, Chessell IP, McQueen DS (July 2008). "Changes in the expression of NaV1.7, NaV1.8 and NaV1.9 in a distinct population of dorsal root ganglia innervating the rat knee joint in a model of chronic inflammatory joint pain". European Journal of Pain. 12 (5): 564–72. doi:10.1016/j.ejpain.2007.09.001. PMID 17950013. S2CID 24952010.
- ^ Blair NT, Bean BP (2002). "Roles of Tetrodotoxin (TTX)-Sensitive Na+ Current, TTX-Resistant Na+ Current, and Ca2+ Current in the Action Potentials of Nociceptive Sensory Neurons". The Journal of Neuroscience. 22 (23): 10277–10290. doi:10.1523/JNEUROSCI.22-23-10277.2002. PMC 6758735. PMID 12451128.
- ^ Renganathan M, Cummins TR & Waxman SG (2001). "Contribution of Nav1.8 Sodium Channels to Action Potential Electrogenesis in DRG Neurons". Journal of Neurophysiology. 86 (2): 629–640. doi:10.1152/jn.2001.86.2.629. PMID 11495938.
- ^ Millan MJ (1999). "The induction of pain: an integrative review". Progress in Neurobiology. 57 (1): 1–164. doi:10.1016/S0301-0082(98)00048-3. PMID 9987804. S2CID 206054345.
- ^ Matthews EA, Wood JN, Dickenson AH (February 2006). "Na(v) 1.8-null mice show stimulus-dependent deficits in spinal neuronal activity". Molecular Pain. 2: 1744-8069–2-5. doi:10.1186/1744-8069-2-5. PMC 1403745. PMID 16478543.
- ^ Jarvis MF, Honore P, Shieh CC, Chapman M, Joshi S, Zhang XF, Kort M, Carroll W, Marron B, Atkinson R, Thomas J, Liu D, Krambis M, Liu Y, McGaraughty S, Chu K, Roeloffs R, Zhong C, Mikusa JP, Hernandez G, Gauvin D, Wade C, Zhu C, Pai M, Scanio M, Shi L, Drizin I, Gregg R, Matulenko M, Hakeem A, Gross M, Johnson M, Marsh K, Wagoner PK, Sullivan JP, Faltynek CR, Krafte DS (May 2007). "A-803467, a potent and selective Nav1.8 sodium channel blocker, attenuates neuropathic and inflammatory pain in the rat". Proceedings of the National Academy of Sciences of the United States of America. 104 (20): 8520–5. doi:10.1073/pnas.0611364104. PMC 1895982. PMID 17483457.
- ^ a b Zimmermann K, Leffler A, Babes A, Cendan CM, Carr RW, Kobayashi J, Nau C, Wood JN, Reeh PW (June 2007). "Sensory neuron sodium channel Nav1.8 is essential for pain at low temperatures". Nature. 447 (7146): 855–8. Bibcode:2007Natur.447..856Z. doi:10.1038/nature05880. PMID 17568746. S2CID 4391511.
- ^ Han C, Estacion M, Huang J, Vasylyev D, Zhao P, Dib-Hajj SD, Waxman SG (May 2015). "Human Na(v)1.8: enhanced persistent and ramp currents contribute to distinct firing properties of human DRG neurons". Journal of Neurophysiology. 113 (9): 3172–85. doi:10.1152/jn.00113.2015. PMC 4432682. PMID 25787950.
- ^ Huang J, Yang Y, Zhao P, Gerrits MM, Hoeijmakers JG, Bekelaar K, Merkies IS, Faber CG, Dib-Hajj SD, Waxman SG (August 2013). "Small-fiber neuropathy Nav1.8 mutation shifts activation to hyperpolarized potentials and increases excitability of dorsal root ganglion neurons". The Journal of Neuroscience. 33 (35): 14087–97. doi:10.1523/JNEUROSCI.2710-13.2013. PMC 6618513. PMID 23986244.
- ^ Black JA, Dib-Hajj S, Baker D, Newcombe J, Cuzner ML, Waxman SG (October 2000). "Sensory neuron-specific sodium channel SNS is abnormally expressed in the brains of mice with experimental allergic encephalomyelitis and humans with multiple sclerosis". Proceedings of the National Academy of Sciences of the United States of America. 97 (21): 11598–602. Bibcode:2000PNAS...9711598B. doi:10.1073/pnas.97.21.11598. PMC 17246. PMID 11027357.
- ^ Renganathan M, Gelderblom M, Black JA, Waxman SG (January 2003). "Expression of Nav1.8 sodium channels perturbs the firing patterns of cerebellar Purkinje cells". Brain Research. 959 (2): 235–42. doi:10.1016/s0006-8993(02)03750-2. PMID 12493611. S2CID 34784900.
- ^ Saab CY, Craner MJ, Kataoka Y, Waxman SG (September 2004). "Abnormal Purkinje cell activity in vivo in experimental allergic encephalomyelitis". Experimental Brain Research. 158 (1): 1–8. doi:10.1007/s00221-004-1867-4. PMID 15118796. S2CID 34656521.
- ^ Shields SD, Cheng X, Gasser A, Saab CY, Tyrrell L, Eastman EM, Iwata M, Zwinger PJ, Black JA, Dib-Hajj SD, Waxman SG (February 2012). "A channelopathy contributes to cerebellar dysfunction in a model of multiple sclerosis". Annals of Neurology. 71 (2): 186–94. doi:10.1002/ana.22665. PMID 22367990. S2CID 25128887.
- ^ Devor M; Govrin-Lippmann R & Angelides (1993). "Na+ Channel lmmunolocalization in Peripheral Mammalian Axons and Changes following Nerve Injury and Neuroma Formation". The Journal of Neuroscience. 13 (5): 1976–1992. doi:10.1523/JNEUROSCI.13-05-01976.1993. PMC 6576562. PMID 7683047.
- ^ Gold MS, Reichling DB, Shuster MJ, Levine JD (February 1996). "Hyperalgesic agents increase a tetrodotoxin-resistant Na+ current in nociceptors". Proceedings of the National Academy of Sciences of the United States of America. 93 (3): 1108–12. Bibcode:1996PNAS...93.1108G. doi:10.1073/pnas.93.3.1108. PMC 40039. PMID 8577723.
- ^ Hector TH (January 1975). "A simple method for making chromatographic records using transparent acetate sheet". The Journal of Physiology. 32 (1): 31–2. doi:10.1113/jphysiol.1996.sp021604. PMC 1160802. PMID 8887754.
- ^ Liu C, Li Q, Su Y, Bao L (March 2010). "Prostaglandin E2 promotes Na1.8 trafficking via its intracellular RRR motif through the protein kinase A pathway". Traffic. 11 (3): 405–17. doi:10.1111/j.1600-0854.2009.01027.x. PMID 20028484. S2CID 997800.
- ^ Khasar SG, Gold MS & Levine JD (1998). "A tetrodotoxin-resistant sodium current mediates inflammatory pain in the rat". Neuroscience Letters. 256 (1): 17–20. doi:10.1016/s0304-3940(98)00738-1. PMID 9832206. S2CID 5614913.
- ^ Wu DF, Chandra D, McMahon T, Wang D, Dadgar J, Kharazia VN, Liang YJ, Waxman SG, Dib-Hajj SD, Messing RO (April 2012). "PKCε phosphorylation of the sodium channel NaV1.8 increases channel function and produces mechanical hyperalgesia in mice". The Journal of Clinical Investigation. 122 (4): 1306–15. doi:10.1172/JCI61934. PMC 3315445. PMID 22426212.
- ^ Hu D, Barajas-Martínez H, Pfeiffer R, Dezi F, Pfeiffer J, Buch T, Betzenhauser MJ, Belardinelli L, Kahlig KM, Rajamani S, DeAntonio HJ, Myerburg RJ, Ito H, Deshmukh P, Marieb M, Nam GB, Bhatia A, Hasdemir C, Haïssaguerre M, Veltmann C, Schimpf R, Borggrefe M, Viskin S, Antzelevitch C (July 2014). "Mutations in SCN10A are responsible for a large fraction of cases of Brugada syndrome". Journal of the American College of Cardiology. 64 (1): 66–79. doi:10.1016/j.jacc.2014.04.032. PMC 4116276. PMID 24998131.
- ^ Monasky MM, Micaglio E, Vicedomini G, Locati ET, Ciconte G, Giannelli L, Giordano F, Crisà S, Vecchi M, Borrelli V, Ghiroldi A, D'Imperio S, Di Resta C, Benedetti S, Ferrari M, Santinelli V, Anastasia L, Pappone C (2019). "Comparable clinical characteristics in Brugada syndrome patients harboring SCN5A or novel SCN10A variants". Europace. 21 (10): 1550–1558. doi:10.1093/europace/euz186. PMID 31292628. Retrieved 27 April 2021.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Monasky MM, Micaglio E, Ciconte G, Pappone C (2020). "Brugada Syndrome: Oligogenic or Mendelian Disease?". Int J Mol Sci. 21 (5): 1687. doi:10.3390/ijms21051687. PMC 7084676. PMID 32121523.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ McMahon SB (March 1996). "NGF as a mediator of inflammatory pain". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 351 (1338): 431–40. Bibcode:1996RSPTB.351..431M. doi:10.1098/rstb.1996.0039. PMID 8730782.
- ^ Okuse K, Malik-Hall M, Baker MD, Poon WY, Kong H, Chao MV, Wood JN (June 2002). "Annexin II light chain regulates sensory neuron-specific sodium channel expression". Nature. 417 (6889): 653–6. Bibcode:2002Natur.417..653O. doi:10.1038/nature00781. PMID 12050667. S2CID 4423351.
- ^ Foulkes T, Nassar MA, Lane T, Matthews EA, Baker MD, Gerke V, Okuse K, Dickenson AH, Wood JN (October 2006). "Deletion of annexin 2 light chain p11 in nociceptors causes deficits in somatosensory coding and pain behavior" (PDF). The Journal of Neuroscience. 26 (41): 10499–507. doi:10.1523/JNEUROSCI.1997-06.2006. PMC 6674704. PMID 17035534.
- ^ a b Pristerà A, Baker MD, Okuse K (2012). "Association between tetrodotoxin resistant channels and lipid rafts regulates sensory neuron excitability". PLOS ONE. 7 (8): e40079. Bibcode:2012PLoSO...740079P. doi:10.1371/journal.pone.0040079. PMC 3411591. PMID 22870192.
- ^ Hoeijmakers JG, Faber CG, Lauria G, Merkies IS, Waxman SG (May 2012). "Small-fibre neuropathies--advances in diagnosis, pathophysiology and management". Nature Reviews. Neurology. 8 (7): 369–79. doi:10.1038/nrneurol.2012.97. PMID 22641108. S2CID 8804151.
- ^ Faber CG, Hoeijmakers JG, Ahn HS, Cheng X, Han C, Choi JS, Estacion M, Lauria G, Vanhoutte EK, Gerrits MM, Dib-Hajj S, Drenth JP, Waxman SG, Merkies IS (January 2012). "Gain of function Naν1.7 mutations in idiopathic small fiber neuropathy". Annals of Neurology. 71 (1): 26–39. doi:10.1002/ana.22485. PMID 21698661. S2CID 11711575.
추가 읽기
- Okuse K (2007). "Pain signalling pathways: from cytokines to ion channels". The International Journal of Biochemistry & Cell Biology. 39 (3): 490–6. doi:10.1016/j.biocel.2006.11.016. PMID 17194618.
- Waxman SG (July 2013). "Painful Na-channelopathies: an expanding universe". Trends in Molecular Medicine. 19 (7): 406–9. doi:10.1016/j.molmed.2013.04.003. PMID 23664154.
- Lai J, Porreca F, Hunter JC, Gold MS (2004). "Voltage-gated sodium channels and hyperalgesia". Annual Review of Pharmacology and Toxicology. 44: 371–97. doi:10.1146/annurev.pharmtox.44.101802.121627. PMID 14744251.
- Wood JN, Boorman JP, Okuse K, Baker MD (October 2004). "Voltage-gated sodium channels and pain pathways". Journal of Neurobiology. 61 (1): 55–71. doi:10.1002/neu.20094. PMID 15362153.
- Malik-Hall M, Poon WY, Baker MD, Wood JN, Okuse K (February 2003). "Sensory neuron proteins interact with the intracellular domains of sodium channel NaV1.8". Brain Research. Molecular Brain Research. 110 (2): 298–304. doi:10.1016/S0169-328X(02)00661-7. PMID 12591166.
- Yamaoka K, Inoue M, Miyazaki K, Hirama M, Kondo C, Kinoshita E, Miyoshi H, Seyama I (March 2009). "Synthetic ciguatoxins selectively activate Nav1.8-derived chimeric sodium channels expressed in HEK293 cells". The Journal of Biological Chemistry. 284 (12): 7597–605. doi:10.1074/jbc.M806481200. PMC 2658054. PMID 19164297.
- Choi JS, Hudmon A, Waxman SG, Dib-Hajj SD (July 2006). "Calmodulin regulates current density and frequency-dependent inhibition of sodium channel Nav1.8 in DRG neurons". Journal of Neurophysiology. 96 (1): 97–108. doi:10.1152/jn.00854.2005. PMID 16598065.
- Liu CJ, Priest BT, Bugianesi RM, Dulski PM, Felix JP, Dick IE, Brochu RM, Knaus HG, Middleton RE, Kaczorowski GJ, Slaughter RS, Garcia ML, Köhler MG (February 2006). "A high-capacity membrane potential FRET-based assay for NaV1.8 channels". Assay and Drug Development Technologies. 4 (1): 37–48. doi:10.1089/adt.2006.4.37. PMID 16506887.
- Browne LE, Blaney FE, Yusaf SP, Clare JJ, Wray D (April 2009). "Structural determinants of drugs acting on the Nav1.8 channel". The Journal of Biological Chemistry. 284 (16): 10523–36. doi:10.1074/jbc.M807569200. PMC 2667739. PMID 19233853.
- Rabert DK, Koch BD, Ilnicka M, Obernolte RA, Naylor SL, Herman RC, Eglen RM, Hunter JC, Sangameswaran L (November 1998). "A tetrodotoxin-resistant voltage-gated sodium channel from human dorsal root ganglia, hPN3/SCN10A". Pain. 78 (2): 107–14. doi:10.1016/S0304-3959(98)00120-1. PMID 9839820. S2CID 45480324.
- Plummer NW, Meisler MH (April 1999). "Evolution and diversity of mammalian sodium channel genes". Genomics. 57 (2): 323–31. doi:10.1006/geno.1998.5735. PMID 10198179.
- Catterall WA, Goldin AL, Waxman SG (December 2005). "International Union of Pharmacology. XLVII. Nomenclature and structure-function relationships of voltage-gated sodium channels". Pharmacological Reviews. 57 (4): 397–409. doi:10.1124/pr.57.4.4. PMID 16382098. S2CID 7332624.