상피 나트륨 채널
Epithelial sodium channel| 상피 나트륨 채널 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
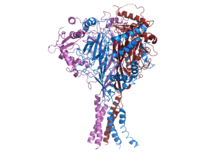 인간 [1]ENaC 구조 | |||||||||||
| 식별자 | |||||||||||
| 기호. | ASC | ||||||||||
| 팜 | PF00858 | ||||||||||
| 인터프로 | IPR001873 | ||||||||||
| 프로 사이트 | PDOC00926 | ||||||||||
| SCOP2 | 6BQN/SCOPe/SUPAM | ||||||||||
| TCDB | 1. A.6 | ||||||||||
| OPM 슈퍼 패밀리 | 181 | ||||||||||
| OPM단백질 | 4fz1 | ||||||||||
| |||||||||||
상피 나트륨 채널(ENAC)은 (아밀로라이드 민감 나트륨 채널이라고도 함) 나트륨에 선택적으로 투과되는 막 결합 이온 채널입니다.Na+) 3개의 상동 서브유닛α 또는 β, [2]β로 이루어진 헤테로트리머로서 조립되며, 이들 서브유닛은 SCNN1A, SCNN1B, SCNN1G, SCNN1D의 4개의 유전자에 의해 부호화된다.ENaC는 주로 신장 네프론의 수집 덕트에서 나트륨 이온의 재흡수에 관여합니다.폐부종, 낭포성 섬유증, COPD 및 COVID-19를 포함한 상피막 간의 유체 균형이 교란되는 질환에 관여하는 것 외에 단백질 분해된 형태의 ENaC는 인간의 소금 [3]맛 수용체로서 기능한다.
많은 촘촘한 상피의 꼭대기 막은 주로 이뇨 차단제 아밀로리드에 [2][4][5][6]대한 높은 친화력을 특징으로 하는 나트륨 채널을 포함합니다.이러한 채널은 체염 및 물의 항상성 [4]유지에 필수적인 활성 나트륨 재흡수의 첫 번째 단계를 중개합니다.척추동물에서, 채널은 신장, 대장, 폐 그리고 땀샘의 나트륨 재흡수를 통제한다; 그들은 또한 미각 지각에 역할을 한다.
상피 나트륨 채널은 구조적으로 아마도 진화적으로 P2X 퓨린 수용체, 즉 ATP를 검출할 때 활성화되는 통증 수용체와 관련이 있을 것입니다.
위치 및 기능
ENAC는 특히 신장(주로 수집관), 폐, 피부,[7] 남성 및 여성 생식 기관 및 [2][8][9]대장에 편극 상피 세포의 단막에 위치합니다.상피 나트륨 채널은 원위부 네프론, 호흡 및 생식 기관 및 외분비선에서 상피 단막 전체에 걸쳐 Naγ의 재흡수를 촉진한다.Na- 이온 농도는 세포외 삼투압의 주요 결정 요인이기 때문에 Na- 이온 농도의 변화는 유체의 이동과 그에 따른 유체 부피 및 혈압에 영향을 미친다.대장과 신장에서 ENaC의 활동은 미네랄 코르티코이드 알도스테론에 의해 조절된다.그것은 이뇨제로 의학적으로 사용되는 트리아메테렌이나 아밀로라이드 중 하나에 의해 차단될 수 있다.신장에서는 심방나트륨 펩타이드에 의해 억제되어 나트륨뇨와 이뇨를 일으킨다.
뇌의 상피 Na+ 채널(ENAC)은 혈압 [10]조절에 중요한 역할을 한다.바소프레신(VP) 뉴런은 심혈관 항상성을 유지하기 위해 신경 내분비와 자율 반응을 조정하는 데 중추적인 역할을 한다.높은 식염 섭취는 VP [10]뉴런의 정상적 탈분극 상태를 초래하는 ENaC의 발현과 활성을 증가시킨다.이것은 식염 섭취가 ENAC 활동을 통해 VP 뉴런의 활동에 어떻게 영향을 미치는가에 기초하는 메커니즘 중 하나이다.뇌의 ENAC 채널은 식이 나트륨에 대한 혈압 반응에 관여합니다.
고해상도 면역 형광 연구는 호흡기와 여성 생식기에서 ENaC가 다섬모세포의 [8]표면을 덮고 있는 섬모의 전체 길이를 따라 위치한다는 것을 밝혀냈다.따라서 이 운동성 섬모 상피에서 ENaC는 근막액의 삼투압 조절제로서 기능하며, 섬모의 운동성에 필요한 깊이로 유체량을 유지하는 데 그 기능이 필수적이다.호흡기에서 이 움직임은 점막 표면을 맑게 하는데 필수적이며, 여성 생식기관에서는 섬모의 운동이 난모세포의 [8]이동에 필수적입니다.
ENAC와 달리 섬모에는 염화물 이온 수송을 조절하는 CFTR이 없다.이러한 연구결과는 ENaC가 CFTR과의 직접적인 상호작용에 의해 하향조절된다는 이전의 가설과 모순된다.낭포성 섬유증(CF) 환자에서는 CFTR이 ENaC를 다운 레귤레이션할 수 없어 폐에 대한 과흡수와 재발성 폐 감염을 일으킨다.리간드 게이트 이온 [11]채널일 수 있다는 주장이 제기되었습니다.
피부 표피층에서는 각질세포, 피지선 [7]및 평활근세포에서 ENAC가 발현된다.이러한 세포에서 ENaC는 대부분 세포질에 [7]위치한다.에크린 땀샘에서 ENAC는 주로 땀덕트의 [7]내강과 마주보는 꼭대기 막에 위치한다.이러한 도관에서 ENaC의 주요 기능은 땀으로 배출되는 Na μ 이온의 재흡입이다.전신성 사이비 히포알도스테론증 타입 I을 일으키는 ENaC 돌연변이를 가진 환자에서 환자는 특히 더운 기후에서 상당한 양의 Na, 이온을 잃을 수 있다.
ENaC는 또한 미각 수용체에서 발견되는데, 소금기 지각에 중요한 역할을 한다.설치류에서, 사실상 전체 소금 맛은 ENaC에 의해 매개되는 반면, 인간에게는 덜 중요한 역할을 하는 것처럼 보입니다: 약 20%가 상피 나트륨 채널에 인가될 수 있습니다.
ENaC의 원생 변종 또한 인간의 소금 맛 수용체 역할을 한다.이러한 역할은 4-프로필페닐 2-후로산염이 식탁용 소금인 염화나트륨(NaCl)의 짠맛 지각에 미치는 영향을 평가하기 위해 인간의 감각 연구를 통해 처음 확인되었다.4-프로필페닐 2-프로에이트는 단백질 분해 ENAC를 [12]활성화하기 위해 발견된 화합물이다.
이온 선택성
연구에 따르면 ENAC 채널은 Na 및+ Li 이온에는+ 투과성이 있지만 K,[13][14] Cs+ 또는+ Rb 이온에는+ 투과성이 매우 낮다.
수송 반응
Na 채널에 대한+ 일반화된 전송 반응은 다음과 같습니다.
- Na+ (아웃) → Na+ (인)
데스토딘의 경우:
- 양이온(out) → 양이온(in)
구조.
ENaC는 α, β, [2][15]β의 세 가지 다른 서브유닛으로 구성되어 있으며,[16] 세 서브유닛 모두 멤브레인 기능 채널의 멤브레인 어셈블리로 이동하기 위해 필수적이다.각 ENAC 서브유닛의 C 말단은 PPXY 모티브를 포함하고 있으며, β 또는 δ-ENAC 서브유닛에서 돌연변이 또는 삭제되면 인간 상염색체 우성 고혈압 형태인 리들 증후군으로 이어진다.ENaC의 크라이오EM 구조는 채널이 같은 [17][18]계열에 속하는 산 감지 이온 채널 1(ASIC1)과 같은 헤테로 이성질 단백질임을 나타낸다.각 서브유닛은 2개의 막간나선 및 세포외 루프로 구성된다.세 가지 폴리펩타이드 모두의 아미노 및 카르복시 터미니는 세포졸에 위치한다.
ASIC1의 결정 구조와 부위 지향 돌연변이 유발 연구는 ENaC가 세 개의 서브유닛 [14][19]사이에 중심 대칭축을 따라 위치한 중심 이온 채널을 가지고 있음을 시사한다.
구조면에서 이 패밀리에 속하는 단백질은 약 510~920개의 아미노산 잔기로 구성되어 있다.이들은 세포 내 N 말단 영역과 이어서 막외 도메인, 큰 세포 외 루프, 두 번째 막내 세그먼트 및 C 말단 세포 내 [20]꼬리로 구성된다.
γ-서브유닛
또한 α-서브유닛과 상당한 배열 유사성을 공유하고 β-서브유닛 및 β-서브유닛과 함께 기능성 이온채널을 형성할 수 있는 제4의 이른바 β-서브유닛이 있다.이러한 β-, β-, β-ENAC는 췌장, 고환, 폐, 난소에 나타난다.그 기능은 아직 알려지지 않았다.
가족들
상피+ Na 채널(ENAC) 패밀리의 구성원은 알파, 베타, 감마 [5]및 델타라고 하는 4개의 아족으로 분류된다.단백질은 각각 큰 세포외 루프로 분리된 2개의 막간 스패닝 세그먼트(TMS)를 가진 동일한 외관 토폴로지를 나타낸다.현재까지 연구되고 있는 대부분의 ENaC 단백질에서 세포외 도메인은 고도로 보존되어 있으며 다수의 시스테인 잔기를 포함하고 측면 C 말단 양성 TM 영역은 올리고머 채널 단백질 복합체의 친수성 모공 형성에 기여하는 것으로 가정된다.잘 보존된 세포외 도메인은 채널의 활동을 조절하는 수용체 역할을 하는 것으로 생각된다.
상피세포에서 나온 척추동물 ENaC 단백질은 계통수에서 긴밀하게 뭉쳐진다; 전압에 민감하지 않은 ENaC 상동물은 뇌에서도 발견된다.웜 드로딘을 포함한 많은 배열된 C. elegans 단백질은 서로뿐만 아니라 척추동물 단백질과도 멀리 관련이 있습니다.척추동물 ENAC 단백질은 케노하브디션 [20]엘레강스의 퇴행성 물질인 deg-1, del-1, mec-4, mec-10 및 unc-8과 유사합니다.이 단백질들은 변이되어 신경 분해를 일으킬 수 있으며 나트륨 채널을 형성하는 것으로도 생각됩니다.
슈퍼 패밀리
상피 나트륨(Na+) 채널(ENAC) 패밀리는 ENaC/P2X 슈퍼 [21]패밀리에 속합니다.ENaC 수용체와 P2X 수용체는 유사한 3-d 구조를 가지고 있으며 [22]상동체이다.
유전자
ENaC의 세 서브유닛을 코드하는 세 유전자의 엑손-인트론 구조는 배열의 [23]차이에도 불구하고 고도로 보존되었다.
관련된 아밀로라이드 민감 나트륨 채널은 4개입니다.
안정된 ENAC 셀 회선
포유동물 세포 배양에서 ENAC의 발현은 세포독성이 있어 나트륨 섭취, 세포 팽창 및 세포 사멸을 초래하고, ENAC를 연구하기 위한 안정적인 세포주 생성을 복잡하게 한다.크로모버트 기술은 ENAC의 [24]기능적이고 안정적이며 실행 가능한 발현을 할 수 있는 희귀 클론을 분리하기 위해 형광 신호 프로브와 유동 세포계를 사용하여 안정적인 ENAC 세포주를 생산할 수 있게 했다.
임상적 의의

CFTR과의 ENaC 상호작용은 낭포성 섬유증에서 병태생리학적으로 중요한 관련이 있다.CFTR은 염화물 운반을 담당하는 트랜스막 채널이며, 이 단백질의 결함은 낭포성 섬유증을 유발하며, 부분적으로 기능성 CFTR이 없는 경우 ENaC 채널의 상향 조절을 통해 발생합니다.
기도에서 CFTR은 염화물의 분비를 허용하고 나트륨 이온과 물은 수동적으로 따라갑니다.그러나 기능성 CFTR이 없는 경우 ENaC 채널은 업 레귤레이션되며 나트륨 이온을 재흡수함으로써 염분비와 수분 분비를 더욱 감소시킨다.이와 같이 낭포성 섬유증의 호흡기 합병증은 염화물 분비 부족만이 아니라 나트륨과 물의 재흡수가 증가하여 발생한다.이것은 두껍고 건조된 점액의 퇴적을 초래하는데, 이것은 호흡기에 모이고, 가스 교환을 [25]방해하고 박테리아를 수집할 수 있게 합니다.단, CFTR의 업 레귤레이션은 고활성 [26]ENAC의 영향을 수정하지 않습니다.아마도 칼륨 채널, 아쿠아포린 또는 Na/[27]K-ATPase와 같은 폐 상피 조직에서 기능성 이온 항상성을 유지하기 위해 다른 상호작용 단백질이 필요할 것이다.
땀샘에서 CFTR은 땀 덕트 내 염화물의 재흡수를 담당합니다.염화물 흐름으로 인한 전기화학적 구배 때문에 나트륨 이온은 ENaC를 통해 수동적으로 따라갑니다.이것은 소금과 물의 손실을 줄여줍니다.낭포성 섬유증에서 염화물 흐름이 없으면 나트륨 이온이 ENaC를 통해 흐르지 않아 염분과 수분 손실이 커집니다.(이것은 ENAC 채널의 상향 조절에도 불구하고, 땀 덕트의 흐름이 CFTR을 통한 염화물 흐름에 의해 설정된 전기 화학적 구배에 의해 제한되기 때문에) 따라서, 환자의 피부는 짠 맛이 나고, 이것은 과거와 오늘날 모두 현대 전기 [28]테스트에 의해 질병을 진단하는 데 일반적으로 사용됩니다.
β 및 β 서브유닛에 대한 기능 돌연변이의 이득은 리들 [29]증후군과 관련이 있다.
아밀로라이드 및 트리아메테렌은 상피 나트륨 채널 차단제 역할을 하는 칼륨 스페어링 이뇨제입니다.
레퍼런스
- ^ Noreng S, Bharadwaj A, Posert R, Yoshioka C, Baconguis I (September 2018). "Structure of the human epithelial sodium channel by cryo-electron microscopy". eLife. 7: e39340. doi:10.7554/eLife.39340. PMC 6197857. PMID 30251954.
- ^ a b c d Hanukoglu I, Hanukoglu A (April 2016). "Epithelial sodium channel (ENaC) family: Phylogeny, structure-function, tissue distribution, and associated inherited diseases". Gene. 579 (2): 95–132. doi:10.1016/j.gene.2015.12.061. PMC 4756657. PMID 26772908.
- ^ Shekdar K, Langer J, Venkatachalan S, Schmid L, Anobile J, Shah P, et al. (March 2021). "Cell engineering method using fluorogenic oligonucleotide signaling probes and flow cytometry". Biotechnology Letters. 43 (5): 949–958. doi:10.1007/s10529-021-03101-5. PMC 7937778. PMID 33683511.
- ^ a b Garty H (May 1994). "Molecular properties of epithelial, amiloride-blockable Na+ channels". FASEB Journal. 8 (8): 522–8. doi:10.1096/fasebj.8.8.8181670. PMID 8181670. S2CID 173677.
- ^ a b Le T, Saier MH (1996). "Phylogenetic characterization of the epithelial Na+ channel (ENaC) family". Molecular Membrane Biology. 13 (3): 149–57. doi:10.3109/09687689609160591. PMID 8905643.
- ^ Waldmann R, Champigny G, Bassilana F, Voilley N, Lazdunski M (November 1995). "Molecular cloning and functional expression of a novel amiloride-sensitive Na+ channel". The Journal of Biological Chemistry. 270 (46): 27411–4. doi:10.1074/jbc.270.46.27411. PMID 7499195.
- ^ a b c d Hanukoglu I, Boggula VR, Vaknine H, Sharma S, Kleyman T, Hanukoglu A (June 2017). "Expression of epithelial sodium channel (ENaC) and CFTR in the human epidermis and epidermal appendages". Histochemistry and Cell Biology. 147 (6): 733–748. doi:10.1007/s00418-016-1535-3. PMID 28130590. S2CID 8504408.
- ^ a b c Enuka Y, Hanukoglu I, Edelheit O, Vaknine H, Hanukoglu A (March 2012). "Epithelial sodium channels (ENaC) are uniformly distributed on motile cilia in the oviduct and the respiratory airways". Histochemistry and Cell Biology. 137 (3): 339–53. doi:10.1007/s00418-011-0904-1. PMID 22207244. S2CID 15178940.
- ^ Sharma S, Hanukoglu A, Hanukoglu I (April 2018). "Localization of epithelial sodium channel (ENaC) and CFTR in the germinal epithelium of the testis, Sertoli cells, and spermatozoa". Journal of Molecular Histology. 49 (2): 195–208. doi:10.1007/s10735-018-9759-2. PMID 29453757. S2CID 3761720.
- ^ a b Sharma K, Haque M, Guidry R, Ueta Y, Teruyama R (September 2017). "Effect of dietary salt intake on epithelial Na+ channels (ENaC) in vasopressin magnocellular neurosecretory neurons in the rat supraoptic nucleus". The Journal of Physiology. 595 (17): 5857–5874. doi:10.1113/JP274856. PMC 5577521. PMID 28714095.
- ^ Horisberger JD, Chraïbi A (2004). "Epithelial sodium channel: a ligand-gated channel?". Nephron Physiology. 96 (2): 37–41. doi:10.1159/000076406. PMID 14988660. S2CID 24608792.
- ^ Shekdar K, Langer J, Venkatachalan S, Schmid L, Anobile J, Shah P, et al. (March 2021). "Cell engineering method using fluorogenic oligonucleotide signaling probes and flow cytometry". Biotechnology Letters. 43 (5): 949–958. doi:10.1007/s10529-021-03101-5. PMC 7937778. PMID 33683511.
- ^ Happle R (October 1990). "Ptychotropism as a cutaneous feature of the CHILD syndrome". Journal of the American Academy of Dermatology. 23 (4 Pt 1): 763–6. doi:10.1016/0190-9622(90)70285-p. PMID 2229513.
- ^ a b Hanukoglu I (February 2017). "ASIC and ENaC type sodium channels: conformational states and the structures of the ion selectivity filters". The FEBS Journal. 284 (4): 525–545. doi:10.1111/febs.13840. PMID 27580245. S2CID 24402104.
- ^ Loffing J, Schild L (November 2005). "Functional domains of the epithelial sodium channel". Journal of the American Society of Nephrology. 16 (11): 3175–81. doi:10.1681/ASN.2005050456. PMID 16192417.
- ^ Edelheit O, Hanukoglu I, Dascal N, Hanukoglu A (April 2011). "Identification of the roles of conserved charged residues in the extracellular domain of an epithelial sodium channel (ENaC) subunit by alanine mutagenesis". American Journal of Physiology. Renal Physiology. 300 (4): F887-97. doi:10.1152/ajprenal.00648.2010. PMID 21209000.
- ^ Noreng S, Bharadwaj A, Posert R, Yoshioka C, Baconguis I (September 2018). "Structure of the human epithelial sodium channel by cryo-electron microscopy". eLife. 7: e39340. doi:10.7554/eLife.39340. PMC 6197857. PMID 30251954.
- ^ Jasti J, Furukawa H, Gonzales EB, Gouaux E (September 2007). "Structure of acid-sensing ion channel 1 at 1.9 A resolution and low pH". Nature. 449 (7160): 316–23. Bibcode:2007Natur.449..316J. doi:10.1038/nature06163. PMID 17882215.
- ^ Edelheit O, Ben-Shahar R, Dascal N, Hanukoglu A, Hanukoglu I (April 2014). "Conserved charged residues at the surface and interface of epithelial sodium channel subunits--roles in cell surface expression and the sodium self-inhibition response". The FEBS Journal. 281 (8): 2097–111. doi:10.1111/febs.12765. PMID 24571549. S2CID 5807500.
- ^ a b Snyder PM, McDonald FJ, Stokes JB, Welsh MJ (September 1994). "Membrane topology of the amiloride-sensitive epithelial sodium channel". The Journal of Biological Chemistry. 269 (39): 24379–83. doi:10.1016/S0021-9258(19)51094-8. PMID 7929098.
- ^ "ATP-gated P2X Receptor Cation Channel (P2X Receptor) Family". Functional and Phylogenetic Classification of Membrane Transport Proteins. Saier Lab. Group, UCSD and SDSC.
- ^ Chen JS, Reddy V, Chen JH, Shlykov MA, Zheng WH, Cho J, et al. (2011). "Phylogenetic characterization of transport protein superfamilies: superiority of SuperfamilyTree programs over those based on multiple alignments". Journal of Molecular Microbiology and Biotechnology. 21 (3–4): 83–96. doi:10.1159/000334611. PMC 3290041. PMID 22286036.
- ^ Saxena A, Hanukoglu I, Strautnieks SS, Thompson RJ, Gardiner RM, Hanukoglu A (November 1998). "Gene structure of the human amiloride-sensitive epithelial sodium channel beta subunit". Biochemical and Biophysical Research Communications. 252 (1): 208–13. doi:10.1006/bbrc.1998.9625. PMID 9813171.
- ^ Shekdar K, Langer J, Venkatachalan S, Schmid L, Anobile J, Shah P, et al. (March 2021). "Cell engineering method using fluorogenic oligonucleotide signaling probes and flow cytometry". Biotechnology Letters. 43 (5): 949–958. doi:10.1007/s10529-021-03101-5. PMC 7937778. PMID 33683511.
- ^ Mall M, Grubb BR, Harkema JR, O'Neal WK, Boucher RC (May 2004). "Increased airway epithelial Na+ absorption produces cystic fibrosis-like lung disease in mice". Nature Medicine. 10 (5): 487–93. doi:10.1038/nm1028. PMID 15077107. S2CID 45366866.
- ^ Grubb BR, O'Neal WK, Ostrowski LE, Kreda SM, Button B, Boucher RC (January 2012). "Transgenic hCFTR expression fails to correct β-ENaC mouse lung disease". American Journal of Physiology. Lung Cellular and Molecular Physiology. 302 (2): L238-47. doi:10.1152/ajplung.00083.2011. PMC 3349361. PMID 22003093.
- ^ Toczyłowska-Mamińska R, Dołowy K (February 2012). "Ion transporting proteins of human bronchial epithelium". Journal of Cellular Biochemistry. 113 (2): 426–32. doi:10.1002/jcb.23393. PMID 21975871. S2CID 31970069.
- ^ Berdiev BK, Qadri YJ, Benos DJ (February 2009). "Assessment of the CFTR and ENaC association". Molecular BioSystems. 5 (2): 123–7. doi:10.1039/B810471A. PMC 2666849. PMID 19156256.
- ^ 이온 채널 질환

