방향성 화합물
Aromatic compound방향성 화합물은 주변 전체에 산소를 제거한 파이 전자가 있는 하나 이상의 고리를 포함하는 화학 화합물이다. 방향성을 보이는 화합물과는 대조적으로, 알리파틱 화합물은 이러한 탈초점화가 결여되어 있다. "자동"이라는 용어는 방향성을 결정하는 물리적 메커니즘이 발견되기 전에 할당되었고, 그러한 많은 화합물들이 달콤하거나 즐거운 냄새를 가지고 있다는 사실만을 언급하였다. 그러나 모든 방향성 화합물들이 달콤한 냄새를 가지고 있는 것은 아니며, 달콤한 냄새를 가진 모든 화합물들이 방향성 화합물인 것은 아니다. 방향족 탄화수소, 즉 아렌은 탄소 원자와 수소 원자만을 포함하는 방향족 유기 화합물이다. 방향족 화합물에서 6개의 탄소 원자를 구성하는 것을 단순한 방향족 화합물 벤젠의 이름을 따서 "벤젠 고리"라고 부르거나, 더 큰 화합물의 일부일 때 페닐 그룹이라고 부른다.
모든 방향족 화합물이 벤젠을 기반으로 하는 것은 아니다; 방향성은 후켈의 법칙을 따르는 헤테로아렌에서도 나타날 수 있다(단축 링의 경우: 그것의 π 전자 수가 4n + 2일 때, 여기서 n = 0, 1, 2, 3, ...). 이러한 화합물에서 적어도 하나의 탄소 원자는 이질소 산소, 질소 또는 유황 중 하나로 대체된다. 방향족 특성을 가진 비벤젠 화합물의 예로는 단일 산소 원자를 포함하는 5-엠베드 링의 헤테로사이클릭 화합물인 푸란과 질소 원자 1개를 포함하는 6-엠베드 링의 헤테로사이클릭 화합물인 피리딘이 있다.[1]
벤젠 링 모델
벤젠, 6 }은 가장 덜 복잡한 방향족 탄화수소인데, 그런 이름이 처음이었다. 그 결합의 본질은 19세기에 아우구스트 케쿨레에 의해 처음으로 인정되었다. 육각 사이클의 각 탄소 원자는 공유할 전자가 4개 있다. 하나는 수소 원자로 가고, 하나는 이웃한 두 탄소로 간다. 이렇게 되면 하나의 전자가 두 개의 인접한 탄소 원자와 공유하게 되어 하나의 탄소 원자와 이중 결합을 형성하고 다른 하나의 탄소와의 결합을 남기기 때문에 벤젠 분자의 어떤 표현은 단일 결합과 이중 결합이 교대로 이루어진 육각형으로 그려진다.
그 구조물의 다른 묘사는 6개의 전자가 반지 자체의 크기만큼 분산된 분자 궤도로 떠돌고 있음을 나타내기 위해 그 안에 원을 그리며 육각형을 묘사한다. 이것은 6개의 탄소-탄소 결합의 등가 특성을 나타내며, 모든 채권 순서 1.5를 공진 양식으로 설명한다. 전자는 링 위와 아래에 떠 있는 것으로 시각화되며, 전자장은 링을 평평하게 유지하기 위해 작용한다.
방향족 탄화수소의 일반 특성:
- 그들은 향기를 보인다.
- 탄소-수소 비율이 높다.
- 그들은 높은 탄소-수소 비율 때문에 강한 검붉은 황색 불꽃과 함께 탄다.
- 그들은 전기적 대체 반응과 핵분열 방향제 대체를 겪는다.
방향성의 원 상징은 1925년[2] 로버트 로빈슨 경과 그의 제자 제임스 아밋에 의해 소개되었고 1959년부터 유기화학에 관한 모리슨 & 보이드 교과서에 의해 대중화되었다. 기호의 적절한 사용은 논쟁의 여지가 있다: 어떤 출판물은 그것을 어떤 주기 π 시스템에도 사용하는 반면, 다른 출판물은 후켈의 통치에 따르는 π 시스템에만 사용한다. Jensen은[3] 로빈슨의 원래 제안에 따라 원 기호 사용이 단핵 6 π 전자 계통으로 제한되어야 한다고 주장한다. 이러한 방식으로 6-중앙 6-전자 결합에 대한 원 기호를 3-중앙 2-전자 결합에 대한 Y 기호와 비교할 수 있다.
아레네 합성
불포화 또는 부분적으로 불포화 주기 전구체로부터 아레네 화합물을 형성하는 반응을 단순히 아로마화라고 한다. 비-아레네 전구체로부터 아레네를 유기적으로 합성하기 위한 많은 실험실 방법이 존재한다. 많은 방법들이 사이클로어 추가 반응에 의존한다. 알킨 트리머라이징은 3알킨의 [2+2+2] 사이클링을 설명하는데, ö츠 반응에서는 알킨, 일산화탄소, 크롬 카베네 콤플렉스가 반응제들이다. 이산화 탄소나 일산화탄소의 배출에 따른 피론 또는 사이클로펜타디엔온과 알키네스의 디엘-알데르 반응도 아렌 화합물을 형성한다. 버그만 사이클링에서 반응 물질은 에닌과 수소 기증자다.
시약들은 백금, 팔라듐, 니켈(역수소화), 퀴논, 황, 셀레늄과 같은 수소화에 사용되는 촉매들이다.[4]
반응
방향족 링 시스템은 많은 유기적인 반응에 참여한다.
방향족 치환
방향족 대체에서 아레네 링의 한 대체물, 보통 수소는 다른 대체물로 대체된다. 두 가지 주요 유형은 활성 시약이 전기 시약일 경우 전기 방향족 치환과 시약이 핵일 경우 핵 방향족 치환이다. 급진-핵분열 방향족 치환에서 활성 시약은 급진적이다. 전기영양 방향제 치환 예로는 살리실산 질화(nitration)가 있다.[5]
커플링 반응
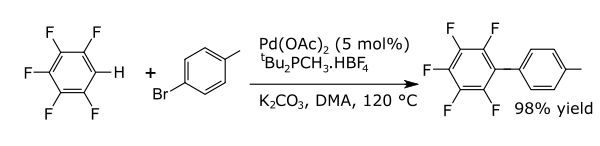
결합 반응에서 금속은 두 개의 공식 급진적 파편 사이의 결합을 촉매한다. 아레네와의 공통적인 결합 반응은 알킬라렌, 비닐 아레네, 버럴, 새로운 탄소-질소 결합(아닐린) 또는 새로운 탄소-산소 결합(아릴록시 화합물)과 같은 새로운 탄소-탄소 결합을 형성한다. 과불화불화탄젠의[6] 직접 아릴레이팅이 그 예다.
수소화
아렌의 수소화는 포화 고리를 만든다. 화합물 1-나프톨은 데칼린-올 이소머의 혼합물로 완전히 감소한다.[7]
수산화나트륨 수산화 메틸로 알킬화하여 2-메틸-1,3-사이클로헥산디온에 라니 니켈로 수소를 첨가한 레소르시놀 화합물은 에놀레이트를 형성한다.[8]
사이클로아데스
사이클로어 추가 반응은 흔하지 않다. 비정상적인 열 디엘-알데르 반응성은 바그너-자우르그 반응에서 찾을 수 있다. 알켄과의 다른 광화학 사이클로어 추가 반응은 흥분제를 통해 발생한다.
디로마화
디노미화 반응에서 반응물질의 방향성은 영구히 상실된다.
벤젠 및 벤젠 파생상품
벤젠 유도체는 중앙 벤젠 코어에 부착된 1개에서 6개까지의 대체물이 있다. 대체제가 1개뿐인 벤젠 화합물의 예로는 히드록실 그룹을 운반하는 페놀과 메틸 그룹을 가진 톨루엔이 있다. 링에 둘 이상의 대체물이 있을 때, 그들의 공간 관계는 정형, 메타, 파라와 같은 영역 대체 패턴을 고안하는 데 중요해진다. 예를 들어 메틸 그룹과 히드록실 그룹을 서로 옆에 둘 수 있기 때문에(정통), 한 포지션을 서로 제거하거나(메타), 두 포지션을 서로 제거(파라)할 수 있기 때문에 크레스올을 위해 3개의 이소머가 존재한다. 자일레놀은 히드록실 그룹 외에 2개의 메틸 그룹을 가지고 있으며, 이 구조를 위해 6개의 이소머가 존재한다.
- 대표적인 아레네 화합물
아렌 반지는 전하를 안정시키는 능력이 있다. 이는 예를 들어 히드록실(OH)에서 산성인 페놀(CH65–OH)에서 볼 수 있는데, 이는 이 산소(알카산화물 –O−)의 전하량이 벤젠 링에 부분적으로 소산되기 때문이다.
기타 단핵 방향족 탄화수소
다른 단핵 방향족 탄화수소로는 사이클로테트라데카헵타인 또는 사이클로옥타데카노네인이 있다.
다순환 방향족 탄화수소
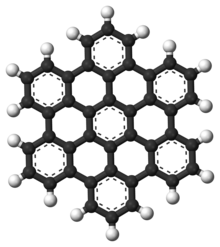
다핵 방향족 탄화수소(PAHs)는 융합 방향족 링으로 구성되며 이질성 또는 대체 물질을 함유하지 않는 방향족 탄화수소다.[9] 나프탈렌은 PAH. PAHs의 가장 간단한 예로 석유, 석탄, 타르 매장지에서 발생하며 연료 연소의 부산물로 생산된다(화석 연료든 바이오매스든). 오염물질로서, 일부 화합물이 발암성, 돌연변이성, 기형성 등으로 확인되었기 때문에, 그것들은 우려된다. PAH는 조리된 음식에서도 발견된다. 예를 들어, 굽거나 바비큐와 같은 고온에서 조리된 고기와 훈제 생선에서는 높은 수준의 PAH가 발견된다는 연구 결과가 나왔다.[10][11][12]
그것들은 또한 성간 매체, 혜성, 운석에서도 발견되며 가장 초기 형태의 생명체의 기초가 되는 후보 분자다. 그래핀에서는 PAH 모티브가 큰 2D 시트로 확장된다.
참고 항목
참조
- ^ "HighBeam Encyclopedia: aromatic compound".
- ^ Armit, James Wilkins; Robinson, Robert (1925). "Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases". J. Chem. Soc. Trans. 127: 1604–1618.
- ^ Jensen, William B. (April 2009). "The circle symbol for aromaticity" (PDF). J. Chem. Educ. 86 (4): 423–424. Bibcode:2009JChEd..86..423J. doi:10.1021/ed086p423.
- ^ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7
- ^ Webb, K.; Seneviratne, V. (1995). "A mild oxidation of aromatic amines". Tetrahedron Letters. 36 (14): 2377–2378. doi:10.1016/0040-4039(95)00281-G.
- ^ Lafrance, M.; Rowley, C.; Woo, T.; Fagnou, K. (2006). "Catalytic intermolecular direct arylation of perfluorobenzenes". Journal of the American Chemical Society. 128 (27): 8754–8756. CiteSeerX 10.1.1.631.607. doi:10.1021/ja062509l. PMID 16819868.
- ^ Meyers, A. I.; Beverung, W. N.; Gault, R. "1-Naphthol". Organic Syntheses. 51: 103.; Collective Volume, 6
- ^ Noland, Wayland E.; Baude, Frederic J. "Ethyl Indole-2-carboxylate". Organic Syntheses. 41: 56.; Collective Volume, 5
- ^ Fetzer, J. C. (2000). "The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons". Polycyclic Aromatic Compounds. New York: Wiley. 27 (2): 143. doi:10.1080/10406630701268255. ISBN 0-471-36354-5.
- ^ "Polycyclic Aromatic Hydrocarbons – Occurrence in foods, dietary exposure and health effects" (PDF). European Commission, Scientific Committee on Food. December 4, 2002.
- ^ Larsson, B. K.; Sahlberg, GP; Eriksson, AT; Busk, LA (1983). "Polycyclic aromatic hydrocarbons in grilled food". J. Agric. Food Chem. 31 (4): 867–873. doi:10.1021/jf00118a049. PMID 6352775.
- ^ "Polycyclic Aromatic Hydrocarbons (PAHs)". Agency for Toxic Substances and Disease Registry. 1996.
외부 링크
 위키미디어 커먼스의 아로마틱스 관련 매체
위키미디어 커먼스의 아로마틱스 관련 매체