페닐군
Phenyl group유기 화학에서 페닐 그룹, 즉 페닐 링은 CH라는65 공식을 가진 원자의 주기적인 그룹이다. 페닐 그룹은 벤젠과 밀접하게 연관되어 있으며 수소를 뺀 벤젠 링으로 볼 수 있으며, 기능 그룹의 역할을 하기 위해 일부 다른 원소나 화합물로 대체될 수 있다. 페닐 그룹은 6개의 탄소 원자가 육각 평면 링에 결합되어 있고, 그 중 5개는 개별 수소 원자에 결합되어 있으며, 나머지 탄소는 대체 원자에 결합되어 있다. 페닐 그룹은 유기화학에서 흔히 볼 수 있다.[1] 페닐 그룹은 종종 이중 결합과 단일 결합을 교대로 나타내지만 화학적으로 방향성이 높으며 링에 있는 탄소 원자 사이의 결합 길이가 같다.[1][2]
명명법
보통 "페닐 그룹"은 CH-와65 동의어로서 Ph 또는 φ 기호로 표현된다. 벤젠은 Ph-로 표기되기도 한다. 페닐 그룹은 일반적으로 다른 원자나 그룹에 부착된다. 예를 들어, 트리페닐메탄(PhCH3)은 동일한 탄소중심에 3개의 페닐 그룹이 부착되어 있다. 많은 또는 심지어 대부분의 페닐 화합물은 "페닐"이라는 용어로 설명되지 않는다. 예를 들어 클로로파생물 CHCl은65 일반적으로 클로로벤젠이라고 불릴 수 있지만 염화 페닐이라고 불릴 수 있다. 특별한 경우(그리고 드문 경우)에는 페닐 음이온(CH65−), 페닐 양이온(CH65+), 페닐 래디컬(CH65•) 등 격리된 페닐군이 검출된다.
Ph와 페닐은 고유하게 CH-를65 나타내지만 대체 파생상품도 페닐 용어를 사용하여 설명한다. 예를 들어, CHNO-는642 니트로페닐이고, CF-는65 펜타플루오로페닐이다. 단분해성 페닐 그룹(즉, 탈분해성 벤젠)은 전기영양성 방향족 치환 반응과 연관되며 제품은 아렌 치환 패턴을 따른다. 그래서, 주어진 대체 페닐 화합물은 정형외과(1,2-분열), 메타(1,3-분열), 파라(1,4-분열)의 3개의 이소머를 가지고 있다. 예를 들어, 페닐화합물(삼분해 벤젠)은 1,3,5-삼분해 또는 1,2,3-삼분해일 수 있다. 펜타플루오로페닐 그룹이 예시인 대체의 상위도가 존재하며 IUPAC 명명법에 따라 이름이 지정된다.
어원
페닐은 프랑스어 pényle에서 유래되었는데, 이는 그리스어 φαίωΩ(phaino)에서 유래한 것으로, 최초의 페닐 화합물이 조명에 사용되는 각종 가스를 만들고 정제하는 부산물이었기 때문에 '시닝'이라는 명칭이다.[3] 맥머리에 따르면 "이 단어는 1825년 마이클 패러데이가 런던 가로등에 사용된 조명 가스가 남긴 기름기 잔류물에서 벤젠이 발견된 것을 기념하는 그리스 페노("I bear light")에서 유래했다"[4]고 한다.
구조, 본딩 및 특성화
페닐 화합물은 벤젠(CH66)에서 파생되는데, 적어도 개념적으로 그리고 종종 생산 측면에서 나타난다. 그 전자적 특성 면에서 페닐 그룹은 비닐 그룹과 관련이 있다. 일반적으로 sp2 탄소 원자의 전기성이 높아 귀납적 철수군(-I)과 공명 기부군(+M)은 결합이 가능할 때 전자 밀도를 기부할 수 있는 π 시스템의 능력으로 간주된다.[5] 페닐 집단은 소수성이 있다. 페닐 그룹은 산화 및 감소에 저항하는 경향이 있다. 페닐 그룹(모든 방향족 화합물과 유사)은 알리파틱(비자동) 그룹의 등가 접합에 비해 안정성이 향상되었다. 이러한 안정성이 높아진 것은 방향족 분자 궤도의 고유한 특성 때문이다.[2]
페닐 그룹에서 탄소 원자 사이의 결합 길이는 약 1.4 å이다.[6]
H-NMR 분광학에서 페닐 그룹의 양성자는 일반적으로 약 7.27ppm의 화학적 변화를 가진다. 이러한 화학적 변화는 방향족 링 전류의 영향을 받으며 대체품에 따라 달라질 수 있다.
준비, 발생 및 적용
페닐 그룹은 대개 페닐 음이온이나 페닐 양이온의 원천으로 작용하는 시약을 사용하여 도입된다. 대표적인 시약으로는 페닐리튬(CHLi65)과 페닐마그네슘브로마이드(CHMgBr65)가 있다. 전기영양체는 페닐 유도체를 제공하기 위해 벤젠을 공격한다.
- C6H6 + E+ → C6H5E + H+
여기서+ E("전자파") = Cl+, NO2+, SO3. 이러한 반응을 전기영양 방향제 대체라고 한다.
- 페닐 그룹을 포함하는 대표적인 화합물
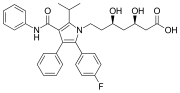
페닐 2개, p-fluorophenyl 1개 그룹이 등장하는 블록버스터급 약물 아토르바스타틴(Lipitor)이다. 이것은 고콜세스테롤라혈증을 가진 사람들의 콜레스테롤을 낮추는데 사용된다.
페닐알라닌, 흔한 아미노산.
비페닐, 두 개의 페닐 그룹으로 구성된다. 그 두 개의 고리는 같은 층이 아닌 경향이 있다.
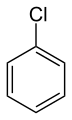
클로로벤젠(또는 페닐 염화물) 용제.
페닐 그룹은 자연 화합물과 합성 화합물 모두에서 발견된다(그림 참조). 천연물 중 가장 흔한 것은 페닐 그룹을 함유한 아미노산 페닐알라닌이다. 석유화학 산업의 주요 제품은 벤젠, 톨루엔, 자일렌 등으로 구성된 'BTX'로, 모두 페닐 화합물의 구성 요소다. 폴리머 폴리스티렌은 페닐 함유 모노머에서 파생되며 그 성질은 페닐 그룹의 강성과 친수성 때문이다. 많은 오염물질뿐만 아니라 많은 약품들도 페닐고리를 함유하고 있다. 페닐 함유 화합물 중 가장 간단한 것은 페놀, CHOH이다65. 흔히 페놀의 공진 안정성이 에탄올과 같은 알콜보다 강한 산을 만든다고 한다(pKa = 10 대 16–18). 그러나 유의미한 기여는 페놀에서 sp2 알파 탄소의 전기성이 알콜에서 sp3 알파 탄소에 비해 더 크다는 것이다.[7]
참조
- ^ a b March, Jerry (1992). Advanced organic chemistry: reactions, mechanisms, and structure (4th ed.). New York: Wiley. ISBN 978-0-471-60180-7.
- ^ a b "Aromaticity. Benzene and Other Aromatic Compounds". Virtual Textbook of Organic Chemistry. Michigan State University.
- ^ "phenyl". English by Lexico Dictionaries. Retrieved 24 July 2019.
- ^ McMurry, John E. (2009). Organic Chemistry, Enhanced Edition. Cengage Learning. p. 518. ISBN 9781111790042.
- ^ Hansch, Corwin.; Leo, A.; Taft, R. W. (1991-03-01). "A survey of Hammett substituent constants and resonance and field parameters". Chemical Reviews. 91 (2): 165–195. doi:10.1021/cr00002a004. ISSN 0009-2665.
- ^ Hameka, Hendrik F. (1987). "Computation of the structures of the phenyl and benzyl radicals with the UHF method". The Journal of Organic Chemistry. 52 (22): 5025–5026. doi:10.1021/jo00231a035. ISSN 0022-3263.
- ^ Silva, Pedro Jorge (2009). "Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens". The Journal of Organic Chemistry. 74 (2): 914–916. doi:10.1021/jo8018736. hdl:10284/3294. ISSN 0022-3263. PMID 19053615.
외부 링크
 위키미디어 커먼스의 페닐 그룹 관련 매체
위키미디어 커먼스의 페닐 그룹 관련 매체