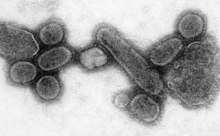
바이러스
Virus| 바이러스 | |
|---|---|
 | |
| SARS-CoV-2, 아족 코로나비리나과 소속 | |
| 바이러스 분류 | |
| (랭킹되지 않음): | 바이러스 |
| 렘스 | |
바이러스는 유기체의 살아있는 세포 안에서만 복제하는 잠수형 감염제다.[1]바이러스는 박테리아와 고고학을 포함한 동물과 식물에서 미생물에 이르기까지 모든 생명체를 감염시킨다.[2][3]드미트리 이바노프스키가 1898년 담배 식물을 감염시키는 비균 병원체를 기술하고 마르티누스 베이제린크에 의한 담배 모자이크 바이러스의 발견을 기술한 이후, 9,000종 이상의 바이러스 종들이 환경에 있는 수백만 종류의 바이러스를 상세히[5] 기술하고 있다.[4][6]바이러스는 지구의 거의 모든 생태계에서 발견되며 생물학적 실체의 가장 많은 유형이다.[7][8]바이러스에 대한 연구는 미생물학의 하위 전문인 바이러스학으로 알려져 있다.
감염되면 숙주세포는 종종 수천 개의 원본 바이러스를 신속하게 생성해야 한다.바이러스는 감염된 세포 안에 있지 않거나 세포를 감염시키는 과정에서 독립된 입자, 즉 (i) 유전 물질, 즉 바이러스가 작용하는 단백질의 구조를 인코딩하는 DNA나 RNA의 긴 분자, (ii) 단백질 코팅, 캡시드(capsid)로 구성되어 있으며, 이는 유전자를 둘러싸고 보호하는 것이다.ic 소재, 그리고 어떤 경우에는 (주) 지질의 외부 봉투.이러한 바이러스 입자의 모양은 단순한 나선형 및 이코사이드 형태에서부터 보다 복잡한 구조까지 다양하다.대부분의 바이러스 종은 광학 현미경으로 볼 수 없을 정도로 작은 처녀성을 가지고 있으며 대부분의 박테리아 크기의 100분의 1이다.
생명의 진화 역사에서 바이러스의 기원은 분명하지 않다: 일부는 세포 사이를 움직일 수 있는 DNA의 일부인 플라스미드에서 진화했을 수도 있고, 다른 일부는 박테리아에서 진화했을 수도 있다.진화에 있어서 바이러스는 수평적 유전자 전달의 중요한 수단이며, 이것은 성적 재생산과 유사한 방식으로 유전적 다양성을 증가시킨다.[9]바이러스는 일반적으로 생물을 정의하는 데 필요한 기준으로 여겨지는 세포구조와 같은 핵심 특성은 부족하지만 유전 물질을 운반하고 생식하며 자연선택을 통해 진화하기 때문에 일부 생물학자에 의해 생명체로 간주된다.그들은 일부지만 모든 그런 자질들을 가지고 있지 않기 때문에, 바이러스는 "생명의 가장자리에 있는 유기체"[10]로, 그리고 복제자로 묘사되어 왔다.[11]
바이러스는 여러 가지 방법으로 퍼진다.한 가지 전염 경로로는 벡터라고 알려진 질병을 가진 유기체를 통해 있다. 예를 들어, 바이러스는 진딧물과 같은 식물 수액을 먹고 사는 곤충에 의해 식물에서 식물로 옮겨지는 경우가 많다. 그리고 동물의 바이러스는 피를 빨아먹는 곤충에 의해 옮겨질 수 있다.인플루엔자 바이러스, 사스-CoV-2, 수두, 천연두, 홍역 등 많은 바이러스가 기침과 재채기를 통해 공중으로 퍼진다.바이러스성 위장염의 흔한 원인인 노로바이러스와 로타바이러스는 대뇌-구강경로를 통해 전염되며, 손으로 직접 접촉하거나 음식이나 물을 통해 전염된다.인간에게 감염을 일으키는 데 필요한 노로바이러스의 감염량은 100개 미만이 된다.[12]HIV는 성적인 접촉과 감염된 혈액에 노출되어 전염되는 여러 바이러스 중 하나이다.바이러스가 감염시킬 수 있는 호스트 세포의 다양성을 "호스트 레인지"라고 부른다.이것은 좁을 수 있다. 즉, 바이러스가 적은 종을 감염시킬 수 있다는 뜻이고, 또는 광범위하다는 것은 바이러스가 많은 종을 감염시킬 수 있다는 뜻이다.[13]
동물의 바이러스 감염은 보통 감염 바이러스를 제거하는 면역 반응을 유발한다.면역 반응은 또한 특정 바이러스 감염에 인위적으로 획득된 면역성을 부여하는 백신에 의해서도 생성될 수 있다.HIV/AIDS, HPV 감염, 바이러스성 간염을 유발하는 바이러스를 포함한 일부 바이러스는 이러한 면역 반응을 피하고 만성적인 감염을 초래한다.몇몇 종류의 항바이러스제가 개발되었다.
어원
The word is from the Latin neuter vīrus referring to poison and other noxious liquids, from the same Indo-European base as Sanskrit viṣa, Avestan vīša, and ancient Greek ἰός (all meaning 'poison'), first attested in English in 1398 in John Trevisa's translation of Bartholomeus Anglicus's De Proprietatibus Rerum.[14][15]라틴 바이런티우스('독성')에서 온 비린틱은 c. 1400까지 거슬러 올라간다.[16][17]'감염병을 일으키는 매개체'의 의미는 1892년 드미트리 이바노프스키에 의해 바이러스가 발견되기 훨씬 전인 [15]1728년에 처음 기록된다.영어 복수형은 바이러스(때로는 비라)인 반면,[18] 라틴어는 집단명사로 분류적으로 증명된 복수형이 없다(vīra는 네오라틴어로[19] 사용된다).형용사 바이러스는 1948년까지 거슬러 올라간다.[20]1959년부터 유래한 처녀자리(plulal virion)라는 용어는 세포에서 방출되어 같은 유형의 다른 세포를 감염시킬 수 있는 단일 바이러스 입자를 가리키는 말로도 쓰인다.[21][22]
역사

루이 파스퇴르는 광견병의 원인 물질을 찾을 수 없었고 현미경으로 탐지하기에는 너무 작은 병원체에 대해 추측했다.[23]1884년 프랑스의 미생물학자 찰스 체임벌랜드가 체임벌랜드 필터(또는 파스퇴르-체임벌랜드 필터)를 발명하여 체임벌랜드가 통과하는 용액에서 모든 박테리아를 제거하기에 충분할 정도로 작은 모공을 만들었다.[24]1892년 러시아의 생물학자 드미트리 이바노프스키는 현재 담배 모자이크 바이러스라고 알려진 것을 연구하기 위해 이 필터를 사용했다: 감염된 담배 식물에서 나온 찌그러진 잎 추출물은 박테리아를 제거하기 위해 여과한 후에도 여전히 전염성이 있었다.이바노프스키는 이 감염이 박테리아에 의해 생성된 독소에 의한 것일 수도 있다고 제안했지만, 그는 이 아이디어를 추구하지 않았다.[25]당시에는 모든 전염성 물질이 필터에 의해 유지되고 영양성분 매개체에서 자랄 수 있다고 생각되었다. 이것은 질병의 세균 이론의 일부였다.[4]1898년 네덜란드의 미생물학자 마르티누스 베이제린크는 이 실험을 반복하여 여과된 용액에 새로운 형태의 감염 물질이 포함되어 있다고 확신하게 되었다.[26]그는 이 물질이 분열하고 있는 세포에서만 증식하는 것을 관찰했지만, 그의 실험에서 입자로 만들어진 것이 드러나지 않자 이를 전염성 생체액(생존 세균)이라고 부르고 바이러스라는 단어를 다시 도입했다.베이제린크는 바이러스가 자연에서 액체라고 주장했는데, 나중에 그것이 미립자임을 증명했던 웬델 스탠리에 의해 신빙성이 떨어진 이론이다.[25]같은 해 프리드리히 뢰플러와 폴 프로슈는 비슷한 필터를 통해 최초의 동물 바이러스인 아프토바이러스(구제역)를 통과시켰다.[27]
20세기 초, 영국의 세균학자 프레드릭 트워트는 박테리아를 감염시키는 바이러스 그룹을 발견했는데, 지금은 박테리오파지[28](또는 흔히 '페이지'라고 불리며, 프랑스계 캐나다 미생물학자 펠릭스 d'Herelle은 한천판의 박테리아에 추가되면 죽은 박테리아의 영역을 만들어 낼 수 있는 바이러스를 묘사했다.그는 이들 바이러스의 정지를 정확히 희석시켰고, 모든 박테리아를 죽이기보다는 가장 높은 희석(가장 낮은 바이러스 농도)이 죽은 유기체의 분리된 영역을 형성한다는 것을 발견했다.이러한 영역을 세고 희석 인자에 곱한 것을 통해 그는 원래의 중지 상태에 있는 바이러스 수를 계산할 수 있었다.[29]페이지는 장티푸스나 콜레라 같은 질병에 대한 잠재적 치료법으로 알려졌으나 페니실린의 발달로 약속은 잊혀졌다.항생제에 대한 박테리아 내성이 발달하면서 박테리오파지의 치료적 사용에 대한 관심이 다시 높아졌다.[30]
19세기 말까지 바이러스는 감염성, 필터 통과 능력, 살아있는 숙주에 대한 요구 등의 관점에서 정의되었다.바이러스는 오직 식물과 동물에서만 자랐다.1906년 로스 그랜빌 해리슨은 림프에서 조직을 배양하는 방법을 발명했고, 1913년 E.스타인하르트, C.이스라엘과 R.A. 램버트는 이 방법을 사용하여 기니피그 각막조직의 파편에서 백신 바이러스를 배양했다.[31]1928년 H. B. M. C. M. M. M. M. Maitland는 다진 암탉의 콩팥을 정지시켜 백신 바이러스를 배양했다.그들의 방법은 1950년대까지 널리 채택되지 않았다. 그 당시 소아마비바이러스는 백신 생산을 위해 대규모로 성장했다.[32]
또 다른 돌파구는 1931년 미국의 병리학자 어니스트 윌리엄 굿파스처와 앨리스 마일스 우드러프가 수정 닭알에서 독감과 다른 여러 바이러스를 키웠을 때 나왔다.[33]1949년 존 프랭클린 엔더스, 토마스 웰러, 프레드릭 로빈스는 인간 배아 조직의 배양된 세포에서 소아마비 바이러스를 배양했는데,[34] 이것은 단단한 동물 조직이나 난자를 사용하지 않고 배양된 최초의 바이러스였다.이 연구는 힐러리 코프로스키와 조나스 소크가 효과적인 소아마비 백신을 만들 수 있게 했다.[35]
바이러스의 첫 이미지는 1931년 전자현미경의 발명으로 독일의 엔지니어 Ernst Russka와 Max Knoll에 의해 얻어졌다.[36]1935년 미국의 생화학자와 바이러스학자 웬델 메러디스 스탠리는 담배 모자이크 바이러스를 검사한 결과 대부분이 단백질로 만들어졌다는 사실을 발견했다.[37]얼마 후, 이 바이러스는 단백질과 RNA 부분으로 분리되었다.[38]담배 모자이크 바이러스는 가장 먼저 결정되었고, 따라서 담배의 구조는 상세하게 해명될 수 있었다.결정화된 바이러스의 최초의 X선 회절 사진은 1941년 베르날과 판쿠헨에 의해 입수되었다.로잘린드 프랭클린은 엑스레이 결정 사진을 바탕으로 1955년 바이러스의 전체 구조를 발견했다.[39]같은 해, 하인츠 프라운켈-콘라트와 로블리 윌리엄스는 정제된 담배 모자이크 바이러스 RNA와 그 단백질 코팅이 스스로 모여 기능 바이러스를 형성할 수 있다는 것을 보여주었는데, 이 간단한 메커니즘이 아마도 숙주 세포 내에서 바이러스가 생성되는 수단이었을 것임을 시사했다.[40]
20세기 후반은 바이러스 발견의 황금기였고, 이 기간 동안 기록되어 있는 동물, 식물, 박테리아 바이러스의 대부분이 발견되었다.[41]1957년 에퀴닌 동맥바이러스와 보바인 바이러스 설사증(페스티바이러스)의 원인이 발견되었다.1963년 바루치 블럼버그에 의해 B형 간염 바이러스가 발견되었고,[42] 1965년 하워드 테민은 첫 번째 레트로바이러스를 묘사했다.역분해효소는 역바이러스가 RNA의 DNA 복사를 위해 사용하는 효소로서 1970년 테민과 데이비드 볼티모어에 의해 처음으로 독자적으로 기술되었다.[43]1983년 프랑스 파스퇴르 연구소의 Luc Montagnier 팀은 현재 HIV라고 불리는 레트로 바이러스를 처음으로 격리시켰다.[44]1989년에 Chiron Corporation의 Michael Houton의 팀은 C형 간염을 발견했다.[45][46]
오리진스
바이러스는 생명체가 있는 곳이면 어디든 발견되며 살아있는 세포가 처음 진화했을 때부터 존재해 왔을 것이다.[47]바이러스의 기원은 화석을 형성하지 않기 때문에 불분명하기 때문에 분자 기법을 사용하여 어떻게 발생했는지를 조사한다.[48]게다가, 바이러스 유전 물질은 때때로 숙주 유기체의 세균선에 통합되는데, 이 물질은 숙주의 자손에게 여러 세대에 걸쳐 수직으로 전달될 수 있다.이것은 고생물학자들이 수백만년 전에 존재했던 고대 바이러스를 추적할 수 있는 귀중한 정보원을 제공한다.바이러스의 기원을 설명하는 것을 목표로 하는 세 가지 주요 가설이 있다.[49][50]
- 퇴행 가설
- 바이러스는 한때 더 큰 세포를 기생시키는 작은 세포였을지도 모른다.시간이 지남에 따라 그들의 기생에 필요치 않은 유전자는 없어졌다.리케티아와 클라미디아 박테리아는 바이러스처럼 숙주 세포 안에서만 번식할 수 있는 살아있는 세포다.그들은 기생에 대한 의존이 세포 밖에서 생존할 수 있게 한 유전자의 상실을 초래했을 가능성이 높기 때문에 이 가설을 뒷받침해 준다.이것을 '퇴행 가설',[51][52] 즉 '축소 가설'[53]이라고도 한다.
- 세포원시 가설
- 어떤 바이러스는 더 큰 유기체의 유전자로부터 "탈출"된 DNA나 RNA의 조각으로부터 진화했을지도 모른다.탈출한 DNA는 플라스미드(세포 사이를 움직일 수 있는 알몸의 DNA의 일부)나 트랜스포존(세포의 유전자 안에서 복제하여 서로 다른 위치로 이동하는 DNA의 분자)에서 나왔을 수 있다.[54]한때 "점핑 유전자"라고 불렸던 트랜스포존은 이동 유전 원소의 예로서 일부 바이러스의 기원이 될 수 있다.그것들은 1950년 바바라 맥클린톡에 의해 옥수수에서 발견되었다.[55]이것을 '비그랜시 가설'[51][56] 또는 '탈출 가설'[53]이라고 부르기도 한다.
- 공진화 가설
- 이것은 '바이러스 우선 가설'[53]이라고도 하며, 바이러스가 지구상에 세포가 처음 나타났던 것과 동시에 단백질과 핵산의 복잡한 분자에서 진화하여 수십억 년 동안 세포 생명에 의존했을 것이라고 제안한다.바이로이드는 단백질 코팅이 부족하기 때문에 바이러스로 분류되지 않는 RNA의 분자다.그것들은 여러 바이러스에 공통적인 특성을 가지고 있으며 종종 하위 바이러스제라고 불린다.[57]바이로이드는 식물의 중요한 병원균이다.[58]그들은 단백질을 암호화하는 것이 아니라 숙주 세포와 상호작용하고 복제를 위해 숙주 기계를 사용한다.[59]인간의 델타형 간염 바이러스는 바이로이드와 유사한 RNA 게놈을 갖고 있지만 B형 간염 바이러스에서 파생된 단백질 코트를 가지고 있어 자체 생산은 불가능하다.그러므로 그것은 결함이 있는 바이러스다.델타형 간염 바이러스 게놈은 숙주 세포 안에서 한 번 독립적으로 복제할 수 있지만, 새로운 세포로 전달될 수 있도록 단백질 코팅을 제공하기 위해서는 B형 간염 바이러스의 도움이 필요하다.[60]비슷한 방식으로 스푸트니크 viropage는 원생동물인 아칸타메바 카스텔라니에 감염되는 미미바이러스에 의존한다.[61]숙주세포에 있는 다른 바이러스 종의 존재에 의존하는 이들 바이러스는 '위성'이라고 불리며 바이로이드와 바이러스의 진화 매개체를 나타낼 수도 있다.[62][63]
과거에는 이러한 모든 가설들에 문제가 있었다: 퇴행적 가설은 왜 가장 작은 세포 기생충도 바이러스와 전혀 닮지 않는지를 설명하지 않았다.탈출 가설은 바이러스 입자의 복잡한 캡시드와 다른 구조를 설명하지 않았다.바이러스 우선 가설은 숙주 세포를 필요로 한다는 점에서 바이러스의 정의를 위반했다.[53]바이러스는 이제 고대로 인식되고 세 개의 영역으로 생명의 분화를 기점으로 하는 기원을 가지고 있다.[64]이 발견으로 현대의 바이러스학자들은 이 세 가지 고전적인 가설들을 재고하고 재평가하게 되었다.[64]
RNA 세포의[65] 조상 세계에 대한 증거와 바이러스 및 숙주 DNA 서열의 컴퓨터 분석은 다른 바이러스들 사이의 진화적 관계를 더 잘 이해하고 있으며 현대 바이러스의 조상들을 식별하는 데 도움을 줄 수 있다.현재까지 그러한 분석은 이들 가설 중 어느 것이 올바른지 입증하지 못했다.[65]현재 알려진 모든 바이러스가 공통 조상을 가지고 있을 가능성은 없어 보이고, 바이러스는 아마도 하나 이상의 메커니즘에 의해 과거에 수없이 발생했을 것이다.[66]
미생물학
생명특성
바이러스가 생물의 한 형태인지, 살아있는 유기체와 상호작용하는 유기적 구조인지에 대해서는 과학적인 의견이 엇갈린다.[11]이들은 유전자를 갖고 있고, 자연선택에 의해 진화하며,[67] 자가조립을 통해 여러 개의 복제본을 만들어 번식한다는 점에서 생물의 가장자리에 있는 유기체라고 설명되어 왔다.[10]그들은 유전자를 가지고 있지만, 생명체의 기본 단위로 흔히 볼 수 있는 세포 구조를 가지고 있지 않다.바이러스는 그들만의 신진대사가 없고 새로운 제품을 만들기 위해 숙주세포를 필요로 한다.따라서 그들은 숙주 세포[68] 밖에서 자연적으로 번식할 수 없다. 리케티아와 클라미디아와 같은 일부 박테리아는 같은 한계에도 불구하고 살아있는 유기체로 간주된다.[69][70]수용된 형태의 생명체는 세포분열을 이용하여 생식하는 반면, 바이러스는 세포 내에서 자발적으로 결합한다.자연선택을 받으면서도 유전적 돌연변이를 물려받기 때문에 크리스탈의 자율적 성장과 차이가 있다.숙주세포 내의 바이러스 자가조립은 생명체가 자기조립 유기 분자로 시작할 수 있었다는 가설에 더욱 신빙성을 부여하기 때문에 생명의 기원에 대한 연구에 시사하는 바가 있다.[2]
구조
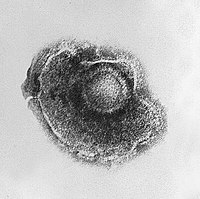
바이러스는 '모폴로로지'라고 불리는 크기와 모양의 매우 다양한 모습을 보여준다.일반적으로, 바이러스는 박테리아보다 훨씬 작으며 천 개 이상의 박테리오파지 바이러스가 대장균 박테리아의 세포 안에 들어갈 것이다.[71]연구된 많은 바이러스는 구형이며 지름은 20~300나노미터 사이이다.필라멘트인 일부 필로비러스는 총 길이가 1400nm에 이르며, 직경은 약 80nm에 불과하다.[72]대부분의 바이러스는 광학 현미경으로는 볼 수 없기 때문에 전자현미경을 스캐닝하고 전송해 시각화하는 데 사용한다.[73]바이러스와 배경의 대비를 높이기 위해 전자-덴스 "점"을 사용한다.이것들은 텅스텐과 같은 중금속의 소금 용액으로 얼룩이 덮인 지역에서 전자를 흩뿌리는 것이다.처녀막이 얼룩(양성 얼룩)으로 코팅되면 미세한 디테일이 가려진다.부정적인 얼룩은 배경만을 얼룩지게 함으로써 이 문제를 극복한다.[74]
바이러스라고 알려진 완전한 바이러스 입자는 캡시드라고 불리는 단백질의 보호 코팅으로 둘러싸인 핵산으로 구성되어 있다.이것들은 캐피섬레즈라고 불리는 단백질 서브유닛에서 형성된다.[75]바이러스는 숙주 세포막에서 파생된 지질 "envelope"를 가질 수 있다.캡시드는 바이러스성 게놈에 의해 암호화된 단백질로 만들어지며 그 모양이 형태학적 구분을 위한 기초가 된다.[76][77]일반적으로 바이러스 게놈의 존재가 요구되며, 바이러스 코딩 단백질 서브유닛은 캡시드를 형성하기 위해 자체 조립할 것이다.복잡한 바이러스는 그들의 캡시드를 만드는 것을 돕는 단백질을 암호로 한다.핵산과 관련된 단백질은 뉴클레오프로틴으로 알려져 있으며, 바이러스성 핵산과 바이러스성 캡시드 단백질의 연관성을 뉴클레오캡시드라고 한다.캡시드와 전체 바이러스 구조는 원자력의 현미경을 통해 기계적으로 (물리학적으로) 탐사될 수 있다.[78][79]일반적으로 5가지 주요 형태학 바이러스 유형이 있다.
- 헬리컬
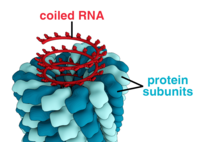
- 이들 바이러스는 중심축 주위에 쌓인 단일 형태의 캡시미어(capsyre)로 구성되어 있으며, 중심 공동 또는 관을 가질 수 있는 나선 구조를 형성한다.이 배열은 짧고 매우 단단한 막대 또는 길고 매우 유연한 필라멘트를 초래할 수 있다.유전 물질(일반적으로 단일 가닥 RNA, 그러나 어떤 경우에는 단일 가닥 DNA)은 음전하 핵산과 단백질에 대한 양전하 간의 상호작용에 의해 단백질 나선에 결합된다.전체적으로 헬리컬 캡시드의 길이는 그 안에 들어 있는 핵산의 길이와 관련되며, 지름은 캡시드르의 크기와 배열에 따라 달라진다.잘 연구된 담배 모자이크 바이러스와[80] 이노바이러스는 헬리컬 바이러스의 예다.
- 이코사헤드랄
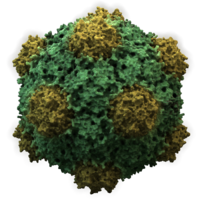
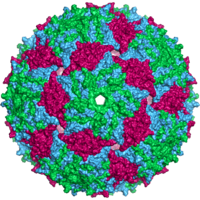
- 대부분의 동물성 바이러스는 치랄성 치랄성 대칭을 가진 이코사이드 또는 근구형이다.일반 이코사면체는 동일한 부항으로부터 닫힌 껍질을 형성하는 최적의 방법이다.각 삼각형 면에 필요한 최소 개수는 3개인데, 이는 이두면체에 60개를 준다.로타바이러스와 같은 많은 바이러스들은 60개 이상의 캡토머를 가지고 있고 구형으로 보이지만 그것들은 이 대칭을 유지한다.이를 이루기 위해 유인원의 캐피소스는 다른 5개의 캐피소스에 둘러싸여 펜톤이라고 불린다.삼각형의 면에 있는 갑상선은 다른 여섯 개의 면에 둘러싸여 있으며 육각형이라고 불린다.[82]육각형은 본질적으로 평평하고 12정점을 이루는 펜톤은 곡선이다.동일한 단백질이 펜타머와 육각체의 서브 유닛으로 작용하거나 다른 단백질로 구성될 수 있다.[83]
- 프롤레이트
- 이것은 다섯 개의 축을 따라 길게 늘어선 이코사시드론이며 박테리오파지머리의 일반적인 배열이다.이 구조는 양쪽 끝에 캡이 달린 실린더로 구성되어 있다.[84]
- 감싼
- 어떤 종류의 바이러스는 감염된 숙주세포를 둘러싸고 있는 외막이나 핵막이나 내소성 망막과 같은 내부막 중 하나인 세포막 중 하나의 변형된 형태로 자신을 감싸고 있어 바이러스성 봉투로 알려진 외지질 빌레이어를 얻는다.이 막은 바이러스 게놈과 숙주 게놈에 의해 암호화된 단백질로 채워져 있다; 지질막 그 자체와 현존하는 탄수화물은 전적으로 숙주로부터 유래한다.인플루엔자 바이러스, HIV(에이즈 유발), 중증급성호흡기증후군 코로나바이러스 2(COVID-19 유발)[85]는 이 전략을 사용한다.감춰진 대부분의 바이러스는 감염성 때문에 봉투에 의존한다.[86]
- 콤플렉스
- 이 바이러스는 순전히 나선형도 아니고 순전히 이코사이드도 아닌 캡시드를 가지고 있으며, 단백질 꼬리나 복잡한 외벽과 같은 여분의 구조를 가지고 있을 수 있다.엔테로박테리아 페이지 T4와 같은 일부 박테리오파지는 나선 꼬리에 묶인 이코사면체로 구성된 복잡한 구조를 가지고 있는데, 이 구조는 단백질 꼬리 섬유들이 돌출된 육각형 베이스 플레이트를 가지고 있을 수 있다.이 꼬리 구조는 분자 주사기처럼 작용하여 박테리아 숙주에 부착한 다음 바이러스 게놈을 세포에 주입한다.[87]
양귀비루스는 특이한 형태론을 가진 크고 복잡한 바이러스들이다.바이러스 게놈은 핵으로 알려진 중앙 디스크 구조 내의 단백질과 연관되어 있다.핵은 막과 알 수 없는 기능의 두 개의 측면으로 둘러싸여 있다.그 바이러스는 겉 봉투를 가지고 있고 표면에 두꺼운 단백질 층이 박혀 있다.처녀자리 전체가 난형에서 벽돌 모양에 이르는 약간 플롬프(plomphorphia)이다.[88]
거대 바이러스
미미바이러스는 가장 큰 특징적인 바이러스 중 하나로 캡시드 직경이 400nm이다.표면에서 100nm 크기의 단백질 필라멘트.캡시드는 전자 현미경 아래 육각형으로 나타나므로 캡시드는 아마도 이코사이드일 것이다.[89]2011년, 연구원들은 칠레의 라스 크루체스 해안의 해저에서 채취한 물 샘플에서 당시 알려진 가장 큰 바이러스를 발견했다.잠정적으로 메가바이러스 칠렌시스라고 이름 붙여진 이것은 기본적인 광학 현미경으로 볼 수 있다.[90]2013년 판도라바이러스 속은 칠레와 호주에서 발견됐으며, 메가바이러스와 미미바이러스보다 약 2배 큰 게놈을 갖고 있다.[91]모든 거대 바이러스는 dsDNA 게놈을 가지고 있으며 다음과 같은 몇 가지 패밀리로 분류된다.미미비르과, 피토비르과, 판도라비르과, 피코드나비르과, 몰리바이러스과.[92]
아르케아니아를 감염시키는 일부 바이러스는 다른 형태의 바이러스와 무관한 복잡한 구조를 가지고 있는데, 스핀들 모양의 구조에서부터 갈고리 막대, 눈물방울 또는 병을 닮은 바이러스에 이르기까지 매우 다양한 특이한 모양을 하고 있다.다른 고고학 바이러스는 꼬리가 달린 박테리오파지를 닮았고, 여러 개의 꼬리 구조를 가질 수 있다.[93]
게놈
| 속성 | 매개변수 |
|---|---|
| 핵산 |
|
| 모양 |
|
| 좌초 |
|
| 감각 |
|
바이러스성 종들 사이에서 엄청나게 다양한 유전체 구조를 볼 수 있다; 집단으로서, 그것들은 식물, 동물, 고고학 또는 박테리아보다 더 많은 구조적인 유전체 다양성을 포함하고 있다.상세하게 설명되어 있는 것은 7,000여종도 안 되지만 수백만종의 바이러스가 있다.[6][94]2021년 1월 현재 NCBI 바이러스 게놈 데이터베이스는 전체 게놈 서열을 19만3000개 이상 보유하고 있지만,[95] 의심할 여지 없이 더 많은 게놈 서열을 발견할 수 있다.[96][97]
바이러스는 DNA나 RNA 게놈을 가지고 있으며 각각 DNA 바이러스 또는 RNA 바이러스라고 불린다.대부분의 바이러스는 RNA 게놈을 가지고 있다.식물 바이러스는 단일 가닥의 RNA 게놈을 갖는 경향이 있고 박테리오파지는 이중 가닥의 DNA 게놈을 갖는 경향이 있다.[98]
바이러스성 게놈은 다항체에서와 같이 원형 또는 아데노바이러스에서와 같이 선형이다.핵산의 종류는 게놈의 모양과 무관하다.RNA 바이러스와 특정 DNA 바이러스 중 게놈은 종종 분리된 부분으로 나뉘는데, 이 경우 분할이라고 한다.RNA 바이러스의 경우, 각 세그먼트는 종종 하나의 단백질에 대해서만 코딩을 하고 그것들은 보통 하나의 캡시드에서 함께 발견된다.모든 세그먼트는 브롬 모자이크 바이러스와 몇 가지 다른 식물 바이러스로 증명되었듯이 바이러스가 감염되기 위해 동일한 바이러스 내에 있을 필요가 없다.[72]
바이러스성 게놈은 핵산 타입에 관계없이 거의 항상 단일 가닥(ss) 또는 이중 가닥(ds)이다.단일 가닥의 게놈은 가운데로 갈라진 사다리의 1/2과 유사한, 손상되지 않은 핵산으로 구성된다.이중 가닥 게놈은 사다리와 유사한 두 개의 상호 보완적인 쌍체 핵산으로 구성된다.헤파드나비르과에 속하는 것과 같은 일부 바이러스 계열의 바이러스 입자에는 부분적으로 이중 가닥이 있고 부분적으로 단일 가닥이 있는 게놈을 포함하고 있다.[98]
RNA 게놈을 가진 대부분의 바이러스와 단일 가닥 DNA(ssDNA) 게놈을 가진 바이러스의 경우, 바이러스성 메신저 RNA(mRNA)를 보완하는지에 따라 단일 가닥은 양감('플러스 스트랜드') 또는 음감('마이너스 스트랜드'라고 한다.양감 바이러스 RNA는 바이러스 mRNA와 같은 의미여서 적어도 그 일부는 숙주세포에 의해 즉시 번역될 수 있다.음성감 바이러스 RNA는 mRNA를 보완하므로 번역 전에 RNA 의존 RNA 중합효소에 의해 양성감 RNA로 전환되어야 한다.유전체 ssDNA를 가진 바이러스에 대한 DNA 명명법은 RNA 명명법과 유사하며, 양성 및 바이러스 ssDNA는 바이러스 mRNA와 순서가 동일하여 코딩 스트랜드인 반면 음성 바이러스 ssDNA는 바이러스 mRNA를 보완하여 템플릿 스트랜드라는 점에서 RNA 명명법과 유사하다.[98]ssDNA와 ssRNA 바이러스의 여러 유형은 이중 가닥 복제 중간에서 양쪽 가닥에서 모두 전사가 발생할 수 있다는 점에서 양면성이 있는 게놈을 가지고 있다.예로는 동물들의 ssRNA 바이러스인 ssDNA 식물 바이러스와 영역 바이러스인 geminivirus가 있다.[99]
게놈 크기
게놈 크기는 종마다 크게 다르다.가장 작은 ssDNA circovirus, Circovirus 계열인 Circovirus는 단지 두 개의 단백질에 대한 코드이며, 가장 큰 유전체 크기는 약 2 메가바이트([100]메가바이트)로 약 2500개의 단백질을 코드화한다.[91]바이러스 유전자는 인트론을 거의 가지고 있지 않으며 종종 게놈에 배열되어 겹친다.[101]
일반적으로 RNA 바이러스는 복제 시 오류율이 높아 DNA 바이러스보다 게놈 크기가 작고, 최대 크기 제한이 있다.[48]이 외에도, 복제 시 오류는 바이러스를 쓸모없거나 경쟁력 없게 만든다.이를 보완하기 위해 RNA 바이러스는 종종 게놈을 세분화(게놈은 더 작은 분자로 분할)하여 단일 성분 게놈의 오류가 전체 게놈을 무력화할 가능성을 줄인다.대조적으로, DNA 바이러스는 복제 효소의 높은 충실도 때문에 일반적으로 더 큰 게놈을 가지고 있다.[102]이러한 게놈에 대한 돌연변이 비율이 ssRNA 바이러스 사례의 극치에 근접할 수 있기 때문에 단일 스트랜드 DNA 바이러스는 이 규칙의 예외다.[103]
유전자 돌연변이

바이러스는 몇 가지 메커니즘에 의해 유전적 변화를 겪는다.여기에는 DNA나 RNA의 개별 염기들이 다른 염기들로 변이되는 항원적 표류라고 불리는 과정이 포함된다.이러한 포인트 돌연변이의 대부분은 "침묵"이다. 즉, 유전자가 암호화하는 단백질을 변화시키지 않지만, 다른 것들은 항바이러스 약물에 대한 저항성과 같은 진화적 이점을 제공할 수 있다.[104][105]항원적 변화는 바이러스의 게놈에 중대한 변화가 있을 때 일어난다.이것은 재조합 또는 재조정 결과일 수 있다.독감 바이러스에 이런 일이 일어나면, 유행병이 발생할 수 있다.[106]RNA 바이러스는 종종 같은 종의 기질이나 바이러스 떼로 존재하지만 게놈 뉴클레오사이드 순서는 약간 다르다.그러한 기진맥진증은 자연선택의 주요 대상이다.[107]
세분화된 게놈은 진화적 이점을 부여한다; 세분화된 게놈을 가진 다른 종류의 바이러스는 유전자를 섞어서 결합시킬 수 있고, 독특한 특성을 가진 유전자 바이러스(또는 자손)를 생산할 수 있다.이것을 재분배 또는 '바이러스 섹스'라고 한다.[108]
유전자 재조합은 DNA(또는 RNA) 한 가닥이 깨진 다음 다른 DNA(또는 RNA) 분자의 끝에 결합되는 과정이다.이는 바이러스가 동시에 세포를 감염시키고 바이러스 진화에 대한 연구가 연구된 종에 재조합이 만연해 있음을 보여줄 때 발생할 수 있다.[109]재조합은 RNA 바이러스와 DNA 바이러스 모두에 공통적이다.[110][111]
복제 주기

바이러스군은 세포분열을 통해 성장하지 않는다. 왜냐하면 세포분열을 통해서는 성장하지 않기 때문이다.대신 숙주세포의 기계와 신진대사를 이용해 자기자신의 여러 사본을 만들어 내고, 세포에 모여든다.[112]감염되면 숙주세포는 수천 개의 원본 바이러스를 신속하게 복제할 수 밖에 없다.[113]
그들의 수명주기는 종마다 크게 다르지만, 그들의 수명주기에는 다음과 같은 여섯 가지 기본 단계가 있다.[114]
부착은 바이러스 캡시드 단백질과 숙주 세포 표면의 특정 수용체 사이의 특정한 결합이다.이 특수성은 바이러스의 호스트 범위와 유형을 결정한다.예를 들어, HIV는 제한된 범위의 인간 백혈구를 감염시킨다.이는 표면 단백질인 gp120이 특히 CD4+T-Cells 표면에서 가장 흔히 발견되는 CD4 분자인 케모킨 수용체와 상호작용하기 때문이다.이 메커니즘은 복제할 수 있는 세포만을 감염시키는 바이러스를 선호하도록 진화했다.수용체에 부착하면 바이러스성 봉투 단백질이 바이러스성 세포막과 세포막의 융합을 초래하는 변화나 바이러스가 침투할 수 있는 비개발성 바이러스 표면 단백질의 변화를 겪게 할 수 있다.[115]
침투나 바이러스 유입은 애착을 따른다: 처녀막은 수용체 매개 내분포증이나 막 융합을 통해 숙주세포로 들어간다.식물과 진균세포의 감염은 동물세포의 감염과는 다르다.식물은 셀룰로오스로 만들어진 단단한 세포벽과 키틴의 하나로 된 곰팡이를 가지고 있기 때문에 대부분의 바이러스는 세포벽에 외상을 입어야만 이들 세포 안으로 들어갈 수 있다.[116]거의 모든 식물 바이러스(담배 모자이크 바이러스 등)도 플라스모드마타(plasmodesmata)라고 불리는 모공을 통해 단일 가닥의 핵단백질 복합체의 형태로 세포에서 세포로 직접 이동할 수 있다.[117]박테리아는 식물과 마찬가지로 바이러스가 세포를 감염시키기 위해 반드시 뚫어야 하는 강한 세포벽을 가지고 있다.박테리아 세포벽은 크기가 훨씬 작아 식물 세포벽보다 훨씬 얇다는 점에서 일부 바이러스는 세포벽을 가로지르는 박테리아 세포에 게놈을 주입하는 메커니즘을 진화시킨 반면 바이러스 캡시드는 외부에 남아 있다.[118]
유코팅(uncoating)은 바이러스 캡시드가 제거되는 과정이다.이것은 바이러스 효소나 숙주 효소에 의한 분해나 단순한 분리에 의한 것일 수 있다. 최종 결과는 바이러스 게놈 핵산의 방출이다.[119]
바이러스의 복제는 주로 게놈의 곱셈을 포함한다.복제에는 "초기" 유전자(양감 RNA 바이러스의 예외 포함), 바이러스 단백질 합성, 바이러스 단백질의 가능한 결합, 그리고 초기 또는 규제 단백질 표현에 의해 매개된 바이러스 게놈 복제(mRNA)의 합성이 포함된다.이것은 더 큰 게놈을 가진 복잡한 바이러스의 경우, 하나 이상의 mRNA 합성: "늦은" 유전자 표현은 일반적으로 구조 또는 처녀 단백질의 것이다.[120]
조립 – 바이러스 입자의 구조 매개 자가 조립에 따라, 종종 단백질의 일부 개조가 발생한다.HIV와 같은 바이러스에서는 이 바이러스가 숙주 세포에서 방출된 후에 이러한 수정(일종의 성숙이라고 불리기도 한다)이 일어난다.[121]
방출 – 바이러스는 숙주 세포에서 방출될 수 있는데, 이는 세포막과 세포벽이 존재한다면 파열하여 세포를 죽이는 과정이다. 이것은 많은 박테리아와 몇몇 동물 바이러스의 특징이다.어떤 바이러스는 바이러스 게놈을 유전적 재조합에 의해 숙주의 염색체에서 특정 장소로 통합하는 리소겐 주기를 거친다.바이러스 게놈은 그 후 "도발 바이러스" 또는 박테리오파지의 경우 "도발"로 알려져 있다.[122]숙주가 분열할 때마다 바이러스 게놈도 복제된다.바이러스성 게놈은 숙주 내에서는 대부분 침묵한다.언제부턴가, 프로페지 바이러스는 숙주 세포를 침윤시킬 수 있는 활성 바이러스를 발생시킬 수도 있다.[123]밀폐된 바이러스(예: HIV)는 일반적으로 싹을 틔워 숙주 세포에서 방출된다.이 과정에서 바이러스는 그 봉투를 획득하는데, 이것은 숙주의 플라즈마나 다른 내부 막의 변형된 부분이다.[124]
게놈 복제
바이러스 입자 내의 유전 물질과 물질이 복제되는 방법은 다른 유형의 바이러스 간에 상당히 다르다.
- DNA 바이러스
- 대부분의 DNA 바이러스의 게놈 복제는 세포 핵에서 일어난다.세포 표면에 적절한 수용체가 있는 경우, 이러한 바이러스는 세포막(예: 헤르페스바이루스)과의 직접 융합을 통해 세포로 들어가거나, 더 일반적으로 수용체 매개 내세포 분열에 의해 세포로 들어간다.대부분의 DNA 바이러스는 전적으로 숙주세포의 DNA와 RNA가 기계와 RNA 가공 기계에 의존한다.더 큰 게놈을 가진 바이러스들은 이 기계들의 상당 부분을 자체적으로 암호화 할 수 있다.진핵생물에서, 바이러스 게놈은 이 기계에 접근하기 위해 세포의 핵막을 통과해야 하는 반면, 박테리아에서는 세포 안으로만 들어가면 된다.[125]
- RNA바이러스
- RNA 바이러스의 복제는 보통 세포질에서 일어난다.RNA 바이러스는 복제 방식에 따라 4개의 다른 그룹으로 나눌 수 있다.단일 가닥 RNA 바이러스의 극성(단백질을 만들기 위해 리보솜이 직접 사용할 수 있는지 여부)은 크게 복제 메커니즘을 결정한다. 또 다른 주요 기준은 유전 물질이 단일 가닥인지 이중 가닥인지 여부다.모든 RNA 바이러스는 그들의 게놈의 복사본을 만들기 위해 그들 자신의 RNA 복제효소를 사용한다.[126]
- 역 필사 바이러스
- 역전사 바이러스는 입자에 ssRNA(Retrovirae, Metavirae, Pseudovirae) 또는 dsDNA(Caullimovirae, Hepadnavirae)가 있다.RNA 게놈(레트로비루스)을 이용한 역전사 바이러스는 DNA 중간을 이용해 복제하는 반면, DNA 게놈(파라트로비루스)을 가진 바이러스는 게놈 복제 시 RNA 중간을 사용한다.두 종류 모두 역분포효소, 즉 RNA 의존 DNA 중합효소 효소를 사용하여 핵산 변환을 수행한다.역전사(retrovirus)는 복제 과정의 일부로서 숙주 게놈에 역전사(reverse transcription)로 생성된 DNA를 숙주 게놈으로 통합한다. 특히 식물 파라레트로바이러스의 통합 게놈 복사본은 감염 바이러스를 발생시킬 수 있지만, 파라레트로바이러스는 그렇지 않다.[127]그들은 지도부딘과 라미부딘과 같은 역분해효소 효소를 억제하는 항바이러스제에 취약하다.첫 번째 유형의 예는 레트로바이러스인 HIV이다.두 번째 유형의 예로는 B형 간염 바이러스가 포함된 헤파드나비르과가 있다.[128]
호스트 셀에 대한 세포질 효과
바이러스가 숙주세포에 미치는 구조적, 생화학적 효과의 범위는 광범위하다.[129]이를 '사이토패틱 효과'라고 한다.[130]대부분의 바이러스 감염은 결국 숙주 세포의 사망을 초래한다.사인은 세포 용해, 세포 표면막의 변형, 세포 사멸 등이다.[131]흔히 세포 죽음은 바이러스 특이 단백질에 의한 억제 때문에 정상적인 활동을 중단함으로써 발생하는데, 이 모든 것이 바이러스 입자의 구성요소가 아니다.[132]세포질과 무해성의 구별은 점진적이다.엡스타인-바르 바이러스 등 일부 바이러스는 악성 종양을 일으키지 않고 세포가 증식할 수 있는 반면,[133] 파필로마비루스와 같은 바이러스는 암의 원인이 확립되어 있다.[134]
휴면성 및 잠복성
어떤 바이러스는 감염된 세포에 뚜렷한 변화를 일으키지 않는다.바이러스가 잠복해 있고 활동이 뜸한 세포는 감염의 징후가 거의 보이지 않고 정상적으로 기능하는 경우가 많다.[135]이것은 지속적인 감염을 야기하고, 바이러스는 종종 수개월 또는 수 년 동안 휴면 상태에 있다.헤르페스 바이러스의 경우는 흔히 이런 경우가 있다.[136][137]
호스트 범위
바이러스는 지구상에서 단연코 가장 풍부한 생물학적 실체인데, 그것들은 다른 모든 것을 합친 것보다 많다.[138]그들은 동물, 식물, 박테리아, 곰팡이를 포함한 모든 종류의 세포 생물들을 감염시킨다.[94]다른 종류의 바이러스는 한정된 범위의 호스트만을 감염시킬 수 있으며 많은 종류의 바이러스는 종에 특화되어 있다.예를 들어 천연두 바이러스와 같은 일부 종은 오직 한 종(이 경우 인간)[139]만 감염시킬 수 있으며 숙주 범위가 좁다고 한다.광견병 바이러스와 같은 다른 바이러스는 다른 종의 포유류를 감염시킬 수 있으며 범위가 넓다고 한다.[140]식물을 감염시키는 바이러스는 동물에게는 무해하며, 다른 동물을 감염시키는 대부분의 바이러스는 인간에게는 무해하다.[141]일부 박테리오파지의 숙주 범위는 박테리아의 단일 변종으로 제한되며, 페이지 타이핑이라고 불리는 방법으로 감염의 발생원을 추적하는데 사용될 수 있다.[142]유기체나 서식지에 있는 완전한 바이러스 집합을 바이롬이라고 부른다. 예를 들어, 모든 인간 바이러스는 인간의 바이롬을 구성한다.[143]
분류
분류는 유사성에 근거하여 바이러스의 이름을 지정하고 그룹화함으로써 바이러스의 다양성을 기술하려고 한다.1962년 안드레 르우프, 로버트 혼, 폴 투르니에가 린네아의 위계체계를 바탕으로 바이러스 분류 수단을 최초로 개발했다.[144]이 시스템은 망울, 계급, 질서, 가족, 속, 종을 기준으로 분류한다.바이러스는 숙주의 특성이 아닌 공유된 특성과 게놈을 형성하는 핵산의 종류에 따라 분류되었다.[145]1966년 국제 바이러스 분류 위원회(ICTV)가 결성되었다.Lwoff, Horne, Tournier가 제안한 시스템은 바이러스의 작은 게놈 크기와 높은 돌연변이를 통해 그들의 조상을 질서 이상으로 판단하기 어렵게 했기 때문에 ICTV에 의해 처음에 받아들여지지 않았다.이와 같이 볼티모어 분류 체계는 전통적인 계층 구조를 보완하는 데 이용되게 되었다.[146]ICTV는 2018년부터 시간이 흐르면서 발견된 바이러스 간의 보다 깊은 진화적 관계를 인정하기 시작했고, 영역부터 종까지 15계급 분류 체계를 채택했다.[147]
ICTV 분류
ICTV는 현재의 분류 체계를 개발하여 가족의 통일성을 유지하기 위해 특정 바이러스 성질에 더 큰 비중을 두는 지침을 작성하였다.통합된 분류 체계(바이러스를 분류하는 보편적 시스템)가 구축되었다.바이러스의 전체 다양성 중 극히 일부만이 연구되었다.[148]2020년 현재 ICTV는 6개 영역, 10개 왕국, 17개 필라, 2개 서브피롤라, 39개 계급, 59개 명령, 8개 하위질서, 189개 가정, 136개 하위가족, 2224개 제네랄, 70개 하위세대, 9,110종의 바이러스를 정의하고 있다.[5]
세손 범위의 일반 분류 구조와 분류 이름에 사용되는 접미사를 다음에 나타낸다.2020년 현재 서브리얼, 서브킹덤, 서브클래스의 등급은 미사용인 반면 다른 등급은 모두 사용 중이다.
- 영역(-viria)
볼티모어 분류
노벨상을 수상한 생물학자 데이비드 볼티모어가 볼티모어 분류 체계를 고안했다.[43][149]ICTV 분류 시스템은 볼티모어 분류 시스템과 연계하여 현대 바이러스 분류에 사용된다.[150][151][152]
볼티모어의 바이러스 분류는 mRNA 생산 메커니즘에 기초한다.바이러스는 단백질을 생산하고 스스로 복제하기 위해 게놈으로부터 mRNA를 생성해야 하지만, 각 바이러스 계열에서는 이를 달성하기 위해 서로 다른 메커니즘이 사용된다.바이러스성 게놈은 단일 가닥(ss) 또는 이중 가닥(ds), RNA 또는 DNA일 수 있으며, 역분해효소(RT)를 사용할 수도 있고 사용하지 않을 수도 있다.또한 ssRNA 바이러스는 감각(+) 또는 반감(-)일 수 있다.이 분류는 바이러스를 7개 그룹으로 분류한다.
- I: dsDNA 바이러스(예: 아데노비루스, 헤르페스비루스, Poxvirus)
- II: ssDNA 바이러스(+ Strand 또는 "sense") DNA(예: Parvovirus)
- III: dsRNA 바이러스(예: Reovirus)
- IV: (+)ssRNA 바이러스(+strand 또는 sense) RNA(예: Coronavirus, Picornavirus, Togavirus)
- V: (-)ssRNA 바이러스(- 가닥 또는 항균) RNA(예: Orthomyxovirus, Rhabdovirus)
- VI: 수명 주기 중 DNA 중간이 있는 ssRNA-RT 바이러스(+스트랜드 또는 감지) RNA(예: 레트로바이러스)
- VII: 수명 주기 중 RNA 중간이 있는 dsDNA-RT 바이러스 DNA(예: 헤패드나비루스)
인간병에서의 역할

바이러스에 의해 유발되는 일반적인 인간 질병의 예로는 감기, 인플루엔자, 수두, 감기 염증이 있다.광견병, 에볼라 바이러스병, 에이즈(HIV), 조류독감, 사스 같은 많은 심각한 질병들이 바이러스에 의해 발생한다.질병을 유발하는 바이러스의 상대적 능력은 정력적인 측면에서 설명된다.그 밖에 인체 헤르페스 바이러스 6(HHV6)와 다발성 경화증, 만성 피로 증후군 등 신경성 질환과의 연관 가능성 등 원인 물질로 바이러스가 있는지 여부를 규명하기 위해 조사 중이다.[154]기존에 말에서 신경성 질환을 유발한다고 여겨졌던 보나바이러스가 과연 인간의 정신질환에 원인이 될 수 있을지에 대한 논란이 일고 있다.[155]
바이러스는 그들이 유기체에서 질병을 생성하는 다른 메커니즘을 가지고 있는데, 이것은 주로 바이러스 종에 의존한다.세포 수준의 메커니즘은 주로 세포 투석, 파괴 개방 및 후속 사망을 포함한다.다세포 유기체에서는 세포가 충분히 죽으면 유기체 전체가 그 영향을 받기 시작할 것이다.바이러스는 건강한 동태에 장애를 일으켜 질병을 일으키지만, 유기체 내에서 비교적 무해하게 존재할 수 있다.예를 들면 감기 염증을 유발하는 대상포진형 심플렉스 바이러스의 인체 내 휴면 상태에 머무르는 능력이 포함된다.이를 잠복기라고[156] 하며 선열증을 일으키는 엡스타인-바르 바이러스, 수두와 대상포진을 일으키는 바리셀라 조스터 바이러스 등 대상포진 바이러스의 특징이다.대부분의 사람들은 적어도 이런 종류의 헤르페스 바이러스에 감염되었다.[157]바이러스의 존재는 예르시니아 페스티스와 같은 박테리아 병원체에 대한 면역력을 증가시킬 수 있기 때문에, 이러한 잠복 바이러스는 때때로 유익할 수 있다.[158]
일부 바이러스는 숙주의 방어 메커니즘에도 불구하고 바이러스가 체내에서 계속 복제되는 평생 또는 만성 감염을 일으킬 수 있다.[159]B형 간염과 C형 간염 바이러스 감염에서는 흔히 볼 수 있는 일이다.만성적으로 감염된 사람들은 전염성 바이러스의 저장고 역할을 하기 때문에 보균자로 알려져 있다.[160]보균자 비율이 높은 인구에서는 이 질병이 고유병이라고 한다.[161]
역학
바이러스 역학이란 인간의 바이러스 감염의 전염과 통제를 다루는 의학 분야의 한 분야다.바이러스의 전염은 엄마에서 아이로, 또는 사람에서 사람으로 수평을 의미하는 수직이 될 수 있다.수직 전이의 예로는 B형 간염 바이러스와 HIV 바이러스가 있는데, 이 바이러스에 이미 감염된 아기가 태어난 곳이다.[162]또 다른, 더 드문 예로는 바리셀라 조스터 바이러스가 있는데, 이 바이러스는 어린이와 성인에게 비교적 가벼운 감염을 일으키긴 하지만 태아와 갓 태어난 아기에게 치명적일 수 있다.[163]
수평 전송은 집단 내 바이러스의 가장 일반적인 확산 메커니즘이다.[164]수평 전달은 성행위 중, 침 교환에 의해 체액이 교환될 때 또는 오염된 음식이나 물을 섭취할 때 발생할 수 있다.바이러스를 함유한 에어로졸을 흡입하거나 감염된 모기가 숙주의 피부에 침투하는 등 곤충 벡터에 의해도 발생할 수 있다.[164]대부분의 유형의 바이러스는 이러한 메커니즘 중 하나 또는 두 개로 제한되며, 이를 "호흡형 바이러스" 또는 "입체형 바이러스" 등으로 지칭한다.바이러스 감염의 전송 속도 또는 속도는 인구 밀도, 취약한 개인 수, (즉 면역되지 않은 사람),[165] 건강관리 품질 및 날씨를 포함하는 요인에 따라 달라진다.[166]
역학학은 바이러스성 질병이 발병하는 동안 인구의 감염 사슬을 끊기 위해 사용된다.[167]바이러스가 어떻게 전염되는지 알고 있는 것에 근거한 통제 수단을 사용한다.발병의 원인, 즉 근원을 찾아 바이러스를 식별하는 것이 중요하다.일단 바이러스가 확인되면, 전염의 사슬이 백신에 의해 끊어질 수도 있다.백신을 접종할 수 없을 때는 위생과 소독이 효과적일 수 있다.흔히 감염자는 나머지 지역사회와 격리돼 바이러스에 노출된 사람은 격리된다.[168]2001년 영국에서 발생한 소의 구제역을 막기 위해 수천 마리의 소가 도살되었다.[169]인간과 다른 동물의 대부분의 바이러스 감염은 잠복기를 가지고 있는데, 그 기간 동안 그 감염은 아무런 징후나 증상도 일으키지 않는다.[170]바이러스성 질환의 잠복기는 며칠에서 몇 주까지 다양하지만 대부분의 감염으로 알려져 있다.[171]어느 정도 겹치지만 주로 잠복기에 따라 전염성이 있는 기간(감염된 개인이나 동물이 전염되어 다른 사람이나 동물을 감염시킬 수 있는 시기)이 있다.[171]이것 역시 많은 바이러스 감염으로 알려져 있으며, 두 기간 모두 발병을 통제하는 데 있어서 그 기간에 대한 지식이 있다.[172]발생이 인구, 공동체 또는 지역에서 비정상적으로 높은 비율의 발병률을 야기할 때, 그것들은 전염병이라고 불린다.만약 전염병이 전세계로 퍼지면, 그것들은 유행병이라고 불린다.[173]
전염병 및 유행병
전염병은 전 세계적인 전염병이다.1919년까지 지속된 1918년 독감 대유행은 유별나게 심각하고 치명적인 독감 A형 바이러스에 의해 발생한 5급 독감 대유행이었다.대부분의 인플루엔자 발생이 청소년, 노인 또는 그 밖의 약해진 환자들에게 주로 영향을 미치는 것과는 대조적으로 피해자들은 종종 건강한 젊은 성인이었다.[174]오래된 추정에 의하면 4천만 내지 5천만 명의 목숨을 앗아갔다고 하는 반면,[175] 최근의 연구는 1918년 세계 인구의 5%에 해당하는 1억 명의 목숨을 앗아갔을 수도 있다고 한다.[176]
비록 바이러스성 유행병은 드물지만, 적어도 1980년대부터 원숭이와 침팬지에게서 발견된 바이러스로부터 진화한 HIV는 대유행이다.[177]20세기 동안 인플루엔자 바이러스로 인한 4대 유행병이 있었고 1918년, 1957년, 1968년에 발생한 유행병은 심각했다.[178]대부분의 연구자들은 HIV가 20세기 사하라 이남 아프리카에서 발생했다고 믿고 있다.[179] HIV는 현재 전세계적으로 3790만 명이 HIV에 감염되어 살고 있는 것으로 추정된다.[180]2018년 에이즈 사망자는 약 77만 명이었다.[181]세계보건기구(WHO)와 유엔 에이즈 공동프로그램은 1981년 6월 5일 에이즈가 처음 인식된 이래 2500만 명 이상의 사망자를 낸 것으로 추산해 역사상 가장 파괴적인 전염병 중 하나로 꼽힌다.[182]2007년에는 270만 명의 새로운 HIV 감염과 200만 명의 HIV 관련 사망자가 발생했다.[183]
필로비르과에는 매우 치명적인 바이러스 병원균이 몇 개 있다.필로비러스는 바이러스성 출혈열을 일으키는 필라멘트 같은 바이러스로 ebolavirus와 Marburgvirus가 있다.1967년에 처음 발견된 마버그 바이러스는 2005년 4월 앙골라에서 발생한 발병으로 언론의 광범위한 관심을 끌었다.[184]에볼라 바이러스 질환도 처음 확인된 1976년 이후 사망률이 높은 간헐적 발병을 일으켰다.최악이자 가장 최근의 것은 2013~2016년 서아프리카 전염병이다.[185]
천연두를 제외하고 대부분의 유행병은 새로이 진화된 바이러스에 의해 발생한다.이러한 "신생한" 바이러스는 보통 인간이나 다른 동물에서 이전에 유통되었던 덜 해로운 바이러스의 돌연변이들이다.[186]
중증급성호흡기증후군(SARS)과 중동호흡기증후군(MERS)은 새로운 형태의 코로나비루스에 의해 발생한다.다른 코로나바이러스는 인간에게 가벼운 감염을 일으키는 것으로 알려져 있기 때문에 2003년 7월까지 약 8,000명의 환자와 800명의 사망자를 낸 사스 감염의 맹독성과 급속한 확산은 예상치 못한 일이었고 대부분의 나라들은 준비되지 않았다.[187][188]
박쥐에서 유래한 것으로 추정되는 관련 코로나바이러스인 중증급성호흡기증후군 코로나바이러스 2(SARS-Cov-2)가 2019년 11월 중국 우한(武漢)에서 나타나 전 세계로 빠르게 확산됐다.이 바이러스에 감염되어 2020년에 시작된 COVID-19 대유행의 원인이 되었다.[189][190][191]평화시의 전례 없는 제약을 국제 여행에 가했고,[192] 전염병에 대응하여 전 세계 몇몇 주요 도시에서 통행금지가 부과되었다.[193]
암
바이러스는 인간과 다른 종에서 암의 확립된 원인이다.바이러스성 암은 소수의 감염자(또는 동물)에서만 발생한다.암 바이러스는 RNA 바이러스와 DNA 바이러스를 모두 포함한 다양한 바이러스 계열에서 발생하기 때문에 단일 유형의 "온코바이러스"(원래 급성 변혁 레트로바이러스에 사용되는 구식 용어)가 존재하지 않는다.암의 발병은 숙주 면역[194], 숙주 내 돌연변이 등 다양한 요인에 의해 결정된다.[195]인간암을 유발하기 위해 수용되는 바이러스에는 인간 유피오마바이러스, B형 간염, C형 간염 바이러스, 엡스타인-바르 바이러스, 카포시의 육종 관련 헤르페스 바이러스, 인간 T-림프토방성 바이러스 등이 있다.가장 최근에 발견된 인간 암 바이러스는 메르켈 세포암이라고 불리는 희귀한 형태의 피부암을 대부분 유발하는 폴리오마바이러스(메르켈 세포 폴리오마바이러스)이다.[196]간염 바이러스는 간암으로 이어지는 만성 바이러스 감염으로 발전할 수 있다.[197][198]인간 T-림프소트방성 바이러스에 의한 감염은 열대성 척추측만증과 성인 T-세포 백혈병을 유발할 수 있다.[199]인간 유두종은 자궁경부암, 피부암, 항문암, 페니스암의 확립된 원인이다.[200]헤르페스비르과 내에서는 카포시의 육종 관련 헤르페스 바이러스가 카포시의 육종과 체세포성 림프종을 유발하고, 엡스타인-바르 바이러스는 버킷의 림프종, 호지킨의 림프종, B 림프종, 비 림프종양, 비인두종암 등을 유발한다.[201]메르켈 세포 폴리오마바이러스는 50년 넘게 암 바이러스의 동물 모델로 사용돼 온 SV40과 생쥐 폴리오마바이러스와 밀접한 관련이 있다.[202]
숙주 방어 메커니즘
바이러스에 대한 신체의 첫 번째 방어선은 선천적인 면역 체계다.이것은 특정되지 않은 방식으로 숙주를 감염으로부터 보호하는 세포와 다른 메커니즘으로 구성된다.이는 선천적 체계의 세포가 병원균을 일반적 방식으로 인식하고 대응하지만 적응적 면역 체계와는 달리 숙주에게 오래 지속되거나 보호적인 면역력을 부여하지 않는다는 것을 의미한다.[203]
RNA 간섭은 바이러스에 대한 중요한 선천적 방어 수단이다.[204]많은 바이러스는 이중 가닥 RNA(dsRNA)를 포함하는 복제 전략을 가지고 있다.그런 바이러스가 세포에 감염되면 RNA 분자나 분자를 방출하게 되는데, RNA를 더 작은 조각으로 잘라내는 디커라고 불리는 단백질 복합체에 즉시 결합하게 된다.바이러스 mRNA를 분해하여 세포 생존을 보장하는 생화학적 경로인 RISC 콤플렉스가 활성화된다.로타비루스는 세포 내부에서 완전히 코팅을 해제하지 않고 입자의 내부 캡시드의 모공을 통해 새로 생성된 mRNA를 방출함으로써 이러한 방어 메커니즘을 피하도록 진화했다.그들의 게놈 dsRNA는 처녀자리 핵심 안에서 보호되고 있다.[205][206]
척추동물의 적응성 면역체계가 바이러스에 맞닥뜨리면 바이러스와 결합하는 특정 항체를 생성해 감염되지 않는 경우가 많다.이것을 '도덕면역'이라고 한다.두 종류의 항체가 중요하다.IgM이라 불리는 첫 번째 것은 바이러스를 중화시키는데 매우 효과적이지만 면역 체계의 세포에 의해 몇 주 동안만 생산된다.IgG라고 불리는 두 번째는 무한정 생산된다.숙주의 혈액에 IgM의 존재는 급성 감염 여부를 검사하는 데 사용되는 반면 IgG는 과거 어느 때 감염을 나타낸다.[207]IgG 항체는 면역력 검사를 실시할 때 측정한다.[208]
항체는 바이러스가 숙주세포에 침입한 후에도 효과적인 방어 메커니즘이 될 수 있다.TRIM21이라고 불리는 세포 안에 있는 단백질은 바이러스 입자의 표면에 있는 항체에 부착될 수 있다.이것은 세포의 프로테오솜 시스템의 효소에 의해 바이러스의 후속 파괴를 촉진한다.[209]

바이러스에 대한 척추동물의 두 번째 방어는 세포 매개 면역이라고 불리며 T세포로 알려진 면역 세포를 포함한다.신체의 세포들은 세포 표면에 끊임없이 단백질들의 짧은 파편을 표시하며, T세포가 거기서 의심스러운 바이러스 파편을 인식하면 '킬러 T'세포에 의해 숙주세포가 파괴되고 바이러스 특이 T세포가 증식한다.대식세포와 같은 세포들은 이 항원발현에서 전문가들이다.[210]인터페론의 생산은 중요한 호스트 방어 메커니즘이다.이것은 바이러스가 존재할 때 몸에서 생성되는 호르몬이다.면역력에 있어서 그것의 역할은 복잡하다; 그것은 결국 감염된 세포와 그것의 가까운 이웃들을 죽임으로써 바이러스의 번식을 막는다.[211]
모든 바이러스 감염이 이런 식으로 보호 면역 반응을 일으키는 것은 아니다.HIV는 처녀자리 표면에 있는 단백질의 아미노산 염기서열을 끊임없이 변화시킴으로써 면역체계를 퇴치한다.이것은 바이러스성 상피들이 숙주 면역 반응에 의해 인식되지 않기 때문에 "탈피 돌연변이"라고 알려져 있다.이러한 끈질긴 바이러스는 격리, 항원 표시의 봉쇄, 사이토카인 저항, 자연적인 킬러 세포 활동의 회피, 사멸으로부터 탈출, 항원 이동에 의해 면역 통제를 회피한다.[212]'신경방성 바이러스'라고 불리는 다른 바이러스는 면역 특권 때문에 면역체계가 접근할 수 없는 신경 확산에 의해 전파된다.[213]
예방 및 치료
바이러스는 숙주 세포 내에서 중요한 대사 경로를 이용해 복제를 하기 때문에 숙주 세포에 독성 효과를 일으키는 약물을 사용하지 않고는 제거하기 어렵다.바이러스성 질환에 대한 가장 효과적인 의학적 접근법은 감염에 대한 면역력을 제공하기 위한 백신 접종과 바이러스 복제를 선택적으로 방해하는 항바이러스제다.
백신
백신 접종은 바이러스에 의한 감염을 예방하는 값싸고 효과적인 방법이다.백신은 실제 바이러스가 발견되기 훨씬 전에 바이러스 감염을 예방하기 위해 사용되었다.이들의 사용으로 소아마비, 홍역, 유행성 이하선염, 풍진 등의 바이러스 감염과 관련된 질병성(기름)과 사망률(사망)이 극적으로 감소하는 결과를 낳았다.[214]천연두 감염은 근절되었다.[215]백신은 인간의 13개 이상의 바이러스 감염을 예방하기 위해 이용 가능하며,[216] 동물의 바이러스 감염을 예방하기 위해 더 많이 사용된다.[217]백신은 살아있는 감쇠 또는 죽은 바이러스, 바이러스 단백질, RNA로 구성될 수 [218][219]있다. 살아있는 백신은 약화된 형태의 바이러스를 포함하고 있는데, 이것은 질병을 유발하지는 않지만 그럼에도 불구하고 면역성을 부여한다.그러한 바이러스는 감쇠라고 불린다.살아있는 백신은 면역력이 약한 사람들에게 주어질 때 위험할 수 있는데, 이러한 사람들에게서 약화된 바이러스는 원래 질병을 유발할 수 있기 때문이다.[220]생명공학과 유전공학 기술은 소단위 백신을 생산하는데 사용된다.이 백신들은 바이러스의 캡시드 단백질만 사용한다.B형 간염 백신은 이런 종류의 백신이다.[221]서브유닛 백신은 면역항암을 유발할 수 없기 때문에 면역항암 환자에게 안전하다.[222]17D라고 불리는 살아있는 감쇠종인 황열 바이러스 백신은 아마도 지금까지 생성된 백신 중 가장 안전하고 효과적인 백신일 것이다.[223]
항바이러스제
항바이러스제는 종종 뉴클레오사이드 유사물질(가짜 DNA 빌딩블록)이며, 바이러스는 복제 중 게놈에 잘못 통합된다.[224]그리고 나서 새로 합성된 DNA가 비활성이기 때문에 바이러스의 수명주기는 중단된다.이러한 아날로그에는 인 원자와 함께 서로 연결되어 DNA 분자의 강한 '백본'을 형성하는 히드록실 그룹이 부족하기 때문이다.이것을 DNA 체인종말이라고 한다.[225]뉴클레오사이드 유사점의 예로는 헤르페스 심플렉스 바이러스 감염의 경우 아세클로비르, HIV 및 B형 간염 바이러스 감염의 경우 라미부딘이 있다.아세클로비르는 가장 오래되고 가장 자주 처방되는 항바이러스제 중 하나이다.[226]사용 중인 다른 항바이러스제는 바이러스 수명 주기의 다른 단계를 대상으로 한다.HIV는 HIV-1 프로테아제라고 불리는 단백질 분해 효소에 의존하고 있다.프로테아제 억제제라고 불리는 많은 종류의 약들이 이 효소를 불활성화시킨다.[227]각기 다른 바이러스나 바이러스 복제 단계를 대상으로 하는 항바이러스제의 종류는 약 13가지가 있다.[224]
C형 간염은 RNA 바이러스에 의해 발생한다.감염자의 80%는 만성질환으로 치료하지 않으면 평생 감염된다.직접 작용하는 항바이러스제를 사용하는 효과적인 치료법이 있다.[228]라미부딘 등 항바이러스제를 포함한 비슷한 전략을 구사해 B형 간염의 만성 보균자 치료법이 개발됐다.[229]
타종 감염
바이러스는 모든 세포 생명을 감염시키고, 비록 바이러스가 보편적으로 발생하지만, 각각의 세포 종은 종종 그 종만을 감염시키는 고유의 범위를 가지고 있다.[230]인공위성이라고 불리는 일부 바이러스는 이미 다른 바이러스에 감염된 세포 내에서만 복제할 수 있다.[61]
동물바이러스
바이러스는 가축의 중요한 병원균이다.구제역이나 블루통 같은 질병은 바이러스에 의한 것이다.[231]고양이, 개, 말과 같은 반려동물은 예방접종을 하지 않으면 심각한 바이러스 감염에 취약하다.송곳니 파보바이러스는 작은 DNA 바이러스에 의해 발생하며 새끼들에게 감염은 종종 치명적이다.[232]모든 무척추동물들처럼 꿀벌은 많은 바이러스성 감염에 취약하다.[233]대부분의 바이러스는 숙주에게 해를 끼치지 않고 공존하며 병의 징후나 증상을 일으키지 않는다.[4]
식물바이러스

식물 바이러스의 종류는 여러 가지가 있지만 수확량 손실만 일으키는 경우가 많으며, 이를 통제하려고 하는 것은 경제적으로 실행가능하지 않다.식물 바이러스는 종종 벡터라고 알려진 유기체에 의해 식물에서 식물로 퍼진다.이것들은 보통 곤충들이지만 몇몇 곰팡이, 네마토드 벌레, 단세포 유기체, 기생 식물들은 벡터들이다.[234]예를 들어, 다년생 과일의 경우, 식물 바이러스 감염의 통제가 경제적인 것으로 간주될 때, 벡터를 죽이고 잡초와 같은 대체 숙주를 제거하는 데 집중된다.[235]식물 바이러스는 살아있는 식물 세포에서만 번식할 수 있기 때문에 인간과 다른 동물들을 감염시킬 수 없다.[236]
원래 페루에서 온 감자는 전세계적으로 주요 작물이 되었다.[237]감자 바이러스 Y는 감자와 토마토와 후추를 포함한 관련 종에 질병을 일으킨다.1980년대에, 이 바이러스는 종자 감자 작물에서 통제하기 어렵다는 것이 밝혀졌을 때 경제적 중요성을 얻었다.진딧물에 의해 전염되는 이 바이러스는 농작물 수확량을 최대 80%까지 줄일 수 있어 감자 수확량에 상당한 손실을 입힌다.[238]
식물은 바이러스에 대한 정교하고 효과적인 방어 메커니즘을 가지고 있다.가장 효과적인 것 중 하나는 소위 저항(R) 유전자의 존재다.각 R 유전자는 감염된 세포 주변의 국소화된 세포사멸 영역을 촉발하여 특정 바이러스에 대한 저항을 유발하는데, 이는 종종 보조되지 않은 눈으로 큰 반점으로 볼 수 있다.이것은 감염의 확산을 막는다.[239]RNA 간섭은 식물에서도 효과적인 방어 수단이다.[240]식물은 감염되면 살리실산, 질소산화물, 활성산소 분자 등 바이러스를 죽이는 천연 소독제를 생산하는 경우가 많다.[241]
식물 바이러스 입자 또는 바이러스 유사 입자(VLP)는 생명공학과 나노기술 모두에 응용된다.대부분의 식물 바이러스의 캡시드는 단순하고 견고한 구조로 식물의 감염이나 다양한 이질적 시스템에서 표현에 의해 대량으로 생산될 수 있다.식물 바이러스 입자는 이물질을 캡슐화하기 위해 유전적으로 화학적으로 변형될 수 있으며 생명공학에 사용하기 위해 초분자 구조로 통합될 수 있다.[242]
세균바이러스
박테리오파지는 흔하고 다양한 바이러스의 집단이며 수생 환경에서 가장 풍부한 생물학적 실체로서, 해양에는 박테리아가 있는 것보다 최대 10배 더 많은 바이러스가 있으며, 바닷물 [243]1밀리리터 당 2억 5천만 박테리오파지의 수준에 도달한다.[244]이들 바이러스는 표면 수용체 분자에 결합한 다음 세포에 들어가 특정 박테리아를 감염시킨다.짧은 시간 내에 박테리아 중합효소가 바이러스성 mRNA를 단백질로 변환하기 시작하는 경우도 있다.이 단백질들은 세포 내의 새로운 처녀성, 새로운 처녀성의 조립을 돕는 도우미 단백질, 또는 세포 용해와 관련된 단백질이 되기 위해 계속된다.바이러스 효소는 세포막의 분해에 도움을 주며, T4 페이지의 경우 3백 페이지를 주입한 지 20분이 조금 넘어서면 방출될 수 있다.[245]
박테리아가 박테리오파지로부터 자신을 방어하는 주요한 방법은 외국의 DNA를 파괴하는 효소를 생산하는 것이다.제한 내핵이라고 불리는 이 효소들은 박테리오파지스가 박테리아 세포에 주입하는 바이러스 DNA를 잘라낸다.[246]박테리아는 또한 과거에 박테리아가 접촉한 바이러스의 게놈의 파편을 보존하기 위해 크리스퍼 시퀀스를 사용하는 시스템을 포함하고 있어 RNA 간섭의 형태를 통해 바이러스의 복제를 차단할 수 있다.[247][248]이 유전체계는 박테리아에게 감염에 대한 후천성 면역력을 제공한다.[249]
고고 바이러스
어떤 바이러스들은 고고학 내에서 복제된다: 이것들은 특이하고 때로는 독특한 모양을 가진 DNA 바이러스들이다.[7][93]이 바이러스들은 열성고고대에서 가장 상세하게 연구되어 왔는데, 특히 설포오발레스와 열성단백질(Thermoproteales)의 순서였다.[250]이러한 바이러스에 대한 방어에는 바이러스의 유전자와 관련된 고고학적 게놈 내의 반복적인 DNA 배열로부터의 RNA 간섭이 수반된다.[251][252]대부분의 고고학자는 바이러스에 대한 적응적 방어로서 CRISPR-Cas 시스템을 가지고 있다.이것들은 고대가 바이러스 DNA의 부분을 보존할 수 있게 하고, 그것은 RNA 간섭과 유사한 과정을 이용하여 바이러스에 의한 후속 감염을 목표로 하고 제거하는 데 사용된다.[253]
수생태계의 역할
바이러스는 수생 환경에서 가장 풍부한 생물학적 실체다.[2]한 티스푼의 바닷물에 약 천만 마리가 들어 있다.[254]이들 바이러스의 대부분은 이질성 박테리아와 시아노박테리아를 감염시키는 시아노박테리아를 감염시키는 박테리오파지로서 염수와 담수 생태계의 규제에 필수적이다.[255]박테리오파지는 동식물에 무해하며 해양과 담수생태계[256] 규제에 필수불가결한 것으로 수생환경에서 먹이 사슬의 기반인 식물플랑크톤의 중요한 사망요인이다.[257]그들은 수생 미생물 집단의 박테리아를 감염시키고 파괴하며, 해양 환경에서 탄소 및 영양분 순환을 재활용하는 가장 중요한 메커니즘 중 하나이다.죽은 박테리아 세포에서 방출된 유기 분자는 바이러스 분자로 알려진 과정에서 신선한 박테리아와 조류 성장을 자극한다.[258]특히 바이러스에 의한 박테리아 용해로 질소 순환을 강화하고 식물성 플랑크톤 성장을 촉진하는 것으로 나타났다.[259]바이러스 활동은 또한 생물학적 펌프에 영향을 미칠 수 있는데, 그것은 깊은 바다에서 탄소가 격리되는 과정이다.[260]
미생물은 바다 생물량의 90% 이상을 차지한다.바이러스는 매일 이 바이오매스의 약 20%를 죽이며 해양에는 박테리아와 고고학보다 10~15배나 많은 바이러스가 있는 것으로 추정된다.[261]바이러스는 또한 유해한 녹조를 포함한 식물성 플랑크톤 파괴의 주요 원인이다.[262] 해양의 바이러스의 수는 더 멀리 앞바다에서 감소하고, 숙주 생물이 더 적은 더 깊은 물 속으로 들어간다.[260]
2018년 1월, 과학자들은 지구 대기권으로부터 지구 표면의 모든 평방미터까지 매일 8억개의 바이러스가 축적되고 있다고 보고했다. 이는 지구 대기권으로부터 지구 표면의 모든 평방미터까지 바이러스의 흐름이 기상계 위에서는 순환하지만 일반적인 항공 여행의 고도 아래에서는 순환하면서 바이러스를 분산시키는 결과였다.행성에 [263][264]우주를 뿌리다
다른 유기체들과 마찬가지로 해양 포유류도 바이러스 감염에 취약하다.1988년과 2002년에 유럽에서 수천개의 항만 물개가 포신 디스템퍼 바이러스에 의해 죽임을 당했다.[265]해양 포유류 개체군에는 칼리시바이루스, 헤르페스바이루스, 아데노비루스, 파보비루스를 포함한 많은 다른 바이러스들이 순환한다.[260]
진화에서의 역할
바이러스는 유전자의 다양성을 증가시키고 진화를 추진하는 다른 종들 사이에 유전자를 전달하는 중요한 자연적인 수단이다.[9][266]마지막 보편적인 공통 조상이 박테리아, 고고학, 진핵생물로 다양화되기 이전, 바이러스가 초기 진화에 중심적인 역할을 했다고 생각된다.[267]바이러스는 여전히 지구상에서 미개척 유전적 다양성의 가장 큰 저장고 중 하나이다.[260]
적용들
생명과학과 의학

바이러스는 세포의 기능을 조작하고 조사하는 데 사용될 수 있는 간단한 시스템을 제공하기 때문에 분자와 세포 생물학의 연구에 중요하다.[268]바이러스의 연구와 사용은 세포 생물학의 측면에 대한 귀중한 정보를 제공했다.[269]예를 들어, 바이러스는 유전학 연구에 유용했고 DNA 복제, 전사, RNA 처리, 번역, 단백질 운반, 면역학 등 분자 유전학의 기본 메커니즘에 대한 우리의 이해를 도왔다.
유전학자들은 종종 바이러스를 벡터로 사용하여 그들이 연구하고 있는 세포에 유전자를 주입한다.이것은 세포가 이물질을 생산하게 하거나 게놈에 새로운 유전자를 도입하는 효과를 연구하는데 유용하다.마찬가지로 바이로테라피도 바이러스를 벡터로 삼아 각종 질병을 치료하는데, 특히 세포와 DNA를 대상으로 할 수 있기 때문이다.그것은 암 치료와 유전자 치료에서 유망한 사용을 보여준다.동유럽 과학자들은 한동안 항생제의 대안으로 페이지 요법을 사용해 왔으며, 현재 일부 병원성 박테리아에서 발견되는 높은 항생제 내성 때문에 이 접근법에 대한 관심이 높아지고 있다.[270]바이러스에 의한 이질 단백질의 표현은 현재 백신 항원, 항체 등 다양한 단백질의 생산에 사용되고 있는 여러 제조 과정의 기초가 된다.최근 바이러스 벡터를 이용한 산업적 과정이 개발되었으며 현재 여러 제약 단백질이 임상 전 및 임상시험 중이다.[271]
바이로테라피
바이로테라피는 질병을 치료하기 위해 유전자 변형 바이러스를 사용하는 것을 포함한다.[272]바이러스는 암세포에서 번식하여 파괴하되 건강한 세포를 감염시키지 않도록 과학자들에 의해 변형되었다.예를 들어 탈리모젠 라에르파레프벡(T-VEC)은 유전자를 갖고 있는 변형 헤르페스 심플렉스 바이러스로, 건강한 세포에서 바이러스가 복제되려면 이를 삭제해 면역력을 자극하는 인간유전자(GM-CSF)로 대체해야 한다.이 바이러스가 암세포를 감염시키면, 암세포를 파괴하고, 그렇게 함으로써 유전자 지엠-CSF 유전자가 신체의 주변 조직으로부터 덴드리트 세포를 끌어들인다.덴드리트리틱 세포는 죽은 암세포를 처리하고 그 성분을 면역계의 다른 세포에 제시한다.[273]임상시험에 성공한 이 바이러스는 2015년 말 흑색종 치료 허가를 받았다.[274]암세포를 죽이기 위해 재프로그래밍된 바이러스를 용융제 바이러스라고 부른다.[275]
재료과학과 나노기술
나노기술의 현재 추세는 바이러스를 훨씬 더 다용도적으로 사용할 것을 약속한다.[276]재료 과학자의 관점에서 바이러스는 유기 나노입자로 간주될 수 있다.그들의 표면은 그들이 숙주 세포의 장벽을 넘을 수 있는 특정한 도구를 가지고 있다.바이러스의 크기와 형태, 그리고 표면에 있는 기능 그룹의 수와 성질을 정확하게 정의한다.이와 같이 바이러스는 공동연계된 표면변형을 위한 비계로 재료과학에서 흔히 사용된다.특정한 종류의 바이러스는 지시된 진화에 의해 맞춤화될 수 있다는 것이다.생명과학이 개발한 강력한 기술은 생물학과 의학을 넘어 광범위한 응용 분야를 개방하면서 나노물질에 대한 공학 접근법의 기초가 되고 있다.[277]
바이러스는 크기, 형태, 그리고 잘 정의된 화학 구조 때문에 나노스케일에 물질을 조직하는 템플릿으로 사용되어 왔다.최근의 예로는 워싱턴 D.C.의 해군 연구소에서 DNA 마이크로어레이 기반 센서의 신호를 증폭시키기 위해 Cowpea 모자이크 바이러스(CPMV) 입자를 사용하는 작업이 있다.이 애플리케이션에서 바이러스 입자는 신호 전달에 사용되는 형광 염료를 분리하여 퀀처 역할을 하는 비형광 다이머의 형성을 방지한다.[278]또 다른 예는 분자 전자장치를 위한 나노 크기의 빵판으로 CPMV를 사용하는 것이다.[279]
합성바이러스
많은 바이러스는 노보("처음부터")를 합성할 수 있다.최초의 합성 바이러스는 2002년에 만들어졌다.[280]다소 오해가 있긴 하지만, 합성되는 것이 실제 바이러스가 아니라, 그 DNA 게놈(DNA 바이러스의 경우), 또는 그 게놈의 cDNA 복제품(RNA 바이러스의 경우)이다.많은 바이러스 계열의 경우, 적나라한 합성 DNA 또는 RNA(한 때 합성 cDNA에서 효소적으로 다시 변환됨)는 세포에 유입될 때 감염된다.즉, 그들은 새로운 바이러스를 생산하는데 필요한 모든 정보를 포함하고 있다.이 기술은 현재 새로운 백신 전략을 조사하는 데 사용되고 있다.[281]바이러스의 게놈 서열 정보가 알려지고 허용 가능한 세포가 있는 한 바이러스를 더 이상 멸종된 것으로 간주할 수 없기 때문에 바이러스를 합성하는 능력은 광범위한 결과를 가져온다.2021년 6월 현재 천연두를 포함한 11,464종의 다른 바이러스의 전체 유전체 배열은 국립보건원이 관리하는 온라인 데이터베이스에서 공개적으로 이용할 수 있다.[282]
무기
인간 사회에 파괴적인 전염병을 일으키는 바이러스의 능력은 생물학 전쟁을 위해 바이러스가 무기로 사용될 수 있다는 우려로 이어졌다.악명 높은 1918년 인플루엔자 바이러스를 실험실에서 성공적으로 재현함으로써 더 많은 우려가 제기되었다.[283]천연두 바이러스는 근절되기 전에 역사를 통틀어 수많은 사회를 황폐화시켰다.천연두 바이러스 재고를 보유하기 위해 세계보건기구가 승인한 센터는 러시아에 있는 Viological and BECTOR의 주 연구 센터와 미국의 질병통제예방센터 두 곳뿐이다.[284]천연두 백신은 때때로 심각한 부작용을 일으키기 때문에, 그것은 더 이상 어느 나라에서도 일상적으로 사용되지 않는다.[284]따라서 현대 인구의 상당수는 천연두에 대한 저항력이 거의 확립되어 있지 않고 바이러스에 취약할 것이다.[284]
참고 항목
참조
메모들
- ^ Wu KJ (15 April 2020). "There are more viruses than stars in the universe. Why do only some infect us? – More than a quadrillion quadrillion individual viruses exist on Earth, but most are not poised to hop into humans. Can we find the ones that are?". National Geographic Society. Retrieved 18 May 2020.
- ^ a b c Koonin EV, Senkevich TG, Dolja VV (September 2006). "The ancient Virus World and evolution of cells". Biology Direct. 1 (1): 29. doi:10.1186/1745-6150-1-29. PMC 1594570. PMID 16984643.
- ^ Zimmer C (26 February 2021). "The Secret Life of a Coronavirus - An oily, 100-nanometer-wide bubble of genes has killed more than two million people and reshaped the world. Scientists don't quite know what to make of it". Archived from the original on 28 December 2021. Retrieved 28 February 2021.
- ^ a b c 딤목 페이지 4
- ^ a b "Virus Taxonomy: 2020 Release". talk.ictvonline.org. International Committee on Taxonomy of Viruses. Retrieved 21 May 2021.
- ^ a b Breitbart M, Rohwer F (June 2005). "Here a virus, there a virus, everywhere the same virus?". Trends in Microbiology. 13 (6): 278–84. doi:10.1016/j.tim.2005.04.003. PMID 15936660.
- ^ a b Lawrence CM, Menon S, Eilers BJ, Bothner B, Khayat R, Douglas T, Young MJ (May 2009). "Structural and functional studies of archaeal viruses". The Journal of Biological Chemistry. 284 (19): 12599–603. doi:10.1074/jbc.R800078200. PMC 2675988. PMID 19158076.
- ^ Edwards RA, Rohwer F (June 2005). "Viral metagenomics". Nature Reviews. Microbiology. 3 (6): 504–10. doi:10.1038/nrmicro1163. PMID 15886693. S2CID 8059643.
- ^ a b Canchaya C, Fournous G, Chibani-Chennoufi S, Dillmann ML, Brüssow H (August 2003). "Phage as agents of lateral gene transfer". Current Opinion in Microbiology. 6 (4): 417–24. doi:10.1016/S1369-5274(03)00086-9. PMID 12941415.
- ^ a b Rybicki EP (1990). "The classification of organisms at the edge of life, or problems with virus systematics". South African Journal of Science. 86: 182–86.
- ^ a b Koonin EV, Starokadomskyy P (October 2016). "Are viruses alive? The replicator paradigm sheds decisive light on an old but misguided question". Studies in History and Philosophy of Biological and Biomedical Sciences. 59: 125–34. doi:10.1016/j.shpsc.2016.02.016. PMC 5406846. PMID 26965225.
- ^ Robilotti E, Deresinski S, Pinsky BA (January 2015). "Norovirus". Clinical Microbiology Reviews. 28 (1): 134–64. doi:10.1128/CMR.00075-14. PMC 4284304. PMID 25567225.
- ^ 쇼르 페이지 123-124
- ^ "Virus, n.". OED Online. Oxford University Press. March 2015.
- ^ a b Harper D (2011). "virus". The Online Etymology Dictionary. Retrieved 19 December 2014.
- ^ "Virulent, adj.". OED Online. Oxford University Press. March 2015.
- ^ Harper D (2011). "virulent". The Online Etymology Dictionary. Retrieved 19 December 2014.
- ^ Buschard K, Thon R (2003). "Diabetic Animal Models". In Hau J, Van Hoosier Jr GL (eds.). Handbook of Laboratory Animal Science. Animal Models. Vol. II (Second ed.). CRC Press. pp. 163, 166.
- ^ 윌리엄 T.Stearn: 식물 라틴어. 역사, 문법, 구문, 용어 그리고 어휘.데이비드 & 찰스, 1983년 3판.인용: "바이러스: 바이러스 (s.n. II), 젠지가 노래한다.viri, nom. pl. vira, gen. pl. vīroum(남자의 virorum과 구별할 것)."
- ^ Harper D (2011). "viral". The Online Etymology Dictionary. Retrieved 19 December 2014.
- ^ Harper D (2011). "virion". The Online Etymology Dictionary. Retrieved 19 December 2014.
- ^ Casjens S (2010). Mahy BW, Van Regenmortel MH (eds.). Desk Encyclopedia of General Virology. Boston: Academic Press. p. 167. ISBN 978-0-12-375146-1.
- ^ Bordenave G (May 2003). "Louis Pasteur (1822-1895)". Microbes and Infection. 5 (6): 553–60. doi:10.1016/S1286-4579(03)00075-3. PMID 12758285.
- ^ 쇼르 74, 827페이지
- ^ a b 콜리어 페이지 3
- ^ 딤모크 pp.4–5
- ^ Fenner F (2009). Mahy BW, Van Regenmortal MH (eds.). Desk Encyclopedia of General Virology (1 ed.). Oxford: Academic Press. p. 15. ISBN 978-0-12-375146-1.
- ^ 쇼르스 페이지 827
- ^ D'Herelle F (September 2007). "On an invisible microbe antagonistic toward dysenteric bacilli: brief note by Mr. F. D'Herelle, presented by Mr. Roux. 1917". Research in Microbiology. 158 (7): 553–54. doi:10.1016/j.resmic.2007.07.005. PMID 17855060.
- ^ Domingo-Calap P, Georgel P, Bahram S (March 2016). "Back to the future: bacteriophages as promising therapeutic tools". HLA. 87 (3): 133–40. doi:10.1111/tan.12742. PMID 26891965. S2CID 29223662.
- ^ Steinhardt E, Israeli C, Lambert RA (1913). "Studies on the cultivation of the virus of vaccinia". The Journal of Infectious Diseases. 13 (2): 294–300. doi:10.1093/infdis/13.2.294.
- ^ 콜리어 페이지 4
- ^ Goodpasture EW, Woodruff AM, Buddingh GJ (October 1931). "The cultivation of vaccine and other viruses in the chorioallantoic membrane of chick embryos". Science. 74 (1919): 371–72. Bibcode:1931Sci....74..371G. doi:10.1126/science.74.1919.371. PMID 17810781.
- ^ Thomas Huckle Weller (2004). Growing Pathogens in Tissue Cultures: Fifty Years in Academic Tropical Medicine, Pediatrics, and Virology. Boston Medical Library. p. 57. ISBN 978-0-88135-380-8.
- ^ Rosen FS (October 2004). "Isolation of poliovirus--John Enders and the Nobel Prize". The New England Journal of Medicine. 351 (15): 1481–83. doi:10.1056/NEJMp048202. PMID 15470207.
- ^ Frängsmyr T, Ekspång G, eds. (1993). Nobel Lectures, Physics 1981–1990. Singapore: World Scientific Publishing Co. Bibcode:1993nlp..book.....F.
- 1887년, Buist는 가장 큰 바이러스 중 하나인 Pepinia 바이러스를 광학 현미경 검사로 그것을 시각화했다.당시 바이러스인 것으로 알려진 바는 없다.(부이스트 J.B.Puppinia and Variola: 그들의 인생사에 대한 연구, Churchill, London)
- ^ Stanley WM, Loring HS (January 1936). "The Isolation of Crystalline Tobacco Mosaic Virus Protein From Diseased Tomato Plants". Science. 83 (2143): 85. Bibcode:1936Sci....83...85S. doi:10.1126/science.83.2143.85. PMID 17756690.
- ^ Stanley WM, Lauffer MA (April 1939). "Disintegration of Tobacco Mosaic Virus in Urea Solutions". Science. 89 (2311): 345–47. Bibcode:1939Sci....89..345S. doi:10.1126/science.89.2311.345. PMID 17788438.
- ^ Creager AN, Morgan GJ (June 2008). "After the double helix: Rosalind Franklin's research on Tobacco mosaic virus". Isis; an International Review Devoted to the History of Science and Its Cultural Influences. 99 (2): 239–72. doi:10.1086/588626. PMID 18702397. S2CID 25741967.
- ^ 딤목 페이지 12
- ^ Norrby E (2008). "Nobel Prizes and the emerging virus concept". Archives of Virology. 153 (6): 1109–23. doi:10.1007/s00705-008-0088-8. PMID 18446425. S2CID 10595263.
- ^ 콜리어 페이지 745
- ^ a b Temin HM, Baltimore D (1972). "RNA-directed DNA synthesis and RNA tumor viruses". Advances in Virus Research. 17: 129–86. doi:10.1016/S0065-3527(08)60749-6. ISBN 9780120398171. PMID 4348509.
- ^ Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, et al. (May 1983). "Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)". Science. 220 (4599): 868–71. Bibcode:1983Sci...220..868B. doi:10.1126/science.6189183. PMID 6189183.
- ^ Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M (April 1989). "Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome". Science. 244 (4902): 359–62. Bibcode:1989Sci...244..359C. CiteSeerX 10.1.1.469.3592. doi:10.1126/science.2523562. PMID 2523562.
- ^ Houghton M (November 2009). "The long and winding road leading to the identification of the hepatitis C virus". Journal of Hepatology. 51 (5): 939–48. doi:10.1016/j.jhep.2009.08.004. PMID 19781804.
- ^ Iyer LM, Balaji S, Koonin EV, Aravind L (April 2006). "Evolutionary genomics of nucleo-cytoplasmic large DNA viruses". Virus Research. 117 (1): 156–84. doi:10.1016/j.virusres.2006.01.009. PMID 16494962.
- ^ a b Sanjuán R, Nebot MR, Chirico N, Mansky LM, Belshaw R (October 2010). "Viral mutation rates". Journal of Virology. 84 (19): 9733–48. doi:10.1128/JVI.00694-10. PMC 2937809. PMID 20660197.
- ^ 쇼르 페이지 14-16
- ^ 콜리어 페이지 11-21
- ^ a b 딤목 페이지 16
- ^ 콜리어 페이지 11
- ^ a b c d Mahy WJ, Regenmortel MH, eds. (2009). Desk Encyclopedia of General Virology. Oxford: Academic Press. p. 24. ISBN 978-0-12-375146-1.
- ^ 쇼어 페이지 810
- ^ McClintock B (June 1950). "The origin and behavior of mutable loci in maize". Proceedings of the National Academy of Sciences of the United States of America. 36 (6): 344–55. Bibcode:1950PNAS...36..344M. doi:10.1073/pnas.36.6.344. PMC 1063197. PMID 15430309.
- ^ 콜리어 페이지 11-12
- ^ 딤목 페이지 55
- ^ 791쪽 쇼르
- ^ Tsagris EM, Martínez de Alba AE, Gozmanova M, Kalantidis K (November 2008). "Viroids". Cellular Microbiology. 10 (11): 2168–79. doi:10.1111/j.1462-5822.2008.01231.x. PMID 18764915. S2CID 221581424.
- ^ Shors pp.460
- ^ a b La Scola B, Desnues C, Pagnier I, Robert C, Barrassi L, Fournous G, et al. (September 2008). "The virophage as a unique parasite of the giant mimivirus". Nature. 455 (7209): 100–04. Bibcode:2008Natur.455..100L. doi:10.1038/nature07218. PMID 18690211. S2CID 4422249.
- ^ 콜리어 페이지 777
- ^ 딤목 페이지 55-57
- ^ a b Mahy WJ, Van Regenmortel MH, eds. (2009). Desk Encyclopedia of General Virology. Oxford: Academic Press. p. 28. ISBN 978-0-12-375146-1.
- ^ a b Mahy WJ, Regenmortel MH, eds. (2009). Desk Encyclopedia of General Virology. Oxford: Academic Press. p. 26. ISBN 978-0-12-375146-1.
- ^ 딤목 페이지 15-16
- ^ Holmes EC (October 2007). "Viral evolution in the genomic age". PLOS Biology. 5 (10): e278. doi:10.1371/journal.pbio.0050278. PMC 1994994. PMID 17914905.
- ^ Wimmer E, Mueller S, Tumpey TM, Taubenberger JK (December 2009). "Synthetic viruses: a new opportunity to understand and prevent viral disease". Nature Biotechnology. 27 (12): 1163–72. doi:10.1038/nbt.1593. PMC 2819212. PMID 20010599.
- ^ Horn M (2008). "Chlamydiae as symbionts in eukaryotes". Annual Review of Microbiology. 62: 113–31. doi:10.1146/annurev.micro.62.081307.162818. PMID 18473699.
- ^ Ammerman NC, Beier-Sexton M, Azad AF (November 2008). "Laboratory maintenance of Rickettsia rickettsii". Current Protocols in Microbiology. 11 (1): 3A.5.1–3A.5.21. doi:10.1002/9780471729259.mc03a05s11. ISBN 978-0471729259. PMC 2725428. PMID 19016440.
- ^ 크라스너 페이지 98
- ^ a b 콜리어 페이지 33-55
- ^ 콜리어 페이지 33–37
- ^ Kiselev NA, Sherman MB, Tsuprun VL (1990). "Negative staining of proteins". Electron Microscopy Reviews. 3 (1): 43–72. doi:10.1016/0892-0354(90)90013-I. PMID 1715774.
- ^ 콜리어 페이지 40
- ^ Caspar DL, Klug A (1962). "Physical principles in the construction of regular viruses". Cold Spring Harbor Symposia on Quantitative Biology. 27: 1–24. doi:10.1101/sqb.1962.027.001.005. PMID 14019094.
- ^ Crick FH, Watson JD (March 1956). "Structure of small viruses". Nature. 177 (4506): 473–75. Bibcode:1956Natur.177..473C. doi:10.1038/177473a0. PMID 13309339. S2CID 5740221.
- ^ Falvo MR, Washburn S, Superfine R, Finch M, Brooks FP, Chi V, Taylor RM (March 1997). "Manipulation of individual viruses: friction and mechanical properties". Biophysical Journal. 72 (3): 1396–403. Bibcode:1997BpJ....72.1396F. doi:10.1016/S0006-3495(97)78786-1. PMC 1184522. PMID 9138585.
- ^ Kuznetsov YG, Malkin AJ, Lucas RW, Plomp M, McPherson A (September 2001). "Imaging of viruses by atomic force microscopy". The Journal of General Virology. 82 (Pt 9): 2025–34. doi:10.1099/0022-1317-82-9-2025. PMID 11514711.
- ^ 콜리어 페이지 37
- ^ Straus SK, Bo HE (2018). "Filamentous Bacteriophage Proteins and Assembly". Sub-Cellular Biochemistry. 88: 261–279. doi:10.1007/978-981-10-8456-0_12. ISBN 978-981-10-8455-3. PMID 29900501.
- ^ 콜리어 페이지 40, 42
- ^ Wilson DP (2016). "Protruding Features of Viral Capsids Are Clustered on Icosahedral Great Circles". PLOS ONE. 11 (4): e0152319. Bibcode:2016PLoSO..1152319W. doi:10.1371/journal.pone.0152319. PMC 4821576. PMID 27045511.
- ^ Casens S (2009). Desk Encyclopedia of General Virology. Boston: Academic Press. pp. 167–74. ISBN 978-0-12-375146-1.
- ^ Dhama K, Khan S, Tiwari R, Sircar S, Bhat S, Malik YS, Singh KP, Chaicumpa W, Bonilla-Aldana DK, Rodriguez-Morales AJ (September 2020). "Coronavirus Disease 2019-COVID-19". Clinical Microbiology Reviews. 33 (4). doi:10.1128/CMR.00028-20. PMC 7405836. PMID 32580969.
- ^ 콜리어 페이지 42-43
- ^ Rossmann MG, Mesyanzhinov VV, Arisaka F, Leiman PG (April 2004). "The bacteriophage T4 DNA injection machine". Current Opinion in Structural Biology. 14 (2): 171–80. doi:10.1016/j.sbi.2004.02.001. PMID 15093831.
- ^ Long GW, Nobel J, Murphy FA, Herrmann KL, Lourie B (September 1970). "Experience with electron microscopy in the differential diagnosis of smallpox". Applied Microbiology. 20 (3): 497–504. doi:10.1128/AEM.20.3.497-504.1970. PMC 376966. PMID 4322005.
- ^ Suzan-Monti M, La Scola B, Raoult D (April 2006). "Genomic and evolutionary aspects of Mimivirus". Virus Research. 117 (1): 145–55. doi:10.1016/j.virusres.2005.07.011. PMID 16181700.
- ^ Arslan D, Legendre M, Seltzer V, Abergel C, Claverie JM (October 2011). "Distant Mimivirus relative with a larger genome highlights the fundamental features of Megaviridae". Proceedings of the National Academy of Sciences of the United States of America. 108 (42): 17486–91. Bibcode:2011PNAS..10817486A. doi:10.1073/pnas.1110889108. PMC 3198346. PMID 21987820.
- ^ a b Philippe N, Legendre M, Doutre G, Couté Y, Poirot O, Lescot M, et al. (July 2013). "Pandoraviruses: amoeba viruses with genomes up to 2.5 Mb reaching that of parasitic eukaryotes" (PDF). Science. 341 (6143): 281–86. Bibcode:2013Sci...341..281P. doi:10.1126/science.1239181. PMID 23869018. S2CID 16877147.
- ^ Brandes N, Linial M (April 2019). "Giant Viruses-Big Surprises". Viruses. 11 (5): 404. doi:10.3390/v11050404. PMC 6563228. PMID 31052218.
- ^ a b Prangishvili D, Forterre P, Garrett RA (November 2006). "Viruses of the Archaea: a unifying view". Nature Reviews. Microbiology. 4 (11): 837–48. doi:10.1038/nrmicro1527. PMID 17041631. S2CID 9915859.
- ^ a b 딤목 페이지 49
- ^ "NCBI Viral Genome database". ncbi.nlm.nih.gov. Retrieved 15 January 2017.
- ^ Pennisi E (March 2011). "Microbiology. Going viral: exploring the role of viruses in our bodies". Science. 331 (6024): 1513. Bibcode:2011Sci...331.1513P. doi:10.1126/science.331.6024.1513. PMID 21436418.
- ^ Shi M, Lin XD, Tian JH, Chen LJ, Chen X, Li CX, et al. (December 2016). "Redefining the invertebrate RNA virosphere". Nature. 540 (7634): 539–43. Bibcode:2016Natur.540..539S. doi:10.1038/nature20167. PMID 27880757. S2CID 1198891.
- ^ a b c 콜리어 페이지 96-99
- ^ Saunders VA, Carter J (2007). Virology: principles and applications. Chichester: John Wiley & Sons. p. 72. ISBN 978-0-470-02387-7.
- ^ Belyi VA, Levine AJ, Skalka AM (December 2010). "Sequences from ancestral single-stranded DNA viruses in vertebrate genomes: the parvoviridae and circoviridae are more than 40 to 50 million years old". Journal of Virology. 84 (23): 12458–62. doi:10.1128/JVI.01789-10. PMC 2976387. PMID 20861255.
- ^ Brandes N, Linial M (May 2016). "Gene overlapping and size constraints in the viral world". Biology Direct. 11 (1): 26. doi:10.1186/s13062-016-0128-3. PMC 4875738. PMID 27209091.
- ^ Pressing J, Reanney DC (1984). "Divided genomes and intrinsic noise". Journal of Molecular Evolution. 20 (2): 135–46. Bibcode:1984JMolE..20..135P. doi:10.1007/BF02257374. PMC 7087551. PMID 6433032.
- ^ Duffy S, Holmes EC (June 2009). "Validation of high rates of nucleotide substitution in geminiviruses: phylogenetic evidence from East African cassava mosaic viruses". The Journal of General Virology. 90 (Pt 6): 1539–47. doi:10.1099/vir.0.009266-0. PMC 4091138. PMID 19264617.
- ^ Sandbulte MR, Westgeest KB, Gao J, Xu X, Klimov AI, Russell CA, et al. (December 2011). "Discordant antigenic drift of neuraminidase and hemagglutinin in H1N1 and H3N2 influenza viruses". Proceedings of the National Academy of Sciences of the United States of America. 108 (51): 20748–53. Bibcode:2011PNAS..10820748S. doi:10.1073/pnas.1113801108. PMC 3251064. PMID 22143798.
- ^ Moss RB, Davey RT, Steigbigel RT, Fang F (June 2010). "Targeting pandemic influenza: a primer on influenza antivirals and drug resistance". The Journal of Antimicrobial Chemotherapy. 65 (6): 1086–93. doi:10.1093/jac/dkq100. PMID 20375034.
- ^ Hampson AW, Mackenzie JS (November 2006). "The influenza viruses". The Medical Journal of Australia. 185 (S10): S39–43. doi:10.5694/j.1326-5377.2006.tb00705.x. PMID 17115950. S2CID 17069567.
- ^ Metzner KJ (December 2006). "Detection and significance of minority quasispecies of drug-resistant HIV-1". Journal of HIV Therapy. 11 (4): 74–81. PMID 17578210.
- ^ Gossmit, Jaap.바이럴 섹스.1998년 옥스퍼드 유니브 프레스ISBN 978-0-19-512496-5, 0-19-512496-0
- ^ Worobey M, Holmes EC (October 1999). "Evolutionary aspects of recombination in RNA viruses". The Journal of General Virology. 80 (10): 2535–43. doi:10.1099/0022-1317-80-10-2535. PMID 10573145.
- ^ Lukashev AN (2005). "Role of recombination in evolution of enteroviruses". Reviews in Medical Virology. 15 (3): 157–67. doi:10.1002/rmv.457. PMID 15578739. S2CID 26000112.
- ^ Umene K (July 1999). "Mechanism and application of genetic recombination in herpesviruses". Reviews in Medical Virology. 9 (3): 171–82. doi:10.1002/(SICI)1099-1654(199907/09)9:3<171::AID-RMV243>3.0.CO;2-A. PMID 10479778.
- ^ Freed EO (August 2015). "HIV-1 assembly, release and maturation". Nature Reviews. Microbiology. 13 (8): 484–96. doi:10.1038/nrmicro3490. PMC 6936268. PMID 26119571.
- ^ Yin J, Redovich J (June 2018). "Kinetic Modeling of Virus Growth in Cells". Microbiology and Molecular Biology Reviews. 82 (2). doi:10.1128/MMBR.00066-17. PMC 5968458. PMID 29592895.
- ^ 콜리어 페이지 75-91
- ^ Más V, Melero JA (2013). "Entry of enveloped viruses into host cells: membrane fusion". Structure and Physics of Viruses. Subcellular Biochemistry. Vol. 68. pp. 467–87. doi:10.1007/978-94-007-6552-8_16. ISBN 978-94-007-6551-1. PMC 7121288. PMID 23737062.
- ^ 딤목 페이지 70
- ^ Boevink P, Oparka KJ (August 2005). "Virus-host interactions during movement processes". Plant Physiology. 138 (4): 1815–21. doi:10.1104/pp.105.066761. PMC 1183373. PMID 16172094.
- ^ 딤목 페이지 71
- ^ Blaas D (May 2016). "Viral entry pathways: the example of common cold viruses". Wiener Medizinische Wochenschrift. 166 (7–8): 211–26. doi:10.1007/s10354-016-0461-2. PMC 4871925. PMID 27174165.
- ^ Isomura H, Stinski MF (February 2013). "Coordination of late gene transcription of human cytomegalovirus with viral DNA synthesis: recombinant viruses as potential therapeutic vaccine candidates". Expert Opinion on Therapeutic Targets. 17 (2): 157–66. doi:10.1517/14728222.2013.740460. PMID 23231449. S2CID 11448687.
- ^ Barman S, Ali A, Hui EK, Adhikary L, Nayak DP (September 2001). "Transport of viral proteins to the apical membranes and interaction of matrix protein with glycoproteins in the assembly of influenza viruses". Virus Research. 77 (1): 61–69. doi:10.1016/S0168-1702(01)00266-0. PMID 11451488.
- ^ 836쪽 쇼르
- ^ Dimmock, 15장 바이러스 대기 시간 메커니즘, 페이지 243–59
- ^ 딤목 185-87
- ^ 쇼어 페이지 118; 콜리어 페이지 78
- ^ 콜리어 페이지 79
- ^ Staginnus C, Richert-Pöggeler KR (October 2006). "Endogenous pararetroviruses: two-faced travelers in the plant genome". Trends in Plant Science. 11 (10): 485–91. doi:10.1016/j.tplants.2006.08.008. PMID 16949329.
- ^ 콜리어 페이지 88-89
- ^ 콜리어 페이지 115-46
- ^ 콜리어 페이지 115
- ^ Roulston A, Marcellus RC, Branton PE (1999). "Viruses and apoptosis". Annual Review of Microbiology. 53: 577–628. doi:10.1146/annurev.micro.53.1.577. PMID 10547702.
- ^ Alwine JC (2008). "Modulation of host cell stress responses by human cytomegalovirus". Current Topics in Microbiology and Immunology. 325: 263–79. doi:10.1007/978-3-540-77349-8_15. ISBN 978-3-540-77348-1. PMID 18637511.
- ^ Barozzi P, Potenza L, Riva G, Vallerini D, Quadrelli C, Bosco R, et al. (December 2007). "B cells and herpesviruses: a model of lymphoproliferation". Autoimmunity Reviews. 7 (2): 132–36. doi:10.1016/j.autrev.2007.02.018. PMID 18035323.
- ^ Subramanya D, Grivas PD (November 2008). "HPV and cervical cancer: updates on an established relationship". Postgraduate Medicine. 120 (4): 7–13. doi:10.3810/pgm.2008.11.1928. PMID 19020360. S2CID 1399003.
- ^ Sinclair J (March 2008). "Human cytomegalovirus: Latency and reactivation in the myeloid lineage". Journal of Clinical Virology. 41 (3): 180–85. doi:10.1016/j.jcv.2007.11.014. PMID 18164651.
- ^ Jordan MC, Jordan GW, Stevens JG, Miller G (June 1984). "Latent herpesviruses of humans". Annals of Internal Medicine. 100 (6): 866–80. doi:10.7326/0003-4819-100-6-866. PMID 6326635.
- ^ Sissons JG, Bain M, Wills MR (February 2002). "Latency and reactivation of human cytomegalovirus". The Journal of Infection. 44 (2): 73–77. doi:10.1053/jinf.2001.0948. PMID 12076064.
- ^ Crawford DH (2011). Viruses: A Very Short Introduction. Oxford University Press, US. pp. 16. ISBN 978-0-19-957485-8.
- ^ 쇼어 페이지 643
- ^ 쇼르스 페이지 631
- ^ 딤목 페이지 272
- ^ Baggesen DL, Sørensen G, Nielsen EM, Wegener HC (January 2010). "Phage typing of Salmonella Typhimurium – is it still a useful tool for surveillance and outbreak investigation?". Euro Surveillance. 15 (4): 19471. PMID 20122382. Retrieved 19 December 2014.
- ^ Parker MT (September 2016). "An Ecological Framework of the Human Virome Provides Classification of Current Knowledge and Identifies Areas of Forthcoming Discovery". The Yale Journal of Biology and Medicine. 89 (3): 339–51. PMC 5045143. PMID 27698618.
- ^ Lwoff A, Horne RW, Tournier P (June 1962). "[A virus system]". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences (in French). 254: 4225–27. PMID 14467544.
- ^ Lwoff A, Horne R, Tournier P (1962). "A system of viruses". Cold Spring Harbor Symposia on Quantitative Biology. 27: 51–55. doi:10.1101/sqb.1962.027.001.008. PMID 13931895.
- ^ Fauquet CM, Fargette D (August 2005). "International Committee on Taxonomy of Viruses and the 3,142 unassigned species". Virology Journal. 2: 64. doi:10.1186/1743-422X-2-64. PMC 1208960. PMID 16105179.
- ^ International Committee on Taxonomy of Viruses Executive Committee (May 2020). "The New Scope of Virus Taxonomy: Partitioning the Virosphere Into 15 Hierarchical Ranks". Nat Microbiol. 5 (5): 668–674. doi:10.1038/s41564-020-0709-x. PMC 7186216. PMID 32341570.
- ^ Delwart EL (2007). "Viral metagenomics". Reviews in Medical Virology. 17 (2): 115–31. doi:10.1002/rmv.532. PMC 7169062. PMID 17295196.
- ^ Baltimore D (1974). "The strategy of RNA viruses". Harvey Lectures. 70 Series. 70 Series: 57–74. PMID 4377923.
- ^ van Regenmortel MH, Mahy BW (January 2004). "Emerging issues in virus taxonomy". Emerging Infectious Diseases. 10 (1): 8–13. doi:10.3201/eid1001.030279. PMC 3322749. PMID 15078590.
- ^ Mayo MA (1999). "Developments in plant virus taxonomy since the publication of the 6th ICTV Report. International Committee on Taxonomy of Viruses". Archives of Virology. 144 (8): 1659–66. doi:10.1007/s007050050620. PMID 10486120. S2CID 33422303.
- ^ de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H (June 2004). "Classification of papillomaviruses". Virology. 324 (1): 17–27. doi:10.1016/j.virol.2004.03.033. PMID 15183049.
- ^ 주로 33장 (질병 요약), 페이지 367–92:Fisher B, Harvey RP, Champe PC (2007). Lippincott's Illustrated Reviews: Microbiology. Lippincott's Illustrated Reviews Series. Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 367–92. ISBN 978-0-7817-8215-9.
- ^ Komaroff AL (December 2006). "Is human herpesvirus-6 a trigger for chronic fatigue syndrome?". Journal of Clinical Virology. 37 (Suppl 1): S39–46. doi:10.1016/S1386-6532(06)70010-5. PMID 17276367.
- ^ Chen CH, Chiu YL, Wei FC, Koong FJ, Liu HC, Shaw CK, et al. (January 1999). "High seroprevalence of Borna virus infection in schizophrenic patients, family members and mental health workers in Taiwan". Molecular Psychiatry. 4 (1): 33–38. doi:10.1038/sj.mp.4000484. PMID 10089006. S2CID 19830976.
- ^ Margolis TP, Elfman FL, Leib D, Pakpour N, Apakupakul K, Imai Y, Voytek C (October 2007). "Spontaneous reactivation of herpes simplex virus type 1 in latently infected murine sensory ganglia". Journal of Virology. 81 (20): 11069–74. doi:10.1128/JVI.00243-07. PMC 2045564. PMID 17686862.
- ^ Whitley RJ, Roizman B (May 2001). "Herpes simplex virus infections". Lancet. 357 (9267): 1513–18. doi:10.1016/S0140-6736(00)04638-9. PMID 11377626. S2CID 9854903.
- ^ Barton ES, White DW, Cathelyn JS, Brett-McClellan KA, Engle M, Diamond MS, et al. (May 2007). "Herpesvirus latency confers symbiotic protection from bacterial infection". Nature. 447 (7142): 326–29. Bibcode:2007Natur.447..326B. doi:10.1038/nature05762. PMID 17507983. S2CID 4425405.
- ^ Bertoletti A, Gehring A (October 2007). "Immune response and tolerance during chronic hepatitis B virus infection". Hepatology Research. 37 (Suppl 3): S331–38. doi:10.1111/j.1872-034X.2007.00221.x. PMID 17931183. S2CID 13386004.
- ^ Rodrigues C, Deshmukh M, Jacob T, Nukala R, Menon S, Mehta A (2001). "Significance of HBV DNA by PCR over serological markers of HBV in acute and chronic patients". Indian Journal of Medical Microbiology. 19 (3): 141–44. PMID 17664817.
- ^ Nguyen VT, McLaws ML, Dore GJ (December 2007). "Highly endemic hepatitis B infection in rural Vietnam". Journal of Gastroenterology and Hepatology. 22 (12): 2093–100. doi:10.1111/j.1440-1746.2007.05010.x. PMID 17645465. S2CID 29885790.
- ^ Fowler MG, Lampe MA, Jamieson DJ, Kourtis AP, Rogers MF (September 2007). "Reducing the risk of mother-to-child human immunodeficiency virus transmission: past successes, current progress and challenges, and future directions". American Journal of Obstetrics and Gynecology. 197 (3 Suppl): S3–9. doi:10.1016/j.ajog.2007.06.048. PMID 17825648.
- ^ Sauerbrei A, Wutzler P (December 2000). "The congenital varicella syndrome". Journal of Perinatology. 20 (8 Pt 1): 548–54. doi:10.1038/sj.jp.7200457. PMID 11190597. S2CID 7973561.
- ^ a b Antonovics J, Wilson AJ, Forbes MR, Hauffe HC, Kallio ER, Leggett HC, Longdon B, Okamura B, Sait SM, Webster JP (May 2017). "The evolution of transmission mode". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 372 (1719). doi:10.1098/rstb.2016.0083. PMC 5352810. PMID 28289251.
- ^ Garnett GP (February 2005). "Role of herd immunity in determining the effect of vaccines against sexually transmitted disease". The Journal of Infectious Diseases. 191 (Suppl 1): S97–106. doi:10.1086/425271. PMID 15627236.
- ^ Platonov AE (2006). "[The influence of weather conditions on the epidemiology of vector-borne diseases by the example of West Nile fever in Russia]". Vestnik Rossiiskoi Akademii Meditsinskikh Nauk (in Russian) (2): 25–29. PMID 16544901.
- ^ 쇼르스 페이지 264
- ^ 쇼르스 페이지 894
- ^ Jewell CP, Keeling MJ, Roberts GO (December 2009). "Predicting undetected infections during the 2007 foot-and-mouth disease outbreak". Journal of the Royal Society, Interface. 6 (41): 1145–51. doi:10.1098/rsif.2008.0433. PMC 2817150. PMID 19091686.
- ^ 쇼르스 페이지 170
- ^ a b 쇼르스 페이지 170-72
- ^ 쇼르스 페이지 272
- ^ 891쪽 쇼르
- ^ 콜리어 페이지 409-15
- ^ Patterson KD, Pyle GF (1991). "The geography and mortality of the 1918 influenza pandemic". Bulletin of the History of Medicine. 65 (1): 4–21. PMID 2021692.
- ^ Johnson NP, Mueller J (2002). "Updating the accounts: global mortality of the 1918-1920 "Spanish" influenza pandemic". Bulletin of the History of Medicine. 76 (1): 105–15. doi:10.1353/bhm.2002.0022. PMID 11875246. S2CID 22974230.
- ^ Eisinger RW, Fauci AS (March 2018). "1". Emerging Infectious Diseases. 24 (3): 413–16. doi:10.3201/eid2403.171797. PMC 5823353. PMID 29460740.
- ^ Qin Y, Zhao MJ, Tan YY, Li XQ, Zheng JD, Peng ZB, Feng LZ (August 2018). "[History of influenza pandemics in China during the past century]". Zhonghua Liu Xing Bing Xue Za Zhi = Zhonghua Liuxingbingxue Zazhi (in Chinese). 39 (8): 1028–31. doi:10.3760/cma.j.issn.0254-6450.2018.08.003. PMID 30180422.
- ^ Gao F, Bailes E, Robertson DL, Chen Y, Rodenburg CM, Michael SF, et al. (February 1999). "Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes". Nature. 397 (6718): 436–41. Bibcode:1999Natur.397..436G. doi:10.1038/17130. PMID 9989410. S2CID 4432185.
- ^ "Fact Sheet" (PDF). UNAIDS.org. 2018. Retrieved 12 December 2019.
- ^ "UN AIDS DATA2019". UNAIDS.org. 2019. Retrieved 5 December 2019.
- ^ Mawar N, Saha S, Pandit A, Mahajan U (December 2005). "The third phase of HIV pandemic: social consequences of HIV/AIDS stigma & discrimination & future needs" (PDF). The Indian Journal of Medical Research. 122 (6): 471–84. PMID 16517997. Archived from the original (PDF) on 4 March 2016. Retrieved 19 December 2014.
- ^ "Status of the global HIV epidemic" (PDF). UNAIDS. 2008. Archived from the original (PDF) on 22 November 2015. Retrieved 19 December 2014.
- ^ Towner JS, Khristova ML, Sealy TK, Vincent MJ, Erickson BR, Bawiec DA, et al. (July 2006). "Marburgvirus genomics and association with a large hemorrhagic fever outbreak in Angola". Journal of Virology. 80 (13): 6497–516. doi:10.1128/JVI.00069-06. PMC 1488971. PMID 16775337.
- ^ "World Health Organisation report, 24 September 2014" (PDF).
- ^ "Virology Journal". Virology Journal.
- ^ Weiss SR, Leibowitz JL (2011). Coronavirus pathogenesis. Advances in Virus Research. Vol. 81. pp. 85–164. doi:10.1016/B978-0-12-385885-6.00009-2. ISBN 978-0-12-385885-6. PMC 7149603. PMID 22094080.
- ^ Wong AT, Chen H, Liu SH, Hsu EK, Luk KS, Lai CK, et al. (May 2017). "From SARS to Avian Influenza Preparedness in Hong Kong". Clinical Infectious Diseases. 64 (suppl_2): S98–S104. doi:10.1093/cid/cix123. PMID 28475794.
- ^ Ashour HM, Elkhatib WF, Rahman MM, Elshabrawy HA (March 2020). "Insights into the Recent 2019 Novel Coronavirus (SARS-CoV-2) in Light of Past Human Coronavirus Outbreaks". Pathogens. 9 (3): 186. doi:10.3390/pathogens9030186. PMC 7157630. PMID 32143502.
- ^ Deng SQ, Peng HJ (February 2020). "Characteristics of and Public Health Responses to the Coronavirus Disease 2019 Outbreak in China". Journal of Clinical Medicine. 9 (2): 575. doi:10.3390/jcm9020575. PMC 7074453. PMID 32093211.
- ^ Han Q, Lin Q, Jin S, You L (April 2020). "Coronavirus 2019-nCoV: A brief perspective from the front line". The Journal of Infection. 80 (4): 373–77. doi:10.1016/j.jinf.2020.02.010. PMC 7102581. PMID 32109444.
- ^ Londoño E, Ortiz A (16 March 2020). "Coronavirus Travel Restrictions, Across the Globe" – via NYTimes.com.
- ^ "US takes more big pandemic response steps; Europe COVID-19 cases soar". CIDRAP.
- ^ Einstein MH, Schiller JT, Viscidi RP, Strickler HD, Coursaget P, Tan T, et al. (June 2009). "Clinician's guide to human papillomavirus immunology: knowns and unknowns". The Lancet. Infectious Diseases. 9 (6): 347–56. doi:10.1016/S1473-3099(09)70108-2. PMID 19467474.
- ^ Shuda M, Feng H, Kwun HJ, Rosen ST, Gjoerup O, Moore PS, Chang Y (October 2008). "T antigen mutations are a human tumor-specific signature for Merkel cell polyomavirus". Proceedings of the National Academy of Sciences of the United States of America. 105 (42): 16272–77. Bibcode:2008PNAS..10516272S. doi:10.1073/pnas.0806526105. PMC 2551627. PMID 18812503.
- ^ Pulitzer MP, Amin BD, Busam KJ (May 2009). "Merkel cell carcinoma: review". Advances in Anatomic Pathology. 16 (3): 135–44. doi:10.1097/PAP.0b013e3181a12f5a. PMID 19395876. S2CID 36110778.
- ^ Koike K (June 2007). "Hepatitis C virus contributes to hepatocarcinogenesis by modulating metabolic and intracellular signaling pathways". Journal of Gastroenterology and Hepatology. 22 (Suppl 1): S108–11. doi:10.1111/j.1440-1746.2006.04669.x. PMID 17567457. S2CID 25399220.
- ^ Hu J, Ludgate L (2007). "HIV-HBV and HIV-HCV coinfection and liver cancer development". Cancer Treatment and Research. 133: 241–52. doi:10.1007/978-0-387-46816-7_9. ISBN 978-0-387-46804-4. PMID 17672044.
- ^ Bellon M, Nicot C (2007). "Telomerase: a crucial player in HTLV-I-induced human T-cell leukemia". Cancer Genomics & Proteomics. 4 (1): 21–25. PMID 17726237.
- ^ Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S (September 2007). "Human papillomavirus and cervical cancer". Lancet. 370 (9590): 890–907. doi:10.1016/S0140-6736(07)61416-0. PMID 17826171. S2CID 20196938.
- ^ Klein E, Kis LL, Klein G (February 2007). "Epstein-Barr virus infection in humans: from harmless to life endangering virus-lymphocyte interactions". Oncogene. 26 (9): 1297–305. doi:10.1038/sj.onc.1210240. PMID 17322915.
- ^ Zur Hausen H (July 2008). "Novel human polyomaviruses – re-emergence of a well known virus family as possible human carcinogens". International Journal of Cancer. 123 (2): 247–50. doi:10.1002/ijc.23620. PMID 18449881. S2CID 9482506.
- ^ Alberta B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Molecular Biology of the Cell (Fourth ed.). New York and London: Garland Science. ISBN 0-8153-3218-1.
- ^ Ding SW, Voinnet O (August 2007). "Antiviral immunity directed by small RNAs". Cell. 130 (3): 413–26. doi:10.1016/j.cell.2007.07.039. PMC 2703654. PMID 17693253.
- ^ Patton JT, Vasquez-Del Carpio R, Spencer E (2004). "Replication and transcription of the rotavirus genome". Current Pharmaceutical Design. 10 (30): 3769–77. doi:10.2174/1381612043382620. PMID 15579070.
- ^ Jayaram H, Estes MK, Prasad BV (April 2004). "Emerging themes in rotavirus cell entry, genome organization, transcription and replication". Virus Research. 101 (1): 67–81. doi:10.1016/j.virusres.2003.12.007. PMID 15010218.
- ^ Greer S, Alexander GJ (December 1995). "Viral serology and detection". Bailliere's Clinical Gastroenterology. 9 (4): 689–721. doi:10.1016/0950-3528(95)90057-8. PMID 8903801.
- ^ Matter L, Kogelschatz K, Germann D (April 1997). "Serum levels of rubella virus antibodies indicating immunity: response to vaccination of subjects with low or undetectable antibody concentrations". The Journal of Infectious Diseases. 175 (4): 749–55. doi:10.1086/513967. PMID 9086126.
- ^ Mallery DL, McEwan WA, Bidgood SR, Towers GJ, Johnson CM, James LC (November 2010). "Antibodies mediate intracellular immunity through tripartite motif-containing 21 (TRIM21)". Proceedings of the National Academy of Sciences of the United States of America. 107 (46): 19985–90. Bibcode:2010PNAS..10719985M. doi:10.1073/pnas.1014074107. PMC 2993423. PMID 21045130.
- ^ Cascalho M, Platt JL (2007). "Novel functions of B cells". Critical Reviews in Immunology. 27 (2): 141–51. doi:10.1615/critrevimmunol.v27.i2.20. PMID 17725500.
- ^ Le Page C, Génin P, Baines MG, Hiscott J (2000). "Interferon activation and innate immunity". Reviews in Immunogenetics. 2 (3): 374–86. PMID 11256746.
- ^ Hilleman MR (October 2004). "Strategies and mechanisms for host and pathogen survival in acute and persistent viral infections". Proceedings of the National Academy of Sciences of the United States of America. 101 (Suppl 2): 14560–66. Bibcode:2004PNAS..10114560H. doi:10.1073/pnas.0404758101. PMC 521982. PMID 15297608.
- ^ Libbey JE, Fujinami RS (2014). "Adaptive immune response to viral infections in the central nervous system". Handbook of Clinical Neurology. 123: 225–47. doi:10.1016/B978-0-444-53488-0.00010-9. ISBN 9780444534880. PMC 4370180. PMID 25015488.
- ^ Asaria P, MacMahon E (October 2006). "Measles in the United Kingdom: can we eradicate it by 2010?". BMJ. 333 (7574): 890–95. doi:10.1136/bmj.38989.445845.7C. PMC 1626346. PMID 17068034.
- ^ Lane JM (2006). "Mass vaccination and surveillance/containment in the eradication of smallpox". Current Topics in Microbiology and Immunology. 304: 17–29. doi:10.1007/3-540-36583-4_2. ISBN 978-3-540-29382-8. PMC 7120753. PMID 16989262.
- ^ Arvin AM, Greenberg HB (January 2006). "New viral vaccines". Virology. 344 (1): 240–49. doi:10.1016/j.virol.2005.09.057. PMID 16364754.
- ^ Pastoret PP, Schudel AA, Lombard M (August 2007). "Conclusions--future trends in veterinary vaccinology". Revue Scientifique et Technique. 26 (2): 489–94, 495–501, 503–09. doi:10.20506/rst.26.2.1759. PMID 17892169.
- ^ Palese P (January 2006). "Making better influenza virus vaccines?". Emerging Infectious Diseases. 12 (1): 61–65. doi:10.3201/eid1201.051043. PMC 3291403. PMID 16494719.
- ^ Anand P, Stahel VP (May 2021). "Review the safety of Covid-19 mRNA vaccines: a review". Patient Safety in Surgery. 15 (1): 20. doi:10.1186/s13037-021-00291-9. PMC 8087878. PMID 33933145.
- ^ Thomssen R (1975). "Live attenuated versus killed virus vaccines". Monographs in Allergy. 9: 155–76. PMID 1090805.
- ^ McLean AA (1986). "Development of vaccines against hepatitis A and hepatitis B". Reviews of Infectious Diseases. 8 (4): 591–98. doi:10.1093/clinids/8.4.591. PMID 3018891.
- ^ Casswall TH, Fischler B (October 2005). "Vaccination of the immunocompromised child". Expert Review of Vaccines. 4 (5): 725–38. doi:10.1586/14760584.4.5.725. PMID 16221073. S2CID 40821818.
- ^ Barnett ED, Wilder-Smith A, Wilson ME (July 2008). "Yellow fever vaccines and international travelers". Expert Review of Vaccines. 7 (5): 579–87. doi:10.1586/14760584.7.5.579. PMID 18564013. S2CID 19352868.
- ^ a b De Clercq E, Li G (July 2016). "Approved Antiviral Drugs over the Past 50 Years". Clinical Microbiology Reviews. 29 (3): 695–747. doi:10.1128/CMR.00102-15. PMC 4978613. PMID 27281742.
- ^ Magden J, Kääriäinen L, Ahola T (March 2005). "Inhibitors of virus replication: recent developments and prospects". Applied Microbiology and Biotechnology. 66 (6): 612–21. doi:10.1007/s00253-004-1783-3. PMC 7082807. PMID 15592828.
- ^ Mindel A, Sutherland S (September 1983). "Genital herpes - the disease and its treatment including intravenous acyclovir". The Journal of Antimicrobial Chemotherapy. 12 (Suppl B): 51–59. doi:10.1093/jac/12.suppl_b.51. PMID 6355051.
- ^ Palmisano L, Vella S (2011). "A brief history of antiretroviral therapy of HIV infection: success and challenges". Annali dell'Istituto Superiore di Sanità. 47 (1): 44–48. doi:10.4415/ANN_11_01_10. PMID 21430338.
- ^ Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, Fried MW, Segal JB, Sulkowski MS (May 2017). "Oral Direct-Acting Agent Therapy for Hepatitis C Virus Infection: A Systematic Review". Annals of Internal Medicine. 166 (9): 637–648. doi:10.7326/M16-2575. PMC 5486987. PMID 28319996.
- ^ Nguyen MH, Wong G, Gane E, Kao JH, Dusheiko G (March 2020). "Hepatitis B Virus: Advances in Prevention, Diagnosis, and Therapy". Clinical Microbiology Reviews. 33 (2). doi:10.1128/CMR.00046-19. PMC 7048015. PMID 32102898.
- ^ 딤목 페이지 3
- ^ Goris N, Vandenbussche F, De Clercq K (April 2008). "Potential of antiviral therapy and prophylaxis for controlling RNA viral infections of livestock". Antiviral Research. 78 (1): 170–78. doi:10.1016/j.antiviral.2007.10.003. PMID 18035428.
- ^ Carmichael LE (2005). "An annotated historical account of canine parvovirus". Journal of Veterinary Medicine. B, Infectious Diseases and Veterinary Public Health. 52 (7–8): 303–11. doi:10.1111/j.1439-0450.2005.00868.x. PMID 16316389.
- ^ Chen Y, Zhao Y, Hammond J, Hsu HT, Evans J, Feldlaufer M (October–November 2004). "Multiple virus infections in the honey bee and genome divergence of honey bee viruses". Journal of Invertebrate Pathology. 87 (2–3): 84–93. doi:10.1016/j.jip.2004.07.005. PMID 15579317.
- ^ Hull, Roger (2002). "12". Matthews' Plant Virology (Fourth ed.). Academic Press. pp. 555–556. ISBN 9780123611604. Retrieved 21 February 2022.
- ^ 쇼어 p 802
- ^ 쇼르 페이지 799-807
- ^ Zaheer K, Akhtar MH (2016). "Potato Production, Usage, and Nutrition – A Review". Critical Reviews in Food Science and Nutrition. 56 (5): 711–21. doi:10.1080/10408398.2012.724479. PMID 24925679. S2CID 33074838.
- ^ Fuentes S, Jones RA, Matsuoka H, Ohshima K, Kreuze J, Gibbs AJ (July 2019). "Potato virus Y; the Andean connection". Virus Evolution. 5 (2): vez037. doi:10.1093/ve/vez037. PMC 6755682. PMID 31559020.
- ^ Dinesh-Kumar SP, Tham WH, Baker BJ (December 2000). "Structure-function analysis of the tobacco mosaic virus resistance gene N". Proceedings of the National Academy of Sciences of the United States of America. 97 (26): 14789–94. Bibcode:2000PNAS...9714789D. doi:10.1073/pnas.97.26.14789. PMC 18997. PMID 11121079.
- ^ 809쪽 쇼르
- ^ Soosaar JL, Burch-Smith TM, Dinesh-Kumar SP (October 2005). "Mechanisms of plant resistance to viruses". Nature Reviews. Microbiology. 3 (10): 789–98. doi:10.1038/nrmicro1239. PMID 16132037. S2CID 27311732.
- ^ Lomonossoff GP (2011). "Virus Particles and the Uses of Such Particles in Bio- and Nanotechnology". Recent Advances in Plant Virology. Caister Academic Press. ISBN 978-1-904455-75-2.
- ^ Wommack KE, Colwell RR (March 2000). "Virioplankton: viruses in aquatic ecosystems". Microbiology and Molecular Biology Reviews. 64 (1): 69–114. doi:10.1128/MMBR.64.1.69-114.2000. PMC 98987. PMID 10704475.
- ^ Bergh O, Børsheim KY, Bratbak G, Heldal M (August 1989). "High abundance of viruses found in aquatic environments". Nature. 340 (6233): 467–68. Bibcode:1989Natur.340..467B. doi:10.1038/340467a0. PMID 2755508. S2CID 4271861.
- ^ 834-35 페이지
- ^ Bickle TA, Krüger DH (June 1993). "Biology of DNA restriction". Microbiological Reviews. 57 (2): 434–50. doi:10.1128/MMBR.57.2.434-450.1993. PMC 372918. PMID 8336674.
- ^ Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, et al. (March 2007). "CRISPR provides acquired resistance against viruses in prokaryotes". Science. 315 (5819): 1709–12. Bibcode:2007Sci...315.1709B. doi:10.1126/science.1138140. hdl:20.500.11794/38902. PMID 17379808. S2CID 3888761.
- ^ Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP, et al. (August 2008). "Small CRISPR RNAs guide antiviral defense in prokaryotes". Science. 321 (5891): 960–64. Bibcode:2008Sci...321..960B. doi:10.1126/science.1159689. PMC 5898235. PMID 18703739.
- ^ Mojica FJ, Rodriguez-Valera F (September 2016). "The discovery of CRISPR in archaea and bacteria". The FEBS Journal. 283 (17): 3162–69. doi:10.1111/febs.13766. hdl:10045/57676. PMID 27234458. S2CID 42827598.
- ^ Prangishvili D, Garrett RA (April 2004). "Exceptionally diverse morphotypes and genomes of crenarchaeal hyperthermophilic viruses" (PDF). Biochemical Society Transactions. 32 (Pt 2): 204–08. doi:10.1042/BST0320204. PMID 15046572.
- ^ Mojica FJ, Díez-Villaseñor C, García-Martínez J, Soria E (February 2005). "Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements". Journal of Molecular Evolution. 60 (2): 174–82. Bibcode:2005JMolE..60..174M. doi:10.1007/s00239-004-0046-3. PMID 15791728. S2CID 27481111.
- ^ Makarova KS, Grishin NV, Shabalina SA, Wolf YI, Koonin EV (March 2006). "A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action". Biology Direct. 1: 7. doi:10.1186/1745-6150-1-7. PMC 1462988. PMID 16545108.
- ^ van der Oost J, Westra ER, Jackson RN, Wiedenheft B (July 2014). "Unravelling the structural and mechanistic basis of CRISPR-Cas systems". Nature Reviews. Microbiology. 12 (7): 479–92. doi:10.1038/nrmicro3279. PMC 4225775. PMID 24909109.
- ^ Dávila-Ramos S, Castelán-Sánchez HG, Martínez-Ávila L, Sánchez-Carbente MD, Peralta R, Hernández-Mendoza A, et al. (2019). "A Review on Viral Metagenomics in Extreme Environments". Frontiers in Microbiology. 10: 2403. doi:10.3389/fmicb.2019.02403. PMC 6842933. PMID 31749771.
- ^ Zhang QY, Gui JF (December 2018). "Diversity, evolutionary contribution and ecological roles of aquatic viruses". Science China Life Sciences. 61 (12): 1486–1502. doi:10.1007/s11427-018-9414-7. PMID 30443861. S2CID 53564176.
- ^ Weitz JS, Wilhelm SW (2013). "An ocean of viruses". The Scientist. 27 (7): 35–39.
- ^ Suttle CA (September 2005). "Viruses in the sea". Nature. 437 (7057): 356–61. Bibcode:2005Natur.437..356S. doi:10.1038/nature04160. PMID 16163346. S2CID 4370363.
- ^ Wilhelm SW, Suttle CA (1999). "Viruses and nutrient cycles in the sea: viruses play critical roles in the structure and function of aquatic food webs". BioScience. 49 (10): 781–88. doi:10.2307/1313569. JSTOR 1313569.
- ^ Shelford EJ, Suttle CA (2018). "Virus-mediated transfer of nitrogen from heterotrophic bacteria to phytoplankton". Biogeosciences. 15 (3): 809–15. Bibcode:2018BGeo...15..809S. doi:10.5194/bg-15-809-2018.
- ^ a b c d Suttle CA (October 2007). "Marine viruses – major players in the global ecosystem". Nature Reviews. Microbiology. 5 (10): 801–12. doi:10.1038/nrmicro1750. PMID 17853907. S2CID 4658457.
- ^ Wigington CH, Sonderegger D, Brussaard CP, Buchan A, Finke JF, Fuhrman JA, et al. (January 2016). "Re-examination of the relationship between marine virus and microbial cell abundances" (PDF). Nature Microbiology. 1 (15024): 15024. doi:10.1038/nmicrobiol.2015.24. PMID 27572161. S2CID 52829633.
- ^ Brussaard CP (2004). "Viral control of phytoplankton populations – a review". The Journal of Eukaryotic Microbiology. 51 (2): 125–38. doi:10.1111/j.1550-7408.2004.tb00537.x. PMID 15134247. S2CID 21017882.
- ^ Robbins J (13 April 2018). "Trillions Upon Trillions of Viruses Fall From the Sky Each Day". The New York Times. Retrieved 14 April 2018.
- ^ Reche I, D'Orta G, Mladenov N, Winget DM, Suttle CA (April 2018). "Deposition rates of viruses and bacteria above the atmospheric boundary layer". The ISME Journal. 12 (4): 1154–62. doi:10.1038/s41396-017-0042-4. PMC 5864199. PMID 29379178.
- ^ Hall AJ, Jepson PD, Goodman SJ, Harkonen T (2006). "Phocine distemper virus in the North and European Seas – data and models, nature and nurture". Biological Conservation. 131 (2): 221–29. doi:10.1016/j.biocon.2006.04.008.
- ^ Broecker F, Moelling K (2019). "What viruses tell us about evolution and immunity: beyond Darwin?". Annals of the New York Academy of Sciences. 1447 (1): 53–68. Bibcode:2019NYASA1447...53B. doi:10.1111/nyas.14097. PMC 6850104. PMID 31032941.
- ^ Forterre P, Philippe H (June 1999). "The last universal common ancestor (LUCA), simple or complex?". The Biological Bulletin. 196 (3): 373–75, discussion 375–77. doi:10.2307/1542973. JSTOR 1542973. PMID 11536914.
- ^ 콜리어 페이지 8
- ^ Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Viruses: Structure, Function, and Uses". Molecular Cell Biology (4th ed.). New York: W. H. Freeman.
- ^ Matsuzaki S, Rashel M, Uchiyama J, Sakurai S, Ujihara T, Kuroda M, et al. (October 2005). "Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases". Journal of Infection and Chemotherapy. 11 (5): 211–19. doi:10.1007/s10156-005-0408-9. PMID 16258815. S2CID 8107934.
- ^ Gleba YY, Giritch A (2011). "Plant Viral Vectors for Protein Expression". Recent Advances in Plant Virology. Caister Academic Press. ISBN 978-1-904455-75-2.
- ^ Jefferson A, Cadet VE, Hielscher A (September 2015). "The mechanisms of genetically modified vaccinia viruses for the treatment of cancer". Critical Reviews in Oncology/Hematology. 95 (3): 407–16. doi:10.1016/j.critrevonc.2015.04.001. PMID 25900073.
- ^ Karimkhani C, Gonzalez R, Dellavalle RP (August 2014). "A review of novel therapies for melanoma". American Journal of Clinical Dermatology. 15 (4): 323–37. doi:10.1007/s40257-014-0083-7. PMID 24928310. S2CID 38864550.
- ^ "FDA approves Amgen's injected immunotherapy for melanoma". Reuters. 27 October 2015. Retrieved 24 January 2020.
- ^ Burke J, Nieva J, Borad MJ, Breitbach CJ (August 2015). "Oncolytic viruses: perspectives on clinical development". Current Opinion in Virology. 13: 55–60. doi:10.1016/j.coviro.2015.03.020. PMID 25989094.
- ^ Dogic Z (2016). "Filamentous Phages As a Model System in Soft Matter Physics". Frontiers in Microbiology. 7: 1013. doi:10.3389/fmicb.2016.01013. PMC 4927585. PMID 27446051.
- ^ Fischlechner M, Donath E (2007). "Viruses as building blocks for materials and devices". Angewandte Chemie. 46 (18): 3184–93. doi:10.1002/anie.200603445. PMID 17348058.
- ^ Soto CM, Blum AS, Vora GJ, Lebedev N, Meador CE, Won AP, et al. (April 2006). "Fluorescent signal amplification of carbocyanine dyes using engineered viral nanoparticles". Journal of the American Chemical Society. 128 (15): 5184–89. doi:10.1021/ja058574x. PMID 16608355.
- ^ Blum AS, Soto CM, Wilson CD, Brower TL, Pollack SK, Schull TL, et al. (July 2005). "An engineered virus as a scaffold for three-dimensional self-assembly on the nanoscale". Small. 1 (7): 702–06. doi:10.1002/smll.200500021. PMID 17193509.
- ^ Cello J, Paul AV, Wimmer E (August 2002). "Chemical synthesis of poliovirus cDNA: generation of infectious virus in the absence of natural template". Science. 297 (5583): 1016–18. Bibcode:2002Sci...297.1016C. doi:10.1126/science.1072266. PMID 12114528. S2CID 5810309.
- ^ Coleman JR, Papamichail D, Skiena S, Futcher B, Wimmer E, Mueller S (June 2008). "Virus attenuation by genome-scale changes in codon pair bias". Science. 320 (5884): 1784–87. Bibcode:2008Sci...320.1784C. doi:10.1126/science.1155761. PMC 2754401. PMID 18583614.
- ^ "NIH viral genome database". Ncbi.nlm.nih.gov. Retrieved 28 June 2021.
- ^ Zilinskas RA (August 2017). "A brief history of biological weapons programmes and the use of animal pathogens as biological warfare agents". Revue Scientifique et Technique (International Office of Epizootics). 36 (2): 415–422. doi:10.20506/rst.36.2.2662. PMID 30152475.
- ^ a b c Artenstein AW, Grabenstein JD (October 2008). "Smallpox vaccines for biodefense: need and feasibility". Expert Review of Vaccines. 7 (8): 1225–37. doi:10.1586/14760584.7.8.1225. PMID 18844596. S2CID 33855724.
참고 문헌 목록
- Collier L, Balows A, Sussman M (1998). Mahy B, Collier LA (eds.). Topley and Wilson's Microbiology and Microbial Infections. Virology. Vol. 1 (Ninth ed.). ISBN 0-340-66316-2.
- Dimmock NJ, Easton AJ, Leppard K (2007). Introduction to Modern Virology (Sixth ed.). Blackwell Publishing. ISBN 978-1-4051-3645-7.
- Knipe DM, Howley PM, Griffin DE, Lamb RA, Martin MA, Roizman B, Straus SE (2007). Fields Virology. Lippincott Williams & Wilkins. ISBN 978-0-7817-6060-7.
- Krasner, Robert (2014). The microbial challenge : a public health perspective. Burlington, Mass: Jones & Bartlett Learning. ISBN 978-1-4496-7375-8. OCLC 794228026.</ref>
- Shors T (2017). Understanding Viruses. Jones and Bartlett Publishers. ISBN 978-1-284-02592-7.