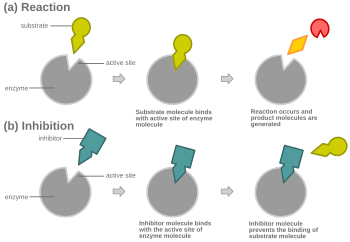
경쟁 억제
Competitive inhibition경쟁억제란 한 화학물질이 결합 또는 결합을 위해 경쟁함으로써 다른 화학물질의 효과를 저해하기 때문에 화학경로가 중단되는 것이다.어떤 대사 또는 화학 메신저 시스템도 잠재적으로 이 원리에 의해 영향을 받을 수 있지만, 경쟁적인 형태의 효소 억제, 경쟁적인 형태의 수용체 길항, 경쟁적인 형태의 항대사물 활성, 그리고 com을 포함한 여러 종류의 경쟁적인 억제들은 생화학 및 의학에서 특히 중요합니다.(상기 유형 중 하나를 포함할 수 있음) 중독의 형태.
효소억제형
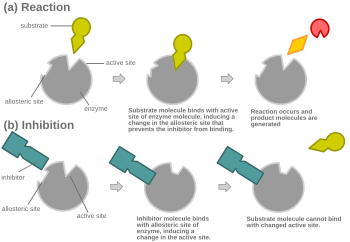
효소 촉매의 경쟁적 억제에서 억제제의 결합은 [1][2]기질이라고도 알려진 효소의 표적 분자의 결합을 방지한다.이것은 기판의 바인딩 부위(활성 부위)를 어떤 방법으로 차단함으로써 실현됩니다.V는max 반응의 최대 속도를 나타내며, K는m V의max 절반에 도달하는 데 필요한 기질의 양이다. 또한m K는 [3]효소와 결합하는 기질의 경향을 나타내는데 한 몫을 한다.더 많은 기질을 반응에 첨가함으로써 경쟁 억제를 극복할 수 있으며, 이는 효소와 기질 결합의 가능성을 증가시킨다.그 결과, 경쟁 억제는 K만을m 변화시키고, V는max [4]그대로 둔다.이는 Michaelis-Menten 그림 또는 Lineweaver-Burk 그림과 같은 효소 동역학 그림을 사용하여 입증할 수 있다.일단 억제제가 효소에 결합되면,[5][6][7] K가m 반응의 원래m K보다 증가하거나 감소하기 때문에 기울기가 영향을 받는다.
대부분의 경쟁 억제제는 [1]효소의 활성 부위에 가역적으로 결합함으로써 기능한다.결과적으로, 많은 출처는 이것이 경쟁 억제제의 [8]결정적인 특징이라고 말한다.그러나 이것은 효소가 억제제나 기질 중 하나에 결합할 수 있지만 결코 동시에 [1]두 가지 모두를 결합할 수 없는 많은 가능한 메커니즘이 있기 때문에 오해의 소지가 있는 과잉 단순화이다.예를 들어 알로스테릭 억제제는 경쟁적,[1] 비경쟁적 또는 비경쟁적 억제를 나타낼 수 있다.
메커니즘
경쟁억제에서는 통상적인 기질과 유사한 억제제가 효소에 결합하고, 통상 활성부위에서 기질이 [9]결합하는 것을 방지한다.어느 시점에서든 효소는 억제제, 기질 또는 둘 다에 결합할 수 있지만 동시에 결합할 수는 없다.경합 억제 중에 억제제와 기질은 활성 부위를 위해 경합한다.활성 부위는 특정 단백질 또는 기질이 결합할 수 있는 효소 상의 영역입니다.따라서 활성 부위는 두 개의 복합체 중 하나만 사이트에 결합할 수 있으며, 반응이 발생하거나 발생할 수 있습니다.경쟁억제에서 억제제는 기질을 닮아 그 자리를 차지하고 효소의 활성부위에 결합한다.기질 농도를 높이면 기질이 활성 부위에 적절히 결합하기 위한 "경쟁"이 줄어들어 반응이 [4]일어날 수 있다.기질이 경쟁 억제제의 농도보다 더 높은 농도의 경우, 기질이 억제제의 농도보다 효소의 활성 부위와 접촉할 가능성이 더 높다.
경쟁 억제제는 일반적으로 [4]의약품을 만드는 데 사용된다.예를 들어, 메트렉세이트는 경쟁력 있는 억제제 역할을 하는 화학 치료제이다.그것은 구조적으로 디히드로폴산 환원효소에 [4]결합하는 조효소인 엽산과 유사하다.이 효소는 DNA와 RNA의 합성 과정 중 하나로 메토렉세이트가 효소와 결합하면 비활성 상태가 돼 DNA와 [4]RNA를 합성할 수 없다.따라서 암세포는 성장하거나 분열할 수 없다.또 다른 예: 프로스타글란딘은 통증에 대한 반응으로 다량 만들어지며 염증을 일으킬 수 있다.필수 지방산은 프로스타글란딘을 형성한다; 이것이 발견되었을 때, 이것들이 프로스타글란딘에 대한 매우 좋은 억제제라는 것이 밝혀졌다.이러한 지방산 억제제는 기질 역할을 하고 효소와 결합하며 프로스타글란딘을 [10]차단할 수 있기 때문에 통증을 완화시키는 약물로 사용되어 왔다.
비약물 관련 경쟁 억제의 예는 과일 및 야채의 갈변 방지이다.예를 들어 버섯 속의 효소인 티로시나아제는 보통 기질인 모노페놀과 결합해 갈색 오퀴논을 [11]형성한다.버섯용 4치환 벤조알데하이드와 같은 경쟁 기질은 결합하는 모노페놀의 양을 낮추는 기질과 경쟁합니다.이러한 억제성분들은 [11]갈색을 유발하는 모노페놀의 결합을 감소시킴으로써 더 오랜 시간 동안 신선도를 유지합니다.이를 통해 생산물의 품질과 유통기한을 높일 수 있습니다.
경쟁적 억제는 가역적일 수도 있고 돌이킬 수도 없다.가역억제라면 기질농도를 [9]높임으로써 억제제의 효과를 극복할 수 있다.돌이킬 수 없는 경우 이를 극복하는 유일한 방법은 더 많은 타깃을 생성하는 것입니다(그리고 일반적으로 돌이킬 수 없는 억제된 타깃을 분해 및/또는 배출합니다).
거의 모든 경우에 경쟁억제제는 기질과 동일한 결합부위(활성부위)에서 결합하지만 동일한 부위 결합은 요건이 아니다.경쟁억제제는 기질이 결합되었을 때 알로스테릭 부위와 결합하지 않는 한 유리효소의 알로스테릭 부위와 결합하고 기질 결합을 방지할 수 있다.예를 들어 스트리치닌은 포유류의 척수 및 뇌간에서 글리신 수용체의 알로스테릭 억제제로서 작용한다.글리신은 특정 수용체를 가진 주요 시냅스 후 억제 신경전달물질이다.스트리치닌은 글리신에 대한 글리신 수용체의 친화력을 감소시키는 대체 부위에 결합하고 글리신에 [12]의한 억제 감소로 인해 경련을 일으킨다.
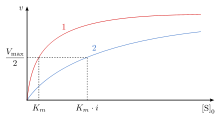
경쟁억제에서는 반응의 최대속도({\ 는 변하지 않고 결합부위에 대한 기질의 겉보기 친화력은 감소한다( d{ 는 현저하게 증가한다).의 Michaelis-Menten 상수)는 K의 와 평행하며, 다른 는 증가해야 합니다경쟁 억제제가 효소에 결합하면 K_})이 증가합니다이는 효소에 대한 결합 친화력은 감소하지만 [13]기질의 농도를 높임으로써 극복할 수 있음을 의미한다.기판농도를 높임으로써 임의의 경쟁억제제 농도를 극복할 수 있다.이 경우, 기질은 억제제가 결합하는 가능성을 감소시키고, 따라서 [13]효소에 결합하는 억제제를 능가한다.
생물학적 예
오염된 오피오이드 약물 데스메틸프로딘을 잘못 섭취한 후 1-메틸-4-페닐-1, 2, 3, 6-테트라히드로피리딘(MPTP)의 신경독성 효과가 발견되었다.MPTP는 혈액 뇌 장벽을 넘어 산성 [14]리소좀으로 들어갈 수 있다.MPTP는 주로 신경학적 장애와 [15]질병에 집중된 모노아민산화효소(MAO)의 동질효소인 MAO-B에 의해 생물학적으로 활성화된다.나중에 MPTP가 파킨슨병과 비슷한 증상을 일으킨다는 것이 밝혀졌다.중추신경계(아스트로사이트)의 세포에는 MPTP를 [14]독성 있는 1-메틸-4-페닐피리디늄(MPP+)으로 산화시키는 MAO-B가 포함된다.MPP+는 궁극적으로 파킨슨병의 증상을 유발하는 도파민 운반체를 통해 세포외 액체로 이동한다.단, MAO-B 효소 또는 도파민 트랜스포터의 경쟁적 억제는 MPTP에서 MPP+로의 산화에 대해 보호한다.메틸렌 블루, 5-니트로인다졸, 노르하르만, 9-메틸노르하르만, 메나디온 [15]등 MPTP에서 MPP+로의 산화를 억제하는 능력이 시험되었다.이는 MPTP에 의해 생성되는 신경독성의 감소를 입증했다.
술파 약물은 또한 경쟁적 억제제 역할을 한다.예를 들어 술파닐아미드는 기질 파라아미노벤조산(PABA)[16]을 모방함으로써 디히드로프테로산합성효소(DHPS) 활성부위의 효소에 경쟁적으로 결합한다.이는 기질 자체가 결합하는 것을 방지하여 필수 영양소인 엽산의 생산을 중단시킵니다.박테리아는 엽산을 위한 운반체를 가지고 있지 않기 때문에 반드시 합성해야 한다.엽산이 없으면 박테리아는 자라고 분열할 수 없다.따라서 술파 약물의 경쟁 억제 작용으로 우수한 항균제이다.Krebs 회로에서 숙신산염의 산화를 촉매하여 푸마르산염으로 만드는 숙신산 탈수소효소에 대하여 경쟁 억제의 예가 실험적으로 입증되었다.말론산염은 숙신산탈수소효소의 경쟁적 억제제이다.석신산탈수소효소의 기질인 석신산염으로의 결합은 경쟁적으로 억제된다.이것은 말론산염의 화학작용이 숙신산염과 비슷하기 때문에 일어난다.말론산염의 효소 및 기질 결합 억제 능력은 말론산염과 숙신산염의 비율에 기초한다.말론산염은 숙신산 탈수소효소의 활성 부위에 결합하여 숙신산염이 결합하지 못하게 한다.그래서 반응을 [17]억제합니다.
방정식
Michaelis-Menten 모델은 효소 동역학을 이해하는 데 매우 유용한 도구가 될 수 있습니다.이 모델에 따르면 기판의 농도 [S]에 관련된 반응속도(V0)의 플롯을 사용하여 V, 초기속도 및 Km(Vmax/2 또는 효소와 [5]기질복합체와의 친화력) 등의max 값을 결정할 수 있다.
경쟁 억제는 Michaelis-Menten 상수 app의 겉보기 값을 증가시킨다. K app {\는 초기 반응 속도 0이 다음과 같이 주어진다.
서 1+ [ / }}=은 억제제의 해리 상수이고[는
max { }}는 높은 기질 농도로 억제제의 존재를 극복할 수 있기 때문에 동일하게 유지됩니다. /에하기 위해 필요한 기질 인 K text는 경쟁 억제제의 존재에 따라 증가한다.이는 억제제를 사용하여 max 에 도달하는 데 필요한 기질 농도가 억제제를 사용하지 않고 max {\}}에 도달하는 데 필요한 기질 농도보다 높기 때문이다.
파생
Michaelis-Menten kinetics에 따르는 단일 기질 효소의 가장 단순한 경우, 전형적인 체계
유리 효소에 대한 억제제 결합을 포함하도록 수정된다.
억제제는 ES 복합체에 결합하지 않으며 기질은 EI 복합체에 결합하지 않습니다.일반적으로 이러한 거동은 두 화합물이 동일한 부위에서 결합하는 것을 나타내는 것으로 가정되지만, 반드시 필요한 것은 아니다.Michaelis-Menten 방정식의 유도와 마찬가지로, 시스템이 정상 상태, 즉 각 효소 종의 농도가 변하지 않는다고 가정합니다.
또한 알려진 총효소 농도는[ 0 [+ [ + [EI { [ { \[ { \ {}}} + [ { \ {EI + [ {\ce { + [ {\ce {\ce {EI 인데, 기질 및 기질에서 실질적으로 변화하지 않는 조건에서 속도를 측정한다.움푹 패인
따라서 방정식 시스템을 설정할 수 있습니다.
-
(1)
-
(2)
-
(3)
-
(4)
여기서[ [{[ [ [ 0은 알 수 있습니다.초기 속도는 V [ P / [ V _ { 0 } = { \{ } } / =_ {2 [ { {}로 정의되므로 [ \ style {} sof of of of of the the { aystyle입니다
식 (3)에서 ES의 관점에서 E를 정의할 수 있는 것은 다음과 같습니다.
1[ ]({ k_로 나누면 다음과 같습니다.
Michaelis-Menten 방정식의 도출과 마찬가지로(- + k )/ ( k _ { displaystyle ( k _ {} + k { } ) / } 은 거시적 환율 K m ( \ K { m )로 대체할 수 있습니다.
-
(5)
등식(5)을 등식(4)으로 대입하면 다음과 같이 된다.
재정렬을 알 수 있습니다.
이 때 억제제의 해리 는 - / 3 ({{i}=}/3 로 정의할 수 있으며, 다음과 같다.
-
(6)
이때 등식(5)과 등식(6)을 등식(1)으로 치환한다.
ES를 위해 해결할 수 있는 재편성을 통해
-
(7)
0의 표현으로 돌아가면 다음과 같습니다.
모든 효소가 효소-효소 복합체로 결합될 때 속도가 최대이므로, 2 {\V_{\max {E0이다. 용어의 치환과 결합은 최종적으로 일반적인 형태를 나타낸다.
-
(8)
의 f 0({을 산출하는 [ 0의 농도 계산서0 < < < f_ { f_ { _ { 0 。
-
(9)
주 및 참고 자료
- ^ a b c d "Types of Inhibition". NIH Center for Translational Therapeutics. Archived from the original on 8 September 2011. Retrieved 2 April 2012.
- ^ Srinivasan, Bharath (March 2022). "A guide to enzyme kinetics in early drug discovery". The FEBS Journal. doi:10.1111/febs.16404. ISSN 1742-464X.
- ^ Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Functional Design of Proteins". Molecular Cell Biology (4th ed.).
- ^ a b c d e Berg JM, Tymoczko JL, Stryer L (2002). Enzymes Can Be Inhibited by Specific Molecules. Biochemistry (5th ed.).
- ^ a b Berg JM, Tymoczko JL, Stryer L (2002). "The Michaelis–Menten Model Accounts for the Kinetic Properties of Many Enzymes". Biochemistry (5th ed.).
- ^ Eadie SG (1942). "The Inhibition of Cholinesterase by Physostigmine and Prostigmine". Journal of Biological Chemistry. 146: 85–93. doi:10.1016/S0021-9258(18)72452-6.
- ^ Berg JM, Tymoczko JL, Stryer L (2002). "Appendix: Vmax and KM Can Be Determined by Double-Reciprocal Plots". Biochemistry (5th ed.).
- ^ Ophardt C. "Virtual Chembook". Elmhurst College. Retrieved 1 September 2015.
- ^ a b "Map: Biochemistry Free & Easy (Ahern and Rajagopal)". Biology LibreTexts. 24 December 2014. Retrieved 2 November 2017.
- ^ Flower RJ (March 1974). "Drugs which inhibit prostaglandin biosynthesis". Pharmacological Reviews. 26 (1): 33–67. PMID 4208101.
- ^ a b Jiménez M, Chazarra S, Escribano J, Cabanes J, García-Carmona F (August 2001). "Competitive inhibition of mushroom tyrosinase by 4-substituted benzaldehydes". Journal of Agricultural and Food Chemistry. 49 (8): 4060–4063. doi:10.1021/jf010194h. PMID 11513710.
- ^ Dick RM (2011). "Chapter 2. Pharmacodynamics: The Study of Drug Action". In Ouellette R, Joyce JA (eds.). Pharmacology for Nurse Anesthesiology. Jones & Bartlett Learning. ISBN 978-0-7637-8607-6.
- ^ a b Voet D, Voet JG, Pratt CW (29 February 2016). Fundamentals of biochemistry : life at the molecular level (Fifth ed.). Hoboken, NJ. ISBN 9781118918401. OCLC 910538334.
- ^ a b Sian J, Youdim MB, Riederer P, Gerlach M (1999). "MPTP-Induced Parkinsonian Syndrome". Basic Neurochemistry: Molecular, Cellular and Medical Aspects. 6th Edition.
- ^ a b Herraiz T, Guillén H (August 2011). "Inhibition of the bioactivation of the neurotoxin MPTP by antioxidants, redox agents and monoamine oxidase inhibitors". Food and Chemical Toxicology. 49 (8): 1773–1781. doi:10.1016/j.fct.2011.04.026. hdl:10261/63126. PMID 21554916.
- ^ "How Sulfa Drugs Work". National Institutes of Health (NIH). 15 May 2015. Retrieved 2 November 2017.
- ^ Potter VR, Dubois KP (March 1943). "Studies on the Mechanism of Hydrogen Transport in Animal Tissues". The Journal of General Physiology. 26 (4): 391–404. doi:10.1085/jgp.26.4.391. PMC 2142566. PMID 19873352.

 현저하게 증가한다).
현저하게 증가한다).




![V_{0}={\frac {V_{\max }\,[S]}{K_{m}^{{\text{app}}}+[S]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e6ea985b759c13c54c08b2e1a1f7b292c549beb)
![K_{m}^{{\text{app}}}=K_{m}(1+[I]/K_{i})](https://wikimedia.org/api/rest_v1/media/math/render/svg/e013bb3d416acd07c0c55ee196d46e9ede190a63)
 억제제의 해리 상수이고
억제제의 해리 상수이고![[I]](https://wikimedia.org/api/rest_v1/media/math/render/svg/5962300a54e8ce8b5761dac9a5fbbca450c2ce0f)

![{\displaystyle {\ce {E + S <=>[k_1][k_{-1}] ES ->[k_2] E + P}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa34fa0b8ef16e2c4886b79b41fd6a84e83a68fd)
![{\displaystyle {\ce {EI + S <=>[k_{-3}][k_3] E + S + I <=>[k_1][k_{-1}] ES + I ->[k_2] E + P + I}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9c358fddd797429f33b9c778a4bf4f669e8000b0)
![{\displaystyle {\frac {d[{\ce {E}}]}{dt}}={\frac {d[{\ce {ES}}]}{dt}}={\frac {d[{\ce {EI}}]}{dt}}=0.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d5d8b4f228bd04aff5488c2efbc9f11f6a27a4b)
![{\displaystyle [{\ce {E}}]_{0}=[{\ce {E}}]+[{\ce {ES}}]+[{\ce {EI}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee7863f535867e7f0b9e3619c9d5431b8d14851a)
![{\displaystyle {\frac {d[{\ce {E}}]}{dt}}=0=-k_{1}[{\ce {E}}][{\ce {S}}]+k_{-1}[{\ce {ES}}]+k_{2}[{\ce {ES}}]-k_{3}[{\ce {E}}][{\ce {I}}]+k_{-3}[{\ce {EI}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/524f829178a7d543a7f1dfe0d3836d3f2cd9beca)
![{\displaystyle {\frac {d[{\ce {ES}}]}{dt}}=0=k_{1}[{\ce {E}}][{\ce {S}}]-k_{-1}[{\ce {ES}}]-k_{2}[{\ce {ES}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/deee1b4eb1dae3e5957260a6e625632daa130b8c)
![{\displaystyle {\frac {d[{\ce {EI}}]}{dt}}=0=k_{3}[{\ce {E}}][{\ce {I}}]-k_{-3}[EI]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/632d3667fd0a9b85d3e0572d171e0ee8b67e8668)
![{\displaystyle {\ce {[S], [I]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ec1dbaad807d3af650d3805d798ed15120624bd)
![{\displaystyle {\ce {[E]_0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9a654ad516b5d2547fd9980bb7590464441d6c38) 알 수 있습니다.초기 속도는 V
알 수 있습니다.초기 속도는 V ![{\displaystyle V_{0}=d[{\ce {P}}]/dt=k_{2}[{\ce {ES}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0cee1a793ade4b98a68c506615766985cb243899)
![{\displaystyle {\ce {[ES]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a96c38a14c944f4ae51601cd8670fd2bf8e12331)
![{\displaystyle k_{1}[{\ce {E}}][{\ce {S}}]=(k_{-1}+k_{2})[{\ce {ES}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/940c092e01999c100f4d5fff6650b39dff53de02)
![{\displaystyle k_{1}[{\ce {S}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/28690106a4f72a9371157eefe3e178d952cb36f0) 나누면 다음과 같습니다.
나누면 다음과 같습니다.![{\displaystyle [{\ce {E}}]={\frac {(k_{-1}+k_{2})[{\ce {ES}}]}{k_{1}[{\ce {S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/41cd11072115b7e97377d2dc62bd80a0e9460cd5)

![{\displaystyle [{\ce {E}}]={\frac {K_{m}[{\ce {ES}}]}{\ce {[S]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5caf94a9df39bcbeae36e01bfcd1f48e27626ce9)
![{\displaystyle 0={\frac {k_{3}[{\ce {I}}]K_{m}[{\ce {ES}}]}{\ce {[S]}}}-k_{-3}[{\ce {EI}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3612eb7c921915246bb9dd47363904140d563374)
![{\displaystyle [{\ce {EI}}]={\frac {K_{m}k_{3}[{\ce {I}}][{\ce {ES}}]}{k_{-3}[{\ce {S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b5e8681d305f3fa55e808a5c06fad3748f06e131)

![{\displaystyle [{\ce {EI}}]={\frac {K_{m}[{\ce {I}}][{\ce {ES}}]}{K_{i}[{\ce {S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b5b6d93be687b516fc668d4934ac27e5972ae30)
![{\displaystyle [{\ce {E}}]_{0}={\frac {K_{m}[{\ce {ES}}]}{\ce {[S]}}}+[{\ce {ES}}]+{\frac {K_{m}[{\ce {I}}][{\ce {ES}}]}{K_{i}[{\ce {S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c1417ec7ba5d7255a28927ed40932af9323e01)
![{\displaystyle [{\ce {E}}]_{0}=[{\ce {ES}}]\left({\frac {K_{m}}{\ce {[S]}}}+1+{\frac {K_{m}[{\ce {I}}]}{K_{i}[{\ce {S}}]}}\right)=[{\ce {ES}}]{\frac {K_{m}K_{i}+K_{i}[{\ce {S}}]+K_{m}[{\ce {I}}]}{K_{i}[{\ce {S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2691e0b26e6bee9fe37253403c892909a07add45)
![{\displaystyle [{\ce {ES}}]={\frac {K_{i}[{\ce {S}}][{\ce {E}}]_{0}}{K_{m}K_{i}+K_{i}[{\ce {S}}]+K_{m}[{\ce {I}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b57aff644fb93ec40ef3663d1463f25ea158869e)
![{\displaystyle V_{0}=k_{2}[{\ce {ES}}]={\frac {k_{2}K_{i}[{\ce {S}}][{\ce {E}}]_{0}}{K_{m}K_{i}+K_{i}[{\ce {S}}]+K_{m}[{\ce {I}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7548c901ebd2e13620f6c9c6c30510ad5365859)
![{\displaystyle V_{0}={\frac {k_{2}[{\ce {E}}]_{0}[{\ce {S}}]}{K_{m}+[{\ce {S}}]+K_{m}{\frac {[{\ce {I}}]}{K_{i}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/83cb5b38fc5e1ea8d7df09f1f8fec2d8f47db635)
![{\displaystyle V_{\max }=k_{2}[{\ce {E}}]_{0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ea107b2c44540b990daab7f21c8a35fc76f6476)
![{\displaystyle V_{0}={\frac {V_{\max }[{\ce {S}}]}{K_{m}\left(1+{\frac {[{\ce {I}}]}{K_{i}}}\right)+[{\ce {S}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/09a841f4777fa07f79bcec43de7264e95ef8f57c)
 산출하는
산출하는 ![{\displaystyle {\ce {[I]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/da716928de5f662f6ff1a1fc9ec0bde65f3fe2c2) 농도 계산
농도 계산
![{\displaystyle [{\ce {I}}]=\left({\frac {1}{f_{V{_{0}}}}}-1\right)K_{i}\left(1+{\frac {[{\ce {S}}]}{K_{m}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ccc99438e12f1dfdd4bdbdd0b21637c4003c470f)