녹아웃 마우스
Knockout mouse녹아웃 마우스 또는 녹아웃 마우스는 연구자들이 기존의 유전자를 인공 DNA 조각으로 대체하거나 파괴함으로써 비활성화 또는 "녹아웃"시킨 유전자 변형 마우스이다.그것들은 배열은 되었지만 기능이 결정되지 않은 유전자의 역할을 연구하기 위한 중요한 동물 모델이다.특정 유전자를 마우스 내에서 비활성화하고 정상적인 행동이나 생리학과의 차이를 관찰함으로써 연구자는 그 기능을 추론할 수 있다.
쥐는 현재 녹아웃 기술을 쉽게 적용할 수 있는 인간과 가장 가까운 실험 동물 종이다.그들은 녹아웃 실험, 특히 인간의 생리와 관련된 유전 문제를 조사하는 실험에서 널리 사용된다.쥐의 유전자 녹아웃은 훨씬 더 어렵고 2003년 [1][2]이후로만 가능했다.
최초의 녹아웃 마우스는 마리오 R에 의해 만들어졌다. 1989년 카페치, 마틴 에반스, 올리버 스미시스는 이 공로로 2007년 노벨 생리의학상을 수상했다.녹아웃 마우스를 생성하는 기술의 측면과 마우스 자체는 많은 국가에서 민간 기업에 의해 특허를 받았습니다.
사용하다
유전자의 활성을 파괴하는 것은 그 유전자가 보통 무엇을 하는지에 대한 정보를 제공한다.인간은 쥐와 많은 유전자를 공유한다.결과적으로 녹아웃 생쥐의 특성을 관찰하는 것은 연구자들에게 유사한 유전자가 어떻게 사람에게 질병을 유발하거나 기여하는지를 더 잘 이해하기 위해 사용될 수 있는 정보를 준다.
녹아웃 마우스가 유용했던 연구의 예로는 다양한 종류의 암, 비만, 심장병, 당뇨병, 관절염, 약물 남용, 불안, 노화, 파킨슨병을 연구하고 모델링하는 것이 있다.녹아웃 마우스는 또한 약물과 다른 치료법이 개발되고 시험될 수 있는 생물학적, 과학적 맥락도 제공한다.
매년 [3]수백만 마리의 녹아웃 생쥐가 실험에 사용된다.
변종
녹아웃 [3]생쥐에는 수천 종의 다른 변종이 있습니다.많은 쥐 모델들은 불활성화된 유전자의 이름을 따서 붙여졌다.예를 들어 p53 녹아웃 마우스는 세포분열을 억제하거나 아포토시스를 유도함으로써 종양의 성장을 정상적으로 억제하는 단백질을 코드하는 p53 유전자의 이름을 딴 것이다.p53 유전자를 비활성화하는 돌연변이를 가지고 태어난 사람은 어린 나이에 골암, 유방암, 혈액암 발병 위험을 극적으로 높이는 Li-Fraumeni 증후군을 가지고 있다.다른 마우스 모델은 물리적 특성이나 행동에 따라 이름이 지정됩니다.
절차.

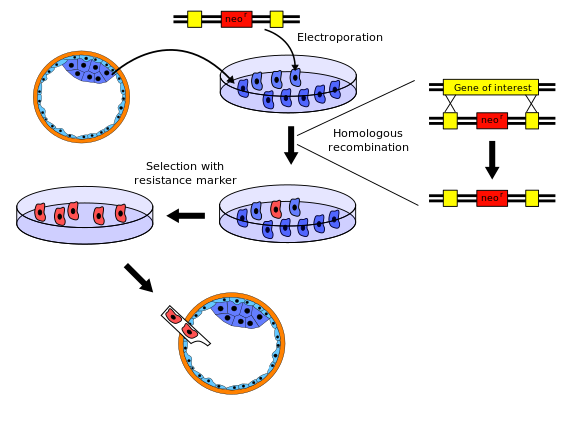
녹아웃 마우스를 생성하는 절차에는 몇 가지 변형이 있습니다. 다음은 대표적인 예입니다.
- 쥐 유전자 라이브러리에서 녹아웃되는 유전자를 분리한다.그런 다음 유전자를 작동 불능으로 만들 정도로 충분히 변화한다는 점을 제외하고는 원래의 유전자와 바로 인접한 염기서열과 매우 유사한 새로운 DNA 배열을 제작한다.보통, 새로운 염기서열은 또한 정상 쥐가 가지고 있지 않고 특정 독성 물질에 내성을 부여하거나 관찰 가능한 변화를 일으키는 유전자인 마커 유전자가 주어진다.또한 완전한 선택을 달성하기 위해 헤르페스 tk+ 등의 제2유전자도 포함된다.
- 배아줄기세포는 쥐의 배반포(아주 어린 배아)에서 분리돼 체외에서 자란다.이 예에서는 흰 생쥐에서 줄기세포를 추출합니다.
- 1단계의 새로운 배열은 2단계의 줄기세포에 전기절단에 의해 도입된다.상동 재조합의 자연적 과정에 의해, 일부 전기 분해된 줄기세포는 원래의 유전자 대신 녹아웃된 유전자를 가진 새로운 염기서열을 염색체에 통합시킬 것이다.성공적인 재조합 사건의 가능성은 상대적으로 낮기 때문에, 변경된 세포의 대부분은 관련된 두 염색체 중 한 개에만 새로운 염기서열을 가질 것이다. 즉, 그들은 헤테로 접합이라고 한다.네오마이신 내성유전자 및 헤르페스 tk+유전자를 포함한 벡터에 의해 형질전환된 세포를 네오마이신 및 간시클로버를 포함한 용액 중에 성장시켜 상동재조합에 의해 발생한 형질전환을 선택한다.무작위 삽입을 통해 발생한 DNA의 어떤 삽입도 네오마이신 내성 유전자와 헤르페스 tk+ 유전자에 양성 반응이 나타나기 때문에 사망할 것이다.게다가, 어떤 유전 물질도 통합되지 않은 세포는 두 유전자에 대해 음성으로 검사되고, 따라서 네오마이신 중독의 결과로 죽는다.
- 녹아웃 유전자를 통합한 배아줄기세포는 1단계에서 마커 유전자를 이용해 변화하지 않은 세포로부터 분리된다.예를 들어 변화하지 않은 세포는 변화된 세포에 내성이 있는 독성제를 사용하여 죽일 수 있다.
- 4단계에서 녹아웃된 배아줄기세포는 쥐의 배반포에 삽입된다.이 예에서는 회색 생쥐의 배반포를 사용합니다.이제 배반포는 두 종류의 줄기세포를 포함하고 있다: 원래의 줄기세포와 녹아웃된 세포이다.이 배반포들은 암컷 쥐의 자궁에 이식되고, 그곳에서 성장합니다.따라서 새로 태어난 쥐들은 키메라일 것이다: 그들의 몸의 어떤 부분은 원래의 줄기세포에서 비롯되고 다른 부분은 녹아웃된 줄기세포에서 비롯된다.그들의 털은 녹아웃된 줄기세포에서 파생된 흰색 부분과 이식된 배반포에서 파생된 회색 부분과 함께 흰색과 회색 부분들을 보여줄 것이다.
- 새로 태어난 키메라 쥐들 중 일부는 녹아웃된 줄기세포에서 유래한 생식선을 가지고 있을 것이고, 따라서 녹아웃된 유전자를 가진 난자나 정자를 생산할 것이다.이 키메라 쥐들이 야생 유형의 다른 쥐들과 교배될 때, 그들의 자손들 중 일부는 그들의 모든 세포에 녹아웃된 유전자의 복사본을 갖게 될 것이다.이 쥐들은 어떤 회색 쥐 DNA도 보유하지 않고 키메라도 아니지만 여전히 헤테로 접합되어 있다.
- 이 헤테로 접합된 자손들이 이종 교배될 때, 그들의 자손들 중 일부는 양쪽 부모로부터 녹아웃 유전자를 물려받을 것이다; 그들은 원래 변하지 않은 유전자의 기능적인 복사본을 가지고 있지 않다.
녹아웃(KO) 마우스가 어떻게 만들어지는지에 대한 자세한 설명은 2007 노벨 생리의학상 웹사이트에 있습니다.[4]
제한 사항
국립보건원은 이 기술의 [5]몇 가지 중요한 제한 사항에 대해 논의합니다.
녹아웃 마우스 기술은 귀중한 연구 도구이지만 몇 가지 중요한 제한이 있습니다.유전자 녹아웃의 약 15퍼센트는 발달적으로 치명적이며, 이것은 유전자 변형 배아가 성체 쥐로 자랄 수 없다는 것을 의미한다.이 문제는 종종 조건부 돌연변이를 사용함으로써 극복된다.성체 쥐의 부족은 연구를 배아 발달로 제한하고 종종 인간의 건강과 관련된 유전자의 기능을 결정하는 것을 더 어렵게 만든다.어떤 경우에, 그 유전자는 성인에게 배아를 발달시키는 것과 다른 기능을 할 수 있다.
유전자를 녹아웃시키는 것은 또한 생쥐에서 관찰할 수 있는 변화를 일으키지 못하거나 심지어 같은 유전자가 불활성화된 사람에게서 관찰된 것과 다른 특징을 만들어 낼 수도 있다.예를 들어, p53 유전자의 돌연변이는 인간 암의 절반 이상과 연관되어 있으며 종종 특정 조직 세트의 종양으로 이어진다.하지만, p53 유전자가 쥐에서 녹아웃되면, 동물들은 다른 조직 배열에서 종양이 생긴다.
줄기세포가 파생된 변형률에 따라 전체 시술에 변화가 있다.일반적으로 균주 129에서 유래한 세포를 사용한다.이 특정 변종은 많은 실험(예: 행동)에 적합하지 않으므로 자손을 다른 변종으로 역교배하는 것이 매우 일반적입니다.어떤 유전체 흔적은 제거하기가 매우 어려운 것으로 증명되었다.이유는 반복 배열, 광범위한 DNA 메틸화 또는 헤테로크로마틴의 존재일 수 있다.유전물질의 녹아웃 세그먼트에 인접한 129개의 유전자가 혼돈하는 것을 "플랭킹 유전자 효과"[6]라고 한다.이 문제를 해결하기 위한 방법 및 지침이 [7][8]제안되었습니다.
또 다른 한계는 기존의 (즉, 조건 없는) 녹아웃 마우스가 조사되는 유전자가 없을 때 발병한다는 것이다.때때로, 발달 중의 활동 상실은 성체 상태에서 유전자의 역할을 가릴 수 있으며, 특히 유전자가 발달에 걸친 수많은 과정에 관여한다면 더욱 그러하다.그런 다음 관심 유전자를 절제하기 전에 먼저 마우스가 정상적으로 발달하고 성숙할 수 있도록 하는 조건부/유도 돌연변이 접근법이 필요하다.
또 다른 심각한 한계는 자연 돌연변이 후 야생 유형 동물에서 발생할 수 있는 녹아웃 모델에서 진화적 적응이 부족하다는 것이다.예를 들어 GLUT1과 스토마틴의 적혈구 특이적 동시발현은 비타민C를 [9]합성할 수 없는 포유동물에서 보상기구를 구성한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Pilcher HR (2003-05-19). "It's a knockout". Nature. doi:10.1038/news030512-17. Retrieved 2014-04-03.
- ^ Zan Y, Haag JD, Chen KS, Shepel LA, Wigington D, Wang YR, Hu R, Lopez-Guajardo CC, Brose HL, Porter KI, Leonard RA, Hitt AA, Schommer SL, Elegbede AF, Gould MN (June 2003). "Production of knockout rats using ENU mutagenesis and a yeast-based screening assay". Nature Biotechnology. 21 (6): 645–51. doi:10.1038/nbt830. PMID 12754522.
- ^ a b Spencer G (December 2002). "Background on Mouse as a Model Organism". National Human Genome Research Institute. Retrieved 2014-04-03.
- ^ "The Nobel Prize in Physiology or Medicine 2007". Nobelprize.org. 1985-09-19. Retrieved 2014-04-03.
- ^ "Knockout Mice Fact Sheet". National Human Genome Research Institute. August 2015. Retrieved 2014-04-03.
- ^ Gerlai R (May 1996). "Gene-targeting studies of mammalian behavior: is it the mutation or the background genotype?". Trends in Neurosciences. 19 (5): 177–81. doi:10.1016/S0166-2236(96)20020-7. PMID 8723200.
- ^ Wolfer DP, Crusio WE, Lipp HP (July 2002). "Knockout mice: simple solutions to the problems of genetic background and flanking genes". Trends in Neurosciences. 25 (7): 336–40. doi:10.1016/S0166-2236(02)02192-6. PMID 12079755.
- ^ Crusio WE, Goldowitz D, Holmes A, Wolfer D (February 2009). "Standards for the publication of mouse mutant studies". Genes, Brain and Behavior. 8 (1): 1–4. doi:10.1111/j.1601-183X.2008.00438.x. PMID 18778401.
- ^ Montel-Hagen A, Kinet S, Manel N, Mongellaz C, Prohaska R, Battini JL, Delaunay J, Sitbon M, Taylor N (March 2008). "Erythrocyte Glut1 triggers dehydroascorbic acid uptake in mammals unable to synthesize vitamin C". Cell. 132 (6): 1039–48. doi:10.1016/j.cell.2008.01.042. PMID 18358815.
외부 링크
| 라이브러리 리소스 정보 녹아웃 마우스 |
- Texas A&M Institute for Genomic Medicine (TIGM)– TIGM에서 생성된 줄기세포와 마우스를 주문하기 위한 웹사이트
- KMR(Knockout Mouse Research)에서 벡터를 타겟팅하기 위한 녹아웃 마우스 만들기– KMR에 의해 생성된 벡터와 트랜스제닉 마우스를 타겟팅하여 배아줄기세포를 주문하기 위한 웹사이트.
- 유전자 기능 연구: 녹아웃 마우스 만들기– Science Creative Quarterly 리뷰
- KOMP(Knock Out Mouse Project) Data Coordination 웹사이트– KOMP 이니셔티브에 포함된 유전자의 상태에 대한 공개 인터페이스.
- KOMP(Knock Out Mouse Project) 저장소 웹 사이트 – KOMP 프로젝트에서 생성된 ES 셀, 벡터 및 마우스를 주문하는 웹 사이트
- MGI(Mouse Genome Informatics) 웹사이트– 실험용 마우스 커뮤니티 모델 유기체 데이터베이스
- 상동재조합방법(및 녹아웃마우스)
- 녹아웃 마우스 팩트 시트(Genome.gov)