프러시안 블루
Prussian blue | |
| 이름 | |
|---|---|
| IUPAC명 철(II,III) 헥사시아니도페레이트 (II,III) | |
기타명
| |
| 식별자 | |
3D 모델(JSmol) | |
| ChEBI | |
| CHEMBL | |
| 켐스파이더 | |
| ECHA 인포카드 | 100.034.418 |
| EC 번호 |
|
| 1093743 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C18Fe7N18 | |
| 어금니 질량 | 859.239 g·mol−1 |
| 외모 | 블루 불투명 크리스탈 |
| 불용성 | |
| 구조. | |
| 면심입방, cF43 | |
| Fm3m, No. 225[1] | |
| 약리학 | |
| V03AB31 (WHO) | |
| 오랄 | |
| 위험성 | |
| 안전 데이터 시트(SDS) | MSDS 프러시안 블루 |
| 관련 화합물 | |
기타 양이온 | 페로시안화칼륨 |
달리 명시된 경우를 제외하고 표준 상태의 재료에 대한 데이터가 제공됩니다(25°C [77°F], 100kPa). | |
프러시안 블루(Prussian blue) 또는 프러시안 블루(Prussian blue)는 페로시아나이드 제1철염의 산화에 의해 생성되는 암청색 안료입니다. 화학식은 FeIII
4[FeII
(CN)]
6
3입니다. 턴불의 푸른색은 화학적으로 동일하지만 다른 시약으로 만들어졌으며, 색이 약간 다른 것은 불순물과 입자 크기가 다르기 때문입니다.
프러시안 블루는 18세기 초에 만들어졌으며 최초의 현대 합성 색소입니다. 화합물이 물에 녹지 않기 때문에 매우 미세한 콜로이드 분산액으로 제조됩니다. 다양한 양의[2] 다른 이온을 포함하고 있으며 콜로이드 입자의 크기에 따라 모양이 민감하게 달라집니다. 안료는 페인트에 사용되고, 19세기 藍摺り絵(Aizuri-e) 일본 목판화에서 두드러졌으며, 기술적인 청사진에서 전통적인 "파란색"입니다.
의학에서 경구 투여된 프러시안 블루는 탈륨(I) 및 세슘 방사성 동위원소와 같은 특정 종류의 중금속 중독에 대한 해독제로 사용됩니다. 이 치료법은 프러시안 블루의 이온 교환 특성과 특정 "부드러운" 금속 양이온에 대한 높은 친화력을 이용합니다. 기본적인 건강 시스템에 필요한 가장 중요한 의약품인 세계보건기구 필수 의약품 목록에 올라 있습니다.[3]
프러시안 블루는 그 이름을 프러시안산(시안화수소)에서 따온 것입니다. 독일어로 시안화수소를 블루슈어('파란산')라고 합니다. 프랑스의 화학자 조셉 루이스 게이뤼삭은 프러시안의 푸른색 때문에 고대 그리스어 κύα νος(kyanos, 'blue'/'cyan')에서 시안화물이라는 이름을 붙였습니다.
역사

프러시안 블루 안료는 이집트 블루의 합성에 대한 지식이 상실된 이후 안정적이고 비교적 가벼운 속도의 블루 안료로는 최초로 널리 사용되었다는 점에서 의미가 큽니다. 유럽의 화가들은 이전에 인디고 염료, 스몰트, 티리안 퍼플과 같은 많은 색소들과 라피스 라줄리로 만든 매우 비싼 울트라 마린을 사용했습니다. 마찬가지로 일본의 화가들과 목판화가들도 유럽에서 프러시안 블루를 수입하기 시작할 때까지 오래 지속되는 블루 안료에 접근할 수 없었습니다.[4]
프러시안 블루 Fe
7(
18CN)(또한
4 Fe[Fe(CN)·
6
3xHO
2)는 아마도 1706년경 베를린의 페인트 제조업체 요한 야콥 디즈바흐에 의해 최초로 합성되었을 것입니다.[5][6] 이 색소는 Diesbach가 피로 오염된 칼륨을 사용하여 붉은 코치닐 염료를 만들 때 우연히 만들어진 것으로 믿어지고 있습니다. 원래 염료에는 포타시, 황산제2철 및 건조 코치닐이 필요했습니다. 대신 혈액, 칼륨, 황산철이 반응하여 철 페로시아나이드라는 화합물이 만들어졌는데, 이 화합물은 원하는 적색 안료와 달리 파란색이 매우 뚜렷합니다.[7] 1709년 최초의 무역업자에 의해 프레우 ß리스 블라우(Preu ßisch Blau)와 베를리니쉬 블라우(Berlinisch Blau)로 명명되었습니다.
이 안료는 값비싼 라피스라줄리 유래 울트라마린을 쉽게 대체했으며 1708년에서 1716년 사이에 요한 레온하르트 프리슈와 프로이센 과학 아카데미의 회장 고트프리트 빌헬름 라이프니츠 사이에 교환된 편지에서 중요한 주제였습니다.[8] 1708년 3월 31일 프리슈가 라이프니츠에게 보낸 편지에서 처음 언급됩니다. 1708년까지 프리슈는 유럽 전역에 이 안료를 홍보하고 판매하기 시작했습니다. 1709년 8월까지 이 색소는 프루시쉬 블라우(Preusisch blau)라고 불렸고, 1709년 11월까지 독일어 이름인 베를리쉬 블라우(Berlinisch Blau)는 프리쉬에 의해 처음으로 사용되었습니다. 프리슈 자신은 그의 편지에서 추론할 수 있듯이 1710년 노티티아 코에룰레이 베로리넨시스 누퍼 발명이라는 논문에서 프러시안 블루의 최초로 알려진 출판물의 저자입니다. Diesbach는 1701년경부터 Frisch를 위해 일해왔습니다.

현재까지, 피테르 반 데어 베르프 (산수치, 포츠담, 그림 갤러리)에 의해 그려진 1709년의 그리스도의 봉분은 프러시안 블루가 사용된 것으로 알려진 가장 오래된 그림입니다. 1710년경, 프로이센 궁정의 화가들은 이미 그 안료를 사용하고 있었습니다. 비슷한 시기에 프로이센 블루가 파리에 도착했고, 그곳에서 앙투안 와토와 후에 그의 후계자 니콜라스 랑크레트와 장바티스트 파테르가 그림에 그것을 사용했습니다.[5][11] 프랑수아 부셰는 이 색소를 파란색과 초록색 모두에 광범위하게 사용했습니다.[12]
1731년 게오르크 에른스트 스탈은 프러시안 블루의 최초 합성에 대한 설명을 출판했습니다.[13] 이 이야기에는 디즈바흐뿐만 아니라 요한 콘라드 디펠도 포함되어 있습니다. Diesbach는 코치닐에서 붉은 호수 안료를 개발하려고 시도했지만, 그가 사용하고 있던 오염된 포타쉬 때문에 대신 파란색을 얻었습니다. 그는 그 포타시를 자신의 동물 기름을 생산하는 데 사용했던 디펠에게서 빌렸습니다. 이러한 맥락에서 디펠에 대해서는 알려진 다른 사료가 언급되어 있지 않습니다. 따라서 오늘날 이 이야기의 신뢰성을 판단하기가 어렵습니다. 1724년에 마침내 존 우드워드에 의해 요리법이 출판되었습니다.[14][15][16]
1752년, 프랑스의 화학자 피에르 J. 매커는 프러시안 블루가 철의 염과 새로운 산으로 환원될 수 있다는 것을 보여주는 중요한 단계를 만들었습니다. 이것은 염료를 재구성하는 데 사용될 수 있습니다.[17] 프러시안 블루에서 처음 순수한 형태로 분리되어 1782년 스웨덴의 화학자 칼 빌헬름 셸레에 의해 특징지어진 새로운 산인 시안화수소는 [18]프러시안 블루에서 파생되었기 때문에 결국 블루슈레(말 그대로 "블루산")라는 이름이 붙었고, 영어로는 프러시안 산으로 대중적으로 알려지게 되었습니다. 프러시안 블루를 만드는 과정에서 생기는 무색의 음이온인 시안화물은 그리스어로 짙은 블루를 뜻하는 단어에서 이름을 따왔습니다.
1800년대 후반, 라드진의 하시딕 렙베인 랍비 게르손 헤노흐 라이너는 이것이 진정한 테카일 염료라고 믿고, 세피아로 만든 프러시안 블루로 치찌요트를 염색했습니다. 비록 일부 사람들이 그것의 인공적인 생산 때문에 그것의 정체성에 의문을 제기했고, 랍비 라이너가 이것을 알았다면 그가 그의 염료가 테킬레라는 그의 입장을 철회했을 것이라고 주장했지만,[19] 다른 사람들은 이것에 이의를 제기했고 랍비 라이너는 철회하지 않았을 것이라고 주장했습니다.[20]
군기호
18세기 초부터 프로이센 군대의 보병 연대와 포병 연대가 입는 유니폼 색상은 프로이센 블루였습니다.[21] 던켈블라우(진청색)로서 이 색상은 상징적인 중요성을 달성했으며 제1차 세계 대전이 발발할 때까지 대부분의 독일 군인들이 의식 및 비번 행사에 계속 착용했습니다. 이 색상은 녹회색 들판 회색(펠드라우)으로 대체되었습니다.[22]
합성
프러시안 블루는 페로시아나이드 제1철염의 산화에 의해 생성됩니다. 이 백색 고체들은 M = Na 또는 K의 화학식 MFe[Fe(CN)]를 갖습니다. 이 물질의 철은 모두 철이므로 혼합 원자가와 관련된 깊은 색상이 없습니다. 이 백색 고체를 과산화수소 또는 염소산나트륨으로 산화시키면 페리시안화물이 생성되며 프러시안 블루를 제공합니다.[23]
수용성 형태인 K[FeFeIIIII(CN)]
6는 페로시안화칼륨과 철(III)으로 만들 수 있습니다.
- K+
+ Fe3+
+ [FeII(CN)
6]4−
→ KFeIII[FeII(CN)
6]
페리시안화칼륨과 철의 유사 반응(II)는 [FeIII(CN)]
63−
가 페로시아나이드로 전환되기 때문에 동일한 콜로이드 용액을 생성합니다.
상기 반응에서 과량의 Fe가3+
첨가되면 "불용성" 프러시안 블루가 얻어집니다.
- 4Fe3+
+ 3[FeII(CN)
6]4−
→ FeIII[FeIIIFeII(CN)
6]
3 [24]
프러시안 블루는 시안화물 염으로 제조되지만, 시안화물 그룹이 철과 단단히 결합되어 있기 때문에 독성이 없습니다.[25] 페로시아나이드(FeII(CN))64− 및 페리시아나이드(FeIII(CN)))63− 둘 다 시안화 이온에 대한 강한 철 배위로 인해 특히 안정적이고 독성이 없는 고분자 시아노메탈레이트입니다. 일반적으로 시안화물은 크롬과 같은 전이 금속과 잘 결합하지만, 이러한 비철 배위 화합물은 시안화철만큼 안정적이지 않으므로 CN− 이온 방출 위험이 증가하고, 그에 따라 비교 독성이 증가합니다.[26]
턴불 블루
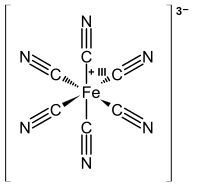
예전에는 철의 첨가(II) 페리시안화물 용액에 대한 염은 프러시안 블루와는 다른 물질을 제공한다고 생각되었습니다. 그 제품은 전통적으로 턴불스 블루 (TB)라고 이름 붙여졌습니다. 하지만 엑스레이 회절과 전자 회절 방식은 PB와 TB의 구조가 동일하다는 것을 보여주었습니다.[27][28] TB와 PB의 색상 차이는 입자 크기와 불순물 함량에 강한 영향을 미치는 침전 방법의 미묘한 차이를 반영합니다.
프러시안 화이트
프로이센 화이트는 베를린 화이트 또는 에버렛 소금으로도 알려져 있으며 모든 철이 존재하는 프로이센 블루의 완전 환원 형태의 나트륨 최종 구성원입니다. FeII. 화학식 NaFe2[Fe(CN)]6[29]의 Fe(II)의 헥사시아노퍼레이트 나트륨입니다. 분자량 값은 314g/mol입니다.[29]
Na 양이온을 K 양이온으로 대체할 수 있는 보다 일반적인 공식은 ABFe(CN)(여기서 A 또는 B = Na 또는 K)입니다. 프러시안 화이트는 프러시안 블루와 밀접한 관계가 있지만 결정 구조, 분자 구조 기공 크기, 색상 등에 따라 크게 다릅니다. Na-이온 배터리의 양극재로는 입방 나트륨 프러시안 화이트인 NaKFe(2−x)x2(CN)·6yHO와2 칼륨 프러시안 화이트인 KNaFe(2−x)x2(CN)·6yHO가2 후보 물질입니다.[30] 칼륨 프러시안 화이트의 골격에 Na+ 및 K 양이온을+ 삽입하면 장기적인 배터리 안정성을 향상시키고 가능한 충전 사이클 수를 증가시켜 사용 수명이 길어지는 유리한 시너지 효과를 얻을 수 있습니다.[30] Na+ 및 K+ 양이온을 쉽게 수용하는 프러시안 화이트의 대형 프레임워크는 충방전 사이클 동안 이들의 삽입 및 후속 추출을 용이하게 합니다. 넓고 단단한 호스트 결정 구조는 여러 사이클 후 나트륨 배터리에서 발생하는 내부 팽창 응력 및 변형에 대한 체적 안정성에 기여합니다.[29] 또한 이 소재는 낮은 온도에서도 높은 충전 속도를 제공하면서 높은 에너지 밀도(Ah/kg)를 제공합니다.[29]
특성.
프러시안 블루는 미결정 블루 파우더입니다. 불용성이지만 결정체는 콜로이드를 형성하는 경향이 있습니다. 이러한 콜로이드는 미세 필터를 통과할 수 있습니다.[2] 프러시안 블루의 조성은 알려진 가장 오래된 합성 화합물 중 하나임에도 불구하고 수년 동안 불확실한 상태로 남아 있었습니다. 그것의 정확한 식별은 세 가지 요인에 의해 복잡해졌습니다.
- 프러시안 블루는 매우 불용성이지만 콜로이드를 형성하는 경향이 있습니다.
- 전통적인 합성은 불순한 조성을 제공하는 경향이 있습니다.
- 순수한 프러시안 블루도 구조적으로 복잡하기 때문에 일상적인 결정학적 분석이 불가능합니다.
결정구조
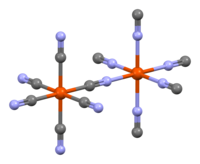

6 그룹 중 4분의 1이 누락되어 평균 18개의 시안 이온(24개가 아닌)과 3개의 철 원자를 제공합니다.

불용성 프러시안 블루의 화학식은 Fe(CN) · xHO이며, 여기서 x = 14–16입니다. 구조는 IR 분광법, Mössbauer 분광법, X-선 결정학 및 중성자 결정학을 사용하여 결정되었습니다. X-선 회절은 철과 같은 더 무거운 원소가 존재할 때 탄소와 질소를 쉽게 구별할 수 없기 때문에, 이러한 더 가벼운 원소의 위치는 철 원자 중심으로부터의 거리를 관찰하는 것뿐만 아니라 분광학적 수단에 의해 추론됩니다. 중성자 회절은 N과 C 원자를 쉽게 구별할 수 있으며 프러시안 블루와 그 유사체의 세부 구조를 결정하는 데 사용되었습니다.[31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41]
PB는 단위 셀당 4개의 철 III 원자가 있는 면 중심 입방 격자 구조를 가지고 있습니다. "용해성" PB 결정에는 간질성+
K 이온이 포함되어 있고, 대신 불용성 PB에는 간질성 물이 포함되어 있습니다. 이상적인 불용성 PB 결정에서 입방체 구조는 Fe(II)-C-N-Fe(III) 서열로 구성되며, Fe(II)-탄소 거리는 1.92 Å, Fe(III)-질소 거리는 2.03 Å입니다. Fe(CN)
6 소단위의 위치 중 4분의 1은 비어 있으며(임의로 추정) 단위 셀당 평균 3개의 그룹이 남아 있습니다.[42] 빈 질소 부위는 대신 Fe(III)로 조정되는 물 분자로 채워집니다.

6 그룹 중 4분의 1이 누락됩니다. 이 그림은 각 지점에서 물 분자 또는 시안 이온과 같은 두 가지 가능성을 모두 중첩합니다.
저스핀인 Fe(II) 중심은 팔면체 구성으로 6개의 탄소 리간드로 둘러싸여 있습니다. 높은 스핀인 Fe(III) 중심은 평균적으로 4.5개의 질소 원자와 1.5개의 산소 원자(6개의 배위 물 분자에서 나오는 산소)에 의해 팔면체로 둘러싸여 있습니다. 단전지에는 약 8개의 (간질) 물 분자가 존재하며, 분리된 분자 또는 조정된 물에 결합된 수소로 존재합니다. 가용성 헥사시아노페레이트 Fe(II 또는 III)는 항상 시안화물의 탄소 원자에 배위되는 반면, 결정질 프러시안 블루 Fe 이온은 C와 N 모두에 배위된다는 점에 주목할 필요가 있습니다.[43]
격자 결함의 존재로 인해 조성이 다양하기로 악명 높으며, 물 분자가 구조에 통합되어 양이온 빈자리를 차지함에 따라 다양한 정도로 수화될 수 있습니다. 프러시안 블루의 조성의 변동성은 용해도가 낮기 때문에 고체와 액체 사이의 완전한 평형을 달성할 시간 없이 빠른 침전으로 이어집니다.[42][44]
색.
프러시안 블루는 유채색이 강하며 유채색에 섞이면 검은색과 짙은 파란색을 띠는 경향이 있습니다. 정확한 색상은 입자 크기를 결정하는 준비 방법에 따라 다릅니다. 프러시안 블루의 강렬한 블루 색상은 Fe(II)에서 Fe(III)로의 전자 전달 에너지와 관련이 있습니다. 이러한 많은 혼합 원자가 화합물은 간격 전하 전달로 인한 특정 파장의 가시광선을 흡수합니다. 이 경우 파장 680나노미터 안팎의 주황색-적색 빛이 흡수되고, 그 결과 반사된 빛이 파란색으로 보입니다.
대부분의 고색소와 마찬가지로 프러시안 블루도 컴퓨터 디스플레이에 정확하게 표시할 수 없습니다. PB는 전기변색으로 환원 시 파란색에서 무색으로 바뀝니다. 이러한 변화는 Fe(III)가 Fe(II)로 환원되어 프러시안 블루의 색상을 유발하는 간격 전하 전달이 제거되어 발생합니다.
사용하다
안료

프러시안 블루는 쉽게 만들 수 있고 값이 싸고 무독성이며 강렬한 색상이기 때문에 많은 응용을 끌어왔습니다. 발명 직후 안료로 채택되어 유화, 수채화, 염색 등에 거의 즉시 널리 사용되었습니다.[46] 주요 용도는 안료입니다. 프러시안 블루는 검고 푸른색 잉크에 사용하기 위해 매년 약 12,000톤이 생산됩니다. 다른 다양한 안료에도 재료가 포함되어 있습니다.[23] 엔지니어의 파란색과 색소가 시안형에 형성되어 일반적인 이름의 청사진을 제공합니다. 어떤 크레용들은 한때 프러시안 블루 (나중에 미드나잇 블루로 다시 표시됨)로 물들었습니다. 마찬가지로 프러시안 블루는 세탁 블루의 기본입니다.
유럽연합 나노물질관측소에 따르면 프러시안 블루의 나노입자는 일부 화장품 성분에 색소로 사용됩니다.
| 프러시안 블루 | |
|---|---|
| 육각삼중주 | #003153 |
| sRGBB (r, g, b) | (0, 49, 83) |
| HSV(h,s,v) | (205°, 100%, 33%) |
| CIELChuv (L, C, h) | (19, 30, 247°) |
| 원천 | [1] |
| B: [0~255](바이트)로 정규화됨 H: [0-100]으로 정규화(100) | |
약
프러시안 블루는 1가 금속 양이온(Me+)을 함유하는 능력이 있어 특정 독성 중금속의 격리제로 유용합니다. 특히 의약품 등급의 프러시안 블루는 탈륨(Tl+)이나 방사성 세슘(134Cs+, Cs+)을 섭취한 사람들에게 사용됩니다. 국제원자력기구(IAEA)에 따르면 성인 남성은 하루에 프러시안 블루 10g 이상을 심각한 손상 없이 먹을 수 있습니다. 미국 식품의약국(FDA)은 특정 중독 사례에서 "500mg 프러시안 블루 캡슐이 승인된 신약 신청 조건에서 제조되었을 때 안전하고 효과적인 치료법으로 발견될 수 있다"고 결정했습니다.[47][48] 방사선가다제(Radiogardase, Prosus blue involidic capsulficles)는 장에서 세슘-137을 제거하기 위한 상업적 제품이므로, 세슘-137의 장간 순환에 개입하여 혈류로부터 간접적으로 내부 체류 시간([50]및 노출)을 약 3분의 2로 감소시킵니다. 특히 브라질 고이아니아 사고로 중독된 사람들의 유기체에서 Cs를+
흡착하고 제거하는 데 사용되었습니다.[2]
철에 대한 얼룩
프러시안 블루는 병리학자들이 골수 샘플과 같은 생검 샘플에서 철의 존재를 감지하기 위해 사용하는 일반적인 조직병리학적 염색입니다. 역사적으로 1867년 독일의 병리학자 막스 펄스(1843–1881)의 이름을 따서 "펄스 프러시안 블루"로 알려진 최초의 염색 공식은 조직을 염색하기 위해 페로시안화칼륨과 산의 별도 용액을 사용했습니다(이 용액들은 염색 직전에 현재 결합되어 사용됩니다). 그런 다음 조직의 철 침착물은 보라색 프러시안 블루 염료를 형성하고 파란색 또는 보라색 침착물로 시각화됩니다.[51]
- 프로이센 블루 염색으로 헤모시데린 색소를 파란색으로 강조합니다.
- 프러시안 블루 얼룩
기계 및 공구 제작자에 의한
유성 베이스의 엔지니어 블루, 프러시안 블루는 표면 플레이트와 손 스크래핑용 베어링과 같은 금속 표면을 발견하는 데 사용되는 전통적인 재료입니다. 얇은 비건조 페이스트 층이 기준 표면에 도포되어 작업물의 높은 지점으로 이동합니다. 그런 다음 공구 제조기는 긁거나 돌을 던지거나 표시된 높은 곳을 제거합니다. 프러시안 블루는 많은 분쇄 안료와 같이 매우 정확한 기준 표면을 손상시키지 않기 때문에 선호됩니다. 다른 용도로는 조립 중에 기어 톱니를 표시하여 인터페이스 특성을 결정하는 것이 있습니다.
분석화학에서
프러시안 블루는 총 페놀에 대한 프러시안 블루 분석에서 형성됩니다. 샘플과 페놀 표준은 산성 염화제이철과 페놀에 의해 페로시아나이드로 환원되는 페리시아나이드를 제공합니다. 염화제2철과 페로시아나이드가 반응하여 프러시안 블루를 형성합니다. 샘플의 700 nm에서의 흡광도를 표준과 비교하면 총 페놀 또는 폴리페놀을 측정할 수 있습니다.[52][53]
가정용
프러시안 블루는 부인과 같은 세탁 블루의 일부 준비물에 존재합니다. 스튜어트의 블루잉.[54]
조사.
전지재료
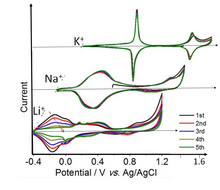
프러시안 블루(PB)는 1978년부터 전기 화학 에너지 저장 분야에 적용하기 위해 연구되어 왔습니다.[55] 프러시안 블루 프로퍼(Fe-Fe 고체)는 K+ 용액에서 두 가지 잘 정의된 가역적 산화환원 전이를 보여줍니다. 약하게 용해된 칼륨 이온(Rb+ 및 Cs뿐만+ 아니라 도시되지 않음)은 용해된 반경을 가지며, 이는 프러시안 블루의 프레임워크에 적합합니다. 반면, 용매화된 Na+ 및 Li의+ 크기는 PB 캐비티에 비해 너무 크고, 이들 이온의 삽입이 방해되고 훨씬 느립니다. 순환 전압 전류 측정에서 피크의 저전압 및 고전압 세트는 각각 Fe 원자당 1 및 ⅔ 전자에 해당합니다. 고전압 설정은 C-원자로 조정된 저스핀 Fe 이온에서 Fe3+/Fe2+ 전이로 인한 것입니다. 저전압 세트는 N-원자에 배위된 고스핀 Fe 이온 때문입니다.[57][58][59]
PB의 Fe 금속 중심을 Mn, Co, Ni, Zn 등과 같은 다른 금속 이온으로 대체하여 전기화학적으로 활성 프러시안 블루 유사체(PBA)를 형성할 수 있습니다. PB/PBA 및 이의 유도체는 리튬 이온 배터리, 나트륨 이온 배터리 및 칼륨 이온 배터리에서 가역적인 알칼리 이온 삽입 및 추출을 위한 전극 재료로도 평가되었습니다.
참고 항목
- 블루빌리 – 프러시안 블루 퇴적물은 화학 산업의 유출물로 오염된 토양에서 형성됩니다.
- 블루안료
- 코발트 블루 – 블루 안료
- Crystal violet – Triarylmethane 염료로 조직학적 염색 및 그람의 세균 분류 방법에 사용됨
- Fluoresein – 염료 및 형광 추적자로 사용되는 합성 유기 화합물
- 한보랏빛과 한블루 – 고대 중국에서 개발된 인공 바륨 구리 실리케이트 안료
- 무기안료 목록
- 미드나잇 블루 – 짙은 색조의 블루
- 프탈로시아닌 블루 BN – 프탈로시아닌 그룹의 합성 블루 안료 페이지 전환 합니다.
참고문헌
- ^ Fuess, H. (20 July 2010). International Tables for Crystallography, Vol. A (2016 ed.). Wiley. ISBN 978-0-470-68575-4.
- ^ a b c Dunbar, K. R. & Heintz, R. A. (1997). Chemistry of Transition Metal Cyanide Compounds: Modern Perspectives. Progress in Inorganic Chemistry. Vol. 45. pp. 283–391. doi:10.1002/9780470166468.ch4. ISBN 9780470166468.
- ^ "WHO Model List of Essential Medicines" (PDF). World Health Organization. October 2013. Retrieved 22 April 2014.
- ^ St. Clair, Kassia (2016). The Secret Lives of Colour. London: John Murray. pp. 189–191. ISBN 9781473630819. OCLC 936144129.
- ^ a b Bartoll, Jens. "The early use of prussian blue in paintings" (PDF). 9th International Conference on NDT of Art, Jerusalem Israel, 25–30 May 2008. Retrieved 2010-01-22.
- ^ Berger, J.E. (c.1730) Kerrnaller Fridrichs=Städtschen Begebenheiten 슈타츠 비블리오텍 주 베를린 – 프레우 ß 연구원 쿨투르베시츠, 핸즈크리프테납테일룽, 보루스 씨. 사분의 124.
- ^ Finlay, Victoria (2014). The Brilliant History of Color in Art. J. Paul Getty Museum. pp. 86–87. ISBN 978-1606064290.
- ^ a b Frisch, J. L. (1896) Briefwechsel mit Gottfried Wilhelm Leibniz L. H. Fischer (ed.), 베를린, Stankiewicz Buchdruck, 재판본 Hildesheim/뉴욕: Georg Olms Verlag, 1976
- ^ Frisch, J. L. (1710). "Serius Exhibita. Notitia Coerulei Berolinensis nuper inventi" [Addendum. Information about the recently discovered Berlin blue.]. Miscellanea Berolinensia Ad Incrementum Scientiarum (in Latin). 1: 377–378.
- ^ Kraft, Alexander (2011). ""Notitia Coerulei Berolinensis nuper inventi" on the 300th anniversary of the first publication on Prussian blue" (PDF). Bulletin for the History of Chemistry. 36 (1): 3–9. PMID 21612121.
- ^ Bartoll, J.; Jackisch, B.; Most, M.; Wenders de Calisse, E.; Vogtherr, C. M. (2007). "Early Prussian Blue. Blue and green pigments in the paintings by Watteau, Lancret and Pater in the collection of Frederick II of Prussia". Techné. 25: 39–46.
- ^ Mulherron, Jamie (2001). "Prussian Blue, Boucher and Newton: the Material, Practice and Theory of Rococo painting". Object. no. 3: 68–93.
- ^ Stahl, Georg Ernst (1731). Georgii Ernesti Stahlii, Experimenta, Observationes, Animadversiones, CCC Numero, Chymicae Et Physicae: Qualium alibi vel nulla, vel rara, nusquam autem satis ampla, ad debitos nexus, & veros usus, deducta mentio, commemeratio, aut explicatio, invenitur. Qualium partim, in aliis Autoris scriptis, varia mentio facta habetur; partim autem nova commemoratio hoc Tractatu exhibetur: utrimque vero, universa res uberius explicatur atque confirmatur (in Latin). Haude.
- ^ Woodward, J. (1724–1725). "Praeparatio coerulei Prussiaci es Germanica missa ad Johannem Woodward." [Preparation of Prussian blue sent from Germany to John Woodward...]. Philosophical Transactions of the Royal Society of London. 33 (381): 15–17. doi:10.1098/rstl.1724.0005.
- ^ Brown, John (1724–1725). "Observations and Experiments upon the Foregoing Preparation". Philosophical Transactions. 33 (381): 17–24. Bibcode:1724RSPT...33...17B. doi:10.1098/rstl.1724.0006. JSTOR 103734.Brown, John (1724–1725). "Observations and Experiments upon the Foregoing Preparation". Philosophical Transactions. 33 (381): 17–24. Bibcode:1724RSPT...33...17B. doi:10.1098/rstl.1724.0006. JSTOR 103734.요리법은 나중에 Geoffroy, Etienne-François (1727) "Bleu de Prusseou Berlin", Mémoires de l'Académie royale des Sciences année 1725에 출판되었습니다. 파리. 153-172쪽.
- ^ "The Creation of Color in Eighteenth-Century Europe: Prussian Blue". www.gutenberg-e.org. Retrieved 2022-07-28.
- ^ 마크커, 피에르 요제프 (1752) "Examen chymique de bleu de Prusse", Mémoires de l'Académie royale des Sciences anne 1752 ... (파리, 1756), 페이지 60–77. 이 기사는 "Surle blue de Prusse", "Histoire de l'Académie royale des Sciences"에서 검토되었습니다... (1752), (Paris, 1756), 79-85쪽.
- ^ Scheelle, Carl W. (1782) "Försök, beträffande det färgande ämnetuiti Berlinerblo" (베를린 파란색의 착색 물질에 관한 실험), 쿵리가 스벤스카 베텐스카카파카데미엔스 핸들링아르 (스웨덴 왕립 과학 아카데미 절차), 3:264–275 (스웨덴어). 다음과 같이 라틴어로 재인쇄: 칼 빌헬름 셸레(Ernst Benjamin Gottlieb Hebenstreit)와 고트프리트 하인리히 셰퍼(Trans.), 오푸스쿨라 케미카 에트 피지카(Lipzig), 독일어: 요한 고드프리트 뮐러, 1789), 2권, 148-174쪽.
- ^ Tekhellet#Sepiaofficinalis 참조
- ^ "Has the long lost chilazon, source of the biblical blue techeiles dye been rediscovered?". 8 April 2008. Archived from the original on 8 April 2008. Retrieved 12 May 2020.
- ^ Haythornhwaite, Philip (1991) Frederick the Great's Army – 보병. 블룸스버리 미국쪽 14쪽. ISBN 1855321602
- ^ 황소, 스티븐 (2000) 세계 1차 대전: 독일군 브래지는 8-10쪽입니다 ISBN 1-85753-271-6
- ^ a b Völz, Hans G. et al. (2006) 울만의 산업화학 백과사전에 수록된 "색소, 무기질" Wiley-VCH, Weinheim. doi:10.1002/14356007.a20_243.pub2.
- ^ Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: 무기화학, p.1444. Academic Press, 2001; 구글북스
- ^ 독성학 저널, 페리시안화칼륨 섭취에 의한 자살 시도
- ^ Jonathan R. Thurston, Scott E. Waters, Brian H. Robb, Michael P. Marshak (March 2022). "Organic and Metal-Organic RFBs". Encyclopedia of Energy Storage. 2: 423–435. doi:10.1016/B978-0-12-819723-3.00082-2. ISBN 9780128197301. S2CID 236672995.
{{cite journal}}: CS1 maint: 다중 이름: 작성자 목록(링크) - ^ Ozeki, Toru.; Matsumoto, Koichi.; Hikime, Seiichiro. (1984). "Photoacoustic spectra of prussian blue and photochemical reaction of ferric ferricyanide". Analytical Chemistry. 56 (14): 2819. doi:10.1021/ac00278a041.
- ^ Izatt, Reed M.; Watt, Gerald D.; Bartholomew, Calvin H.; Christensen, James J. (1970). "Calorimetric study of Prussian blue and Turnbull's blue formation". Inorganic Chemistry (Submitted manuscript). 9 (9): 2019. doi:10.1021/ic50091a012.
- ^ a b c d "Prussian White". Macsen Labs. 2023-10-28. Retrieved 2024-03-16.
- ^ a b Piernas-Muñoz, María José; Castillo-Martínez, Elizabeth; Bondarchuk, Oleksandr; Armand, Michel; Rojo, Teófilo (2016). "Higher voltage plateau cubic Prussian white for Na-ion batteries". Journal of Power Sources. Elsevier. 324: 766–773. doi:10.1016/j.jpowsour.2016.05.050. ISSN 0378-7753.
- ^ 다핵 전이 금속 시안화물의 전기화학 – 프러시안 블루 및 그 유사체. 1986. Accounts of Chemical Research. 19/162-168. doi:10.1021/ar00126a001.
- ^ 고성능 Li-이온 배터리의 안정적인 호스트 재료로서의 낮은 결함 FeFe(CN)6 프레임워크. 2016. ACS 적용 재료 및 인터페이스. 8/23706-23712. doi:10.1021/acsami.6b06880.
- ^ 프러시안 블루 유사체 및 전기 화학 에너지 저장을 위한 그 파생 물질: 약속과 도전. 2024. 자료 연구 회보. 170/ doi:10.1016/j. mater 레스불.2023.112593
- ^ 프러시안 블루 배터리의 일부 성능 특성. 1985. 전기화학학회지 132/1382-1384. doi:10.1149/1.2114121
- ^ 프러시안 블루의 중성자 회절 연구, Fe4[Fe4(CN)].63 14DO2. 1974. Zeitschrift fur Physikalische Chemie. 92/354-357. doi:10.1524/zpch.1974.92.4-6.354.
- ^ 편광 중성자 회절에 의한 프러시안 블루 Fe(III)[4Fe(II)(CN)]·63xDO에서의2 원자가 비국소화. 1980. Helvetica Chimica Acta. 63/148-153. doi:10.1002/hlca.19800630115.
- ^ 프러시안 블루, Fe4[Fe(CN)]·63xHO의2 중성자 회절 연구 물 분자의 위치와 장거리 자기 질서. 1980. 무기화학. 19/956-959. 도이:10.1021/ic50206a032.
- ^ 프러시안 블루와 구조적으로 관련된 화합물의 분말 및 단결정에 대한 중성자 및 X-선 회절 연구. 1999. Zeitschrift fur Naturforschung – Section B Journal of Chemical Sciences. 54/870-876. doi:10.1515/znb-1999-0708.
- ^ 프러시안 블루의 결정성, 혼합가 망간 유사체: 자기, 분광학, X선 및 중성자 회절 연구. 2004. 미국화학회지 126/16472-16477. doi:10.1021/ja0465451.
- ^ 프러시안 블루 아날로그 Cu3[Co(CN)]62에서 수소 흡착에 대한 중성자 회절 및 중성자 진동 분광학 연구. 2006. 재료의 화학 18/3221-3224. doi:10.1021/cm0608600
- ^ 분자자기화합물 NiCo1.1250.375[Fe(CN)]·66.4의 중성자 회절 연구H2O. 2006. Physica B: 응축 물질. 385-386 I/444-446. doi:10.1016/j. physb. 2006.05.147.
- ^ a b c Herren, F.; Fischer, P.; Ludi, A.; Haelg, W. (1980). "Neutron diffraction study of Prussian blue, Fe4[Fe(CN)6]3·xH2O. Location of water molecules and long-range magnetic order". Inorganic Chemistry. 19 (4): 956. doi:10.1021/ic50206a032.
- ^ 프러시안 블루 유사체 및 전기 화학 에너지 저장을 위한 그 파생 물질: 약속과 도전. 2024. 자료 연구 회보. 170/. M. Fayaz, W. Lai, J. Li, W. Chen, X. Luo, Z. Wang, et al. doi:10.1016/j.materresbull.2023.112593
- ^ Lundgren, C. A.; Murray, Royce W. (1988). "Observations on the composition of Prussian blue films and their electrochemistry". Inorganic Chemistry. 27 (5): 933. doi:10.1021/ic00278a036.
- ^ "Turning Big Ben's clock dials blue". UK Parliament. Retrieved 21 October 2023.
- ^ 베리, 바바라 H. (1997). 프로이센 블루. '아티스트 피그먼트'에서. 그들의 역사와 특징에 대한 핸드북, E. W. 피츠휴 (ed. 워싱턴 DC: 국립 미술관. ISBN 0894682563.
- ^ "Questions and Answers on Prussian Blue". Food and Drug Administration. Archived from the original on 2009-07-10. Retrieved 2020-03-20.
- ^ "Questions and Answers on Calcium-DTPA and Zinc-DTPA (Updated)". U.S. Food & Drug Administration. 3 November 2018. Retrieved 21 March 2020.
- ^ 방사선가르드제: Wayback Machine에서 수식이 포함된 패키지 삽입물 2011-03-20
- ^ Heyltex Corporation – Wayback Machine에 보관된 독성학 2007-11-12
- ^ 펄스 프러시안 블루 염색을 위한 포뮬러입니다. 2009년 4월 2일 접속.
- ^ Hagerman, Ann E. (18 March 2011). "Tannin Chemistry" (PDF). Archived from the original (PDF) on 2013-08-26. Retrieved 2009-12-19. (1.41MB)
- ^ Graham, Horace D. (1992). "Stabilization of the Prussian blue color in the determination of polyphenols". Journal of Agricultural and Food Chemistry. 40 (5): 801–805. doi:10.1021/jf00017a018. ISSN 0021-8561.
- ^ Schwarcz, Joe (January 22, 2016). "The Right Chemistry: Columbo, your laundry and liquid bluing". Montreal Gazette. Retrieved February 28, 2017.
- ^ Neff, Vernon D. (1978-06-01). "Electrochemical oxidation and reduction of thin films of Prussian blue". Journal of the Electrochemical Society. 125 (6): 886–887. Bibcode:1978JElS..125..886N. doi:10.1149/1.2131575. ISSN 1945-7111.
- ^ Neff, Vernon D. (1985-06-01). "Some performance characteristics of a Prussian blue battery". Journal of the Electrochemical Society. 132 (6): 1382–1384. doi:10.1149/1.2114121. ISSN 0013-4651.
- ^ Itaya, Kingo; Uchida, Isamu; Neff, Vernon D. (1986-06-01). "Electrochemistry of polynuclear transition metal cyanides: Prussian blue and its analogues". Accounts of Chemical Research. 19 (6): 162–168. doi:10.1021/ar00126a001. ISSN 0001-4842.
- ^ Wu, Xianyong; Shao, Miaomiao; Wu, Chenghao; Qian, Jiangfeng; Cao, Yuliang; Ai, Xinping; Yang, Hanxi (2016-09-14). "Low defect FeFe(CN)6 framework as stable host material for high performance Li-ion batteries". ACS Applied Materials and Interfaces. 8 (36): 23706–23712. doi:10.1021/acsami.6b06880. ISSN 1944-8244.
- ^ Fayaz, Muhammad; Lai, Wende; Li, Jie; Chen, Wen; Luo, Xianyou; Wang, Zhen; Chen, Yingyu; Li, De; Abbas, Syed Mustansar; Chen, Yong (2024). "Prussian blue analogues and their derived materials for electrochemical energy storage: Promises and challenges". Materials Research Bulletin. Elsevier. 170: 112593. doi:10.1016/j.materresbull.2023.112593. ISSN 0025-5408.
외부 링크
- 프러시안 블루에 관한 FDA의 페이지
- 프러시안 블루에 관한 CDC의 페이지.
- 국가 오염 물질 인벤토리 – 시안 화합물 팩트 시트
- Heyltex Corporation Radiogardase 유통업체 (Prosus Blue 불용성 캡슐) Wayback Machine에서 보관 2020-02-21
- 사라 로웬가드, 18세기 유럽의 색채 창조에 있어서 "프로이센 블루", 컬럼비아 대학 출판부, 2006
- 프러시안 블루, 컬러렉스
- Kraft, Alexander (2008). "On the discovery and history of Prussian blue" (PDF). Bull. Hist. Chem. 33 (2): 61–67.