보조 인자 F430
Cofactor F430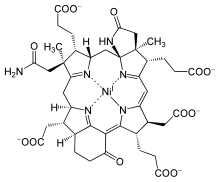 | |
| 식별자 | |
|---|---|
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
PubChem CID | |
| |
| |
| 특성. | |
| 채널 42 51 6− 13 | |
| 몰 질량 | 906.58014 |
| 외모 | 황색 실선 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
F는430 메틸코엔자임M환원효소(MCR)[1][2]의 보조인자(코엔자임이라고도 함)이다.MCR은 메타노제네이션의 마지막 단계에서 메탄을 방출하는 EC 2.8.4.1 반응을 촉매한다.
그것은 메타노제닉[3] 고고학과 혐기성 메타노 영양 고고학에서만 발견된다.그것은 역 메타노제네이션에 관여하는 고세균에서 비교적 높은 농도로 발생한다: 이것들은 니켈 [4]단백질의 무게로 최대 7%를 포함할 수 있다.
구조.
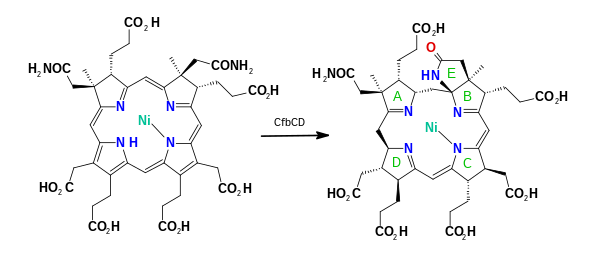
보조인자430 F는 1978년 Methanobacterium thermoautotrophyum에서 추출한 노란색 시료의 특성에 기초하여 지정되었으며, 이 시료의 분광 최대값은 430 [5]nm이다.1982년에[6] MCR 보조 인자로 확인되었으며, 전체 구조는 X선 결정학과 NMR [7]분광법에 의해 추론되었다.코엔자임430 F는 코르핀이라고 [8]불리는 대순환 고리 시스템에서 환원된 포르피린을 특징으로 합니다.또한 표준 테트라피롤(고리 A~D)에 비해 2개의 추가 고리를 가지며, γ-락탐환 E와 케토함유 카보사이클링 F를 가진다.그것은 니켈을 함유한 유일한 천연 테트라피롤인데, 니켈은 생물계에서 [9]거의 발견되지 않는 원소이다.
생합성
생합성은 엽록소, 비타민12 B, 피코빌린, 시로헴, 헴, 헴1 d를 포함한 모든 자연 테트라피롤의 조상인 우로포르피리노겐 III에서 만들어진다.디히드로시드로염소를 [10]통해 시로염소로 전환된다.이 테트라피롤에 니켈을 삽입하는 것은 코발라민의 생합성에 코발트를 삽입하는 동일 킬라타아제 CbiX에 의해 EC4.99.1.11 반응으로 촉매되며, 여기서 니켈(II)-시로염소를 [11]얻는다.
그런 다음 ATP 의존성 Ni-시로염소 a,c-디아미드 합성효소(CfBE)는 EC 6.3.5.12 반응에서 a 및 c 아세트산 측쇄를 아세트아미드로 전환하여 니켈(II)-시로염소 a,c-디아미드를 생성한다.두 개의 아미데이션의 순서는 무작위입니다.[11]2성분 복합체 Ni-시로염소 a,c-디아미드 환원환원효소(CfbCD)는 15,17-seco-F-17-acid34303(seco-F430) 중간체를 생성하는 반응 EC 6.3.7에서 링계를 6전자 및 7단자 환원한다.환원 작용은 ATP 가수분해를 수반하며 전자는 두 개의 4Fe-4S 중심을 통해 전달된다.마지막 단계에서는 EC6.4.1.9 반응으로 ATP의존성 효소인 코엔자임 F(430) 합성효소(CfbB)에 의해 케토함유 카르본환 F가 형성되어 코엔자임430 [11][12][13]F가 생성된다.이 효소는 펩티도글리칸 생합성에서 발견되는 MurF 유사 연결효소이다.
레퍼런스
- ^ Stephen W., Ragdale (2014). "Chapter 6. Biochemistry of Methyl-Coenzyme M Reductase: The Nickel Metalloenzyme that Catalyzes the Final Step in Synthesis and the First Step in Anaerobic Oxidation of the Greenhouse Gas Methane". In Peter M.H. Kroneck and Martha E. Sosa Torres (ed.). The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 125–145. doi:10.1007/978-94-017-9269-1_6. ISBN 978-94-017-9268-4. PMID 25416393.
- ^ Hofer, Ursula (2016). "Masters of methane". Nature Reviews Microbiology. 14 (12): 727. doi:10.1038/nrmicro.2016.170. PMID 27818502. S2CID 35175663.
- ^ Thauer RK (1998). "Biochemistry of Methanogenesis: a Tribute to Marjory Stephenson". Microbiology. 144 (9): 2377–2406. doi:10.1099/00221287-144-9-2377. PMID 9782487. Archived from the original on 2020-05-17. Retrieved 2011-10-01.
- ^ Krüger M, Meyerdierks A, Glöckner FO, et al. (December 2003). "A conspicuous nickel protein in microbial mats that oxidize methane anaerobically". Nature. 426 (6968): 878–81. Bibcode:2003Natur.426..878K. doi:10.1038/nature02207. PMID 14685246. S2CID 4383740.
- ^ Gunsalus, R.P.; Wolfe, R.S. (1978). "Chromophoric factors F342 and F430 of Methanobacterium thermoautotrophicum". FEMS Microbiology Letters. 3 (4): 191–193. doi:10.1111/j.1574-6968.1978.tb01916.x.
- ^ Ellefson, W. L.; Whitman, W. B.; Wolfe, R. S. (1982). "Nickel-containing factor F430: Chromophore of the methylreductase of Methanobacterium". Proceedings of the National Academy of Sciences. 79 (12): 3707–3710. Bibcode:1982PNAS...79.3707E. doi:10.1073/pnas.79.12.3707. PMC 346495. PMID 6954513.
- ^ Färber G, Keller W, Kratky C, Jaun B, Pfaltz A, Spinner C, Kobelt A, Eschenmoser A (1991). "Coenzyme F430 from Methanogenic Bacteria : Complete Assignment of Configuration Based on an X-ray Analysis of 12,13-diepi-F430 Pentamethyl Ester and on NMR Spectroscopy". Helvetica Chimica Acta. 74 (4): 697–716. doi:10.1002/hlca.19910740404.
- ^ Eschenmoser, A. (1986). "Chemistry of Corphinoids". Annals of the New York Academy of Sciences. 471 (1 International): 108–129. Bibcode:1986NYASA.471..108E. doi:10.1111/j.1749-6632.1986.tb48030.x. S2CID 83719424.
- ^ Johnson, Michael K.; Scott, Robert A. (2 October 2017). Metalloprotein Active Site Assembly. ISBN 9781119159834.
- ^ Mucha, Helmut; Keller, Eberhard; Weber, Hans; Lingens, Franz; Trösch, Walter (1985-10-07). "Sirohydrochlorin, a precursor of factor F430 biosynthesis in Methanobacterium thermoautotrophicum". FEBS Letters. 190 (1): 169–171. doi:10.1016/0014-5793(85)80451-8.
- ^ a b c Moore, Simon J.; Sowa, Sven T.; Schuchardt, Christopher; Deery, Evelyne; Lawrence, Andrew D.; Ramos, José Vazquez; Billig, Susan; Birkemeyer, Claudia; Chivers, Peter T.; Howard, Mark J.; Rigby, Stephen E. J.; Layer, Gunhild; Warren, Martin J. (2017). "Elucidation of the biosynthesis of the methane catalyst coenzyme F430". Nature. 543 (7643): 78–82. Bibcode:2017Natur.543...78M. doi:10.1038/nature21427. PMC 5337119. PMID 28225763.
- ^ Zheng, Kaiyuan; Ngo, Phong D.; Owens, Victoria L.; Yang, Xue-Peng; Mansoorabadi, Steven O. (2016). "The biosynthetic pathway of coenzyme F430 in methanogenic and methanotrophic archaea". Science. 354 (6310): 339–342. Bibcode:2016Sci...354..339Z. doi:10.1126/science.aag2947. PMID 27846569.
- ^ R. Caspi (2017-01-09). "Pathway: factor 430 biosynthesis". MetaCyc Metabolic Pathway Database. Retrieved 2020-04-27.