래디컬(화학
Radical (chemistry)화학에서 유리기는 적어도 한 쌍의 원자가 [1][2]전자를 가진 원자, 분자 또는 이온이다.일부 예외를 제외하고, 이러한 쌍이 없는 전자는 라디칼을 화학적으로 매우 반응시킵니다.많은 라디칼은 자발적으로 이합화된다.대부분의 유기산소는 수명이 짧다.
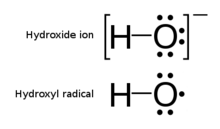
라디칼의 주목할 만한 예는 산소 원자 위에 하나의 비쌍 전자를 가진 분자인 히드록실 라디칼(HO·)이다.두 가지 다른 예로는 삼중항 산소와 삼중항 카르벤(δCH
2)이 있는데, 이들은 두 개의 짝이 없는 전자를 가지고 있다.
래디칼은 여러 가지 방법으로 생성될 수 있지만 일반적인 방법은 산화환원반응을 수반한다.이온화 방사선, 열, 방전 및 전기 분해는 라디칼을 생성하는 것으로 알려져 있습니다.라디칼은 많은 화학 반응의 중간체이며, 균형 방정식보다 더 뚜렷하다.
라디칼은 연소, 대기 화학, 중합, 플라즈마 화학, 생화학, 그리고 많은 다른 화학 작용에서 중요하다.천연물의 대부분은 라디칼 생성 효소에 의해 생성된다.살아있는 유기체에서는 과산화물 및 일산화질소 및 그 반응 산물이 혈관조절 및 혈압의 제어와 같은 많은 과정을 조절한다.그들은 또한 다양한 생물학적 화합물의 중간 대사에도 중요한 역할을 한다.이러한 래디컬은 산화환원 시그널링이라고 불리는 프로세스에서 메신저가 될 수도 있습니다.라디칼은 용제 케이지 내에 갇히거나 다른 방법으로 결합할 수 있다.
형성
라디칼은 (1) 스핀쌍 분자에 의해 형성되거나 (2) 다른 라디칼에 의해 형성된다.라디칼은 환원이라고도 알려진 약한 결합 또는 전자 전달의 균질화를 통해 스핀 쌍을 이루는 분자로 형성됩니다.라디칼은 치환, 첨가 및 제거 반응을 통해 다른 라디칼로부터 형성된다.
스핀쌍 분자에 의한 래디칼 형성
호몰리시스
호몰리시스(homolysis)는 공유 결합을 끊음으로써 스핀쌍 분자에서 [3]두 개의 새로운 라디칼을 만들고, 각각의 조각은 결합에 있는 전자 중 하나를 남긴다.화학 결합을 깨는 데는 에너지가 필요하기 때문에 열이나 빛을 더하면 균질화가 일어난다.균질 분해와 관련된 결합 해리 에너지는 주어진 화합물의 안정성에 의존하며, 일부 약한 결합은 상대적으로 낮은 온도에서 균질화할 수 있다.
일부 균질반응은 다른 래디칼 반응의 개시제 역할을 하기 때문에 특히 중요하다.그러한 예 중 하나는 빛 아래에서 발생하며 래디칼 할로겐화 반응의 원동력 역할을 하는 할로겐의 균질화이다.
또 다른 주목할 만한 반응은 디벤조일 과산화물의 균질화이며, 이는 두 개의 벤조일 라디칼을 형성하고 많은 라디칼 [4]반응에 대한 개시제 역할을 한다.
축소
라디칼은 또한 스핀쌍 분자에 단일 전자가 추가되어 전자 전달을 일으킬 때 형성될 수 있다.환원이라고도 불리는 이 반응은 보통 알칼리 금속이 다른 스핀쌍 [5]분자에 전자를 기증하면서 일어납니다.
다른 래디칼로부터의 래디칼 형성
추상화
수소 추상화는 수소 원자가 하나의 [6]전자와 함께 수소 공여 분자(예: 주석 또는 수소화 규소)에서 제거되는 경우를 말한다.추상화는 새로운 라디칼과 새로운 스핀쌍 분자를 만들어냅니다.이것은 단일 스핀 쌍 분자에서 두 개의 라디칼을 생성하며 반응 물질로 라디칼을 포함하지 않는 균질화와는 다릅니다.수소 추상화는 많은 화학 반응에서 탄소 방사기를 안정적인 분자로 바꾸면서 마지막 전파 단계 역할을 하기 때문에 급진 화학의 기본 과정이다.오른쪽 그림은 벤조일록시 라디칼과 브롬화수소 분자 사이의 급진적 추상화를 보여주며, 벤조산 분자와 브롬산 라디칼이 생성된다.
추가
래디칼 첨가는 래디칼이 스핀쌍 분자에 첨가되어 새로운 [7]래디칼을 형성할 때를 기술한다.오른쪽 그림은 알켄에 브롬 라디칼을 첨가한 것입니다.라디칼 첨가는 덜 치환된 탄소 원자에 치환기가 첨가되는 Anti-Markovnikov 법칙을 따릅니다.
소거
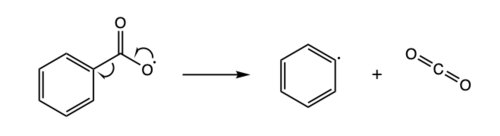
래디컬 제거는 래디컬 덧셈의 역순으로 볼 수 있다.래디칼 제거에서 불안정한 래디칼 화합물은 스핀쌍 분자와 새로운 래디칼 화합물로 분해된다.아래는 벤조일록시기가 [8]페닐기 및 이산화탄소 분자로 분해되는 라디칼 제거 반응의 예입니다.
안정성.
유기라디칼의 안정성

유기 라디칼은 일반적으로 본질적으로 안정적이지만, 실질적으로 그들의 존재는 이량화 경향이 있기 때문에 일시적인 것이다.몇몇은 꽤 오래 산다.일반적으로 유기 라디칼은 전기음성도의 존재, 비국재화 및 입체장애의 [9]일부 또는 모든 요인에 의해 안정화된다.2,2,6,6-테트라메틸피페리디닐록실 화합물은 세 가지 인자의 조합을 나타낸다.이것은 자성을 띠는 것 외에 일반적인 유기 화합물과 같은 작용을 하는 시판 고체입니다.
전기 음성도
유기 라디칼은 본질적으로 전자가 결핍되어 있기 때문에 짝이 없는 전자가 존재하는 원자의 전기음성도가 클수록 [10]라디칼은 안정성이 떨어진다.예를 들어 탄소, 질소, 산소 중에서 탄소가 가장 안정적이고 산소가 가장 안정적이지 않다.
전기음성도는 또한 다른 잡종의 탄소 원자의 안정성에 영향을 미친다.그레이터 s-character은 탄소 원자(s궤도의 핵에 근접함 때문에)의 높은 전기 음성도, 그리고 더 큰 전기 음성도 안정성이 떨어진 급진적인 연관이 있다.[10](50%s-character)가장 안정적인 급진 주의자들sp3-hybridized 탄소(25%s-character)가장 상태를 형성하는 비해 형성되는 탄소 sp-hybridized.과격파
디로컬라이제이션
하나 이상의 공명 구조를 형성하는 능력으로도 알려진 래디칼의 구조에 걸쳐 전자의 비국재화는 전자 결핍을 여러 원자에 분산시켜 불안정성을 최소화합니다.탈국소화는 일반적으로 히드록실기(-OH), 에테르(-OR), 인접한 알케인 및 아민2(-NH 또는 -NR)과 같은 전자 결합기 또는 C=O 또는 CδN과 [3]같은 전자 결합기(전자 결합기)가 있을 때 발생한다.
또한 분자 궤도이론을 렌즈로 사용하여 보다 구체적으로는 기증 그룹의 전자쌍 또는 전자 인출 그룹의 빈 δ* 궤도와의 분자 내 상호작용을 조사함으로써 비국재화 효과를 이해할 수 있다.래디칼의 HOMO는 단독으로 점유되기 때문에 오비탈은 SOMO, 즉 단일 점유 분자 오비탈이라고 불립니다.전자공여 그룹의 경우, SOMO는 낮은 에너지 외톨이 쌍과 상호작용하여 새로운 낮은 에너지 충진 결합-궤도 및 원래의 에너지보다 높은 단일 충진된 새로운 SOMO를 형성한다.짝이 없는 전자의 에너지가 증가하는 동안, 새로운 결합 오비탈을 형성하는 단 한 쌍의 에너지의 감소는 새로운 SOMO의 에너지 증가보다 더 크고, 결과적으로 분자의 에너지의 순 감소를 초래한다.그러므로, 전자 기증 그룹은 라디칼을 안정시키는데 도움을 준다.
대신 전자를 끌어내는 그룹과 함께, SOMO는 빈 δ* 오비탈과 상호작용합니다.형성된 높은 에너지 오비탈을 차지하는 전자는 없고, 에너지가 낮은 새로운 SOMO가 형성됩니다.이것은 래디칼 종의 에너지를 낮추고 안정성을 높인다.기부단체와 금단단체는 모두 급진주의를 안정시킨다.
잘 알려져 있지만 약한 디로컬라이제이션의 또 다른 형태는 하이퍼커넥테이션입니다.래디칼 화학에서 래디칼은 인접한 알킬기와의 과접합에 의해 안정화된다.시그마(θ) C-H 결합을 부분적으로 비어 있는 라디칼 오비탈에 기증하면 3차, 2차 및 1차 탄소에 대한 라디칼의 안정성을 구별하는 데 도움이 된다.3차 탄소기는 기증하는 3개의 γC-H 결합을 가지며, 2차기기는 2개, 1차기기는 1개이다.따라서 3차 라디칼은 가장 안정적이고 1차 라디칼은 가장 안정적이지 않다.
입체 장애

가장 간단히 말해서, 스테릭 장애가 클수록 반응이 일어나기 어렵고, 기본적으로는 급진적인 형태가 선호된다.예를 들어 수소추출형 N-히드록시피페리딘을 분자 [3]TEMPO와 비교해도 TEMPO, 즉 (2, 6, 6-테트라메틸피페리딘-1-일)옥실기는 추가 메틸기에 의해 너무 입체적으로 저해되어 상업적으로 라디칼 형태로 판매되기에는 충분히 안정적이다.그러나 N-히드록시피페리딘은 반응 분자의 길을 방해하는 4개의 메틸기를 가지고 있지 않기 때문에 구조가 [3]불안정하다.
Facile H-atom 기증자
많은 (또는 대부분의) 유기 라디칼의 안정성은 분리성으로 나타나지 않지만 H의• 공여자로서의 기능에서 나타난다.이 성질은 수소에 대한 결합이 약해진 것을 반영하며, 일반적으로 O-H이지만 때로는 N-H 또는 C-H를 반영하기도 한다.이러한• H 기증자들이 생물학과 상업에서 항산화제 역할을 하기 때문에 이러한 행동은 중요하다.예를 들어 α-토코페롤(비타민E)을 들 수 있다.토코페롤 라디칼 자체는 분리하기에 충분히 안정적이지 않지만, 모분자는 매우 효과적인 수소 원자 공여체이다.C-H 결합은 트리페닐메틸(트리셀) 유도체에서 약해집니다.

무기라디칼
많은 종류의 무기라디칼은 안정적이고 사실상 분리할 수 있다.예를 들어 대부분의 1열 전이 금속 착체를 들 수 있습니다.
주요 그룹 라디칼과 관련하여, 우주에서 가장 풍부한 라디칼은 또한 우주에서 가장 풍부한 화학 물질인• H이다. 대부분의 주요 그룹 라디칼은 고유의 안정성에도 불구하고 분리될 수 없다.예를 들어 수소라디칼은 열심히 결합해 H산화질소(NO)를 형성한다2.분리성 무기라디칼의 잘 알려진 예다.프레미의 소금(Nitrosodisulfonate, (KSO3)2NO)이 관련된 예입니다.많은 티아질 라디칼은 δ공명 [11][12]안정화 범위가 제한됨에도 불구하고 알려져 있다.
많은 라디칼들은 균질화에 의한 공유 결합의 파괴의 산물로 생각될 수 있다.일반적으로 "δH °"로 약칭되는 균질 결합 해리 에너지는 결합 강도의 척도이다.예를 들어 H를 2• H로 분할하려면2 +435 kJ/mol의 δH°가 필요하고 Cl을 2• Cl로 분할하려면2 +243 kJ/mol의 δH°가 필요하다.약한 결합의 경우, 균질 분해를 열적으로 유도할 수 있다.강한 결합은 균질화를 유도하기 위해 높은 에너지 광자나 심지어 불꽃을 필요로 한다.
디라디칼
디라디칼은 두 개의 라디칼 중심을 포함하는 분자이다.Dioxygen(O2)은 안정적인 디라디칼의 중요한 예이다.다이옥시겐의 가장 낮은 에너지 비방사성 상태인 싱글트 산소는 Hund의 최대 다중성 법칙 때문에 디라디칼보다 안정성이 낮다.산소 디라디칼의 상대적 안정성은 주로 전자를 잡는 데 필요한 트리플렛-싱글렛 전환의 스핀 금지 특성, 즉 "산화" 때문입니다.산소의 디라디칼 상태는 또한 외부 [13]자석에 대한 흡인력에 의해 증명되는 상사성 특성을 낳습니다.디라디칼은 금속-옥소 복합체에서도 발생할 수 있으며 전이 금속 [14]화학에서 스핀 금지 반응에 대한 연구에 도움이 됩니다.삼중환 상태의 카르벤은 동일한 원자에 중심을 둔 디라디칼로 볼 수 있으며, 이들은 일반적으로 높은 반응성 지속 카르벤으로 알려져 있으며, N-헤테로사이클릭 카르벤이 가장 일반적인 예이다.
트리플렛 카벤과 니트렌은 디라디칼이다.그들의 화학적 특성은 그들의 싱글렛 유사체의 특성과는 다르다.
라디칼의 발생
연소
친숙한 급진적 반응은 연소이다.산소 분자는 안정적인 디라디칼이며 O-O로• 가장 잘 표현됩니다.전자의 스핀은 평행하기 때문에 이 분자는 안정적입니다.산소의 접지 상태는 이 비반응 스핀 무쌍(트리플렛) 디라디칼이지만, 극단적으로 반응성이 높은 스핀 무쌍(싱글렛) 상태를 사용할 수 있습니다.연소가 발생하려면 이들 사이의 에너지 장벽을 극복해야 합니다.이 장벽은 고온을 필요로 하는 열로 극복할 수 있습니다.트리플렛-싱글릿 전환도 "금지"됩니다.이것은 반응에 대한 추가적인 장벽을 제시합니다.이는 또한 상온에서 분자 산소가 상대적으로 반응하지 않는다는 것을 의미합니다. 단, 철이나 구리와 같은 촉매 중원자가 존재하는 경우는 예외입니다.
연소는 싱글렛 래디칼이 시작할 수 있는 다양한 래디칼 연쇄 반응으로 구성됩니다.주어진 물질의 가연성은 시작 전에 얻어야 하는 라디칼 농도에 따라 크게 달라지며, 물질의 연소로 이어지는 전파 반응이 지배적이다.가연성 물질이 소비되면, 종단 반응이 다시 지배하고 불꽃이 사라집니다.이와 같이 전파 또는 종단반응의 촉진은 가연성을 변화시킨다.예를 들어, 납 자체가 가솔린-공기 혼합물의 라디칼을 비활성화하기 때문에, 한때는 일반적으로 가솔린에 테트라에틸 납이 첨가되었습니다.이렇게 하면 연소 상태가 제어되지 않거나 연소되지 않은 잔류물(엔진 노킹) 또는 조기 점화(예비 점화)로 시작되는 것을 방지할 수 있습니다.
탄화수소가 연소될 때, 많은 다른 산소기가 관련된다.처음에는 히드로페르옥실라디칼(HU)이• 형성된다.그런 다음 이것들은 더욱 반응하여 히드록실 라디칼(HO•)로 분해되는 유기 과산화수소를 생성한다.
중합
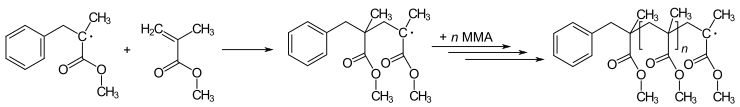
많은 중합 반응은 라디칼에 의해 시작된다.중합은 새로운 래디칼을 만들기 위해 비래디칼(일반적으로 알켄)에 초기 래디칼을 첨가하는 것을 포함한다.이 과정은 급진적 연쇄 반응의 기초이다.중합술은 개시 래디칼을 도입하는 방법을 수반한다.예를 들어 메틸 메타크릴레이트(MMA)는 일련의 라디칼 부가 단계를 반복하여 폴리(PMMA - 플렉시글라스 또는 페르스펙스)를 생성하기 위해 중합될 수 있습니다.
새로운 래디칼 중합 방법은 살아있는 래디칼 중합으로 알려져 있다.변종에는 가역적 부가-파쇄전달(RAFT) 및 원자 전달 래디칼 중합(ATRP)이 있습니다.
널리 퍼져있는 라디칼인 O는 많은2 유기 화합물과 반응하여 히드로페옥사이드 라디칼과 함께 라디칼을 생성한다.건조 오일과 알키드 페인트는 대기 중 산소에 의해 시작된 급진적인 가교로 인해 경화됩니다.
대기 라디칼
저층 대기에서 가장 흔한 래디칼은 분자 다이옥시젠이다.소스 분자의 광분해는 다른 라디칼을 생성한다.대기 하층에서는 이산화질소를 산소 원자와 산화질소로 광분해(아래 예 1.1 참조)하고 오존을 광분해하여 들뜬 산소 원자 O(1D)를 생성한다(아래 예 1.2 참조).순반응과 리턴반응도 표시된다(각각 1.3과 1.4).
-
(예 1.1)
-
(예 1.2)
-
(예: 1.3)
-
(예: 1.4)
상층 대기에서는 태양 자외선에 의한 정상 반응하지 않는 클로로플루오로카본(CFCs)의 광분해는 라디칼의 중요한 공급원이다(아래 예 1 참조).이러한 반응은 오존의 O로의2 전환을 촉매하는 염소 라디칼 Cl을• 제공하여 오존 파괴를 촉진한다(아래 2.2–eq 2.4).
-
(예 2.1)
-
(예: 2.2)
-
(예: 2.3)
-
(예: 2.4)
-
(예: 2.5)
이러한 반응은 오존층의 고갈을 유발하며, 특히 염소 래디칼이 다른 반응 사슬에 자유롭게 관여하기 때문에 냉매로서의 클로로플루오로카본 사용이 제한되었다.
생물학에서
라디칼은 생물학에서 중요한 역할을 한다.과립구나 대식세포와 같은 식세포세포에 의한 세포내 박테리아의 살처분과 같은 많은 것들이 생명을 위해 필요하다.라디칼은 redox 시그널링이라고 불리는 셀 시그널링 프로세스에 [16]관여합니다.예를 들어 리놀레산의 래디칼 공격은 일련의 13-히드록시옥타데카디엔산 및 9-히드록시옥타데카디엔산을 생성하며, 이들은 국부조직의 염증 및/또는 치유반응, 통증지각 및 악성세포의 증식을 조절하는 역할을 할 수 있다.아라키돈산과 도코사헥사엔산에 대한 급진적인 공격은 비슷하지만 광범위한 신호 [17]생성물을 생성한다.
래디칼은 또한 파킨슨병, 노인성 및 약물성 난청, 정신분열증,[18] 알츠하이머병과 관련이 있을 수 있다.전형적인 자유방사성 증후군인 철분 저장성 질환 혈색소증은 일반적으로 운동 장애, 정신 질환, 피부 색소 멜라닌 이상, 난청, 관절염, 당뇨병을 포함한 자유방사성 관련 증상과 관련이 있습니다.노화의 자유 방사 이론은 래디칼이 노화 과정 그 자체의 기초가 된다고 제안합니다.마찬가지로 유사체 형성 과정은 라디칼에 반복적으로 노출되는 것이 수명을 연장할 수 있음을 시사한다.
래디칼은 생명에 필요하기 때문에 몸은 래디칼에 의해 유발되는 손상을 최소화하고 발생하는 손상을 복구하는 많은 메커니즘을 가지고 있다. 예를 들어 슈퍼옥시드 디스무타아제, 카탈라아제, 글루타티온 페르옥시다아제 및 글루타티온 환원효소이다.게다가, 항산화제는 이러한 방어 메커니즘에 중요한 역할을 합니다.이것들은 종종 비타민 A, 비타민 C, 비타민 E와 폴리페놀 항산화제 세 가지입니다.또한 빌리루빈과 요산이 특정 라디칼을 중화시키는 항산화제로 작용할 수 있음을 나타내는 좋은 증거가 있다.빌리루빈은 적혈구 내용물의 분해에서 나오는 반면 요산은 푸린의 분해 산물이다.그러나 빌리루빈이 너무 많으면 황달로 이어져 결국 중추신경계를 손상시킬 수 있고 요산이 너무 많으면 [19]통풍을 일으킬 수 있다.
활성산소종
활성산소종(ROS)은 슈퍼옥사이드, 과산화수소, 히드록실라디칼과 같은 종으로 일반적으로 세포 손상과 관련이 있다.ROS는 산소의 정상적인 대사의 자연적인 부산물로 형성되며 세포 신호 전달에 중요한 역할을 합니다.두 개의 중요한 산소 중심 라디칼은 과산화물과 히드록실 라디칼이다.그것들은 환원 조건하에서 분자 산소로부터 얻어진다.하지만, 그들의 반응성 때문에, 이러한 같은 라디칼들은 세포 손상을 야기하는 원치 않는 부작용에 참여할 수 있습니다.이러한 라디칼의 과도한 양은 암, 뇌졸중, 심근경색, 당뇨병 및 주요 [20]질환과 같은 많은 질병의 원인이 될 수 있는 세포 손상과 죽음을 초래할 수 있습니다.많은 형태의 암은 래디칼과 DNA 사이의 반응의 결과로 생각되며, 잠재적으로 세포 주기에 악영향을 미칠 수 있고 잠재적으로 악성 [21]종양으로 이어질 수 있는 돌연변이를 야기합니다.아테롬성 동맥경화증과 같은 노화 증상 중 일부는 콜레스테롤이 7-케토콜레스테롤로 [22]급진적으로 유도되는 것에 기인한다.또한 라디칼은 알코올로 인한 간 손상에 기여하며 알코올 자체보다 더 많을 수 있습니다.담배 연기에 의해 생성된 라디칼은 폐에서 알파1-항이트립신의 불활성화에 관여한다.이 과정은 폐기종의 발생을 촉진한다.
옥시벤존은 햇빛에서 라디칼을 형성하는 것으로 밝혀졌으며, 따라서 세포 손상과도 관련이 있을 수 있습니다.이것은 산화티타늄과 옥틸메톡시신나메이트와 [23]같은 자외선 차단제에서 흔히 발견되는 다른 성분들과 결합되었을 때만 일어났다.
ROS는 폴리불포화지방산인 리놀레산을 공격하여 일련의 13-히드록시옥타데카디엔산 및 9-히드록시옥타데카디엔산 생성물을 형성하며, 이러한 생성의 원인이 된 조직 손상에 대항하는 반응을 촉발할 수 있는 시그널링 분자로 기능한다.ROS는 아라키돈산 및 도코사헥사엔산과 같은 다른 다불포화 지방산을 공격하여 유사한 일련의 시그널링 [24]생성물을 생성한다.
역사와 명명법
20세기 후반까지 "라디칼"이라는 단어는 화학에서 메틸기 또는 카르복실기와 같은 연결된 원자 그룹을 나타내기 위해 사용되었는데, 이것은 더 큰 분자의 일부이거나 분자의 일부였다.다음으로 Unbound 대소문자를 지정하기 위해 한정자 "free"가 필요했습니다.최근의 명명법 개정 이후, 더 큰 분자의 일부는 이제 기능기 또는 치환기라고 불리고, "라디칼"은 이제 "자유"를 의미한다.그러나 일부 책에는 여전히 옛 명칭이 등장할 수 있다.
지금은 시대에 뒤떨어진 급진주의 이론이 개발되었을 때 급진주의라는 용어는 이미 사용되었다.루이 베르나르 기동 드 모르보는 1785년에 "라디칼"이라는 문구를 도입했고 이 문구는 앙투안 라부아지에 의해 1789년 그의 "아트리제 엘레망테어 드 치미"에서 사용되었다.라디칼은 특정 산의 뿌리 염기로 확인되었다.역사적으로, 래디칼 이론에서 래디칼이라는 용어는 분자의 결합 부분, 특히 반응이 변하지 않을 때 사용되었습니다.이것들은 이제 기능 그룹이라고 불립니다.예를 들어, 메틸 알코올은 메틸 "라디칼"과 히드록실 "라디칼"로 구성된다고 설명되었습니다.서로 영구적으로 결합되어 있고 짝을 이루지 않은 반응성 전자가 없기 때문에 현대 화학적인 의미에서도 라디칼은 아니다. 그러나 에너지 전자 조사에 의해 분해될 때 질량 분석에서 라디칼로 관찰될 수 있다.
현대의 맥락에서 확인된 최초의 유기(탄소 함유) 라디칼은 트리페닐메틸 라디칼(CH65)3C였다•.이 종은 1900년 모세 곰버그에 의해 발견되었다.1933년 모리스 S. 카라쉬와 프랭크 마요는 활성산소가 [25][26]브롬화알릴에 브롬화수소를 첨가하는 반마르코브니코프의 원인이라고 주장했다.
대부분의 화학 분야에서, 라디칼의 역사적 정의는 분자들이 0이 아닌 전자 스핀을 가지고 있다고 주장합니다.그러나 분광학, 화학반응, 우주화학 등의 분야에서는 정의가 약간 다르다.전자 구조와 라디칼의 기하학적 구조에 대한 그의 연구로 노벨상을 받은 게르하르트 헤르츠버그는 자유 라디칼의 정의를 더 느슨하게 제안했습니다: "모든 일시적인 (화학적으로 불안정한)[27] 종들"그의 제안의 요점은 C, C3, CH2 등과 같이2 화학적으로 불안정한 분자들이 0 스핀을 가지고 있다는 것이다.이 정의는 일시적인 화학 과정과 우주 화학에 대한 논의에 더 편리합니다. 따라서 이러한 분야의 연구자들은 이 느슨한 [28]정의를 사용하는 것을 선호합니다.
화학 반응에서의 묘사
화학식에서 라디칼은 종종 다음과 같이 원자 기호 또는 분자식의 바로 오른쪽에 배치되는 점으로 나타납니다.
래디컬 반응 메커니즘은 단일 전자의 움직임을 나타내기 위해 단일 머리 화살표를 사용합니다.
파단 결합의 균질 분열은 표준 곱슬 화살표로 묘사된 두 전자의 일반적인 움직임과 구별하기 위해 '물고기 갈고리' 화살표로 그려집니다.파괴 결합의 두 번째 전자는 또한 공격하는 라디칼 전자와 짝을 이루도록 이동하는데, 이 경우에는 명시적으로 표시되지 않습니다.
라디칼은 반응성 중간체로서 라디칼 부가 및 라디칼 치환에도 관여합니다.라디칼과 관련된 연쇄 반응은 보통 세 가지 뚜렷한 과정으로 나눌 수 있다.이들은 시작, 전파 및 종료입니다.
- 개시 반응은 라디칼의 수가 순증하는 반응입니다.이들은 위의 반응 1에서와 같이 안정적인 종에서 라디칼의 형성을 수반하거나 더 많은 라디칼을 형성하기 위해 안정적인 종과 라디칼의 반응을 수반할 수 있다.
- 전파 반응은 라디칼의 총 수가 동일한 라디칼을 포함하는 반응입니다.
- 종료 반응은 라디칼의 수가 순감하는 반응이다.일반적으로 두 개의 라디칼이 결합되어 보다 안정적인 종을 형성합니다. 예를 들어 다음과 같습니다.
- 2• Cl → Cl2
「 」를 참조해 주세요.
- 프리 래디컬 리서치
레퍼런스
- ^ IUPAC 골드북 래디컬(프리래디컬) PDF Wayback Machine에서 2017-03-02 아카이브 완료
- ^ Hayyan, M.; Hashim, M.A.; Anjkut, I.M. (2016). "Superoxide Ion: Generation and Chemical Implications". Chem. Rev. 116 (5): 3029–85. doi:10.1021/acs.chemrev.5b00407. PMID 26875845.
- ^ a b c d Clayden, Jonathan; Greeves, Nick; Warren, Stuart G. (2012). Organic chemistry (2nd ed.). Oxford: Oxford University Press. ISBN 978-0-19-927029-3. OCLC 761379371.
- ^ "Diacyl Peroxides". polymerdatabase.com. Retrieved 2020-12-08.
- ^ "IV. Nonchain Reactions: Radical Formation by Electron Transfer". Chemistry LibreTexts. 2015-01-21. Retrieved 2020-12-08.
- ^ "II. Atom Abstraction". Chemistry LibreTexts. 2015-01-11. Retrieved 2020-12-08.
- ^ "Radical Additions: Anti-Markovnikov Product Formation". Chemistry LibreTexts. 2013-10-02. Retrieved 2020-12-08.
- ^ Su, Wei-Fang (2013), Su, Wei-Fang (ed.), "Radical Chain Polymerization", Principles of Polymer Design and Synthesis, Lecture Notes in Chemistry, Berlin, Heidelberg: Springer, vol. 82, pp. 137–183, doi:10.1007/978-3-642-38730-2_7, ISBN 978-3-642-38730-2
- ^ Griller, David; Ingold, Keith U. (1976). "Persistent carbon-centered radicals". Accounts of Chemical Research. 9: 13–19. doi:10.1021/ar50097a003.
- ^ a b Forrester, A.R. (1968). Organic Chemistry of Stable Free Radicals. London: Academic Press. pp. 1–6.
- ^ Oakley, Richard T. (1988). "Cyclic and Heterocyclic Thiazenes" (PDF). Progress in Inorganic Chemistry. Cyclic and Heterocyclic Thiazenes (section). Progress in Inorganic Chemistry. Vol. 36. pp. 299–391. doi:10.1002/9780470166376.ch4. ISBN 978-0-470-16637-6. Archived from the original (PDF) on 2015-09-23. Retrieved 2011-03-31.
- ^ Rawson, J; Banister, A; Lavender, I (1995). Advances in Heterocyclic Chemistry. The Chemistry of Dithiadiazolylium and Dithiadiazolyl Rings (section) =. Advances in Heterocyclic Chemistry. Vol. 62. pp. 137–247. doi:10.1016/S0065-2725(08)60422-5. ISBN 978-0-12-020762-6.
- ^ 그러나 상사성은 반드시 급진적인 성격을 의미하는 것은 아니다.
- ^ Linde, C.; Åkermark, B.; Norrby, P.-O.; Svensson, M. (1999). "Timing is Critical: Effect of Spin Changes on the Diastereoselectivity in Mn(Salen)-Catalyzed Epoxidation". Journal of the American Chemical Society. 121 (21): 5083–84. doi:10.1021/ja9809915.
- ^ Broderick, J.B.; Duffus, B.R.; Duschene, K.S.; Shepard, E.M. (2014). "Radical S-Adenosylmethionine Enzymes". Chemical Reviews. 114 (8): 4229–317. doi:10.1021/cr4004709. PMC 4002137. PMID 24476342.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Pacher P, Beckman JS, Liaudet L (2007). "Nitric oxide and peroxynitrite in health and disease". Physiol. Rev. 87 (1): 315–424. doi:10.1152/physrev.00029.2006. PMC 2248324. PMID 17237348.
- ^ Njie-Mbye, Ya Fatou; Kulkarni-Chitnis, Madhura; Opere, Catherine A.; Barrett, Aaron; Ohia, Sunny E. (2013). "Lipid peroxidation: pathophysiological and pharmacological implications in the eye". Frontiers in Physiology. 4: 366. doi:10.3389/fphys.2013.00366. PMC 3863722. PMID 24379787.
- ^ Floyd, R.A. (1999). "Neuroinflammatory processes are important in neurodegenerative diseases: An hypothesis to explain the increased formation of reactive oxygen and nitrogen species as major factors involved in neurodegenerative disease development". Free Radical Biology and Medicine. 26 (9–10): 1346–55. doi:10.1016/s0891-5849(98)00293-7. PMID 10381209.
- ^ 생물학에서 라디칼의 역할과 그들의 검출에서 전자 스핀 공명의 사용에 대한 개요는 다음에서 찾을 수 있다.
- ^ Rajamani Karthikeyan; Manivasagam T; Anantharaman P; Balasubramanian T; Somasundaram ST (2011). "Chemopreventive effect of Padina boergesenii extracts on ferric nitrilotriacetate (Fe-NTA)-induced oxidative damage in Wistar rats". J. Appl. Phycol. 23 (2): 257–63. doi:10.1007/s10811-010-9564-0. S2CID 27537163.
- ^ Mukherjee, P.K.; Marcheselli, V.L.; Serhan, C.N.; Bazan, N.G. (2004). "Neuroprotecin D1: A docosahexanoic acid-derived docosatriene protects human retinal pigment epithelial cells from oxidative stress". Proceedings of the National Academy of Sciences of the USA. 101 (22): 8491–96. Bibcode:2004PNAS..101.8491M. doi:10.1073/pnas.0402531101. PMC 420421. PMID 15152078.
- ^ Lyons, MA; Brown, AJ (1999). "7-Ketocholesterol". Int. J. Biochem. Cell Biol. 31 (3–4): 369–75. doi:10.1016/s1357-2725(98)00123-x. PMID 10224662.
- ^ Serpone, N; Salinaro, A; Emeline, AV; Horikoshi, S; Hidaka, H; Zhao, JC (2002). "An in vitro systematic spectroscopic examination of the photostabilities of a random set of commercial sunscreen lotions and their chemical UVB/UVA active agents". Photochemical & Photobiological Sciences. 1 (12): 970–81. doi:10.1039/b206338g. PMID 12661594.
- ^ Njie-Mbye, Ya Fatou; Kulkarni-Chitnis, Madhura; Opere, Catherine A.; Barrett, Aaron; Ohia, Sunny E. (2013). "Lipid peroxidation: pathophysiological and pharmacological implications in the eye". Frontiers in Physiology. 4: 366. doi:10.3389/fphys.2013.00366. PMC 3863722. PMID 24379787.
- ^ Kharasch, M. S. (1933). "The Peroxide Effect in the Addition of Reagents to Unsaturated Compounds. I. The Addition of Hydrogen Bromide to Allyl Bromide". Journal of the American Chemical Society. 55 (6): 2468–2496. doi:10.1021/ja01333a041.
- ^ Yan, M; Lo, JC; Edwards, JT; Baran, PS (2016). "Radicals: Reactive Intermediates with Translational Potential". J Am Chem Soc. 138 (39): 12692–12714. doi:10.1021/jacs.6b08856. PMC 5054485. PMID 27631602.
- ^ G. 헤르츠베르크(1971), "단순 유리기의 스펙트럼과 구조", ISBN 0-486-65821-X.
- ^ 2007-07-16년 웨이백 머신에서 아카이브된 제28회 프리라디칼 국제 심포지엄.










![{\displaystyle {\ce {NO2 ->[h \nu] NO + O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5da627b27ee3e5b4dc45b156c54a91e1d79ffbd1)

![{\displaystyle {\ce {NO2 + O2 ->[h \nu] NO + O3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eae7fc4c91c01822b8db1423a88911a1eb56a171)

![{\displaystyle {\ce {CFCS->[h\nu ]Cl^{\bullet }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bdfdc999e29261e922e3863cdfa3b4bf84fb5a2)

![{\displaystyle {\ce {O3 ->[h \nu] O + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3acd85b4a5f671e0a421576bf91c3352bec070c1)

![{\displaystyle {\ce {2O3 ->[h \nu] 3O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afc621f0abb1c9cfc08b3cf82f43d9fc60a29c40)