전세대 후생유전 상속
Transgenerational epigenetic inheritance
전세대 후생유전학은 후생유전학 표지를 한 유기체에서 다음 유기체(즉, 부모에서 자식까지)로 전달하는 것으로, DNA의 일차구조(즉, 뉴클레오티드의 순서)[2]: 168 [3]를 바꾸지 않고 자손의 특성에 영향을 미친다. 즉 후생유전학적으로 말이다. 덜 정확한 용어 "유전적 유산"은 세포-세포-조직-조직-정보 전송을 모두 포함할 수 있다. 비록 이 두 단계의 후생유전적 유전이 단세포 유기체에서는 동등하지만, 다세포 유기체에서는 뚜렷한 메커니즘과 진화적 구분이 있을 수 있다.
환경적 요인은 후생유전학적으로 영향을 받은 일부 특징에 대해 후생유전학 마크(후생유전학 태그)를 유도할 수 있는 반면,[2][2] 일부에서는 후생유전학으로 현대 생물학이 더 이상 이전처럼 강하게 후생적 특성(라마르크주의)의 상속을 거부하지 않는다는 점을 고려하게 된다.[3]
후생유전 범주
후생유전적 수정의 4가지 일반 범주가 알려져 있다.[4]
- 예를 들어, 유전자의 mRNA 또는 단백질 제품이 유전자의 전사를 자극하는 자생적 대사 루프. 칸디다 알비칸의 Wor1 유전자;[5]
- 부모의 템플릿 또는 비계 구조를 사용하여 구조물을 복제하는 구조 템플리트(예: 시토골격계 구조물의 방향 및 구조, 실리아 및 플라겔라,[6] 프리온, 정상 단백질의 구조를 자신의 구조와 일치하도록 변경하여 복제하는 단백질).[7]
- 예를 들어, 메틸 또는 아세틸 그룹이 DNA 뉴클레오티드 또는 히스톤에 결합하여 유전자 표현 패턴을 변경하는 염색질 표시. 아래에 설명된 리나리아 로코티스의 Lcyc 유전자.
- 작은 RNA 가닥이 DNA의 전사나 mRNA의 변환에 간섭(RNAi)하는 RNA 사일런스(RNA silencing)는 주로 새너하브염 선충에서 몇 가지 연구에서만 알려져 있다.[8]
후생유전 마크 상속
후생유전자 표지를 계승하는 형태는 다양하지만 후생유전자 표지의 상속은 생식선을 이용하여 후생유전자 정보를 보급하는 것으로 요약할 수 있다.[9] 더욱이 후생적 변화는 일반적으로 네 가지 일반적인 형태 중 하나를 취하지만 아직 해명되지 않은 다른 형태도 있다. 현재 자생적 피드백 루프, 공간 템플팅, 염색질 표시, RNA 매개 경로 등은 개별 세포의 에피겐을 수정한다. 다세포 유기체 내의 후생적 변화는 내생적이거나 외생적이다.[10] 내생성은 세포-세포 신호(예: 세포 분화 초기 개발 중)에 의해 생성되는 반면 외생성은 환경 단서에 대한 세포 반응이다.
제거 대 보존
성적으로 재생산하는 유기체의 경우, 세포 내의 후생유전적 수정의 상당 부분은 감수분열(예: FLC locus의 표시) 중에 재설정되지만(예: FLC locus에서의 식물 번식을[11] 제어하는 표시) 일부 후생유전적 반응은 보존된 것으로 나타났다(예: 식물의[11] 트랜스포손 메틸레이션). 제거 또는 보존 메커니즘의 기초적인 모성 또는 부성 편향으로 인한 후생유전적 마크의 차등 상속은[12] 동물과 식물에서 발생지 효과의 일부 부모에게 후생유전적 인과관계를 할당하게 할 수 있다.[13]
재프로그래밍
포유류에서 후생유전적 자국은 라이프사이클의 두 단계 동안 지워진다. 첫째는 수정 직후에, 둘째는 발달하는 원시 세균 세포에서, 미래 생식세포에 전구체가 생긴다.[2] 수정하는 동안 남성과 여성 생식체는 게놈의 다른 구성과 다른 세포 주기 상태에서 결합한다. 수컷의 후생적 자국은 빠르게 희석된다. 첫째, 수컷 DNA와 관련된 양성자는 암컷의 세포질에서 나온 히스톤으로 대체되는데, 대부분은 암컷의 세포질에서 아세틸화된 히스톤이 풍부하거나 수컷 DNA를 아세틸화된 히스톤에 우선 결합하여 아세틸화된다.[14][15] 둘째, 남성의 DNA는 많은 유기체에서 조직적으로 데메틸화되는데,[16][17] 아마도 5-히드록시메틸시토신을 통해서일 것이다. 그러나 일부 후생유전학적 흔적, 특히 모성 DNA 메틸레이션은 이러한 재프로그래밍에서 벗어날 수 있으며 이는 부모의 각인으로 이어진다.
원시 세균 세포(PGC)에서는 후생유전학적 정보가 더 광범위하게 삭제된다. 그러나 일부 희귀 사이트는 DNA 메틸화의 삭제를 피할 수도 있다.[18] 후생유전학적 표시가 zygotic 및 PGC 재프로그래밍 이벤트 중 모두 소거를 회피하는 경우, 이는 전세대 후생유전학을 활성화할 수 있다.
초기 발생기 발생 시 세포선 정체성의 확립과 고정화에 후생유전자 프로그래밍의 중요성을 인식한 것이 최근 후생유전자 프로그래밍의 인위적 제거에 대한 관심을 자극하고 있다.[19] 후생적 조작은 줄기세포나 세포의 토티포텐도를 더 일반적으로 회복시켜 재생의학을 일반화할 수 있다.
보유
세포 메커니즘은 일부 후생유전학적 마크의 동시 전송을 허용할 수 있다. 복제하는 동안 선행 및 후행 가닥에 작용하는 DNA 중합체는 세포핵항원증증증식세포핵항원(PCNA)에 의해 결합되는데, 후생유전학적 마크의 복사 충실도를 허용하는 패터닝과 스트랜드 크로스스토크에도 관여해왔다.[20][21] 히스톤 수정 복사 충실도에 대한 연구는 모델 단계에 머물렀지만, 초기 노력으로 새로운 히스톤의 수정이 구 히스톤의 수정에 패턴이 적용되고 새 히스톤과 구 히스톤이 두 딸 DNA 가닥 사이에서 무작위로 분류된다는 것을 시사했다.[22] 다음 세대로의 이양에 관해서는, 위에서 기술한 바와 같이 많은 표시가 제거된다. 새로운 연구들은 후생유전학적 보존의 패턴을 세대에 걸쳐 찾아내고 있다. 예를 들어, 중심 위성은 디메틸화에 저항한다.[23] 히스톤의 메틸화가 기여할 수 있다는 일부 증거가 제시되지만, 이러한 보존을 책임지는 메커니즘은 알려져 있지 않다.[23][24] 배아에서 유전자 발현 이상 조절과 관련된 촉진자 메틸레이션 타이밍의 조절 오류도 확인되었다.[25]
썩다
주어진 100 염기 유전자의 돌연변이율은 세대당 10일−7 수 있는 반면, 에피겐은 세대당 여러 번 "교정"되거나 여러 세대에 걸쳐 고정될 수 있다.[26] 이것은 의문을 제기한다: 인식 빈도의 변화가 진화를 구성하는가? 표현형(즉, 3세대 미만으로 지속)에 대한 후생유전학적 영향을 빠르게 감소시키면 유전자형과 환경을 고려한 후 표현형의 잔류 변동을 설명할 수 있다. 그러나 이러한 단기적 효과와 초기 온톨로지에 대한 모성 환경의 영향을 구분하는 것은 과제로 남아 있다.
표현형식에 대한 기여
유전적 유산과 후생적 유산의 상대적 중요성은 논쟁의 대상이 된다.[27][28] 표현형식의 후생유전적 수정 사례 수백 건이 발표됐지만, 실험실 환경 밖에서 진행된 연구는 거의 없었다.[29][30][31] 따라서 자연선택에서 환경의 중심적 역할에도 불구하고 유전자와 에피겐의 환경과의 상호작용을 추론할 수 없다. 후생유전적 메커니즘을 조작하기 위한 실험 방법론은 초기 단계([32]예:)이며 유전자형, 환경 및 후생유전형의 상대적 기여도를 명시적으로 시험하는 연구가 실행 가능하기 전에 엄격한 실증실험이 필요하다.
식물에서

식물에서의 전세대 후생유전유전에 관한 연구는 빠르면 1950년대에 보고되었다.[33] 이것의 가장 초기적이고 가장 특징적인 예들 중 하나는 maize에서의 b1 파라메타레이션이다.[33][34][35][36][37][38][39][40] b1 유전자는 안토시아닌 생산 경로에 관여하는 기본적인 나선형-루프-헬릭스 전사 인자를 인코딩한다. b1 유전자가 발현되면 그 식물은 안토시아닌을 조직 내에 축적하여 그 조직들이 자주색으로 변하게 된다. B-I alle(B-Intense의 경우)은 b1의 발현이 높아서 피복과 허드조직의 색소가 검게 착색되는 반면, B'(B-prime) alle은 b1의 발현이 낮아서 그 조직에서 색소침착이 적다.[41] 동질 B-I 부모를 동질 B'로 교차시키면 그 결과 F1 자손은 모두 b1의 유전자 침묵으로 인한 낮은 색소 침착을 나타낸다.[33][41] 뜻밖에도 F1 발전소가 자가 교차할 때 그 결과 F2 발전은 모두 색소 침착이 낮고 b1 발현 수준이 낮다. 게다가, 어떤 F2 발전소(B-I의 유전적으로 동일한 결합을 포함하는 것 포함)가 동질 B-I로 교차될 때, 자손은 모두 b1의 낮은 색소 침착과 발현을 보일 것이다.[33][41] F2 유전에서 어두운 색소를 띤 개개인의 부족은 비멘델리아 유전자의 한 예로서 추가적인 연구는 B-I 알레르기가 후생유전학적 메커니즘을 통해 B'로 변환된다는 것을 시사했다.[35][36] B'와 B-I 알레르기는 DNA 염기서열 수준에서 동일하지만 핵 내에서 DNA 메틸화, siRNA 생성, 염색체 상호작용 수준이 다르기 때문에 후피알레스로 간주된다.[39][42][38][37] 또한 RNA 유도 DNA-메틸화 경로의 구성 요소에 결함이 있는 식물은 B-I와 유사한 B의 개체에서 b1의 발현이 증가하지만, 이러한 성분이 복원되면 식물은 낮은 발현 상태로 되돌아간다.[40][43][44][45] B-I에서 B'로 자발적 변환이 관찰되었지만, B'에서 B-I(녹색에서 보라색으로)로의 회귀는 50년 동안 관찰된 적이 없으며, 온실 실험과 현장 실험 모두에서 수천 개의 식물이 관찰된 적이 없다.[46]
식물에서 환경적으로 유도된 전세대 후생유전유전의 사례도 보고되었다.[47][48][49] 가뭄 시뮬레이션 치료제에 노출된 벼가 비건조 처리 식물에 비해 단씨 강하에 의한 11세대의 노출과 전파 후 가뭄에 대한 내성이 높아진 사례도 있다.[47] 가뭄 내성 차이는 게놈 전체에 걸친 DNA-메틸화 수준의 방향적 변화와 연관되어 DNA-메틸화 패턴의 스트레스 유발 유전적 변화가 반복적인 스트레스에 적응하는 데 중요할 수 있음을 시사했다.[47] 또 다른 연구에서는 여러 세대에 걸쳐 적당한 애벌레 초식물에 노출된 식물은 초식동물의 압력이 부족한 식물에 비해 (애벌레 건조량으로 측정했을 때) 다음 세대에 걸쳐 초식동물에 대한 저항력이 높아졌다.[48] 이러한 초식동물 저항의 증가는 한 세대에 걸쳐 반응이 전달되었음을 암시하는 초식동물의 노출 없이 성장한 후에도 지속되었다.[48] 보고서는 RNA가 주도하는 DNA-메틸화 경로의 구성요소가 세대에 걸친 저항 증가와 관련이 있다고 결론지었다.[48] 전세대 후생유전학은 폴리플로이드 식물에서도 관찰되었다. 유전적으로 동일한 역수 F1 하이브리드 3배형성은 실행 가능한 F2 종자 개발에 대한 세대간 후생유전학적 영향을 보여주는 것으로 나타났다.[50]
인간에게
표현형 결과를 설명할 때는 유전적 유산이 중요하지만, 왜 자손이 부모를 닮았는지 완전히 설명할 수는 없다. 유전자를 제외하고, 자손들은 이전 세대들에 의해 확립된 유사한 환경 조건을 물려받게 된다.[9]
인간의 자손이 9개월 동안 공통적으로 공유하는 한 가지 환경은 자궁이다. 태아발달의 기간을 고려하면, 모태의 환경은 자손의 건강에 오래 지속되는 영향을 미칠 수 있다.[9]
자궁 내의 환경이 자손의 건강에 어떤 영향을 미칠 수 있는가를 보여주는 예로는 네덜란드의 굶주린 겨울과 그 인과관계가 유도된 전세대 후생유전 유전병에 미치는 것이다.[9]
많은 연구들이 1944-45년의 네덜란드 기근을 포함한 인간에게 전세대 후생유전유전의 존재를 시사하고 있다.[2]
네덜란드의 굶주린 겨울 동안, 기근 기간 동안 태어난 자식은 기근 전 해에 태어난 자들보다 더 작았다. 이 기근이 개발에 미친 영향은 2대까지 지속되었다.
더욱이 기근기에 태어난 자손은 성인기에 포도당 과민증의 위험이 증가하는 것으로 나타났다.[51]
자궁 내 기근에 노출된 성인 여성 자손에게서 차등 DNA 메틸화가 발견됐지만, 이러한 DNA 메틸화의 차이가 생식선에 전달됐는지는 알 수 없다.[51]
PIM3 유전자를 억제하는 것이 후대에 신진대사를 더디게 했을 수 있다는 가설이 있으나 인과관계는 증명되지 않고 단지 상관관계일 뿐이다.[52] 이 현상을 네덜란드 헝거 윈터 증후군이라고도 한다.
게다가 네덜란드 굶주린 겨울 동안 F1과 F2 세대들의 건강에 대한 대사 질환, 심혈관 질환, 그 밖의 위험 요소들의 증가율은 "태아 프로그래밍"이라고 불리는 알려진 현상인데, 이것은 자궁 내 해로운 환경 요인에 노출되어 발생한다.[9]
또 다른 연구는 Y염색체의 후생유전적 변화가 남북전쟁에서 전쟁 포로의 남자 후손들 사이의 수명 차이를 설명할 수 있다는 가설을 세웠다.
외베르칼릭스 연구는 성별에 따른 효과에 주목했다; 일찍 담배를 피우기 시작한 아버지들의 아들이 아닌 9년 동안 더 큰 체질량 지수(BMI)를 보였다.
친할아버지의 식량공급은 손녀가 아닌 손자의 사망률 RR에 연결되었을 뿐이다. 친할머니의 식량공급은 손녀들의 사망위험률과 관련이 있을 뿐이었다. 할머니가 좋은 식량을 공급받았을 때 사망률은 2배 더 높았다.
이러한 세대간 상속은 저성장기(SGP) 동안 노출과 함께 관찰되었다. SGP는 환경적 요인이 신체에 더 큰 영향을 미치는 사춘기가 시작되기 전 시기다. 이 연구에서 선조의 SGP는 남자아이는 9-12세, 여자아이는 8-10세 사이로 정해졌다. 이것은 양쪽 조부모의 SGP에서, 또는 임신 기간/할머니의 유아 생활에서 발생했지만, 조부모의 사춘기 때는 발생하지 않았다.
아버지의 부족한 식량 공급과 어머니의 좋은 식량 공급은 심혈관 사망의 낮은 위험과 관련이 있었다.[51][52]
프레이더-윌리 증후군이나 엔젤만 증후군을 일으키는 유전적 표현의 상실은 어떤 유전적 돌연변이를 수반하는 것이 아니라 양쪽의 대립에 대한 후생적 변화(또는 "진동")에 의해 야기되는 것으로 밝혀졌다. 모든 19가지 유익한 사례에서, 생리학적 각인 및 따라서 다른 알레르기의 침묵과 함께 이러한 신드롬을 유발하는 인식은 특정한 부모 및 조부모의 기원을 가진 염색체에 국부화되었다.
구체적으로는 아버지로부터 파생된 염색체가 SNURF-SNRPN에서 비정상적인 모성 마크를 지니고 있었으며, 이 이상 마크는 친할머니에게서 물려받은 것이었다.[51]
마찬가지로, MLH1 유전자에 대한 인식은 유전성 비폴리포증 대장암의 표현형을 가진 두 개인에서 발견되었고, 그렇지 않으면 질병을 유발하는 어떠한 솔직한 MLH1 돌연변이도 없었다. 같은 경구들이 한 개인의 정자조아에서도 발견되었는데, 이는 자손에게 전달될 가능성을 나타낸다.[51]
MLH1 유전자에 대한 인식 외에, 유방암과 같은 특정 암이 자궁 내 태아 단계에서 발생할 수 있다는 것이 확인되었다.[53]
나아가 모델 시스템(즉 동물)을 활용한 다양한 연구에서 수집된 증거에 따르면, 부모 세대 동안의 노출은 유방암의 다세대 및 전세대 유산을 초래할 수 있다.[53]
더 최근에, 연구는 임신 전 부성 식이요법을 통한 남성 생식 세포의 적응과 자손 발달에서의 유방암 규제 사이의 연관성을 발견했다.[53] 좀 더 구체적으로, 연구는 유방암의 세대간 후생유전유전학과 조상의 소화 성분 또는 출생 체중과 같은 관련 지표 사이의 관계를 강조하는 새로운 데이터를 밝혀내기 시작했다.[53]
쥐와 같은 모델 시스템을 활용함으로써 임신 당시 부성비만을 자극하면 부성균선을 후생적으로 변화시킬 수 있다는 연구결과가 나왔다. 부성 세균선은 태어날 때 딸의 몸무게와 딸이 유방암에 걸릴 가능성을 조절하는 역할을 한다.[54]
게다가, 남성 생식선의 miRNA 표현 프로파일에 대한 수정은 체중의 증가와 연관되어 있는 것으로 밝혀졌다.[54] 또한, 부성 비만은 발암물질에 의한 유방 종양을 발병시키는 여성 자손의 비율을 증가시켰는데, 이는 유방 MiRNA 발현에 의한 것이다.[54]
전세대 후생유전유전의 효과와 관련된 암 관련 고통과는 별도로, 전세대 후생유전유전은 최근 폐동맥고혈압(PAH)의 진행에 관여하고 있다.[55]
최근의 연구들은 PAH에 대한 현재의 치료법이 이 질병과 관련된 불규칙한 표현형을 복구하지 못하기 때문에 PAH의 진행에 있어 전세대 후생유전유전이 관련될 가능성이 높다는 것을 발견했다.[55] 현재의 PAH 치료법은 혈관조영제 및 항혈전 보호제를 사용하여 PAH의 증상을 교정하려고 시도했지만, 두 가지 모두 PAH와 관련된 손상된 표현형식과 관련된 합병증을 효과적으로 완화하지 못했다.[55] Vasodilator와 항혈전 보호제가 PAH를 교정할 수 없다는 것은 PAH의 진행이 여러 변수에 의존하고 있음을 시사하며, 이는 전세대 후유전유전의 결과일 가능성이 높다.[55]
구체적으로는 전세대 후생유전학이 혈관 리모델링과 관련된 표현적 변화와 연계되어 있다고 생각된다.[55] 예를 들어 임신 중 저산소증은 태아 발달 초기 단계에서 해로울 수 있는 전세대 후생유전학적 변화를 유도하고 성인으로서 PAH를 개발할 가능성을 높일 수 있다.[55]
태아 발달 중 전세대 후생유전학의 잠재적 영향을 고려하는 것은 태아 프로그래밍의 개념과 관련이 있는 성인병(FOAD) 가설의 태아 기원에서 비롯된다.[55]
저산소 상태는 PAH와 관련된 전세대 후생유전 분산을 유도할 수 있지만, 다양한 모성 위험 요인이 PAH의 최종 진행과 연관되어 있다는 것을 뒷받침하는 강력한 증거가 있다.[55] 후기성 PAH와 연관된 그러한 모성 위험요인에는 태반 기능장애, 고혈압, 비만, 그리고 혈압증 등이 포함된다.[55] 이러한 모성 위험 요소와 환경 스트레스 요인은 전세대 후생유전학적 변화와 결합되어 태아기 동안 혈관 발달과 관련된 신호 경로에 대한 장기간 모욕을 유발할 수 있으며, 따라서 PAH를 가질 가능성이 높아진다.[55]
한 연구는 "성적 접촉, 심각한 신체적 학대 및/또는 심각한 방치"로 정의되는 아동 학대가 글루코코르티코이드 수용체 발현에 후생유전적 변화를 초래한다는 것을 보여주었다.[56][57]
글루코르티코이드 수용체 표현은 저혈당-피티하수체-아드레날린(HPA) 활동에서 중요한 역할을 한다. 또한, 동물 실험에서는 후생유전학적 변화가 출생 후 모유전자의 상호작용에 따라 달라질 수 있다는 것을 보여주었다.[58]
게다가, 임신 중 모성 스트레스와 십대/그들의 어머니들의 메틸화의 상관관계를 조사한 최근의 연구는 임신 중 학대를 당한 여성의 자녀들이 메틸화된 글루코코르티코이드 수용체 유전자를 가지고 있었을 가능성이 더 높다는 것을 발견했다.[59] 따라서 메틸화 글루코르티코르티코이드 수용체 유전자를 가진 아이들은 스트레스에 대한 반응 변화를 경험하게 되고, 궁극적으로 불안감을 경험할 가능성이 더 높아지게 된다.[59]
내분비 교란제인 디에틸스틸베스트롤(DES)의 효과를 조사한 추가 연구 결과 DES에 노출된 여성의 손주(3세대)가 주의력 결핍/과잉행동장애(ADHD)에 걸릴 확률을 크게 높인 것으로 나타났다.[60] 임신 중 DES와 같은 내분비 교란제에 노출된 여성이 다세대 신경 발달 결손과 연관될 수 있기 때문이다.[60]
게다가, 동물 연구는 내분비 교란물이 세균 세포와 신경 발달에 심대한 영향을 미친다는 것을 보여준다.[60] DES의 다세대 충격의 원인은 아직 결정되지 않았지만 세균선의 후생유전적 재프로그래밍과 관련된 생물학적 과정의 결과로 가정된다.[60]
피트니스에 미치는 영향
후생유전유전은 선택하에서의 특성을 예측할 수 있게 변화시키는 경우에만 적합성에 영향을 미칠 수 있다. 환경 자극이 에피겐의 변화에 중요한 요인이라는 증거가 전달되었다. 아이러니하게도 다윈의 진화는 이러한 신-라마키아의 후천적 특성뿐만 아니라 이들을 생성하는 세포 메커니즘(예: 메틸전달효소 유전자)에도 작용할지 모른다. 후생유전은 중간 시간 계산에서 환경 변화를 다루는 유기체에 건강상 이익을 줄 수 있다.[61] 짧은 사이클링의 변화는 DNA로 인코딩된 규제 프로세스를 가질 가능성이 높은데, 이는 자손이 수명 동안 여러 번 변화에 반응해야 할 확률이 높기 때문이다. 반면에 자연 선택은 더 긴 자전거 환경 변화에 대한 변화를 경험하는 사람들에게 영향을 미칠 것이다. 이러한 경우, 다음 세대의 후생유전적 프라이밍이 대부분의 간격(예: 환경에 대한 잘못된 정보)에 걸쳐 피트니스에 유해한 경우, 이러한 유전자형과 후생유전형은 상실된다. 중간 시간 주기의 경우, 환경에 대응할 수 있는 유전적 구조가 결여된 개인에게 상당한 선택적 압박 없이 자손이 유사한 환경에 직면할 확률은 충분히 높다. 자연적으로 짧고 중간이고 긴 환경 주기의 절대적 길이는 생물의 특성, 후생적 기억의 길이, 생성 시간에 따라 달라질 것이다. 후생적 피트니스 효과에 대한 해석의 상당 부분은 후생성이 표현형의 중요한 기여자라는 가설을 중심으로 하고 있으며, 이는 아직 해결되지 않고 있다.
해로운 영향.
유전되는 후생유전학적 표시는 건강의 중요한 요소를 조절하는 데 중요할 수 있다. 예를 들어 식물에서 리나리아 로코티스의 Lcyc 유전자는 꽃의 대칭을 조절한다. 리나에우스는 처음에 방사상 대칭 돌연변이를 설명했는데, 이것은 Lcyc가 심하게 메틸화되었을 때 발생한다.[62] 꽃모양의 중요성이 꽃가루 매개체에 미치는 영향에 따라 Lcyc 호몰로게이션(예: 사이클로이데아)의 메틸레이션은 식물 적합성에 해로운 영향을 미칠 수 있다.[63] 동물들에서는 유전된 후생유전학적 자국이 질병에 대한 민감성을 증가시킬 수 있다는 많은 연구결과가 있다. 전세대 후생유전학적 영향 또한 인간의 질병, 특히 암에 기여하는 것으로 제안된다. 유전자 촉진제에서의 종양 메틸레이션 패턴은 가족의 암 역사와 긍정적인 상관관계가 있는 것으로 나타났다.[64] 더욱이 MSH2 유전자의 메틸화는 초기온셋 대장암과 자궁내막암과 상관관계가 있다.[65]
putatively adaptive effects
실험적으로 모델 유기체 아라비도시스 탈리아나의 데메틸화 씨앗은 사망률, 성장 저해, 개화 지연, 하과일 세트가 현저하게 높아 에피겐이 체력을 높일 수 있음을 나타낸다.[66] 더욱이, 스트레스에 대한 환경적으로 유도된 후생유전적 반응은 유전되고, 건강과 긍정적인 상관관계가 있는 것으로 나타났다.[67] 동물에서, 공동 보금자리는 쥐의 행동을 변화시켜, 각각 자손의 생존과 자원(예: 먹이, 짝)에 대한 접근을 증가시키기 위해 가정된 부모의 돌봄 체제와[68] 사회적 능력을[69] 증가시킨다.
면책성 상속
2021년 포유류(미끼)에서 후생유전학적 변화를 통해 면역력이 어떻게 계승되는지를 처음으로 보여주었다.[70]
거시진화 패턴
표현형에 대한 유전적 후생유전학적 영향은 박테리아, 양성자, 곰팡이, 식물, 네마토드, 과일파리 등에서 잘 입증되었다.[29][9] 후생유전유전에 대한 체계적인 연구가 실시되지 않았지만(대부분 모범생물에 초점을 맞춘다), 이러한 유전 방식이 동물보다 식물에서 더 중요하다는 예비 증거가 있다.[29] 동물성 세균선의 초기 분화는 후생유전학적 표시가 나중에 발생하는 것을 방지하는 반면, 식물에서는 곰팡이 체세포가 세균선에 통합될 수 있다.[71][72]
전세대 후생유전학은 특정 집단이 가변 환경에 쉽게 적응할 수 있도록 할 수 있다고 생각된다.[9] 특정 개체군에서 전세대 후생유전유전의 사례가 잘 문서화되어 있지만, 이와 같은 형태의 적응성이 포유류에게 적용되는가에 대한 의문이 있다.[9] 좀 더 구체적으로, 그것이 인간에게 적용되는 것인지에 대해 의문을 제기한다.[9] 최근 들어 쥐와 인간의 제한된 관찰을 활용한 대부분의 실험 모델은 두 유기체의 건강에 해로운 후생유전적 특성만을 발견했다.[9] 이러한 해로운 특징들은 심혈관 질환과 같은 질병의 위험 증가에서부터 조기 사망에 이르기까지 다양하다.[9] 그러나 이는 긍정적인 실험 효과와 반대로 부정적인 실험 효과를 탐지하기 쉽기 때문에 제한된 보고 편향을 전제로 할 수도 있다.[9] 더욱이 포유류에서 세균선의 진화적 성공과 발생 초기 단계에 필요한 상당한 후생유전적 재프로그래밍은 포유류에서 염색체 마크의 전세대 상속을 제한하는 잠재적인 원인일 수 있다.[9]
생활사 패턴은 후생유전유전의 발생에도 기여할 수 있다. Sessile 유기체, 낮은 분산 능력을 가진 유기체 및 단순한 행동을 가진 유기체는 후생유전학적 경로를 통해 자손에게 정보를 전달하는 것이 가장 유익할 수 있다. 또한 지리적 패턴이 나타날 수 있는데, 여기서 변동성이 높고 보존성이 높은 환경은 중요한 후생유전유전을 가진 종을 더 적게 유치할 수 있다.
논란
인간은 부모의 특성이 자손에게서 자주 보인다는 것을 오랫동안 인식해 왔다. 이러한 통찰은 동식물의 선택적 번식을 실질적으로 적용하도록 이끌었지만, 이러한 특성들이 어떻게 세대 간에 보존되고, 무엇이 변동을 일으키는가라는 상속의 중심적인 문제는 다루지 않았다. 진화 사상사에서 몇 가지 입장이 있었다.
혼합 대 미립자 상속
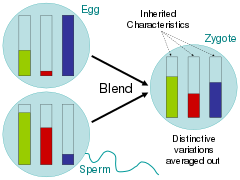
계몽주의 시대의 과학자들은 이와 관련된 질문들을 다루면서 대체로 부모의 특성이 서로 다른 색깔의 페인트가 함께 섞이는 양동이처럼 자손에게 균일화된 혼합 가설을 주장하였다.[73] 찰스 다윈의 '종의 기원'에 대한 비평가들은 이러한 상속 계획 하에서, 변화가 곧 다수의 표현형식에 의해 늪에 빠질 것이라고 지적했다.[74] 페인트 버킷 유추에서, 이것은 두 가지 색상을 함께 섞은 다음 그 결과 색을 모색 중 한 가지 색과 20번만 섞으면 알 수 있을 것이다; 희귀한 변종 색은 빠르게 사라진다.
유럽 과학계 대부분에 알려지지 않은 그레고르 멘델 스님은 완두콩 식물과의 번식 실험을 통해 세대간 특성이 어떻게 유지되는가에 대한 문제를 해결했다.[75] 따라서 찰스 다윈은 멘델이 제안한 "부분적 유산"에 대해 알지 못했다. 멘델은 형질이 혼합되지 않고 우리가 현재 유전자라고 부르는 이산적인 단위로 자손들에게 전달되었다. 다윈은 자신의 사상과 멘델의 이론이 1930년대까지 통일되지 않았음에도 불구하고 혼합 가설을 거부하게 되었는데, 이 시기는 현대 합성이라 일컬어지는 시기였다.
선천적 특성과 후천적 특성의 상속
그의 1809년 저서 《철학 졸로기크》에서 장바티스트 라마르크([76]Jean-Baptiste Lamarck)는 각 종들이 그 형태와 환경 때문에 독특한 일련의 도전을 경험한다는 것을 인정했다. 따라서, 그는 가장 자주 사용되는 캐릭터들이 "신경성 액체를 축적할 것"이라고 제안했다. 그러한 후천적 축적은 개인의 자손에게 전달될 것이다. 현대적인 의미에서 자손에게 전달되는 신경 액체는 후생유전유전의 한 형태일 것이다.
이 사상의 본체가 알려지게 된 라마르크주의는 찰스 다윈과 알프레드 러셀 월리스가 1859년 자연선택에 의한 진화론을 공동제안했을 때 시간이 흐르면서 종들의 변화에 대한 표준적인 설명이었다. 다윈과 월리스의 이론에 대응하여, 비록 꼬리 길이에 아무런 영향을 미치지 않고 몇 세대에 걸쳐 쥐의 꼬리를 잘라낸 바이스만의 유명한[78] 실험으로 인해 라마르크의 열성이 상당 부분 가라앉았지만,[77] 수정된 신 라마르크주의는 소수의 생물학자들을 끌어들였다. 따라서 획득한 특성을 계승할 수 없다는 긴급한 공감대가 형성되었다.[2]
진화론 수정
그러나 비유전적 변동과 유산은 꽤 흔한 것으로 판명되었다. 20세기 근대 진화합성(멘델의 유전학과 자연선택을 통일하는 것)의 발달과 동시에 C. H. 와딩턴(1905~1975)은 발달 생물학과 유전학을 통일하기 위해 노력하고 있었다. 그렇게 하면서, 그는 배아 세포의 DNA가 동일한 1차 구조를 가지고 있음에도 불구하고 기능적으로 구별되는 세포 유형으로 배열된 분화를 나타내기 위해 "유전학"[79]이라는 단어를 채택했다.[80] 연구자들은 와딩턴의 후생유전학을 산발적으로 논했다. - 그것은 조사의 본체를 발전시키는 개념이라기 보다는 비유전 유전적 유전적 인물들을 곤혹스럽게 하는 데 있어서 더 큰 인기를 끌었다.[81][82] 결과적으로, 와딩턴의 단어의 정의는 발전적으로 신호되고 유전된 세포 전문화의 부분집합을 넘어 그 자체로 확대되었다.
일부 과학자들은 후생유전유전이 현대 합성의 토대를 손상시키는지에 대해 의문을 제기해왔다. 분자생물학의 중심 도그마(dogma)를 요약한 프랜시스 크릭은[83] "DNA는 히스톤[s]이 RNA와 단백질의 동시 합성을 위한 수동적 템플릿 역할을 할 수 있도록 히스톤[s]에 의해 구성된다"고 간결하게 말했다. 상세한 '정보'는 히스톤에 들어 있지 않다." 하지만 그는 "이 계획은 현재 실험 결과의 대부분을 설명해준다!"라고 말하면서 기사를 마감한다. 실제로 후생유전유전의 등장은 (진화발달, 표현형 가소성, 진화가능성, 시스템생물학의 연구의 진보에 더하여) 현대 진화합성의 현재의 틀을 긴장시켰고, 이전에 기각되었던 진화기전에 대한 재검토를 촉진시켰다.[84]
나아가 후생유전유전의 패턴과 살아있는 유기체에서의 후생유전적 코드의 진화적 함의는 라마크와 다윈의 진화론과 모두 연결되어 있다.[85] 예를 들어, 라마크는 환경적 요인이 유전적으로 표현형을 수정하는데 책임이 있다고 가정했는데, 이는 개발의 중요한 단계에서 환경적 요인에 노출되는 것이 세균선에 경각심을 유발하여 표현 편차를 증가시킬 수 있다는 구조를 뒷받침한다.[85] 이와는 대조적으로, 다윈의 이론은 자연 선택이 쉽게 적응할 수 있는 인구를 선호함으로써 생존하고 재프로덕션적으로 적합하게 유지되는 개체군의 능력을 강화시켰다고 주장했다.[85] 이 이론은 유전적 적응성에서 비롯되는 세대간 가소성 및 표현적 분산과 일치한다.[85]
또한 일부 후생유전적 변동성은 유익한 가소성을 제공할 수 있으므로 특정 생물이 변동하는 환경 조건에 적응할 수 있다. 그러나 세대간 후생유전적 정보의 교환은 후생유전적 이상을 초래할 수 있는데, 후생유전적 특성은 표준에서 벗어나는 후생유전적 특성이다. 따라서 부모 세대의 자식은 후생적 이상에 의해 특정 질병에 걸리기 쉽고 가소성이 감소될 수 있다. 새로운 환경에 직면했을 때 쉽게 적응할 수 있는 능력이 빠르게 번식할 수 있는 특정 종의 개체군에 이로울 수 있지만, 세대 차이가 긴 종은 그러한 능력의 혜택을 받지 못할 수도 있다. 만약 세대 차이가 더 긴 종들이 예상 환경에 적절하게 적응하지 못한다면, 그 종들의 자손의 생식 적합성은 줄어들 것이다.
에드워드 J 스틸, 로빈 A 린들리와 동료 [86][87][88][89][90]프레드 호일, N에 의한 주류 진화 이론에 대한 비판적인 논의가 있었다.찬드라 Wickramasinghe,[91][92][93]융성 Liu[94][95]데니스 Noble,[96][97]존 Mattick[98]고 다른 사람들로 하여금 직접적인 DNA변형뿐만 아니라 방금 설명한 간접적인, 즉 후생 유전학적, transmiss'ions,을 포함한 논리적 모순들뿐만 아니라 라마르크 학도 상속 효과 진화 생물학에는 전통적인 사고에 도전하다.인접한 필드입니다.
참고 항목
참조
- ^ Bradbury J (December 2003). "Human epigenome project--up and running". PLoS Biology. 1 (3): E82. doi:10.1371/journal.pbio.0000082. PMC 300691. PMID 14691553.
- ^ a b c d e f Moore DS (2015). The Developing Genome. Oxford University Press. ISBN 978-0-19-992234-5.[페이지 필요]
- ^ a b Heard E, Martienssen RA (March 2014). "Transgenerational epigenetic inheritance: myths and mechanisms". Cell. 157 (1): 95–109. doi:10.1016/j.cell.2014.02.045. PMC 4020004. PMID 24679529.
- ^ Jablonka E, Lamb MJ (2010). "Transgenerational epigenetic inheritance.". In Pigliucci M, Müller GB (eds.). Evolution, the expanded synthesis. MIT Press. ISBN 978-0-262-51367-8.
- ^ Zordan RE, Galgoczy DJ, Johnson AD (August 2006). "Epigenetic properties of white-opaque switching in Candida albicans are based on a self-sustaining transcriptional feedback loop". Proceedings of the National Academy of Sciences of the United States of America. 103 (34): 12807–12812. doi:10.1073/pnas.0605138103. PMC 1535343. PMID 16899543.
- ^ Beisson J, Sonneborn TM (February 1965). "Cytoplasmic inheritance of the organization of the cell cortex in Paramecium aurelia". Proceedings of the National Academy of Sciences of the United States of America. 53 (2): 275–282. Bibcode:1965PNAS...53..275B. doi:10.1073/pnas.53.2.275. PMC 219507. PMID 14294056.
- ^ Soto C, Castilla J (July 2004). "The controversial protein-only hypothesis of prion propagation". Nature Medicine. 10 (7): S63–S67. doi:10.1038/nm1069. PMID 15272271. S2CID 8710254.
- ^ Vastenhouw NL, Brunschwig K, Okihara KL, Müller F, Tijsterman M, Plasterk RH (August 2006). "Gene expression: long-term gene silencing by RNAi". Nature. 442 (7105): 882. Bibcode:2006Natur.442..882V. doi:10.1038/442882a. PMID 16929289.
- ^ a b c d e f g h i j k l m Horsthemke B (July 2018). "A critical view on transgenerational epigenetic inheritance in humans". Nature Communications. 9 (1): 2973. doi:10.1038/s41467-018-05445-5. PMC 6065375. PMID 30061690.
- ^ Duclos KK, Hendrikse JL, Jamniczky HA (September 2019). "Investigating the evolution and development of biological complexity under the framework of epigenetics". Evolution & Development. 21 (5): 247–264. doi:10.1111/ede.12301. PMC 6852014. PMID 31268245.
- ^ a b Bond DM, Finnegan EJ (May 2007). "Passing the message on: inheritance of epigenetic traits". Trends in Plant Science. 12 (5): 211–216. doi:10.1016/j.tplants.2007.03.010. PMID 17434332.
- ^ Morison IM, Reeve AE (1998). "A catalogue of imprinted genes and parent-of-origin effects in humans and animals". Human Molecular Genetics. 7 (10): 1599–1609. doi:10.1093/hmg/7.10.1599. PMID 9735381.
- ^ Scott RJ, Spielman M, Bailey J, Dickinson HG (September 1998). "Parent-of-origin effects on seed development in Arabidopsis thaliana". Development. 125 (17): 3329–3341. doi:10.1242/dev.125.17.3329. PMID 9693137.
- ^ Adenot PG, Mercier Y, Renard JP, Thompson EM (November 1997). "Differential H4 acetylation of paternal and maternal chromatin precedes DNA replication and differential transcriptional activity in pronuclei of 1-cell mouse embryos". Development. 124 (22): 4615–4625. doi:10.1242/dev.124.22.4615. PMID 9409678.
- ^ Santos F, Hendrich B, Reik W, Dean W (January 2002). "Dynamic reprogramming of DNA methylation in the early mouse embryo". Developmental Biology. 241 (1): 172–182. doi:10.1006/dbio.2001.0501. PMID 11784103.
- ^ Oswald J, Engemann S, Lane N, Mayer W, Olek A, Fundele R, et al. (April 2000). "Active demethylation of the paternal genome in the mouse zygote". Current Biology. 10 (8): 475–478. doi:10.1016/S0960-9822(00)00448-6. PMID 10801417.
- ^ Fulka H, Mrazek M, Tepla O, Fulka J (December 2004). "DNA methylation pattern in human zygotes and developing embryos". Reproduction. 128 (6): 703–708. doi:10.1530/rep.1.00217. PMID 15579587.
- ^ Hackett JA, Sengupta R, Zylicz JJ, Murakami K, Lee C, Down TA, Surani MA (January 2013). "Germline DNA demethylation dynamics and imprint erasure through 5-hydroxymethylcytosine". Science. 339 (6118): 448–452. Bibcode:2013Sci...339..448H. doi:10.1126/science.1229277. PMC 3847602. PMID 23223451.
- ^ Surani MA, Hajkova P (2010). "Epigenetic reprogramming of mouse germ cells toward totipotency". Cold Spring Harbor Symposia on Quantitative Biology. 75: 211–218. doi:10.1101/sqb.2010.75.010. PMID 21139069.
- ^ Zhang Z, Shibahara K, Stillman B (November 2000). "PCNA connects DNA replication to epigenetic inheritance in yeast". Nature. 408 (6809): 221–225. Bibcode:2000Natur.408..221Z. doi:10.1038/35041601. PMID 11089978. S2CID 205010657.
- ^ Henderson DS, Banga SS, Grigliatti TA, Boyd JB (March 1994). "Mutagen sensitivity and suppression of position-effect variegation result from mutations in mus209, the Drosophila gene encoding PCNA". The EMBO Journal. 13 (6): 1450–1459. doi:10.1002/j.1460-2075.1994.tb06399.x. PMC 394963. PMID 7907981.
- ^ Probst AV, Dunleavy E, Almouzni G (March 2009). "Epigenetic inheritance during the cell cycle". Nature Reviews. Molecular Cell Biology. 10 (3): 192–206. doi:10.1038/nrm2640. PMID 19234478. S2CID 205494340.
- ^ a b Morgan HD, Santos F, Green K, Dean W, Reik W (April 2005). "Epigenetic reprogramming in mammals". Human Molecular Genetics. 14 (Review Issue 1): R47–R58. doi:10.1093/hmg/ddi114. PMID 15809273.
- ^ Santos F, Peters AH, Otte AP, Reik W, Dean W (April 2005). "Dynamic chromatin modifications characterise the first cell cycle in mouse embryos". Developmental Biology. 280 (1): 225–236. doi:10.1016/j.ydbio.2005.01.025. PMID 15766761.
- ^ Taguchi YH (2015). "Identification of aberrant gene expression associated with aberrant promoter methylation in primordial germ cells between E13 and E16 rat F3 generation vinclozolin lineage". BMC Bioinformatics. 16 (Suppl 18): S16. doi:10.1186/1471-2105-16-S18-S16. PMC 4682393. PMID 26677731.
- ^ Richards EJ (May 2006). "Inherited epigenetic variation--revisiting soft inheritance". Nature Reviews. Genetics. 7 (5): 395–401. doi:10.1038/nrg1834. PMID 16534512. S2CID 21961242.
- ^ Jablonka E, Lamb MJ (1998). "Epigenetic inheritance in evolution". Journal of Evolutionary Biology. 11 (2): 159–183. doi:10.1046/j.1420-9101.1998.11020159.x. S2CID 55965463.
- ^ Bird A, Kirschner M, Gerhart J, Moore T, Wopert L (1998). "Comments on "Epigenetic inheritance in evolution"". Journal of Evolutionary Biology. 11 (2): 185–188, 213–217, 229–232, 239–240. doi:10.1046/j.1420-9101.1998.11020185.x.
- ^ a b c Jablonka E, Raz G (June 2009). "Transgenerational epigenetic inheritance: prevalence, mechanisms, and implications for the study of heredity and evolution". The Quarterly Review of Biology. 84 (2): 131–176. CiteSeerX 10.1.1.617.6333. doi:10.1086/598822. PMID 19606595. S2CID 7233550.
- ^ Rassoulzadegan M, Cuzin F (April 2015). "Epigenetic heredity: RNA-mediated modes of phenotypic variation". Annals of the New York Academy of Sciences. 1341 (1): 172–175. Bibcode:2015NYASA1341..172R. doi:10.1111/nyas.12694. PMID 25726734. S2CID 23244919.
- ^ Bossdorf O, Richards CL, Pigliucci M (February 2008). "Epigenetics for ecologists". Ecology Letters. 11 (2): 106–115. doi:10.1111/j.1461-0248.2007.01130.x. PMID 18021243.
- ^ Molinier J, Ries G, Zipfel C, Hohn B (August 2006). "Transgeneration memory of stress in plants". Nature. 442 (7106): 1046–1049. Bibcode:2006Natur.442.1046M. doi:10.1038/nature05022. PMID 16892047. S2CID 4329910.
- ^ a b c d Coe EH (June 1959). "A regular and continuing conversion-type phenomenon at the B locus in maize". Proceedings of the National Academy of Sciences of the United States of America. 45 (6): 828–832. Bibcode:1959PNAS...45..828C. doi:10.1073/pnas.45.6.828. PMC 222644. PMID 16590451.
- ^ Chandler VL (February 2007). "Paramutation: from maize to mice". Cell. 128 (4): 641–645. doi:10.1016/j.cell.2007.02.007. PMID 17320501.
- ^ a b Stam M, Belele C, Ramakrishna W, Dorweiler JE, Bennetzen JL, Chandler VL (October 2002). "The regulatory regions required for B' paramutation and expression are located far upstream of the maize b1 transcribed sequences". Genetics. 162 (2): 917–930. doi:10.1093/genetics/162.2.917. PMC 1462281. PMID 12399399.
- ^ a b Belele CL, Sidorenko L, Stam M, Bader R, Arteaga-Vazquez MA, Chandler VL (2013-10-17). "Specific tandem repeats are sufficient for paramutation-induced trans-generational silencing". PLoS Genetics. 9 (10): e1003773. doi:10.1371/journal.pgen.1003773. PMC 3798267. PMID 24146624.
- ^ a b Arteaga-Vazquez M, Sidorenko L, Rabanal FA, Shrivistava R, Nobuta K, Green PJ, et al. (July 2010). "RNA-mediated trans-communication can establish paramutation at the b1 locus in maize". Proceedings of the National Academy of Sciences of the United States of America. 107 (29): 12986–12991. Bibcode:2010PNAS..10712986A. doi:10.1073/pnas.1007972107. PMC 2919911. PMID 20616013.
- ^ a b Louwers M, Bader R, Haring M, van Driel R, de Laat W, Stam M (March 2009). "Tissue- and expression level-specific chromatin looping at maize b1 epialleles". The Plant Cell. 21 (3): 832–842. doi:10.1105/tpc.108.064329. PMC 2671708. PMID 19336692.
- ^ a b Haring M, Bader R, Louwers M, Schwabe A, van Driel R, Stam M (August 2010). "The role of DNA methylation, nucleosome occupancy and histone modifications in paramutation". The Plant Journal. 63 (3): 366–378. doi:10.1111/j.1365-313X.2010.04245.x. PMID 20444233.
- ^ a b Dorweiler JE, Carey CC, Kubo KM, Hollick JB, Kermicle JL, Chandler VL (November 2000). "mediator of paramutation1 is required for establishment and maintenance of paramutation at multiple maize loci". The Plant Cell. 12 (11): 2101–2118. doi:10.1105/tpc.12.11.2101. PMC 150161. PMID 11090212.
- ^ a b c Chandler V, Alleman M (April 2008). "Paramutation: epigenetic instructions passed across generations". Genetics. 178 (4): 1839–1844. doi:10.1093/genetics/178.4.1839. PMC 2323780. PMID 18430919.
- ^ Nobuta K, Lu C, Shrivastava R, Pillay M, De Paoli E, Accerbi M, et al. (September 2008). "Distinct size distribution of endogeneous siRNAs in maize: Evidence from deep sequencing in the mop1-1 mutant". Proceedings of the National Academy of Sciences of the United States of America. 105 (39): 14958–14963. Bibcode:2008PNAS..10514958N. doi:10.1073/pnas.0808066105. PMC 2567475. PMID 18815367.
- ^ Alleman M, Sidorenko L, McGinnis K, Seshadri V, Dorweiler JE, White J, et al. (July 2006). "An RNA-dependent RNA polymerase is required for paramutation in maize". Nature. 442 (7100): 295–298. Bibcode:2006Natur.442..295A. doi:10.1038/nature04884. PMID 16855589. S2CID 4419412.
- ^ Arteaga-Vazquez MA, Chandler VL (April 2010). "Paramutation in maize: RNA mediated trans-generational gene silencing". Current Opinion in Genetics & Development. 20 (2): 156–163. doi:10.1016/j.gde.2010.01.008. PMC 2859986. PMID 20153628.
- ^ Huang J, Lynn JS, Schulte L, Vendramin S, McGinnis K (2017-01-01). "Epigenetic Control of Gene Expression in Maize". International Review of Cell and Molecular Biology. 328: 25–48. doi:10.1016/bs.ircmb.2016.08.002. ISBN 9780128122204. PMID 28069135.
- ^ Chandler VL (October 2010). "Paramutation's properties and puzzles". Science. 330 (6004): 628–629. Bibcode:2010Sci...330..628C. doi:10.1126/science.1191044. PMID 21030647. S2CID 13248794.
- ^ a b c Zheng X, Chen L, Xia H, Wei H, Lou Q, Li M, et al. (January 2017). "Transgenerational epimutations induced by multi-generation drought imposition mediate rice plant's adaptation to drought condition". Scientific Reports. 7: 39843. Bibcode:2017NatSR...739843Z. doi:10.1038/srep39843. PMC 5209664. PMID 28051176.
- ^ a b c d Rasmann S, De Vos M, Casteel CL, Tian D, Halitschke R, Sun JY, et al. (February 2012). "Herbivory in the previous generation primes plants for enhanced insect resistance". Plant Physiology. 158 (2): 854–863. doi:10.1104/pp.111.187831. PMC 3271773. PMID 22209873.
- ^ Quadrana L, Colot V (November 2016). "Plant Transgenerational Epigenetics". Annual Review of Genetics. 50 (1): 467–491. doi:10.1146/annurev-genet-120215-035254. PMID 27732791.
- ^ Duszynska D, Vilhjalmsson B, Castillo Bravo R, Swamidatta S, Juenger TE, Donoghue MT, et al. (September 2019). "Transgenerational effects of inter-ploidy cross direction on reproduction and F2 seed development of Arabidopsis thaliana F1 hybrid triploids". Plant Reproduction. 32 (3): 275–289. doi:10.1007/s00497-019-00369-6. PMC 6675909. PMID 30903284.
- ^ a b c d e Wei Y, Schatten H, Sun QY (2014). "Environmental epigenetic inheritance through gametes and implications for human reproduction". Human Reproduction Update. 21 (2): 194–208. doi:10.1093/humupd/dmu061. PMID 25416302.
- ^ a b Lalande M (1996). "Parental imprinting and human disease". Annual Review of Genetics. 30: 173–195. doi:10.1146/annurev.genet.30.1.173. PMID 8982453.
- ^ a b c d Da Cruz, R. S., Chen, E., Smith, M., Bates, J., & Assis, S. (2020). 유방암의 식습관과 전이 후생유전: 부성 생식선의 역할. 영양학 전공 프론티어 7, 93. https://doi.org/10.3389/fnut.2020.0009
- ^ a b c Fontelles CC, Carney E, Clarke J, Nguyen NM, Yin C, Jin L, Cruz MI, Ong TP, Hilakivi-Clarke L, de Assis S (June 2016). "Paternal overweight is associated with increased breast cancer risk in daughters in a mouse model". Scientific Reports. 6: 28602. doi:10.1038/srep28602. PMC 4919621. PMID 27339599.
- ^ a b c d e f g h i j Napoli C, Benincasa G, Loscalzo J (April 2019). "Epigenetic Inheritance Underlying Pulmonary Arterial Hypertension". Arteriosclerosis, Thrombosis, and Vascular Biology. 39 (4): 653–664. doi:10.1161/ATVBAHA.118.312262. PMC 6436974. PMID 30727752.
- ^ Weaver IC, Cervoni N, Champagne FA, D'Alessio AC, Sharma S, Seckl JR, et al. (August 2004). "Epigenetic programming by maternal behavior". Nature Neuroscience. 7 (8): 847–854. doi:10.1038/nn1276. PMID 15220929. S2CID 1649281.
- ^ McGowan PO, Sasaki A, D'Alessio AC, Dymov S, Labonté B, Szyf M, et al. (March 2009). "Epigenetic regulation of the glucocorticoid receptor in human brain associates with childhood abuse". Nature Neuroscience. 12 (3): 342–348. doi:10.1038/nn.2270. PMC 2944040. PMID 19234457.
- ^ Meaney MJ, Szyf M (2005). "Environmental programming of stress responses through DNA methylation: life at the interface between a dynamic environment and a fixed genome". Dialogues in Clinical Neuroscience. 7 (2): 103–123. doi:10.31887/DCNS.2005.7.2/mmeaney. PMC 3181727. PMID 16262207.
- ^ a b Radtke KM, Ruf M, Gunter HM, Dohrmann K, Schauer M, Meyer A, Elbert T (July 2011). "Transgenerational impact of intimate partner violence on methylation in the promoter of the glucocorticoid receptor". Translational Psychiatry. 1 (July 19): e21. doi:10.1038/tp.2011.21. PMC 3309516. PMID 22832523.
- ^ a b c d Kioumourtzoglou MA, Coull BA, O'Reilly ÉJ, Ascherio A, Weisskopf MG (July 2018). "Association of Exposure to Diethylstilbestrol During Pregnancy With Multigenerational Neurodevelopmental Deficits". JAMA Pediatrics. 172 (7): 670–677. doi:10.1001/jamapediatrics.2018.0727. PMC 6137513. PMID 29799929.
- ^ Jablonka E, Lamb MJ (2005). Epigenetic inheritance and evolution: the Lamarckian dimension (Reprinted ed.). Oxford: Oxford University Press. ISBN 978-0-19-854063-2.
- ^ Cubas P, Vincent C, Coen E (September 1999). "An epigenetic mutation responsible for natural variation in floral symmetry". Nature. 401 (6749): 157–161. Bibcode:1999Natur.401..157C. doi:10.1038/43657. PMID 10490023. S2CID 205033495.
- ^ Dafni A, Kevan PG (1997). "Flower size and shape: implications in pollination". Israeli Journal of Plant Science. 45 (2–3): 201–211. doi:10.1080/07929978.1997.10676684.
- ^ Frazier ML, Xi L, Zong J, Viscofsky N, Rashid A, Wu EF, et al. (August 2003). "Association of the CpG island methylator phenotype with family history of cancer in patients with colorectal cancer". Cancer Research. 63 (16): 4805–4808. PMID 12941799.
- ^ Chan TL, Yuen ST, Kong CK, Chan YW, Chan AS, Ng WF, et al. (October 2006). "Heritable germline epimutation of MSH2 in a family with hereditary nonpolyposis colorectal cancer". Nature Genetics. 38 (10): 1178–1183. doi:10.1038/ng1866. PMC 7097088. PMID 16951683.
- ^ Bossdorf O, Arcuri D, Richards CL, Pigliucci M (2010). "Experimental alteration of DNA methylation affects the phenotypic plasticity of ecologically relevant traits in Arabidopsis thaliana" (PDF). Evolutionary Ecology. 24 (3): 541–553. doi:10.1007/s10682-010-9372-7. S2CID 15763479.
- ^ Whittle CA, Otto SP, Johnston MO, Krochko JE (2009). "Adaptive epigenetic memory of ancestral temperature regime in Arabidopsis thaliana". Botany. 87 (6): 650–657. doi:10.1139/b09-030.
- ^ 컬리, JP, FA 샴페인, P 베이트슨(2007) 공동 둥지는 자녀들의 대체 정서, 사회, 모성 행동을 유도한다. 사회 행동 Neuroendocrinology 11연례 회의 퍼시픽 그로브, CA, 미국. Branchi에 영향 나는(2009년 4월)."마우스는 공동의 둥지:초기의 사회적 환경 뇌와 행동 개발에 대한 후생 유전학적 영향을 조사하고".뇌 과학과 Biobehavioral 검토. 33(4):551–559. doi:10.1016/j.neubiorev.2008.03.011.PMID 18471879.S2CID 1592896.
- ^ Branchi I, D'Andrea I, Fiore M, Di Fausto V, Aloe L, Alleva E (October 2006). "Early social enrichment shapes social behavior and nerve growth factor and brain-derived neurotrophic factor levels in the adult mouse brain". Biological Psychiatry. 60 (7): 690–696. doi:10.1016/j.biopsych.2006.01.005. PMID 16533499. S2CID 16627324.
- ^ Katzmarski N, Domínguez-Andrés J, Cirovic B, Renieris G, Ciarlo E, Le Roy D, et al. (November 2021). "Transmission of trained immunity and heterologous resistance to infections across generations". Nature Immunology. 22 (11): 1382–1390. doi:10.1038/s41590-021-01052-7. PMID 34663978. Lay summary – Rheinische Friedrich-Wilhelms-Universität Bonn (16 November 2021).
{{cite journal}}: Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말) - ^ Whitham TG, Slobodchikoff CN (July 1981). "Evolution by individuals, plant-herbivore interactions, and mosaics of genetic variability: The adaptive significance of somatic mutations in plants". Oecologia. 49 (3): 287–292. Bibcode:1981Oecol..49..287W. doi:10.1007/BF00347587. PMID 28309985. S2CID 20411802.
- ^ Turian G (1979). "Sporogenesis in fungi". Annual Review of Phytopathology. 12: 129–137. doi:10.1146/annurev.py.12.090174.001021.
- ^ Vorzimmer P (1963). "Charles Darwin and blending inheritance". Isis. 54 (3): 371–390. doi:10.1086/349734. S2CID 143975567.
- ^ Jenkin F (1867). "Review of The Origin of Species". North British Review.
- ^ Mendel G (1866). "Versuche über Plflanzenhybriden. Verhandlungen des naturforschenden Vereines in Brünn" [Experiments in Plant Hybridization] (PDF). Read at the February 8th, and March 8th, 1865, meetings of the Brünn Natural History Society (in German).
- ^ Lamarck JB (1809). Philosophie zoologique: ou Exposition des considérations relative à l'histoire naturelle des animaux. Dentu et L'Auteur, Paris.
- ^ Bowler PJ (1989). Evolution, the history of an idea. Berkeley: University of California Press. ISBN 978-0-520-06386-0.
- ^ Weismann A (1891). Poulton EB, Schönland S, Shipley E (eds.). Essays upon heredity and kindred biological problems. Oxford: Clarendon Press. doi:10.5962/bhl.title.28066.
- ^ Goldberg AD, Allis CD, Bernstein E (February 2007). "Epigenetics: a landscape takes shape". Cell. 128 (4): 635–638. doi:10.1016/j.cell.2007.02.006. PMID 17320500.
- ^ Waddington CH (2016) [1939]. "Development as an Epigenetic Process". Introduction to Modern Genetics. London: Allen and Unwin. ISBN 9781317352037.
One of the classical controversies in embryology was that between the preformationists and the epigenisists[sic]. [...] the interaction of these constituents gives rise to new types of tissue and organ which were not present originally, and in so far development must be considered as 'epigenetic.'
- ^ Holliday R (2006). "Epigenetics: a historical overview". Epigenetics. 1 (2): 76–80. doi:10.4161/epi.1.2.2762. PMID 17998809.
- ^ Nanney DL (July 1958). "Epigenetic Control Systems". Proceedings of the National Academy of Sciences of the United States of America. 44 (7): 712–717. Bibcode:1958PNAS...44..712N. doi:10.1073/pnas.44.7.712. PMC 528649. PMID 16590265.
- ^ Crick FH (1958). "On protein synthesis" (PDF). Symposia of the Society for Experimental Biology. 12: 138–163. PMID 13580867.
- ^ Pigliucci M (December 2007). "Do we need an extended evolutionary synthesis?". Evolution; International Journal of Organic Evolution. 61 (12): 2743–2749. doi:10.1111/j.1558-5646.2007.00246.x. PMID 17924956.
- ^ a b c d van Otterdijk SD, Michels KB (July 2016). "Transgenerational epigenetic inheritance in mammals: how good is the evidence?". FASEB Journal. 30 (7): 2457–65. doi:10.1096/fj.201500083. PMID 27037350.
- ^ Steele EJ (1979). Somatic selection and adaptive evolution: on the inheritance of acquired characters (1st edit ed.). Toronto: Williams-Wallace.
- ^ Steele EJ, Lindley RA, Blanden RV (1998). Davies P (ed.). Lamarck's signature: how retrogenes are changing Darwin's natural selection paradigm. Frontiers of Science. Sydney: Allen & Unwin.
- ^ Lindley RA (2010). The Soma: how our genes really work and how that changes everything!. Piara Waters, CYO Foundation. ISBN 978-1451525649.
- ^ Steele EJ, Lloyd SS (May 2015). "Soma-to-germline feedback is implied by the extreme polymorphism at IGHV relative to MHC: The manifest polymorphism of the MHC appears greatly exceeded at Immunoglobulin loci, suggesting antigen-selected somatic V mutants penetrate Weismann's Barrier". BioEssays. 37 (5): 557–569. doi:10.1002/bies.201400213. PMID 25810320. S2CID 1270807.
- ^ Steele EJ (2016). Levin M, Adams DS (eds.). Origin of congenital defects: stable inheritance through the male line via maternal antibodies specific for eye lens antigens inducing autoimmune eye defects in developing rabbits in utero. Ahead of the Curve -Hidden breakthroughs in the biosciences. Bristol, UK: IOP Publishing. pp. Chapter 3.
- ^ Hoyle F, Wickramasinghe C (1982). Why neo-Darwinism does not work. Cardiff: University College Cardiff Press. ISBN 0-906449-50-2.
- ^ Hoyle F, Wickramasinghe NC (1979). Diseases from space. London: J.M. Dent.
- ^ Hoyle F, Wickramasinghe NC (1981). Evolution from space. London: J.M. Dent.
- ^ Liu Y (September 2007). "Like father like son. A fresh review of the inheritance of acquired characteristics". EMBO Reports. 8 (9): 798–803. doi:10.1038/sj.embor.7401060. PMC 1973965. PMID 17767188.
- ^ Liu Y, Li X (May 2016). "Darwin's Pangenesis as a molecular theory of inherited diseases". Gene. 582 (1): 19–22. doi:10.1016/j.gene.2016.01.051. PMID 26836487.
- ^ Noble D (February 2012). "A theory of biological relativity: no privileged level of causation". Interface Focus. 2 (1): 55–64. doi:10.1098/rsfs.2011.0067. PMC 3262309. PMID 23386960.
- ^ Noble D (August 2013). "Physiology is rocking the foundations of evolutionary biology". Experimental Physiology. 98 (8): 1235–1243. doi:10.1113/expphysiol.2012.071134. PMID 23585325. S2CID 19689192.
- ^ Mattick JS (October 2012). "Rocking the foundations of molecular genetics". Proceedings of the National Academy of Sciences of the United States of America. 109 (41): 16400–16401. Bibcode:2012PNAS..10916400M. doi:10.1073/pnas.1214129109. PMC 3478605. PMID 23019584.