화학적 극성
Chemical polarity
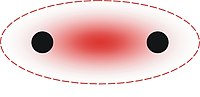
화학에서 극성은 분자 또는 그 화학군이 음전하 끝과 양전하 끝을 가진 전기 쌍극자 모멘트를 가지도록 유도하는 전하의 분리이다.
극성 분자는 결합된 원자 사이의 전기 음성도 차이로 인해 하나 이상의 극성 결합을 포함해야 합니다.극성 결합을 포함하는 분자는 결합 쌍극자가 대칭에 의해 서로를 상쇄하면 분자 극성이 없다.
극성 분자는 쌍극자-쌍극자 분자간 힘과 수소 결합을 통해 상호작용합니다.극성은 표면 장력, 용해성, 녹는점과 끓는점을 포함한 여러 물리적 성질의 기초가 됩니다.
결합 극성
모든 원자가 같은 힘으로 전자를 끌어당기는 것은 아니다.원자가 전자에 가해지는 "당기는" 양을 전기 음성도라고 합니다.불소, 산소, 질소와 같은 높은 전기음성도를 가진 원자는 알칼리 금속이나 알칼리 토류 금속과 같은 낮은 전기음성도를 가진 원자보다 전자에 더 큰 끌림을 가합니다.결합에서, 이것은 전자가 더 높은 전기음성도를 가진 원자에 더 가까이 끌어당겨지기 때문에 원자들 사이의 전자 공유의 불평등을 초래합니다.
전자는 음전하를 띠기 때문에 결합 내에서 전자의 불균등한 공유는 양전하와 음전하의 분리인 전기 쌍극자의 형성을 초래합니다.이러한 쌍극자에서 분리된 전하의 양은 보통 기본 전하보다 작기 때문에 부분 전하라고 불리며, δ+(델타 플러스) 및 δ-(델타 마이너스)로 표시됩니다.이 기호들은 크리스토퍼 잉골드와 에디스 힐다 박사에 의해 소개되었다. 1926년 [1][2]잉골드.결합 쌍극자 모멘트는 분리된 전하량과 전하 사이의 거리를 곱하여 계산됩니다.
분자 내의 이러한 쌍극자는 다른 분자의 쌍극자와 상호작용하여 쌍극자-쌍극자 간 분자력을 만들 수 있습니다.
분류
채권은 양극성 또는 양극성 중 하나의 극단으로 떨어질 수 있습니다.완전 무극성 결합은 전기음성도가 동일하여 차이가 0일 때 발생합니다.완전한 극성 결합은 이온 결합이라고 더 정확하게 불리며, 전기 음성도 사이의 차이가 너무 커서 한 원자가 다른 원자의 전자를 실제로 빼앗을 수 있을 때 발생합니다."극성"과 "무극성"이라는 용어는 일반적으로 극성이 완전하지 않은 공유 결합, 즉 공유 결합에 적용됩니다.수치수단을 이용하여 공유결합의 극성을 결정하기 위해 원자의 전기음성도의 차이를 이용한다.
결합 극성은 일반적으로 두 결합 원자 사이의 전기 음성도 차이에 따라 느슨하게 세 그룹으로 나뉩니다.폴링 척도에 따라:
- 비극성 결합은 일반적으로 두 원자 사이의 전기 음성도 차이가 0.5 미만일 때 발생한다.
- 극성 결합은 일반적으로 두 원자 사이의 전기 음성도 차이가 대략 0.5에서 2.0 사이일 때 발생한다.
- 이온 결합은 일반적으로 두 원자 사이의 전기 음성도 차이가 2.0 이상일 때 발생한다.
폴링은 결합의 부분 이온 특성, 즉 결합 원자 사이의 전기 음성도 차이에 대한 근사 함수에서 이 분류 체계를 기초로 했다.그는 1.7의 차이가 50%의 이온 성질에 해당하므로 더 큰 차이는 주로 [3]이온성 결합에 해당한다고 추정했다.
양자역학적 기술로서 폴링은 극성분자 AB의 파동함수는 공유가 분자와 이온성 분자에 대한 파동함수의 선형결합이라고 제안했다: δ = aθ(A:B) + bθ(AB+−)공유값 및 이온 성질의 양은 계수2 a와2 [4]b의 제곱 값에 따라 달라집니다.
결합 쌍극자 모멘트

결합 쌍극자[5] 모멘트는 분자 내 화학 결합의 극성을 측정하기 위해 전기 쌍극자 모멘트의 개념을 사용합니다.양전하와 음전하가 분리될 때마다 발생합니다.
결합 쌍극자 μ는 다음과 같이 주어진다.
- =\ d} 。
결합 쌍극자는 부분 전하 θ와+ θ– 사이의 거리 d를 갖는 θ+ - θ로– 모델링된다.이것은 결합 축에 평행한 벡터이며, 전기 쌍극자 모멘트 벡터의 경우와 마찬가지로 마이너스부터 [6]플러스까지를 가리킵니다.
화학자들은 종종 플러스부터 [7]마이너스까지를 가리키는 벡터를 그린다.이 벡터는 물리적으로 두 원자가 d간격으로 배치되고 상호작용이 허용될 때 전자에 의해 일어나는 움직임으로 해석될 수 있으며, 전자는 더 많은 전기음성 원자 주위에 위치하기 위해 자유 상태 위치에서 이동합니다.
전기 쌍극자 모멘트의 SI 단위는 쿨롱 미터입니다.이것은 분자 규모로는 실용적이기엔 너무 크다.결합 쌍극자 모멘트는 일반적으로 데바이로 측정되며 기호 D로 표현되며, 10 statcoulomb 단위로−10 전하(\와 거리 d(앙스트롬)를 측정하여 구한다.10 statcoulomb의 환산계수를−10 0.208 단위 기본 전하로 했을 때, 1.0 debye는 0.208 0 떨어져 있는 전자와 양성자에서 나온다.유용한 변환 계수는 1 D = 3.335 64×10−30 C [8]m입니다.
이원자 분자의 경우 단 하나의 결합(단일 또는 복수)만 존재하므로 결합 쌍극자 모멘트는 분자 쌍극자 모멘트가 되며, 일반적인 값은 0 ~ 11 D입니다.염소와
2 같은 대칭분자 Cl은 0쌍극자 모멘트를 가지며, 다른 극단에서 기상 브롬화칼륨 KBr은 10.41D의 [9][page needed][10][verification needed]쌍극자 모멘트를 가진다.
다원자 분자의 경우, 하나 이상의 결합이 있습니다.총 분자 쌍극자 모멘트는 개별 결합 쌍극자 모멘트의 벡터 합으로 근사할 수 있다.종종 결합 쌍극자는 반대의 과정을 통해 얻어진다: 분자의 알려진 총 쌍극자는 결합 쌍극자로 분해될 수 있다.이것은 결합 쌍극자 모멘트를 동일한 결합을 가지고 있지만 총 쌍극자 모멘트가 아직 알려지지 않은 분자에게 전달하기 위해 수행됩니다.전달된 결합 쌍극자의 벡터 합은 분자의 총(알 수 없는) 쌍극자에 대한 추정치를 제공합니다.
분자의 극성
분자는 "극성 공유가", "무극성 공유가", 또는 "이온성"으로 묘사될 수 있지만, 이것은 종종 상대적인 용어이며, 한 분자는 단순히 다른 분자에 비해 더 극성이거나 더 극성이 아니다.그러나 다음과 같은 특성이 그러한 분자의 전형적인 특성이다.
분자는 서로 다른 원자의 분자 궤도 사이에 하나 이상의 화학 결합으로 구성된다.분자는 위에서 설명한 바와 같이 전기음성도의 차이에 의한 극성 결합의 결과 또는 완전한 분자 궤도라고 알려진 전자의 비극성 공유 결합 및 비결합 쌍의 비대칭 배열의 결과로서 극성일 수 있다.
극성 분자
극성분자는 비대칭으로 배치된 극성결합으로부터의 대향전하(즉 부분양전하와 부분음전하를 갖는 것)의 결과로 순쌍극자를 가진다.물(HO2)은 극성 분자의 한 예로, 한쪽에는 약간의 양의 전하가 있고 다른 한쪽에는 약간의 음전하가 있기 때문이다.쌍극자는 상쇄되지 않고 결과적으로 순 쌍극자가 됩니다.물 분자 자체의 극성 때문에, 다른 극성 분자들은 일반적으로 물에 녹을 수 있다.물의 쌍극자 모멘트는 그 상태에 따라 달라진다.기상에서는 쌍극자 모멘트가 1.86 debye(D)[11] 이하이며, 수소 결합 환경이 다르기 때문에 액체 물( 2 2.95 [12]D)과 얼음( 3 3.09 D)[13]이 더 높다.다른 예로는 극성 산소-수소(-OH) 그룹이 많고 전체적으로 극성이 높은 설탕(수크로스)이 있다.
분자의 결합 쌍극자 모멘트가 상쇄되지 않으면 분자는 극성이다.예를 들어 물 분자(HO2)는 구부러진(비선형) 형상의 두 개의 극성 O-H 결합을 포함합니다.결합 쌍극자 모멘트는 상쇄되지 않기 때문에 분자는 산소에서 음극을 형성하고 두 수소 원자 사이의 중간에서 양극을 형성합니다.그림에서 각 결합은 음전하(빨간색)를 가진 중심 O 원자를 양전하(파란색)를 가진 H 원자에 결합한다.
수소 플루오르화물인 HF 분자는 극성 공유 결합에 의해 극성을 띠며, 공유 결합에서 전자는 더 많은 전기 음성의 불소 원자를 향해 변위됩니다.
암모니아(NH3)는 3개의 N-H 결합이 극성(전기음성 질소 원자가 많을수록)에 불과한 분자이다.이 분자는 VSEPR 이론에 의해 예측된 대로 대략적인 정4면체의 네 번째 정점을 가리키는 궤도 내에 두 개의 외로운 전자를 가지고 있다.이 오비탈은 공유 결합에 참여하지 않습니다; 그것은 전자가 풍부하며, 암모니아 분자 전체에 강력한 쌍극자를 형성합니다.
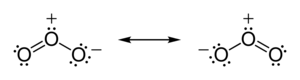
오존(O3) 분자에서 두 O-O 결합은 비극성이다(같은 원소의 원자 간 전기음성 차이는 없다).그러나 다른 전자의 분포는 고르지 않다 - 중앙 원자는 두 개의 다른 원자와 전자를 공유해야 하지만, 각각의 외부 원자는 다른 원자보다 전자를 더 많이 빼앗긴다. (중앙 원자는 +1의 공식 전하를 가지고 있고, 외부 원자는 각각 포멀을 가지고 있다.)l 충전 -1⁄2) 분자는 휘어진 형상을 가지고 있기 때문에 오존 분자 전체의 다이폴이 된다.
비슷한 몰 질량의 극성 분자와 비극성 분자를 비교할 때, 극성 분자 사이의 쌍극자-쌍극자 상호작용이 분자 간 흡인력을 더 강하게 만들기 때문에 일반적으로 극성 분자는 더 높은 끓는점을 가지고 있다.극성 상호작용의 한 가지 일반적인 형태는 수소 결합이며, 수소 결합은 H 결합으로도 알려져 있다.예를 들어 물은 H-결합을 형성하고 몰 질량 M = 18, 비등점 +100°C인 반면, 비등점은 M = 16, 비등점은 -102°C이다.
비극성 분자
분자는 2원자 분자의 두 원자 사이에 전자의 균등한 공유가 있을 때 또는 보다 복잡한 분자의 극성 결합의 대칭 배열 때문에 비극적일 수 있다.예를 들어 삼불화붕소(BF3)는 120°에서 3극 결합의 삼각 평면 배치를 가진다.이것은 분자에 전체적인 쌍극자가 생기지 않게 한다.

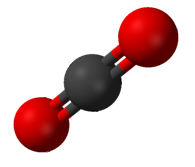
이산화탄소(CO2)는 두 개의 극성 C=O 결합을 가지지만, 두 개의 결합 쌍극자 모멘트가 취소되고 순 분자 쌍극자 모멘트가 존재하지 않도록 CO의2 형상은 선형이다.

가정용 비극성 화합물의 예로는 지방, 기름, 가솔린/가솔린이 있다.대부분의 비극성 분자는 상온에서 물에 녹지 않는다.테레빈유와 같은 많은 비극성 유기 용제는 비극성 물질을 녹일 수 있습니다.
메탄 분자(CH4)는 탄소 원자 주위에 4면체 형태로 4개의 C-H 결합이 배치되어 있다.각 결합에는 극성이 있습니다(강하지 않지만).결합은 대칭적으로 배열되어 있어 분자에 전체적인 쌍극자가 없다.이원자 산소 분자(O2)는 전기음성도가 같기 때문에 공유 결합에 극성이 없기 때문에 분자에 극성이 없다.
양친매성 분자
한쪽 끝에는 극성기가 붙어 있고 다른 한쪽 끝에는 극성기가 붙어 있는 큰 분자는 양친매 또는 양친매성 분자로 묘사됩니다.그것들은 좋은 계면활성제이고 물과 지방의 안정적인 유화, 또는 혼합의 형성에 도움을 줄 수 있습니다.계면활성제는 액체-액체 계면에서 흡착함으로써 기름과 물의 계면장력을 감소시킨다.
인지질은 중요한 생물학적 기능을 가진 효과적인 천연 계면활성제이다.
분자 극성 예측
| 공식 | 묘사 | 예 | 이름. | 쌍극자 모멘트 | |
|---|---|---|---|---|---|
| 북극의 | AB | 선형 분자 | CO | 일산화탄소 | 0.112 |
| HAx | 단일 H를 가진 분자 | 고주파 | 플루오르화수소 | 1.86 | |
| AxOH | 한쪽 끝에 OH가 있는 분자 | 쵸우25 | 에탄올 | 1.69 | |
| OxAy | 한쪽 끝에 O가 있는 분자 | 호2 | 물. | 1.85 | |
| NxAy | 한쪽 끝에 N이 있는 분자 | NH3 | 암모니아 | 1.42 | |
| 논폴라 | A2. | 같은 원소의 이원자 분자 | 오2 | 다이옥시겐 | 0.0 |
| CxAy | 대부분의 탄화수소 화합물 | C3H8 | 프로판 | 0.083 | |
| CxAy | 반전 중심이 있는 탄화수소 | C4H10 | 부탄 | 0.0 |
점군을 결정하는 것은 분자의 극성을 예측하는 유용한 방법입니다.일반적으로 분자의 개별 결합 쌍극자 모멘트가 서로를 상쇄하면 분자는 쌍극자 모멘트를 보유하지 않습니다.이것은 쌍극자 모멘트가 크기와 방향을 가진 유클리드 벡터 양이고, 서로 대립하는 두 개의 동등한 벡터가 상쇄될 것이기 때문이다.
반전 중심("i") 또는 수평 거울 평면("θh")을 가진 분자는 쌍극자 모멘트를 가지지 않는다.마찬가지로, 둘 이상의n C 회전축을 가진 분자는 쌍극자 모멘트가 둘 이상의 차원에 있을 수 없기 때문에 쌍극자 모멘트를 가지지 않을 것이다.그 제약의 결과로, 정의상, D점 그룹은 두 개 또는 여러n 개의 C축을 가지고 있기 때문에, 이면체 대칭(Dn)을 가진 모든 분자는 쌍극자 모멘트를 가지지 않을 것이다.
C, Cs, C∞hn 및nv C 포인트 그룹은 반전 중심, 수평 미러 평면 또는 다중n C 축을 가지고 있지 않기 때문에1 이러한 포인트 그룹 중 하나에 있는 분자는 쌍극자 모멘트를 가질 것이다.
물의 전기적 편향
일반적인 오해와는 달리, 하전 물체로부터의 물줄기의 전기적 편향은 극성에 기초하지 않는다.편향은 전류가 흐르는 물방울에 의해 발생하며, 이는 전류가 흐르는 물방울에 의해 유발됩니다.물의 흐름은 또한 극성 분자에 힘을 가할 수 없는 균일한 전기장에서 편향될 수 있습니다.또한 물의 흐름이 접지된 후에는 더 이상 방향을 바꿀 수 없습니다.무극성 [14]액체는 약한 편향도 가능합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Jensen, William B. (2009). "The Origin of the "Delta" Symbol for Fractional Charges". J. Chem. Educ. 86 (5): 545. Bibcode:2009JChEd..86..545J. doi:10.1021/ed086p545.
- ^ Ingold, C. K.; Ingold, E. H. (1926). "The Nature of the Alternating Effect in Carbon Chains. Part V. A Discussion of Aromatic Substitution with Special Reference to Respective Roles of Polar and Nonpolar Dissociation; and a Further Study of the Relative Directive Efficiencies of Oxygen and Nitrogen". J. Chem. Soc. 129: 1310–1328. doi:10.1039/jr9262901310.
- ^ Pauling, L. (1960). The Nature of the Chemical Bond (3rd ed.). Oxford University Press. pp. 98–100. ISBN 0801403332.
- ^ Pauling, L. (1960). The Nature of the Chemical Bond (3rd ed.). Oxford University Press. p. 66. ISBN 0801403332.
- ^ Blaber, Mike (2018). "Dipole_Moments". Libre Texts. California State University.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "전기 쌍극자 모멘트, p." doi:10.1351/goldbook.E01929
- ^ Hovick, James W.; Poler, J. C. (2005). "Misconceptions in Sign Conventions: Flipping the Electric Dipole Moment". J. Chem. Educ. 82 (6): 889. Bibcode:2005JChEd..82..889H. doi:10.1021/ed082p889.
- ^ Atkins, Peter; de Paula, Julio (2006). Physical Chemistry (8th ed.). W.H. Freeman. p. 620 (and inside front cover). ISBN 0-7167-8759-8.
- ^ 물리화학 제2판(1966) G.M. 바로 맥그로 힐
- ^ Van Wachem, R.; De Leeuw, F. H.; Dymanus, A. (1967). "Dipole Moments of KF and KBr Measured by the Molecular‐Beam Electric‐Resonance Method". J. Chem. Phys. 47 (7): 2256. Bibcode:1967JChPh..47.2256V. doi:10.1063/1.1703301.
- ^ Clough, Shepard A.; Beers, Yardley; Klein, Gerald P.; Rothman, Laurence S. (1 September 1973). "Dipole moment of water from Stark measurements of H2O, HDO, and D2O". The Journal of Chemical Physics. 59 (5): 2254–2259. Bibcode:1973JChPh..59.2254C. doi:10.1063/1.1680328.
- ^ Gubskaya, Anna V.; Kusalik, Peter G. (27 August 2002). "The total molecular dipole moment for liquid water". The Journal of Chemical Physics. 117 (11): 5290–5302. Bibcode:2002JChPh.117.5290G. doi:10.1063/1.1501122.
- ^ Batista, Enrique R.; Xantheas, Sotiris S.; Jónsson, Hannes (15 September 1998). "Molecular multipole moments of water molecules in ice Ih". The Journal of Chemical Physics. 109 (11): 4546–4551. Bibcode:1998JChPh.109.4546B. doi:10.1063/1.477058.
- ^ Ziaei-Moayyed, Maryam; Goodman, Edward; Williams, Peter (2000-11-01). "Electrical Deflection of Polar Liquid Streams: A Misunderstood Demonstration". Journal of Chemical Education. 77 (11): 1520. Bibcode:2000JChEd..77.1520Z. doi:10.1021/ed077p1520. ISSN 0021-9584.



 거리 d(
거리 d(