코디네이션 콤플렉스
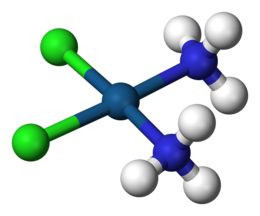
Coordination complex배위 복합체는 보통 금속이고 배위 중심이라고 불리는 중심 원자 또는 이온과 리간드 또는 [1][2][3]복합제라고 알려진 결합 분자 또는 이온의 주변 배열로 구성됩니다.많은 금속 함유 화합물, 특히 전이 금속(주기율표의 d-블록에 속하는 티타늄과 같은 원소)을 포함하는 화합물은 배위 [4]복합체이다.
명명법 및 용어
조정 콤플렉스는 너무 널리 퍼져 있기 때문에 그 구조와 반응은 여러 가지 방법으로 설명되며 때로는 혼란스러울 수 있습니다.중심 금속 원자 또는 이온에 결합되어 있는 배위자 내의 원자는 기증자 원자라고 불립니다.전형적인 복합체에서는 금속 이온이 여러 개의 공여 원자에 결합되어 있으며, 이 원자는 같거나 다를 수 있습니다.폴리덴테이트(다중 결합) 리간드는 리간드의 여러 원자를 통해 중심 원자에 결합하는 분자 또는 이온이다. 2, 3, 4, 또는 심지어 6개의 리간드가 중심 원자에 결합하는 것이 일반적이다.이러한 복합체를 킬레이트 복합체라고 하며, 이러한 복합체의 형성을 킬레이트, 복합화 및 배위라고 합니다.
중심 원자 또는 이온은 모든 배위자와 함께 [5][6]배위구를 구성한다.중심 원자 또는 이온과 공여 원자는 첫 번째 배위구를 구성한다.
배위란 배위자와 중심 원자 사이의 "좌표 공유 결합"(쌍극 결합)을 말한다.원래 복합체는 그러한 약한 화학적 결합을 통해 분자, 원자 또는 이온의 가역적 연관성을 암시했다.배위화학에 적용되면서 이 의미는 진화했다.일부 금속 착체는 사실상 불가역적으로 형성되며, 많은 금속 착체는 상당히 [7][8]강한 결합으로 결합되어 있습니다.
중심 원자 또는 이온에 부착된 공여 원자의 수를 배위수라고 합니다.가장 일반적인 코디네이션 번호는 2, 4, 특히 6입니다.수화 이온은 중심 금속 이온과 하나 이상의 주변 배위자, 분자 또는 이온 사이에 형성되는 복합 이온(또는 단순히 복합체)의 한 종류이다.
만약 모든 배위자가 단치산염이라면, 공여 원자의 수는 배위자의 수와 같다.예를 들어 코발트(헥사하이드레이트 이온 또는 헥사카코발트(II) 이온 [Co(HO2)]62+는 금속 이온 Co에 6개의 물 분자가 붙어 있는 수화 복합 이온이다.산화상태와 배위수는 복합이온에서 금속이온과 배위자 사이에 형성된 결합의 수를 반영한다.단, Pt(2+
2en)의 배위수는 2개의 이원배위자를 가지며, 총 4개의 공여원자를 포함하고 있기 때문에 4개이다.
어떤 공여 원자라도 한 쌍의 전자를 줄 것이다.하나 이상의 전자 쌍을 제공할 수 있는 공여 원자 또는 그룹이 있습니다.이러한 것을 바이덴테이트(두 쌍의 전자 제공) 또는 폴리덴테이트(두 쌍의 전자 제공)라고 합니다.어떤 경우에 원자 또는 그룹은 전자쌍의 분할에 의해 비슷하거나 다른 두 개의 중심 금속 원자 또는 수용체에 전자쌍을 3중심의 2전자 결합으로 제공한다.이것들은 브리징 리간드라고 불립니다.
역사
배위 복합체는 현대 화학이 시작된 이래로 알려져 왔다.초기에 잘 알려진 배위 복합체는 프러시아 블루와 같은 염료를 포함한다.그들의 특성은 1869년 크리스찬 빌헬름 블롬스트랜드의 작품 이후 1800년대 후반에 처음 잘 이해되었다.블롬스트랜드는 복잡한 이온 사슬 이론으로 알려진 것을 개발했다.금속 아민 착체를 고려할 때, 그는 암모니아 분자가 [(NH3)]XX+형 사슬을 형성함으로써 이온의 전하를 보상한다는 이론을 세웠다. 여기서 X는 금속 이온의 배위수이다.그는 자신의 이론적인 암모니아 체인을 (CH2)X[9] 형태의 탄화수소와 비교했다.
이 이론을 따라 덴마크 과학자 소푸스 마즈 예르겐센이 그것을 개선했다.그의 이론 버전에서, 유르겐센은 분자가 용액에서 분해될 때 두 가지 가능한 결과가 있다고 주장했습니다: 블롬스트랜드가 설명한 암모니아 사슬을 통해 이온이 결합하거나 이온이 금속에 직접 결합할 것입니다.
1893년이 되어서야 오늘날 가장 널리 받아들여지고 있는 이론이 알프레드 베르너에 의해 출판되었다.베르너의 업적은 Blomstrand 이론에 대한 두 가지 중요한 변화를 포함했다.첫 번째는 Werner가 두 가지 가능성을 배위 영역에서의 위치 측면에서 설명했다는 것입니다.그는 이온들이 사슬을 형성한다면, 이것은 배위권 밖에서 일어나는 반면 금속에 직접 결합하는 이온들은 배위권 [10]안에서 일어날 것이라고 주장했다.그러나 베르너는 그의 가장 중요한 발견 중 하나에서 사슬 이론의 대부분을 반증했다.Werner는 복잡한 6차원 코발트의 형성에 관여하는 리간드의 공간 배치를 발견했다.그의 이론은 예를 들어 코발타민 염화물의 염화물 이온과 같은 화합물의 배위 배위자와 전하 평형 이온 사이의 차이를 이해하고 이전에 설명할 수 없었던 많은 이성질체를 설명할 수 있게 해줍니다.
1911년, Werner는 탄소 화합물만이 [11]키랄리티를 가질 수 있다는 이론을 뒤엎고 배위 복합체 헥솔을 광학 이성질체로 분해했다.
구조물들
중심 원자를 둘러싼 이온이나 분자는 리간드라고 불립니다.리간드는 리간드와 중심 원자 사이의 결합에 얼마나 많은 전자를 제공하는가에 따라 L 또는 X(또는 이들의 조합)로 분류된다.L배위자는 하나의 전자쌍으로부터 두 개의 전자를 공급하여 좌표 공유 결합을 생성한다.X배위자는 하나의 전자를 제공하고 중심 원자는 다른 전자를 제공하여 규칙적인 공유 결합을 형성한다.배위자는 원자와 배위되어 있다고 한다.알켄의 경우, 파이 결합은 금속 원자와 배위할 수 있습니다.복합체의 에틸렌이 그 예입니다 [PtCl3(CH24)].−
기하학.
배위화학에서 구조는 우선 배위수, 금속에 부착된 배위자의 수(구체적으로는 공여원자의 수)에 의해 설명된다.보통 연결된 리간드를 셀 수 있지만, 때때로 카운트조차 모호해질 수 있습니다.배위 수치는 보통 2에서 9 사이이지만, 많은 수의 리간드는 랜타니드와 악티니드에 대해 드물지 않습니다.결합의 수는 금속 이온과 배위자의 크기, 전하 및 전자 구성에 따라 달라집니다.금속 이온에는 여러 개의 배위 번호가 있을 수 있습니다.
전형적으로 전이 금속 복합체의 화학은 리간드에서 공여자의 s와 p 분자 궤도 사이의 상호작용과 금속 이온의 d 궤도 사이의 상호작용에 의해 지배된다.금속의 s, p 및 d 궤도는 18개의 전자를 수용할 수 있습니다(18-전자 규칙 참조).따라서 특정 금속에 대한 최대 배위수는 금속 이온의 전자 구성(구체적으로는 빈 궤도 수) 및 배위자와 금속 이온의 크기 비율과 관련이 있습니다.[84−Mo(CN)]와 같이 큰 금속과 작은 배위자는 높은 배위수로 이어진다.배위자가 큰 작은 금속은 Pt[P(CMe3)]2와 같은 낮은 배위 수치를 초래한다.큰 크기 때문에 란타니드, 악티니드 및 초기 전이 금속은 배위수가 높은 경향이 있습니다.
대부분의 구조는 궤도 겹침(배위자와 금속 궤도 사이)과 배위자 격퇴가 일정한 기하학적 구조로 이어지는 경향이 있는 다면체의 중앙 원자가 마치 그 모양의 모서리가 배위자의 위치인 것처럼)을 따릅니다.가장 많이 관찰된 기하학적 구조는 아래에 나열되어 있지만, 예를 들어 다양한 유형의 리간드 사용(결합 길이가 불규칙하고 배위 원자가 구면상의 점을 따르지 않음), 리간드의 크기 또는 전자 효과(예: Jahn-Teller 참조)로 인해 규칙적인 기하학적 형태에서 벗어나는 경우가 많다.왜곡):
- 2개의 코디네이션에 대한 선형
- 삼좌표를 위한 삼각 평면
- 4개의 코디네이터를 위한 사면체 또는 정사각형 평면
- 5좌표를 위한 삼각 쌍추체
- 6개의 코디네이터를 위한 8면체
- 7좌표를 위한 오각쌍곡선
- 8개의 코디네이터를 위한 정사각형 대척점
- 9좌표를 위한 3각 삼각 프리즘
5, 7, 8 및 9-좌표에 대한 이상적인 설명은 정사각형 피라미드와 삼각 2원추 [12]구조 사이의 차이와 같이 L-M-L(배위자 금속-배위자) 각도가 약간 다른 대체 구조에서 종종 기하학적으로 불분명하다.
- 5개의[13] 코디네이터를 위한 정사각형 피라미드
- 7개[14] 코디네이터를 위한 캡이 있는 8면체 또는 캡이 있는 삼각 프리즘
- 8좌표를[15] 위한 12면체 또는 2중 삼각 프리즘
- 9개 코디네이터를 위한 캡이 있는 정사각형 대청색제
5개 좌표 복합체에 대한 대체 배위를 구별하기 위해, γ 기하학적 지수를 애디슨 외 [16]연구진이 발명했다.이 지수는 좌표 중심별 각도에 따라 달라지며 사각 피라미드의 경우 0에서 삼각 쌍추체 구조의 경우 1로 변화하여 그 사이의 경우를 분류할 수 있다.이 시스템은 나중에 하우저 외 [17]연구진 및 오쿠니에프스키 [18]외 연구진에 의해 4개의 배위 복합체로 확장되었다.
몇몇 화합물의 삼각형의 프리즘처럼 생긴 기하학 relati 안정된다(second-order)Jahn–Teller과 같은 특별한 전자 영향으로 인해 낮은 d전자 수, 시스템에서.(는 조정 원자들은points-on-a-sphere 패턴을 따르지 않니)은 또 다른 가능성과 관련하여 상대적 안정된 특정 기하학적 구조 stabilization,[19].수의사o 육면체 구조.
이성질
배위자의 배열은 주어진 복합체에 대해 고정되지만, 어떤 경우에는 또 다른 안정적인 이성질체를 형성하는 반응에 의해 변이될 수 있다.
배위 복합체에는 다른 많은 화합물과 마찬가지로 많은 종류의 이성질체가 존재한다.
입체 이성질체
입체 이성질체는 서로 다른 방향으로 같은 결합으로 발생한다.입체 이성질체는 다음과 같이 [20]분류할 수 있다.
시스-트랜스 이성질체와 안면-중간 이성질체
시스-트랜스 이성질체는 8면체와 정사각형 평면 복합체에서 발생한다.두 개의 배위자가 인접해 있을 때는 시스라고 하며, 서로 반대일 때는 트랜스라고 한다.세 개의 동일한 배위자가 8면체의 한 면을 차지하면, 이성질체는 면 또는 면이라고 한다.팩 이성질체에서는 동일한 2개의 배위자가 서로 인접 또는 시스이다.이들 3개의 리간드와 금속이온이 1평면에 있으면 이성질체는 자오선(mer)이라고 한다.mer 이성질체는 트랜스쌍과 시스쌍의 동일한 배위자를 모두 포함하고 있기 때문에 트랜스쌍과 시스의 조합으로 간주할 수 있다.
광학 이성질
광학적 이성질체는 복합체가 거울 이미지와 겹치지 않을 때 발생한다.이는 두 이성체가 각각 광학적으로 활성화되어 있기 때문에, 즉 편광면을 반대 방향으로 회전시키기 때문입니다.표시된 첫 번째 분자는 기호 δ(람브다)를 프리픽스로 사용하여 3개의 이원배위자에 의해 형성되는 왼손 프로펠러 트위스트를 기술한다.두 번째 분자는 첫 번째 분자의 거울 이미지이며, 오른쪽 프로펠러 트위스트의 접두사로 기호 δ(델타)가 있습니다.세 번째와 네 번째 분자는 δ 및 δ 이성질체의 유사한 쌍으로, 이 경우 두 개의 이원배위자와 두 개의 동일한 모노덴테이트 [21]배위자를 가진다.
구조 이성질
구조 이성체는 결합 자체가 다를 때 발생한다.구조 이성질체는 이온화 이성질체, 용매화 이성질체 또는 수화물 이성질체, 결합 이성질체 및 배위 이성질체 등 4가지 유형으로 인식된다.
- 이온화 이성질체 – 이 이성질체는 동일한 구성을 가지고 있지만 용액에서 서로 다른 이온을 생성합니다.이러한 유형의 이성질체는 복합체의 대향 이온이 잠재적 배위자이기도 할 때 발생합니다.예를 들어 황산펜타아민브로모코발트(II)[Co(NH3)5Br]SO는4 붉은 제비꽃이며 용액에서는 황산 이온의 존재를 확인하는 염화바륨으로 침전을 주고, Pentaaminesulphatecovalt(III) 브롬화물[Co(NH3)5SO4]Br은 적색이며 용액에서 [22]황산 이온에 대해 음성이지만 대신 질산은으로 AgBr 침전을 일으킨다.
- 용매 또는 하이드레이트 이성질체 – 이성질체는 동일한 구성을 가지고 있지만 리간드 역할을 하는 용매 분자의 수에 따라 다르며, 결정의 부위를 단순히 점유합니다.예: [Cr(HO2)]6Cl은3 보라색, [CrCl(HO2)]5Cl2...HO는2 청록색으로 [CrCl2(HO2)]4Cl·2HO는2 짙은 녹색입니다.결정수를 보다.[22]
- 결합 이성질체는 앰비네이트 [23]리간드로 알려진 하나 이상의[clarification needed] 유형의 공여 원자를 가진 리간드와 함께 발생한다.예를 들어 아질산염은 O 또는 [24]N을 통해 배위할 수 있다.1쌍의 아질산염 결합 이성질체는 구조3(5NH22+)CoNO(니트로 이성질체) 5및3 (NH2+)CoONO(니트리토 이성질체)[23]를 가진다.
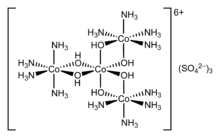
- 배위 이성질 – 소금의 양 및 음이온이 모두 복합 이온이고 두 이성질체가 양이온과 음이온 사이의 배위자 분포가 다를 때 발생합니다.예를 들어 [Co(NH3)][6Cr(CN)]6 및 [Cr(NH3)][6Co(CN)]6[22]입니다.
전자 속성
전이 금속 복합체의 많은 특성은 그 전자 구조에 의해 좌우됩니다.전자 구조는 금속과 배위자의 공식 전하를 귀속시키는 비교적 이온성 모델로 설명할 수 있습니다.이 접근방식은 결정장 이론(CFT)의 본질입니다.1929년 한스 베테에 의해 도입된 결정장 이론은 복합체를 이해하기 위한 양자역학에 기초한 시도를 제공한다.그러나 결정장 이론은 복합체 내의 모든 상호작용을 이온으로 취급하고 배위자가 음점 전하에 의해 근사될 수 있다고 가정합니다.
보다 정교한 모델은 공유가격을 수용하며, 이 접근법은 LFT(Ligand Field Theory)와 Molecular Orbital Theory(MO; 분자 궤도 이론)에 의해 기술됩니다.리간드 필드 이론은 1935년에 도입되어 분자 궤도 이론에서 구축되어 광범위한 복합체를 처리할 수 있으며, 상호작용이 공유가 되는 복합체를 설명할 수 있습니다.군 이론의 화학적 응용은 형식 방정식에 대한 단순하고 대칭적인 해법을 가능하게 함으로써 결정이나 배위자 장 이론의 이해를 도울 수 있습니다.
화학자들은 관심 속성을 예측하는 데 필요한 가장 단순한 모델을 사용하는 경향이 있다. 이러한 이유로 CFT는 가능한 한 논의에서 선호되어 왔다.MO와 LF 이론은 더 복잡하지만 더 현실적인 관점을 제공합니다.
복합체의 전자 구성은 복합체에 몇 가지 중요한 특성을 부여합니다.
전이 금속 착체 색상
전이 금속 복합체는 빛의 흡수에 의한 전자 전이에 의해 종종 화려한 색상을 가집니다.이러한 이유로 그것들은 종종 색소로 도포된다.착색 금속 착체와 관련된 대부분의 전환은 d-d 전환 또는 전하 전달 대역입니다.d-d 전이에서는 금속의 d 오비탈에 있는 전자가 광자에 의해 더 높은 에너지의 또 다른 d 오비탈로 들뜨기 때문에 d-d 전이는 부분적으로 채워진 d 오비탈 복합체(d1–9)에 대해서만 발생한다.d 또는 d10 구성을 가진0 복합체의 경우 d~d 전환이 불가능하더라도 전하 전송은 가능합니다.전하전송밴드는 금속계 오비탈에서 빈 리간드계 오비탈(Metal-to-Ligand Charge Transfer(MLCT))로 전자를 촉진한다.역순으로도 발생합니다. 즉, 배위자 기반 오비탈에서 빈 금속 기반 오비탈(LMCT)로 전자를 들뜨게 하는 것입니다.이러한 현상은 전자 분광학([25]UV-Vis라고도 함)을 통해 관찰할 수 있습니다.대칭성이 높은 단순 화합물의 경우 다나베-스가노 다이어그램을 사용하여 d-d 전이를 할당할 수 있다.이 과제들은 컴퓨터 화학에서 점점 더 많은 지지를 얻고 있다.
| Fe2+ | Fe3+ | 회사2+ | 쿠2+ | 알3+ | Cr3+ | |
|---|---|---|---|---|---|---|
| 수화 이온 | [Fe(H2O)6]2+ 연두색 솔루션 | [Fe(H2O)6]3+ 황색/갈색 솔루션 | [코(HO2)]62+ 핑크 솔루션 | [Cu(H2O)6]2+ 파랑색 솔루션 | [알(HO2)]63+ 무채색 솔루션 | [Cr(H2O)6]3+ 초록의 솔루션 |
| (OH),− 희석 | [Fe(H2O)4(OH)2] 짙은 녹색 침전물 | [Fe(H2O)3(OH)3] 갈색 침전물 | [Co(H2O)4(OH)2] 파란색/녹색 침전물 | [Cu(H2O)4(OH)2] 파랑색 침전물 | [Al(H2O)3(OH)3] 하얀색 침전물 | [Cr(H2O)3(OH)3] 초록의 침전물 |
| (OH),− 집중 | [Fe(H2O)4(OH)2] 짙은 녹색 침전물 | [Fe(H2O)3(OH)3] 갈색 침전물 | [Co(H2O)4(OH)2] 파란색/녹색 침전물 | [Cu(H2O)4(OH)2] 파랑색 침전물 | [알(OH)]4− 무채색 솔루션 | [Cr(OH)6]3− 초록의 솔루션 |
| NH3, 희석 | [Fe(NH3)6]2+ 짙은 녹색 침전물 | [Fe(NH3)6]3+ 갈색 침전물 | [Co(NH3)6]2+ 빨대색 솔루션 | [Cu(NH3)4(H2O)2]2+ 짙은 파란색 솔루션 | [알(NH3)]33+ 하얀색 침전물 | [Cr(NH3)6]3+ 보라색 솔루션 |
| NH3, 집중 | [Fe(NH3)6]2+ 짙은 녹색 침전물 | [Fe(NH3)6]3+ 갈색 침전물 | [Co(NH3)6]2+ 빨대색 솔루션 | [Cu(NH3)4(H2O)2]2+ 짙은 파란색 솔루션 | [알(NH3)]33+ 하얀색 침전물 | [Cr(NH3)6]3+ 보라색 솔루션 |
| (CO3)2- | FeCO3 짙은 녹색 침전물 | Fe2(CO3)3 갈색 침전물+거품 | 코코3 핑크 침전물 | 쿠코3 파란색/녹색 침전물 |
란타니드 복합체 색상
표면상 랜타니드 착체는 착색된 전이금속과 유사하다.그러나 일반적인3+ Ln 이온(Ln = lanthanide)의 경우 색이 모두 옅어 배위자의 성질에 거의 영향을 받지 않는다.색상은 4f 전자 천이 때문입니다.란타니드의 4f 오비탈은 제논 코어에 "매설"되고 5s 및 5p 오비탈에 의해 리간드로부터 보호되기 때문에 리간드의 영향을 크게 받지 않아 전이 금속보다 훨씬 작은 결정장 분할을 초래합니다.Ln3+ 이온의 흡수 스펙트럼은 스핀-오빗 결합에 의해 전자 상태가 설명되는 자유 이온의 흡수 스펙트럼에 가깝다.이는 결정장에 의해 지면 상태가 분할되는 전이 금속과 대조됩니다.Ln에 대한3+ 흡수는 전기 쌍극자 전이 패리티가 금지되어 있기 때문에 약하지만(Laporte 금지), 낮은 대칭 리간드장의 효과 또는 높은 전자 상태와의 혼합(예: d 궤도)으로 인해 강도를 얻을 수 있다.f-f 흡수 대역은 일반적으로 넓은 띠를 [26][27]가진 전이 금속에서 관찰된 것과 대조되는 매우 날카롭다.이로 인해 조명 형태에 따라 현저한 색상 변화가 발생하는 등 매우 특이한 효과가 발생할 수 있습니다.
자기
한 쌍의 전자가 없는 금속 착체는 자성을 띤다.단금속 복합체만을 고려할 때, 짝이 없는 전자는 복합체가 홀수 수의 전자를 가지고 있거나 전자 쌍이 불안정하기 때문에 발생한다.따라서, 단량체 Ti(II) 종은 하나의 "d-전자"를 가지며, 리간드의 형상이나 성질에 관계없이 (파라) 자성을 띠어야 한다.두 개의 d-전자를 가진 Ti(II)는 두 개의 무쌍 전자를 가진 복합체를 형성하고 다른 것들은 무쌍 전자를 가진 복합체를 형성한다.이러한 효과는 화합물 TiX2[(CH3)2PCHCP22(CH3)]:22 X = Cl일 때 복합체는 상사성(고회전 구성)인 반면 X = CH일3 때는 반자성(저회전 구성)이다.리간드가 접지 상태 특성을 조정하는 중요한 수단을 제공한다는 것을 인식하는 것이 중요합니다.
개별 중심이 홀수 개수의 전자를 가지고 있거나 높은 스핀인 바이메탈 및 폴리메탈 복합체에서는 상황이 더 복잡하다.두 개 이상의 금속 중심 사이에 직접 또는 리간드를 통해 상호작용이 있을 경우 전자는 결합(반강자성 결합을 통해 반자성 화합물을 생성)하거나 서로 강화(강자성 결합)할 수 있다.상호작용이 없을 경우 두 개 이상의 개별 금속 중심은 두 개의 분리된 분자에 있는 것처럼 작동합니다.
반응성
복합체는 다양한 가능한 반응을 [28]보인다.
- 전자 전송
- (퇴화) 리간드 교환
- 반응성의 한 가지 중요한 지표는 리간드의 퇴화 교환 속도이다.예를 들어 [M(HO2)]6n+ 복합체의 좌표수 교환 속도는 20배 이상 변화한다.리간드가 방출되어 빠르게 반발하는 복합체는 불안정성으로 분류된다.이러한 불안정한 복합체는 열역학적으로 매우 안정적일 수 있다.전형적인 불안정한 금속 착체는 낮은 전하(Na+), 리간드에 대해 반결합하는 d-오비탈의 전자(Zn2+)를 가지거나 공유가(Ln3+, 여기서 Ln은 란타니드)를 가지지 않는다.금속 착체의 내구성도 가능한 경우 고회전 대 저회전 구성에 따라 달라집니다.따라서 고회전 Fe(II)와 Co(III)는 불안정한 복합체를 형성하지만 저회전 유사체는 불활성이다.Cr(III)은 높은 공식 산화 상태, M–L 반결합인 궤도 내 전자의 부재, 그리고 d 구성과3 관련된 일부 "배위자장 안정화" 때문에 비활성인 저회전 상태(쿼텟)에서만 존재할 수 있다.
- 관련 프로세스
- 미충족 또는 반충족 궤도인 복합체는 종종 기판과 반응할 수 있다.대부분의 기판은 1t의 지면 상태를 가지고 있다. 즉, 단일 전자쌍(물, 아민, 에테르)을 가지고 있기 때문에, 이러한 기판은 금속 중심과 반응할 수 있는 빈 궤도가 필요하다.일부 기질(예: 분자 산소)은 삼중항 지면 상태를 가지며, 이는 반쯤 채워진 궤도를 가진 금속이 그러한 기질과 반응하는 경향을 보인다(이산화수소 분자도 단독 쌍을 가지고 있으므로 '정상적인' 루이스 염기로서 반응할 수 있다).
금속 주위의 배위자를 신중하게 선택하면 금속은 분자의 (stoichometric 또는 catalystic) 변환을 돕거나 센서로 사용할 수 있습니다.
분류
배위 화합물로도 알려진 금속 복합체는 사실상 모든 금속 [29]화합물을 포함합니다."조정 화학"의 연구는 모든 알칼리 및 알칼리 토류 금속, 전이 금속, 란타니드, 악티니드 및 금속의 "무기 화학"에 대한 연구이다.따라서, 배위 화학은 주기율표의 대부분에 해당하는 화학이다.금속 및 금속 이온은 적어도 축합상에서는 리간드로 둘러싸인 상태로 존재한다.
배위 화학 영역은 배위자의 성질에 따라 크게 분류할 수 있다.
- 클래식(또는 "Werner Complex"):고전적 배위 화학에서 배위자는 배타적으로 배위자의 주군 원자에 존재하는 전자쌍을 통해 금속에 결합한다.대표적인 배위자는 HO, NH3, Cl−, CN−, en이다2.이러한 복합체의 가장 단순한 구성 요소 중 일부는 금속 아쿠오 복합체, 금속 암민 복합체,
- 예: [Co(EDTA),− [Co(NH3),63+ [Fe(CO24)]33-
- 유기 금속 화학: 리간드는 유기(알켄, 알킨, 알킬)뿐만 아니라 포스핀, 수소화물, CO와 같은 "유기 비슷한" 리간드입니다.
- 예: (CH55)Fe(CO)2CH3
- 예제:헤모글로빈 환원 헤마틴을 찾은 것이었는데, 철의 분변 포르피린 단지가 포함되어 있습니다.
- 예제:엽록소 마그네슘의 분변 포르피린 단지가 포함되어 있습니다.
- 많은 자연 ligands"고전"특히 물이 포함된다.
- 군발성 화학:Ligands 이 모든 것 때문에 죽음은 물론 다른 금속 이온이나 원자들도 포함한다.
- 예제 Ru3(카이 트리아 오닐)12
- 일부의 경우 다양한 분야 결합: 있다.
- 예제:한 떼 생물학적으로 활성인 종에 포함되[Fe4S4(Scysteinyl cm부터 4]2−.
배위 화학의 감각은 금속 ligands에 둘러싸여 있에 Mineralogy, 자재 과학, 그리고 고체 화학 –로 그들은 금속 이온 –에 적용되다 하위 집합.많은 경우, 이러한 ligands은 산화물 또는 황화물지만, 그 금속들은 그럼에도 불구하고 조정되고 원칙과 지침을 신청하다 아래에서 논의된.수화에서, 적어도 일부를 ligands의 물을 이루고 있다.그것은 광물학, 재료 과학 및 고체 화학의 초점 조정이나 무기 화학의 일상적인 초점에서 다른 것이 사실이다.전 주로 고분자 구조, 특성 고도의 상호 연결된 금속들의 집단 효과에서 발생한 관심을 갖고 있다.대조적으로, 배위 화학 반응도, 단지 개별 금속 원자와 금속 원자의 작은 앙상블을 포함하는 속성에 초점을 맞춘다.
배위 복합체의 명명법
콤플렉스가 명명의 기본적인 절차: 있다.
- 언제 복잡한 이온의 이름을 짓는 그 ligands이 금속 이온기 전에 이름을 갖고 있다.
- 리간드의 이름은 알파벳 순으로 지정됩니다.숫자 프리픽스는 순서에 영향을 주지 않습니다.
- 다중 발생하는 monodentate ligands 수를:di-, tri-, tetra-, penta-, 또는 hexa-에 따라 접두사를 받는다.
- 복수의 발생 폴리덴테이트 리간드(예: 에틸렌디아민, 옥살산염)는 비스, 트리스, 테트라키스 등을 받는다.
- 음이온은 o로 끝납니다.음이온이 '-ide', '-ate' 또는 '-ite'로 끝나면 최종 'e'를 대체합니다(예: 염화물은 클로리도가 되고 황산은 술파토가 됩니다).이전에는 '-ide'(예: 클로로 및 시아노)가 '-o'(예: 클로로 및 시아노)[30]로 변경되었지만, 2005년 IUPAC 권고에서 이 규칙이 수정되었으며, 이러한 리간드의 올바른 형태는 현재 클로로리도와 시아니도이다.
- 중성 배위자는 일반적인 이름이 붙지만, 일부 예외는3 NH가 아민이 되고2, HO가 아쿠아 또는 아쿠아가 되고, CO가 카르보닐이 되고, NO가 니트로실입니다.
- 중심 원자/이온의 이름을 적습니다.복합체가 음이온일 경우 중심 원자의 이름은 -ate로 끝나며, 사용 가능한 경우 라틴어 이름이 사용됩니다(수은 제외).
- 중심 원자의 산화 상태는 (몇 가지 가능한 것 중 하나이거나 0일 때) 지정되어야 하며 괄호 안에 로마 숫자(또는 0)로 표기되어야 한다.
- 양이온 이름 앞에 음이온 이름을 붙여야 합니다.(해당하는 경우, 마지막 예시와 같이)
예:
| 메탈 | 로 변경되었다 |
|---|---|
| 코발트 | 코발트산염 |
| 알루미늄 | 알루민산염 |
| 크롬 | 크롬산염 |
| 바나듐 | 바나데이트 |
| 구리 | 큐레이트 |
| 철 | 페레이트 |
- [Cd(CN)(2en)]2 → 디시아니도비스(에틸렌디아민) 카드뮴(II)
- [CoCl(NH3)5]SO4 → 펜타아민클로로리도코발트(II)황산염
- [Cu(HO2)]6 → 헥사카코퍼(II) 이온
- [CuClNH53]3− → aminpentachloridocuprate (II) 이온
- K4[Fe(CN)]6 → 헥사시아니도페레이트칼륨(II)
- [NiCl4]2− → 테트라클로로리돈켈산염(II) 이온(IUPAC 명명 [31]규칙에서 클로로 사용이 삭제됨)
둘 이상의 금속(브리징 리간드)에 부착된 배위자의 배위 번호는 배위자 이름 앞에 배치된 그리스 기호 μ의 첨자로 표시됩니다.따라서 삼염화 알루미늄의 이합체는 AlCl24(μ-Cl2)2로 설명됩니다.
모든 음이온기는 임의의 양이온에 의해 전자적으로 안정화 될 수 있다.음이온성 착체는 수소 양이온에 의해 안정화되어 해리할 수 있는 산성 착체가 되어 양이온성 수소를 방출할 수 있다.이런 종류의 복합 화합물은 중심 금속 뒤에 "ic"가 추가된 이름을 가지고 있다.예를 들어 H[Pt(CN)]4의2 이름은 테트라시아노플라틴산(II)이다.
안정성 상수
배위자에 대한 금속 이온의 친화력은 형성 상수라고도 하는 안정성 상수로 설명되며 기호f K로 표시됩니다.이것은 구성 금속 및 배위자에서 조립하기 위한 평형 상수이며, 간단한 경우 다음과 같이 그에 따라 계산될 수 있다.
- xM + yL † zZ
여기서 : x, y 및 z는 각 종의 화학량계수입니다.M은 금속/금속 이온, L은 루이스 염기, 그리고 마지막으로 Z는 복합 이온을 나타냅니다.형성 상수는 매우 다양합니다.큰 값은 시스템이 [32]평형 상태일 때 금속이 배위자에 대한 친화력이 높다는 것을 나타냅니다.
때로는 안정성 상수가 파괴성 상수로 알려진 다른 형태가 될 수 있습니다.이 상수는 생성 상수의 역수로 표현되며 K = 1/K로f [33]표시됩니다d.이 상수는 복합 이온이 개별 금속 및 배위자 성분으로 분해되는 역반응을 나타냅니다.K 값을d 비교할 때 값이 클수록 복합 이온이 불안정하다.
이러한 복잡한 이온이 용액에서 형성되기 때문에 다른 화합물의 용해성에도 중요한 역할을 할 수 있습니다.복합 이온이 형성되면 용액에 포함된 성분들의 농도가 바뀔 수 있습니다.예를 들어 다음과 같습니다.
- Ag+
(aq) + 2 NH3 † Ag(NH3)+
2
- AgCl(s) + HO2(l) † Ag+
(aq) + Cl−
(aq)
이러한 반응이 모두 동일한 반응용기에서 일어났을 경우, Diammine Argentum(I) 복합체의 형성은 용액에서 유리 은 이온의 상당 부분을 소비하기 때문에 NHOH의4 존재로 인해 염화은의 용해도가 증가한다.르샤틀리에의 원리에 따라 은이온을 산물로 하는 염화은의 용해에 대한 평형 반응이 오른쪽으로 이동한다.
이 새로운 용해도는 원래 반응에 대한 K와sp K의 값으로f 계산될 수 있다.용해도는 기본적으로 두 개의 분리된 평형을 하나의 결합된 평형 반응으로 결합함으로써 발견되며, 이 결합된 반응은 새로운 용해도를 결정하는 반응이다.따라서c 새로운 용해도 상수인 K는 다음과 같이 표시됩니다.
배위화합물 적용
금속은 배위 복합체로만 용액에 존재하기 때문에, 이 화합물들은 매우 다양한 면에서 유용합니다.
생물무기화학
생체유기화학 및 생체유기금속화학에서 배위복합체는 구조적 또는 촉매적 기능을 한다.단백질의 약 30%는 금속 이온을 포함하고 있다.예를 들어, 강렬한 색상의 비타민12 B, 헤모글로빈의 헴기, 시토크롬, 클로로필의 클로로린기, 소화에 중요한 가수분해효소인 카르복시펩티드가 있다.또 다른 복합 이온 효소는 과산화수소를 분해하는 카탈라아제이다.합성배위화합물은 단백질, 특히 핵산(예: 항암제 시스플라틴)과 결합하는 데도 사용된다.
산업
균질 촉매 작용은 유기물 생산을 위한 배위 화합물의 주요 응용 분야이다.수소화, 하이드로포름화, 산화를 포함한다.예를 들어, 트리클로로화티타늄과 트리에틸알루미늄의 조합으로 지글러-나타 촉매가 생성되며, 지글러-나타 촉매는 에틸렌과 프로필렌의 중합에 사용되어 섬유, 필름 및 플라스틱으로 상업적으로 매우 중요한 폴리머를 제공합니다.
니켈, 코발트 및 구리는 복잡한 이온을 포함하는 하이드로메탈러지컬 공정을 사용하여 추출할 수 있습니다.그들은 그들의 광석에서 아민 복합체로 추출된다.금속은 또한 복합 이온의 선택적 침전 및 용해도를 사용하여 분리할 수 있다.시안화물은 주로 그들의 광석에서 금과 은을 채취하는 데 사용된다.
프탈로시아닌 복합체는 색소의 중요한 종류이다.
분석.
한 때 배위 화합물을 사용하여 시료 내 금속의 존재를 확인했습니다.질적 무기 분석은 주로 원자 흡수 분광법(AAS), 유도 결합 플라즈마 원자 방출 분광법(ICP-AES), 유도 결합 플라즈마 질량 분석법(ICP-MS)과 같은 기구 분석 방법으로 대체되었다.
「 」를 참조해 주세요.
- 활성화 복합체
- 무기화학 IUPAC 명명법
- 코디네이션 케이지
- 좌표 지오메트리
- 배위 이성질
- 배위 복합체가 반복 단위인 배위 고분자.
- 포함 화합물
- 유기 금속 화학은 유기 조각이 적어도 하나의 C 원자를 통해 금속에 결합되는 특별한 종류의 배위 화합물을 다룬다.
레퍼런스
- ^ Lawrance, Geoffrey A. (2010). Introduction to Coordination Chemistry. Wiley. doi:10.1002/9780470687123. ISBN 9780470687123.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "complex" . doi : 10.1351 / goldbook . C01203
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "조정 엔티티"doi: 10.1351/goldbook.C01330
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ "Definition of coordination sphere". chemistry-dictionary.com.
- ^ "What Is A Coordination Compound?". Purdue University Department of Chemistry.
- ^ Cotton, Frank Albert; Geoffrey Wilkinson; Carlos A. Murillo (1999). Advanced Inorganic Chemistry. p. 1355. ISBN 978-0-471-19957-1.
- ^ Miessler, Gary L.; Donald Arthur Tarr (1999). Inorganic Chemistry. p. 642. ISBN 978-0-13-841891-5.
- ^ "Coordination compound - History of coordination compounds". Encyclopedia Britannica. Retrieved 2021-07-07.
- ^ "Coordination Compound".
- ^ Werner, A. (May 1911). "Zur Kenntnis des asymmetrischen Kobaltatoms. I". Berichte der Deutschen Chemischen Gesellschaft (in German). 44 (2): 1887–1898. doi:10.1002/cber.19110440297.
- ^ 웰스 A.F.(1984) 구조무기화학 제5판 옥스퍼드 과학출판 ISBN 0-19-855370-6
- ^ Angelo R. Rossi; Roald. Hoffmann (1975). "Transition metal pentacoordination". Inorganic Chemistry. 14 (2): 365–374. doi:10.1021/ic50144a032.
- ^ Roald. Hoffmann; Barbara F. Beier; Earl L. Muetterties; Angelo R. Rossi (1977). "Seven-coordination. A molecular orbital exploration of structure, stereochemistry, and reaction dynamics". Inorganic Chemistry. 16 (3): 511–522. doi:10.1021/ic50169a002.
- ^ Jeremy K. Burdett; Roald Hoffmann; Robert C. Fay (1978). "Eight-Coordination". Inorganic Chemistry. 17 (9): 2553–2568. doi:10.1021/ic50187a041.
- ^ Addison, A. W.; Rao, N. T.; Reedijk, J.; van Rijn, J.; Verschoor, G. C. (1984). "Synthesis, structure, and spectroscopic properties of copper(II) compounds containing nitrogen–sulphur donor ligands; the crystal and molecular structure of aqua[1,7-bis(N-methylbenzimidazol-2′-yl)-2,6-dithiaheptane]copper(II) perchlorate". J. Chem. Soc., Dalton Trans. (7): 1349–1356. doi:10.1039/dt9840001349.
- ^ Yang, L.; Powell, D. R.; Houser, R. P. (2007). "Structural variation in copper(I) complexes with pyridylmethylamide ligands: structural analysis with a new four-coordinate geometry index, τ4". Dalton Trans. (9): 955–64. doi:10.1039/b617136b. PMID 17308676.
- ^ Okuniewski, A.; Rosiak, D.; Chojnacki, J.; Becker, B. (2015). "Coordination polymers and molecular structures among complexes of mercury(II) halides with selected 1-benzoylthioureas". Polyhedron. 90: 47–57. doi:10.1016/j.poly.2015.01.035.
- ^ Kaupp, Martin (2001). ""Non-VSEPR" Structures and Bonding in d0 Systems". Angew. Chem. Int. Ed. Engl. 40 (1): 3534–3565. doi:10.1002/1521-3773(20011001)40:19<3534::AID-ANIE3534>3.0.CO;2-#.
- ^ von Zelewsky, A. "배위 화합물의 입체 화학" John Wiley: Chichester, 1995.ISBN 0-471-95599-X.
- ^ Miessler, Gary L.; Donald Arthur Tarr (1999). "9". Inorganic Chemistry. pp. 315, 316. ISBN 978-0-13-841891-5.
- ^ a b c Huhey, James E., 무기화학 (제3판, Harper & Row 1983), 페이지 524-5 ISBN 0-06-042987-9
- ^ a b Jolly, William L. (1984). Modern Inorganic Chemistry. McGraw-Hill. pp. 357–9. ISBN 0-07-032760-2.
- ^ Huhey, James E., 무기화학 (제3판, Harper & Row 1983), 페이지 513-24 ISBN 0-06-042987-9
- ^ Harris, D.; Bertolucci, M. (1989). Symmetry and Spectroscopy. Dover Publications. ISBN 9780486661445.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Cotton, Simon (2006). Lanthanide and Actinide Chemistry. John Wiley & Sons Ltd.
- ^ R. G. Wilkins Kinetics and Mechanis of Reactions of Transition Metal Complexs, 제2판, VCH, Weinheim, 1991년.ISBN 1-56081-125-0
- ^ 예외: 금속 증기, 플라스마 및 합금.
- ^ "Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005" (PDF). IUPAC. section 1.6.4 (p. 10-11). Archived from the original (PDF) on 2014-12-22. Retrieved 2016-03-06.
- ^ "Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005" (PDF). IUPAC. section 1.6.4 (p. 10-11). Archived from the original (PDF) on 2014-12-22. Retrieved 2016-03-06.
- ^ "Complex Ion Equilibria".
- ^ Stretton, Tom. "Solubility and Complex-ion Equilibria" (PDF).
추가 정보
- De Vito, D.; Weber, J.; Merbach, A. E. "t 로듐(II) 및 이리듐(III) 헥사콰이온에서의 물2g 교환을 위한 계산된 부피 및 에너지 프로파일:Ia 메커니즘의 결정적 증거"무기화학, 2004, 제43권, 858-863쪽. doi:10.1021/ic035096n
- 줌달, 스티븐 S화학 원리, 제5판뉴욕:호튼 미플린, 2005. 943~946, 957.OCLC 77760970
- Harris, D., Bertolucci, M., 대칭 및 분광학.1989년 뉴욕 도버 출판사

![cis-[CoCl2(NH3)4]+](http://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Cis-dichlorotetraamminecobalt%28III%29.png/120px-Cis-dichlorotetraamminecobalt%28III%29.png)
![trans-[CoCl2(NH3)4]+](http://upload.wikimedia.org/wikipedia/commons/thumb/5/56/Trans-dichlorotetraamminecobalt%28III%29.png/120px-Trans-dichlorotetraamminecobalt%28III%29.png)
![fac-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/120px-Mer-trichlorotriamminecobalt%28III%29.png)
![Λ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png/110px-Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Δ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png/111px-Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Λ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
![Δ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)

![{\displaystyle K_{f}={\frac {[{\text{Z}}]^{z}}{[{\text{M}}]^{x}[{\text{L}}]^{y}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/868b5effa35af1d28b2bac1f0badf0e007fcf290)



