기체 신호 분자
Gaseous signaling molecules기체 신호 분자는 유기체, 조직 또는 세포에서 내부적으로 합성되거나(내생적으로) 외부에서 유기체, 조직 또는 세포에 의해 수신되는 기체 분자로, 특정 생리적 또는 생리적 또는 생리적 신호를 유도하는 화학적 신호를 전달하는 데 사용된다. 유기체, 조직 또는 세포의 생화학적 변화 이 용어는 예를 들어 산소, 이산화탄소, 아황산가스, 아산화질소, 시안화 수소, 암모니아, 메탄, 수소, 에틸렌 등에 적용된다.
선택적 기체 신호 분자는 신경 전달 물질로 작용하며 가소트랜스미터라고 불린다. 여기에는 일산화질소, 일산화탄소, 황화수소 등이 포함된다.
역사적으로 가스와 생리적 효과에 대한 연구는 사실적인 방송으로 분류되었다.
각 기체 신호 분자의 생물학적 역할은 아래에 설명되어 있다.
가스트랜스미터스
가소트랜스미터는 신경전달물질의 일종이다. 가스방사기로 분류되는 기체는 질소산화물, 일산화탄소, 황화수소 등 3개뿐이다.
기체 신호 분자
산소
이 구간은 확장이 필요하다. 덧셈으로 도와줘도 된다(2016년 3월) |
이산화탄소
이산화탄소는 혈액 공급의 국소적 자동 조절의 매개체 중 하나이다. 만약 그것의 수치가 높다면, 모세혈관은 그 조직으로 더 많은 혈액이 흐를 수 있도록 확장된다.
중탄산염 이온은 혈액 pH를 조절하는데 중요하다. 사람의 호흡률은 혈중 CO의2 수치에 영향을 미친다. 너무 느리거나 얕은 호흡은 호흡산증을 유발하는 반면 너무 빠른 호흡은 과호흡으로 이어져 호흡 알칼리증을 유발할 수 있다.
비록 신체가 신진대사를 위해 산소를 필요로 하지만, 낮은 산소 수준은 보통 호흡을 자극하지 않는다. 오히려 호흡은 더 높은 이산화탄소 수치에 의해 자극을 받는다.[1]
호흡기 센터는 동맥의 CO2 압력을 40 mm Hg로 유지하려고 한다. 의도적인 과호흡으로 동맥혈의 CO2 함량을 10~20mmHg(혈액의 산소 함량은 거의 영향을 받지 않음)로 낮출 수 있고 호흡기 추진력이 저하된다. 과호흡을 하지 않는 것보다 과호흡 후 숨을 더 오래 참을 수 있는 이유다. 이는 호흡의 필요성이 압도적으로 커지기 전에 무의식이 초래될 수 있는 위험을 수반하며, 이것이 프리 다이빙 전에 과호흡이 특히 위험한 이유다.
아산화질소
생물학적 시스템의 아산화질소는 아산화질소의 효소 또는 비응질적 감소에 의해 형성될 수 있다.[2] 체외 연구에서는 내생성 아산화질소가 아산화질소와 티올의 반응에 의해 형성될 수 있다는 것을 보여주었다.[3] 일부 저자들은 NO의2 이러한 감소 과정이 간세포, 특히 세포질 및 미토콘드리아에서 일어난다는 것을 보여주었고, NO가2 포유류 세포에서 만들어질 수 있다고 제안했다.[4] NO는2 변성화라고 불리는 과정에서 일부 박테리아에 의해 생성된다는 것은 잘 알려져 있다.[5]
1981년 아산화질소(N2O)를 이용한 임상 연구로부터 기체가 약리학적 수용체에서 직접 작용하여 신경전달물질로 작용한다는 것이 처음 제시되었다.[6][7][8] 체외 실험에서 나중에 NIDA에서 복제된 이러한 관측을[9] 확인했다.[10]
오피오이드 수용체에서의 직간접[11][12] 작용과는 별개로,[13] NO는2 NMDA 수용체 매개 활성과 이온 전류를 억제하고 NMDA 수용체 매개 흥분성 및 신경 파괴 생성을 감소시키는 것으로도 나타났다.[14] 아산화질소는 또한 메티오닌 신타제를 억제하고 호모시스테인의 메티오닌으로의 전환을 늦추고 호모시스테인 농도를 증가시키며 메티오닌 농도를 감소시킨다. 이 효과는 림프구 세포 배양액과[15] 인간의 간 조직검사 샘플에서 나타났다.[16]
아산화질소는 헴에 리간드로 묶이지 않으며 티올 함유 단백질과 반응하지 않는다. 그럼에도 불구하고, 연구들은 아산화질소가 헤모글로빈, 미오글로빈, 시토크롬 산화효소와 같은 일부 헤메 함유 단백질의 내부 구조물에 역행적으로 그리고 비동결적으로 "삽입"할 수 있고 구조와 기능을 변경할 수 있다는 것을 보여주었다.[17] 아산화질소가 이러한 단백질의 구조와 기능을 변화시키는 능력은 헤모글로빈의[18] 시스테인 티올의 적외선 스펙트럼의 변화 및 시토크롬 산화효소의 부분적이고 가역적인 억제에 의해 입증되었다.[19]
내생성 아산화질소는 내생성 오피오이드와[20][21] NMDA 시스테로스경화증, 심한 패혈증, 심각한 말라리아 또는 자가면역성을 조절하는 역할을 할 수 있다. 인간과 관련된 임상실험은 실시됐지만 결과는 아직 나오지 않았다.[22]
아산화 탄소
아산화 탄소, CO는32 일반적으로 일산화탄소, CO를 생성하는 모든 생화학적 공정에서 소량으로 생산될 수 있다. 예를 들어, 헤메 산소화효소-1에 의한 헤메 산화가 진행되는 동안 말이다. 그것은 또한 말론산으로부터 형성될 수 있다. 그것은 생물체 내에서 탄소 하급 산화물 빨리 대환 polycarbon 구조로 일반적인 공식(C3O2)n(대부분(C3O2)6과(C3O2)8)를, 그리고 Na+/K+-ATP-ase과 Ca-dependent ATP-ase 사람들은 대환식 화합물 강력한 억제제, 그리고digoxin-like 생리적 특성과 나트륨 이뇨고 있어 중합하달 수 있다는 것을 보였다.tihyperten사생적인 행동 이러한 매크로순환 탄소 아산화질소 고분자 화합물은 내생 디옥신과 같은 Na+/K-ATP-ases와+ Ca 의존성 ATP-ases의 조절기와 내생성 내염제와 항혈증제인 것으로 생각된다.[23][24][25] 그 외에도, 일부 저자들은 아산화 탄소의 매크로사이클릭 화합물이 자유로운 급진적 형성과 산화적 스트레스를 감소시킬 수 있으며, 예를 들어 망막에서와 같은 내생적인 항암 보호 메커니즘의 역할을 할 수 있다고 생각한다.[26]
이산화황
포유류 생물학에서 아황산가스의 역할은 아직 잘 이해되지 않았다.[27] 아황산가스는 폐 스트레치 수용체로부터의 신경 신호를 차단하고 헤링-브뤼어 팽창 반사를 없앤다.
내생성 아황산가스가 올레산에 의한 실험적인 폐손상을 감소시키는 역할을 하는 것으로 나타났다. 내생성 아황산가스는 지질 과산화, 자유급성형성, 산화스트레스 및 실험 폐 손상 시 염증을 낮췄다. 반대로, 성공적인 폐 손상은 내생적인 아황산가스의 생산을 현저하게 감소시켰고, 지질 과산화지질, 자유 급진적 형성, 산화 스트레스와 염증을 증가시켰다. 더욱이 내생 SO를2 생성하는 효소의 봉쇄는 실험에서 폐조직의 손상 정도를 현저하게 증가시켰다. 반대로 쥐의 식단에 아세틸시스틴이나 글루타티온을 첨가하면 내인성 SO가2 생성되는 양이 증가하여 폐손상, 자유급성형성, 산화스트레스, 염증, 사멸을 감소시켰다.[28]
내생성 아황산가스는 심장과 혈관 기능을 조절하는 데 중요한 생리학적 역할을 하며, 이산화황의 대사 이상 또는 부족은 동맥 고혈압, 무신경화증, 폐동맥 고혈압, 협심증 등 여러 가지 다른 심혈관 질환에 기여할 수 있다고 여겨진다.[29]
선천성 심장질환으로 폐동맥 고혈압이 있는 아동은 호모시스테인 수치가 높고 내생성 아황산가스의 수치가 정상 대조군 아동보다 낮은 것으로 나타났다. 더욱이 이러한 생화학적 파라미터는 폐동맥 고혈압의 중증도와 강하게 상관관계가 있다. 저자들은 호모시스테인이 질병의 심각성을 나타내는 유용한 생화학적 표식 중 하나이며, 아황산가스의 신진대사는 그러한 환자들에게 잠재적인 치료 대상 중 하나라고 생각했다.[30]
내생성 아황산가스는 또한 MAPK 활동을 낮추고 아데닐 사이클라아제와 단백질 키나제 A를 활성화시킴으로써 혈관 내 내 내피성 평활근 세포의 증식률을 낮추는 것으로 나타났다.[31] 원활한 근육세포 증식은 혈관의 비대칭적 리모델링과 그 협착증의 중요한 메커니즘 중 하나이므로 동맥 고혈압과 동맥경화증에서 중요한 병생적 메커니즘이다.
낮은 농도의 내생성 아황산가스는 내피에 의존하는 혈관확장을 일으킨다. 고농도에서는 내피에 독립적인 혈관 절개를 유발하고 심박출량 기능에 부정적인 비등방성 영향을 미치기 때문에 혈압과 심근 산소 소비량을 효과적으로 낮춘다. 이산화황의 혈관확장 효과는 ATP 의존 칼슘 채널과 L형("디히드롭피리딘") 칼슘 채널을 통해 매개된다. 내생성 아황산가스는 또한 강력한 항염증, 항산화제, 세포 보호제다. 혈압을 낮추고 혈관의 비대칭 리모델링을 늦추고 특히 인티마가 두꺼워진다. 지질대사를 조절하기도 한다.[32]
내생성 아황산가스는 이소프로테레놀 아드레날린 과다 자극에 의한 심근 손상을 감소시키고 심근 항산화 방어 예비력을 강화한다.[33]
시안화수소
일부 저자들은 뉴런이 내생성 또는 외생성 오피오이드에 의해 오피오이드 수용체 활성화에 따라 시안화수소를 생산할 수 있다는 것을 보여주었다. 그들은 또한 HCN의 뉴런 생산이 NMDA 수용체를 활성화하고 뉴런 세포간 신호전달(신경전달)에 역할을 한다는 것을 보여주었다. 또한 오피오이드에 의한 내생 뉴런 HCN 생산 증가는 적절한 오피오이드 진통제에 필요한 것으로 보인다. HCN 스캐빈저에 의해 오피오이드의 진통 작용이 감쇠되었기 때문이다. 그들은 내인성 HCN을 신경 조절기로 간주했다.[34]
배양된 페로모사이토마 세포에서 무스카린콜린거 수용체를 자극하면 HCN생성이 증가하지만, 살아있는 유기체( 생체내)에서는 실제로 무스카린콜린거 자극이 HCN생성을 감소시킨다는 것도 나타났다.[35]
백혈구는 혈소판 세포증 동안 HCN을 생성한다.[34]
니트로프루사이드 나트륨에 의한 혈관조영술은 NO 발생뿐만 아니라 독성뿐만 아니라 혈중 시안화수치가 상승하지 않는 니트로글리세린 및 기타 비시안 유발 질산염에 비해 일부 항고혈압 효능이 첨가되어 있는 것으로 나타났다.[36]
암모니아
암모니아는 또한 정상적인 동물 생리학과 비정상적인 동물 생리학 모두에 역할을 한다. 정상적인 아미노산 대사를 통해 생합성되지만 고농도에서는 독성이 있다.[37] 간은 요소 순환이라고 알려진 일련의 반응을 통해 암모니아를 요소로 전환시킨다. 간경변에서 볼 수 있는 것과 같은 간기능 장애는 혈액 속의 암모니아 양을 증가시킬 수 있다(고)의 양을 증가시킬 수 있다. 마찬가지로, 오니틴 트랜스 카르바밀라아제 같은 요소 순환을 담당하는 효소의 결함은 고암모니아혈증을 유발한다. 고암모니아혈증은 간뇌병증의 혼란과 혼수상태에 기여하는 것은 물론, 요소주기 결함과 유기산부리증 환자에게서 흔히 볼 수 있는 신경질환에 기여한다.[38]
암모니아는 정상적인 동물산/기초 균형에 중요하다. 글루타민에서 암모늄이 생성된 후 α-케토글루타레이트(α-케토글루타레이트)는 분해되어 식이산 완충제로 이용 가능한 중탄산염 분자 2개를 생성할 수 있다. 암모늄은 소변 속에 배설되어 순산 손실을 초래한다. 암모니아는 그 자체로 신관절 전체에 확산되어 수소 이온과 결합하여 추가적인 산성 배설을 허용할 수 있다.[39]
메탄
일부 저자들은 내생성 메탄은 장내 식물체에 의해서만 생성되고 혈액에 흡수되며, 진핵 세포에 의해서도 소량으로 생성된다는 것을 보여주었다. 그리고 그들은 또한 실험적인 미토콘드리아 저산소증, 예를 들어 아지드화 나트륨을 섭취하는 동안 내생성 메탄 생산량이 증가한다는 것을 보여주었다. 그들은 메탄이 저산소증과 스트레스의 세포간 신호 중 하나일 수 있다고 생각했다.[40]
다른 저자들은 세포 메탄생산이 패혈증이나 박테리아 내독성혈증에서도 증가한다는 것을 보여주었는데, 여기에는 LPS(LopolySaccharide) 투여에 의한 내독성혈증의 실험적 모방이 포함된다.[41]
일부 다른 연구자들은 장내 식물체가 생산한 메탄은 장에 완전히 '생물학적으로 중립적'이 아니며, 정상 생리학적으로 근막염 조절에 참여한다는 것을 보여주었다. 그리고 그 과잉은 트임, 편평, 복통뿐만 아니라 기능적 변비까지 유발한다.[42]
에틸렌
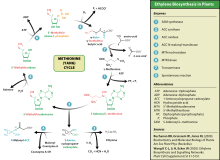
에틸렌은 식물의 호르몬 역할을 한다.[43] 그것은 과일의 숙성, 꽃의 개화, 잎의 퇴화를 자극하거나 조절함으로써 식물의 일생 동안 미량 수준에서 작용한다. 상업용 숙성실은 에탄올의 액체 공급으로 에틸렌 가스를 만들기 위해 "촉매 발전기"를 사용한다. 일반적으로 가스 배출량은 500~2000ppm으로 24~48시간 사용된다. 고온 숙성(20°C;68°F)이 24시간 내에 10%의 CO2 수준을 생성하는 것으로 확인됨에 따라 가스를 주입할 때 숙성실에서 이산화탄소 농도를 제어하도록 주의해야 한다.[44]
에틸렌은 숙성을 자극하기 위해 무화과를 자르곤 했던 고대 이집트인들부터 사용되어 왔다. 고대 중국인들은 배의 숙성을 강화하기 위해 밀폐된 방에서 향을 피웠다. 1864년 가로등에서 가스가 새어 성장이 저해되고 식물이 뒤틀리며 줄기가 비정상적으로 두꺼워지는 현상이 나타났다는 사실이 밝혀졌다.[43] 1901년, Dimitry Nelljubow라는 이름의 러시아 과학자는 활성 성분이 에틸렌이라는 것을 보여주었다.[45] Sarah Debt는 1917년에 에틸렌이 감기를 자극한다는 것을 발견했다.[46] 1934년에야 제인은 식물이 에틸렌을 합성한다고 보고했다.[47] 1935년에 크로커는 에틸렌이 식물성 조직의 노화뿐만 아니라 과일의 숙성을 책임지는 식물 호르몬이라고 제안했다.[48]
에틸렌은 잎, 줄기, 뿌리, 꽃, 과일, 통조림, 씨앗을 포함한 높은 식물의 모든 부분에서 생산된다. 에틸렌 생산은 다양한 개발 및 환경적 요인에 의해 규제된다. 식물의 수명 동안, 에틸렌 생산은 발아, 과일의 숙성, 잎의 퇴화, 꽃의 노화 등 일정한 성장 단계에서 유도된다. 에틸렌 생산은 또한 기계적 부상, 환경적 스트레스, 보조 및 기타 규제 기관을 포함한 특정 화학 물질과 같은 다양한 외부 측면에 의해 유발될 수 있다.[49]
에틸렌은 아미노산 메티오닌에서 S-아데노실-L-메티오닌(SAM, 일명 아도메트)으로 메트 아데노실전달효소(Met Adenosyl transferase)라는 효소에 의해 생합성된다. 그런 다음 SAM은 효소 ACS 신타아제(ACS)에 의해 1-아미노클로프로판-1-카복실산(ACC)으로 전환된다. ACS의 활성도는 에틸렌 생성 속도를 결정하므로 이 효소의 조절은 에틸렌 생합성성의 핵심이다. 마지막 단계는 산소를 필요로 하며, 이전에 에틸렌 형성 효소(EFE)로 알려진 효소 ACC-oxidase(ACO)의 작용을 포함한다. 에틸렌 생합성은 내생성 또는 외생성 에틸렌에 의해 유도될 수 있다. ACC 합성은 높은 수준의 보조에 따라 증가하며, 특히 아세트산(IAA)과 사이토키닌을 인도한다.
에틸렌은 아라비독시스(Arabidopsis)의 ETR1 단백질과 같은 5개의 트랜섬브레인 단백질 다이머로 구성된 제품군에 의해 인식된다. 에틸렌 수용체를[which?] 인코딩하는 유전자는 아라비도시스 탈리아냐와 토마토에서 복제되었다.[citation needed] 에틸렌 수용체는 아라비독시스(Arabidopsis)와 토마토 게놈에 있는 여러 유전자에 의해 암호화된다. 아라비도시스에서는 수용체 5개, 토마토에서는 최소 6개로 구성된 유전자 계열의 돌연변이는 에틸렌 불감증으로 이어질 수 있다.[50] 에틸렌 수용체를 위한 DNA 서열은 다른 많은 식물 종에서도 확인되었고 에틸렌 결합 단백질은 시아노박테리아에서도 확인되었다.[43]
홍수, 가뭄, 오싹, 부상, 병원체 공격과 같은 환경적인 단서는 식물에 에틸렌 형성을 유도할 수 있다. 홍수가 나면 뿌리는 산소 부족, 즉 무옥시아로 인해 1-아미노시클로프로판-1-카복실산(ACC)의 합성을 초래한다. ACC는 공장에서 위쪽으로 운반된 후 잎으로 산화된다. 생산되는 에틸렌은 잎의 탄소 이동(에피니스트)을 유발하며, 아마도 식물이 수분을 잃도록 도울 것이다.[51]
공장 내 에틸렌은 다음과 같은 반응을 유도한다.
- 3중 반응, 두드러진 아피컬 훅으로 하이포코틸의 굵기 및 단축.
- 수분작용에서 꽃가루가 오명에 도달하면 에테네의 전구체인 ACC가 꽃잎에 분비되며, ACC는 ACC 산화효소가 함유된 에틸렌을 방출한다.
- 잎과 꽃 노화를 자극한다.
- 식물 사용에 대비하여 성숙한 자일세포의 노화를 촉진한다.
- 잎사귀 퇴화를 유도한다.
- 씨앗 발아 유도
- 뿌리털 성장 유도 - 리조스하트 형성을 통한 수분 및 미네랄 흡수 효율 증대
- 홍수 시 발생근의 성장을 유도한다.
- 물에 잠긴 식물 조직에서 저산소 조건(저산소증)에서 생존을 촉진
- 후각을 자극함 — 잎사귀가 자라나고, 잎이 늘어져 저절로 곱슬곱슬하게 된다.
- 과일 숙성[60] 촉진
- 에틸렌의 추가 방출을 유발하는 일부 과일의 호흡기 상승을 유도한다.
- 그라비트로피즘에 영향을 미친다.
- 영양 휨 자극
- 줄기 성장을 억제하고 줄기 및 세포의 확대 및 종묘 단계 이외의 수평 가지 성장을 자극한다(Hyponastic response 참조).
- Auxin 운송에 대한 간섭(Auxin 농도가 높은 경우)
- 일부 수생식물을 제외하고 성장 및 기공 폐쇄 억제 또는 일부 쌀 품종과 같은 상습 침수된 식물을 제외하고 반대 현상이 발생하는 경우(CO
2, O 보존
2) - 파인애플에서 꽃을 피우는 유도
- 파르비투스닐과[61] 국화오리폴륨에서의[62] 단일유도 꽃개시 억제
지질 과산화 때문에 인간을 포함한 포유류에서도 소량의 내생 에틸렌이 생산된다. 그런 다음 일부 내생 에틸렌은 산화 에틸렌에 산화되어 헤모글로빈을 포함한 DNA와 단백질을 감압할 수 있다(N-terminal valine, N-hydroxythyl-valine으로 특정 유도체를 형성함).[63] 내생성 에틸렌옥사이드도 환경성(외생성) 1과 마찬가지로 DNA에서 구아닌을 알킬화시켜 7-(2-히드록시틸)-과닌을 형성할 수 있으며 이는 내인성 발암 위험을 내포하고 있다.[64] 그것은 또한 돌연변이 유발적이다.[65][66]
참조
- ^ Hogg N, Singh RJ, Kalyanaraman B (March 18, 1996). "The role of glutathione in the transport and catabolism of nitric oxide". FEBS Letters. 382 (3): 223–228. doi:10.1016/0014-5793(96)00086-5. PMID 8605974.
- ^ DeMaster EG, Quast BJ, Redfern B, Nagasawa HT (Sep 12, 1995). "Reaction of nitric oxide with the free sulfhydryl group of human serum albumin yields a sulfenic acid and nitrous oxide". Biochemistry. 34 (36): 11494–11499. doi:10.1021/bi00036a023. PMID 7547878.
- ^ Hyun J, Chaudhuri G, Fukuto JM (September 1, 1999). "The Reductive Metabolism of Nitric Oxide in Hepatocytes: Possible Interaction with Thiols". Drug Metabolism and Disposition. 27 (9): 1005–1009. PMID 10460799.
- ^ Torres, M.J.; Simon, J.; Rowley, G.; Bedmar, E.J.; Richardson, D.J.; Gates, A.J.; Delgado, M.J. (2016), "Nitrous Oxide Metabolism in Nitrate-Reducing Bacteria", Advances in Microbial Physiology, Elsevier, vol. 68, pp. 353–432, doi:10.1016/bs.ampbs.2016.02.007, ISBN 978-0-12-804823-8, retrieved 2021-10-14
- ^ Gillman MA, Lichtigfeld FJ (January 1981). "A comparison of the effects of morphine sulphate and nitrous oxide analgesia on chronic pain states in man". Journal of the Neurological Sciences. 49 (1): 41–45. doi:10.1016/0022-510X(81)90186-6. PMID 7205318. S2CID 32640794.
- ^ Gillman MA, Lightigfeld FJ (February 1981). "The similarity of the action of nitrous oxide and morphine". Pain. 10 (1): 110. doi:10.1016/0304-3959(81)90054-3. PMID 7232008. S2CID 53157904.
- ^ Gillman MA, Lichtigfeld FJ (May 1983). "Nitrous oxide interacts with opioid receptors: more evidence". Anesthesiology. 58 (5): 483–484. doi:10.1097/00000542-198305000-00021. PMID 6301312.
- ^ Daras C, Cantrill RC, Gillman MA (April 1983). "[3H]naloxone displacement: evidence for nitrous oxide as opioid receptor agonist". European Journal of Pharmacology. 89 (1–2): 177–178. doi:10.1016/0014-2999(83)90626-x. PMID 6305684.
- ^ Ori C, Ford-Rice F, London ED (March 1989). "Effects of nitrous oxide and halothane on mu and kappa opioid receptors in guinea-pig brain". Anesthesiology. 70 (3): 541–544. doi:10.1097/00000542-198903000-00027. PMID 2564264.
- ^ Daras, C; Cantrill, R; Gillman, MA (1983). "(3H)Naloxone displacement: evidence for nitrous oxide as opioid receptor agonist". Eur J Pharmacol. 89 (1–2): 177–178. doi:10.1016/0014-2999(83)90626-x. PMID 6305684.
- ^ Ori, C.; Ford-Rice, F; London, E.D. (1989). "Effects of nitrous oxide and halothane on mu and kappa opioid receptors in guinea-pig brain". Anesthesiology. 70 (3): 541–544. doi:10.1097/00000542-198903000-00027. PMID 2564264.
- ^ Finck, A. D., Samaniego, E, Ngai, S.H. [1995년] 아산화질소는 메5-앵팔린과 메5-앵팔린-아그6-pe7을 선택적으로 캐닌 제3 심실 뇌척수액으로 방출한다. 마취 및 진통 80: 664-70
- ^ Jevtović-Todorović V, Todorović SM, Mennerick S, Powell S, Dikranian K, Benshoff N, Zorumski CF, Olney JW (Apr 1998). "Nitrous oxide (laughing gas) is an NMDA antagonist, neuroprotectant and neurotoxin". Nat Med. 4 (4): 460–463. doi:10.1038/nm0498-460. PMID 9546794. S2CID 9998244.
- ^ Christensen B, Refsum H, Garras A, Ueland PM (Jun 1992). "Homocysteine remethylation during nitrous oxide exposure of cells cultured in media containing various concentrations of folates". J Pharmacol Exp Ther. 261 (3): 1096–1105. PMID 1602376.
- ^ Koblin DD, Waskell L, Watson JE, Stokstad EL, Eger EI 2nd (Feb 1982). "Nitrous oxide inactivates methionine synthetase in human liver". Anesth Analg. 61 (2): 75–78. doi:10.1213/00000539-198202000-00001. PMID 7198880. S2CID 31136411.
- ^ Sampath V, Zhao XJ, Caughey WS (Apr 27, 2001). "Anesthetic-like interactions of nitric oxide with albumin and hemeproteins. A mechanism for control of protein function". The Journal of Biological Chemistry. 276 (17): 13635–13643. doi:10.1074/jbc.M006588200. PMID 11278308.
- ^ Dong A, Huang P, Zhao XJ, Sampath V, Caughey WS (September 30, 1994). "Characterization of sites occupied by the anesthetic nitrous oxide within proteins by infrared spectroscopy". The Journal of Biological Chemistry. 269 (39): 23911–23917. doi:10.1016/S0021-9258(19)51025-0. PMID 7929038.
- ^ Einarsdóttir O, Caughey WS (5 Jul 1988). "Interactions of the anesthetic nitrous oxide with bovine heart cytochrome c oxidase. Effects on protein structure, oxidase activity, and other properties". The Journal of Biological Chemistry. 263 (19): 9199–9205. doi:10.1016/S0021-9258(19)76525-9. PMID 2837481.
- ^ Gillman MA, Lichtigfeld FJ (March 1985). "Nitrous oxide acts directly at the mu opioid receptor". Anesthesiology. 62 (3): 375–376. doi:10.1097/00000542-198503000-00040. PMID 2983587.
- ^ Gillman MA, Lichtigfeld FJ (January 1981). "A comparison of the effects of morphine sulphate and nitrous oxide analgesia on chronic pain states in man". J. Neurol. Sci. 49 (1): 41–45. doi:10.1016/0022-510X(81)90186-6. PMID 7205318. S2CID 32640794.
- ^ Johnson, Carolyn Y. (October 16, 2009). "Poison gas may carry a medical benefit". The Boston Globe. Retrieved October 16, 2009.
- ^ Kerek F (Sep 2000). "The structure of the digitalislike and natriuretic factors identified as macrocyclic derivatives of the inorganic carbon suboxide". Hypertension Research. 23 (Suppl S33): S33–38. doi:10.1291/hypres.23.Supplement_S33. PMID 11016817.
- ^ Stimac R, Kerek F, Apell HJ (Apr 2003). "Macrocyclic carbon suboxide oligomers as potent inhibitors of the Na,K-ATPase". Annals of the New York Academy of Sciences. 986 (1): 327–329. Bibcode:2003NYASA.986..327S. doi:10.1111/j.1749-6632.2003.tb07204.x. PMID 12763840.
- ^ Kerek F, Stimac R, Apell HJ, Freudenmann F, Moroder L (23 December 2002). "Characterization of the macrocyclic carbon suboxide factors as potent Na,K-ATPase and SR Ca-ATPase inhibitors". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1567 (1–2): 213–220. doi:10.1016/S0005-2736(02)00609-0. PMID 12488055.
- ^ Tubaro E. (Jun 1966). "Carbon suboxide, the probable precursor of an antitumor cellular sustance [sic]: retina". Boll Chim Farm (in Italian). 105 (6): 415–416. PMID 6005012.
- ^ Liu, D.; Jin, H; Tang, C; Du, J (2010). "Sulfur dioxide: a novel gaseous signal in the regulation of cardiovascular functions". Mini-Reviews in Medicinal Chemistry. 10 (11): 1039–1045. doi:10.2174/1389557511009011039. PMID 20540708. Archived from the original on 2013-04-26. Retrieved 2015-03-06.
- ^ Chen S, Zheng S, Liu Z, Tang C, Zhao B, Du J, Jin H (Feb 2015). "Endogenous sulfur dioxide protects against oleic acid-induced acute lung injury in association with inhibition of oxidative stress in rats". Lab. Invest. 95 (2): 142–156. doi:10.1038/labinvest.2014.147. PMID 25581610.
- ^ Tian H. (Nov 2014). "Advances in the study on endogenous sulfur dioxide in the cardiovascular system". Chin Med J. 127 (21): 3803–3807. PMID 25382339.
- ^ Yang R, Yang Y, Dong X, Wu X, Wei Y (Aug 2014). "Correlation between endogenous sulfur dioxide and homocysteine in children with pulmonary arterial hypertension associated with congenital heart disease". Zhonghua Er Ke Za Zhi (in Chinese). 52 (8): 625–629. PMID 25224243.
- ^ Liu D, Huang Y, Bu D, Liu AD, Holmberg L, Jia Y, Tang C, Du J, Jin H (May 2014). "Sulfur dioxide inhibits vascular smooth muscle cell proliferation via suppressing the Erk/MAP kinase pathway mediated by cAMP/PKA signaling". Cell Death Dis. 5 (5): e1251. doi:10.1038/cddis.2014.229. PMC 4047873. PMID 24853429.
- ^ Wang XB, Jin HF, Tang CS, Du JB (16 Nov 2011). "The biological effect of endogenous sulfur dioxide in the cardiovascular system". Eur J Pharmacol. 670 (1): 1–6. doi:10.1016/j.ejphar.2011.08.031. PMID 21925165.
- ^ Liang Y, Liu D, Ochs T, Tang C, Chen S, Zhang S, Geng B, Jin H, Du J (Jan 2011). "Endogenous sulfur dioxide protects against isoproterenol-induced myocardial injury and increases myocardial antioxidant capacity in rats". Lab. Invest. 91 (1): 12–23. doi:10.1038/labinvest.2010.156. PMID 20733562.
- ^ a b Borowitz JL, Gunasekar PG, Isom GE (12 Sep 1997). "Hydrogen cyanide generation by mu-opiate receptor activation: possible neuromodulatory role of endogenous cyanide". Brain Res. 768 (1–2): 294–300. doi:10.1016/S0006-8993(97)00659-8. PMID 9369328. S2CID 12277593.
- ^ Gunasekar PG, Prabhakaran K, Li L, Zhang L, Isom GE, Borowitz JL (May 2004). "Receptor mechanisms mediating cyanide generation in PC12 cells and rat brain". Neurosci Res. 49 (1): 13–18. doi:10.1016/j.neures.2004.01.006. PMID 15099699. S2CID 29850349.
- ^ Smith RP, Kruszyna H (Jan 1976). "Toxicology of some inorganic antihypertensive anions". Fed Proc. 35 (1): 69–72. PMID 1245233.
- ^ "PubChem Substance Summary". Retrieved 7 July 2009.
- ^ Zschocke, Johannes; Georg Hoffman (2004). Vademecum Metabolism. Friedrichsdorf, Germany: Milupa GmbH.
- ^ Rose, Burton; Helmut Rennke (1994). Renal Pathophysiology. Baltimore: Williams & Wilkins. ISBN 978-0-683-07354-6.
- ^ Eszter Tuboly; Andrea Szabó; Dénes Garab; Gábor Bartha; Ágnes Janovszky; Gábor Ero″s; Anna Szabó; Árpád Mohácsi; Gábor Szabó; József Kaszaki; Miklós Ghyczy; Mihály Boros (15 January 2013). "Methane biogenesis during sodium azide-induced chemical hypoxia in rats". American Journal of Physiology. Cell Physiology. 304 (2): 207–214. doi:10.1152/ajpcell.00300.2012. PMID 23174561.
- ^ Tuboly E, Szabó A, Erős G, Mohácsi A, Szabó G, Tengölics R, Rákhely G, Boros M (Dec 2013). "Determination of endogenous methane formation by photoacoustic spectroscopy" (PDF). Journal of Breath Research. 7 (4): 046004. Bibcode:2013JBR.....7d6004T. doi:10.1088/1752-7155/7/4/046004. PMID 24185326.
- ^ Sahakian AB, Jee SR, Pimentel M (Aug 2010). "Methane and the gastrointestinal tract". Dig Dis Sci. 55 (8): 2135–2143. doi:10.1007/s10620-009-1012-0. PMID 19830557. S2CID 5493946.
- ^ a b c Lin, Z.; Zhong, S.; Grierson, D. (2009). "Recent advances in ethylene research". J. Exp. Bot. 60 (12): 3311–36. doi:10.1093/jxb/erp204. PMID 19567479.
- ^ 웨이백 기계에 보관된 에틸렌 가싱 및 이산화탄소 제어에 대한 외부 링크 2010-09-14. ne-postharvest.com
- ^ Neljubov D. (1901). "Uber die horizontale Nutation der Stengel von Pisum sativum und einiger anderen Pflanzen". Beih Bot Zentralbl. 10: 128–139.
- ^ Doubt, Sarah L. (1917). "The Response of Plants to Illuminating Gas". Botanical Gazette. 63 (3): 209–224. doi:10.1086/332006. hdl:2027/mdp.39015068299380. JSTOR 2469142. S2CID 86383905.
- ^ Gane R. (1934). "Production of ethylene by some fruits". Nature. 134 (3400): 1008. Bibcode:1934Natur.134.1008G. doi:10.1038/1341008a0. S2CID 4090009.
- ^ 크로커 W, 히치콕 AE, 짐머만 PW.(1935년) "에틸렌과 식물 보조제의 효과에서의 유사성" 기여하다. 보이즈 톰슨 주식회사. 7. 231-48. Auxins Cytokinins IAA 성장 물질, 에틸렌
- ^ Yang, S. F.; Hoffman N. E. (1984). "Ethylene biosynthesis and its regulation in higher plants". Annu. Rev. Plant Physiol. 35: 155–89. doi:10.1146/annurev.pp.35.060184.001103.
- ^ Bleecker, A. B.; Esch, J. J.; Hall, A. E.; Rodríguez, F. I.; Binder, B. M. (1998). "The ethylene-receptor family from Arabidopsis: Structure and function". Philosophical Transactions of the Royal Society B: Biological Sciences. 353 (1374): 1405–12. doi:10.1098/rstb.1998.0295. PMC 1692356. PMID 9800203.
- ^ 에피네스티를 설명하고 있어. 플랜토모몬즈.인프라.
- ^ Tanimoto, Mimi; Roberts, Keith; Dolan, Liam (December 1995). "Ethylene is a positive regulator of root hair development in Arabidopsis thaliana". The Plant Journal. 8 (6): 943–948. doi:10.1046/j.1365-313X.1995.8060943.x. PMID 8580964.
- ^ Zhang, Yingjiao; Du, Huan; Xu, Feiyun; Ding, Yexin; Gui, Yao; Zhang, Jianhua; Xu, Weifeng (June 2020). "Root-Bacteria Associations Boost Rhizosheath Formation in Moderately Dry Soil through Ethylene Responses". Plant Physiology. 183 (2): 780–792. doi:10.1104/pp.19.01020. PMC 7271771. PMID 32220965.
- ^ Hartman, Sjon (3 June 2020). "Trapped in the Rhizosheath: Root-Bacterial Interactions Modulate Ethylene Signaling". Plant Physiology. 183 (2): 443–444. doi:10.1104/pp.20.00379. PMC 7271798. PMID 32493810.
- ^ Dawood, Thikra; Yang, Xinping; Visser, Eric J.W.; te Beek, Tim A.H.; Kensche, Philip R.; Cristescu, Simona M.; Lee, Sangseok; Floková, Kristýna; Nguyen, Duy; Mariani, Celestina; Rieu, Ivo (April 2016). "A Co-Opted Hormonal Cascade Activates Dormant Adventitious Root Primordia upon Flooding in dulcamara". Plant Physiology. 170 (4): 2351–2364. doi:10.1104/pp.15.00773. PMC 4825138. PMID 26850278.
- ^ Negi, Sangeeta; Sukumar, Poornima; Liu, Xing; Cohen, Jerry D.; Muday, Gloria K. (January 2010). "Genetic dissection of the role of ethylene in regulating auxin-dependent lateral and adventitious root formation in tomato". The Plant Journal. 61 (1): 3–15. doi:10.1111/j.1365-313X.2009.04027.x. hdl:10339/30054. PMID 19793078.
- ^ Hartman, S; Liu, Z; van Veen, H; Vicente, J; Reinen, E; Martopawiro, S; Zhang, H; van Dongen, N; Bosman, F; Bassel, GW; Visser, EJW; Bailey-Serres, J; Theodoulou, FL; Hebelstrup, KH; Gibbs, DJ; Holdsworth, MJ; Sasidharan, R; Voesenek, LACJ (5 September 2019). "Ethylene-mediated nitric oxide depletion pre-adapts plants to hypoxia stress". Nature Communications. 10 (1): 4020. Bibcode:2019NatCo..10.4020H. doi:10.1038/s41467-019-12045-4. PMC 6728379. PMID 31488841.
- ^ Van Veen 외, [1], Plant Cell, 2013
- ^ Hartman, Sjon; Sasidharan, Rashmi; Voesenek, Laurentius A. C. J. (18 January 2020). "The role of ethylene in metabolic acclimations to low oxygen". New Phytologist. 229 (1): 64–70. doi:10.1111/nph.16378. PMC 7754284. PMID 31856295.
- ^ Barry, Cornelius S.; Giovannoni, James J. (6 June 2007). "Ethylene and Fruit Ripening". Journal of Plant Growth Regulation. 26 (2): 143–159. doi:10.1007/s00344-007-9002-y. S2CID 29519988.
- ^ Wilmowicz E, Kesy J, Kopcewicz J (December 2008). "Ethylene and ABA interactions in the regulation of flower induction in Pharbitis nil". J. Plant Physiol. 165 (18): 1917–28. doi:10.1016/j.jplph.2008.04.009. PMID 18565620.
- ^ Cockshull KE, Horridge JS (1978). "2-Chloroethylphosphonic Acid and Flower Initiation by Chrysanthemum morifolium Ramat. In Short Days and in Long Days". Journal of Horticultural Science & Biotechnology. 53 (2): 85–90. doi:10.1080/00221589.1978.11514799.
- ^ Filser JG, Denk B, Törnqvist M, Kessler W, Ehrenberg L (1992). "Pharmacokinetics of ethylene in man; body burden with ethylene oxide and hydroxyethylation of hemoglobin due to endogenous and environmental ethylene". Arch. Toxicol. 66 (3): 157–163. doi:10.1007/bf01974008. PMID 1303633. S2CID 39354680.
- ^ Bolt HM, Leutbecher M, Golka K (1997). "A note on the physiological background of the ethylene oxide adduct 7-(2-hydroxyethyl)guanine in DNA from human blood". Arch. Toxicol. 71 (11): 719–721. doi:10.1007/s002040050451. PMID 9363847. S2CID 46278715.
- ^ Csanády GA, Denk B, Pütz C, Kreuzer PE, Kessler W, Baur C, Gargas ML, Filser JG (May 15, 2000). "A physiological toxicokinetic model for exogenous and endogenous ethylene and ethylene oxide in rat, mouse, and human: formation of 2-hydroxyethyl adducts with hemoglobin and DNA". Toxicol Appl Pharmacol. 165 (1): 1–26. doi:10.1006/taap.2000.8918. PMID 10814549.
- ^ Thier R, Bolt HM (Sep 2000). "Carcinogenicity and genotoxicity of ethylene oxide: new aspects and recent advances". Crit Rev Toxicol. 30 (5): 595–608. doi:10.1080/10408440008951121. PMID 11055837. S2CID 21154564.
외부 링크
 위키미디어 공용의 가스 신호 분자와 관련된 매체
위키미디어 공용의 가스 신호 분자와 관련된 매체