미오글로빈
Myoglobin| MB | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 에일리어스 | MB, PVALB, 미글로빈, 미오글로빈, 미오글로빈 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 외부 ID | OMIM: 160000 MGI: 96922 HomoloGene: 3916 GeneCard: MB | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
미오글로빈(기호 Mb 또는 MB)은 일반적으로 그리고 거의 모든 [5][6][7][8][9]포유동물에서 발견되는 철분 및 산소 결합 단백질이다.미오글로빈은 헤모글로빈과 먼 친척이다.헤모글로빈에 비해 미오글로빈은 산소에 대한 친화력이 높고 헤모글로빈처럼 [8][10]산소와 협력적으로 결합하지 않습니다.인간의 미오글로빈은 근육 손상 [11][12][13]후 혈류에서만 발견됩니다.
근육 세포의 높은 농도의 미오글로빈은 유기체가 더 오랜 시간 동안 숨을 참을 수 있게 해줍니다.고래와 바다표범과 같은 잠수 포유류는 특히 [13]미오글로빈이 풍부한 근육을 가지고 있다.미오글로빈은 I형 근육, II형 A형 근육, 그리고 II형 B형 근육에서 발견되지만,[citation needed] 대부분의 텍스트는 미오글로빈이 평활근에서 발견되지 않는다고 간주합니다.
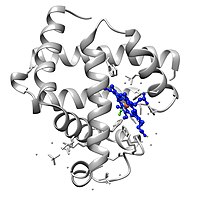
미오글로빈은 X선 결정학에 [14]의해 3차원 구조를 가진 최초의 단백질이었다.이 성과는 1958년 John Kendrew와 [15]동료들에 의해 보고되었다.켄드루는 이 발견으로 1962년 맥스 퍼루츠와 [16][17]함께 노벨 화학상을 수상했다.생물학에서 가장 많이 연구된 단백질 중 하나임에도 불구하고, 그것의 생리학적 기능은 아직 결정적으로 확립되지 않았습니다: 미오글로빈이 부족하도록 유전적으로 조작된 생쥐는 생존 가능하고 가임될 수 있지만, 손실을 극복하기 위해 많은 세포와 생리학적 적응을 보일 수 있습니다.미오글로빈 결핍 생쥐의 이러한 변화를 관찰함으로써, 미오글로빈 기능이 근육으로의 산소 운반 증가 및 산소 저장과 관련이 있으며, 활성 산소 [18]종의 스캐빈저 역할을 한다는 가설을 세웠다.
인간의 경우, 미오글로빈은 [19]MB 유전자에 의해 암호화됩니다.
미오글로빈은 옥시미오글로빈(MbO2), 카르복시미오글로빈(MbCO), 메트미오글로빈(met-Mb)의 형태를 취할 수 있으며, 헤모글로빈(HbO2), 카르복시헤모글로빈(HbCO), 메트헤모글로빈(met-Hb)[20]의 형태를 취할 수 있다.
헤모글로빈과의 차이점
헤모글로빈처럼, 미오글로빈은 헴 그룹에 산소를 결합시키는 세포질 단백질이다.헤모글로빈은 4개의 글로불린 그룹을 가지고 있는 반면, 그것은 오직 하나의 글로불린 그룹을 가지고 있다.그 헴기는 Hb와 동일하지만, Mb는 헤모글로빈보다 산소에 대한 친화력이 더 높다.이 차이는 그것의 다른 역할과 관련이 있다: 헤모글로빈이 산소를 운반하는 반면, 미오글로빈의 기능은 산소를 저장하는 것이다.
요리의 역할
미오글로빈은 붉은 고기의 색을 담당하는 색소인 헴을 함유하고 있습니다.고기의 색깔은 부분적으로 미오글로빈의 산화 정도에 의해 결정된다.신선한 육류에서 철 원자는 산소 분자(O2)에 결합된 철(+2) 산화 상태에 있습니다.잘 익은 고기는 철 원자가 전자를 잃은 철(+3) 산화 상태이기 때문에 갈색이 됩니다.고기가 아질산염에 노출된 경우, 철 원자는 NO, 일산화질소(예: 소금에 절인 쇠고기 또는 경화된 햄)와 결합하기 때문에 분홍색으로 유지됩니다.구운 고기는 또한 [21]일산화탄소에 대한 헴 중심 결합에서 오는 붉은 분홍색 "스모크 링"을 가질 수 있습니다.일산화탄소 대기 중에 포장된 생고기 또한 동일한 원리로 인해 동일한 분홍색 "연기 고리"를 보여줍니다.특히, 이 생고기의 표면은 보통 신선한 고기와 관련이 있는 분홍색도 나타낸다.이 인위적으로 유도된 분홍색은 [22]1년까지 지속될 수 있다고 한다.호멜과 카길(미국의 육류 가공 회사)은 모두 이러한 육류 포장 공정을 사용하는 것으로 보고되고 있으며,[23] 이러한 방식으로 처리된 육류는 2003년부터 소비자 시장에서 판매되고 있다.
질병에서의 역할
미오글로빈은 미오글로빈 [24]농도가 매우 높은 손상된 근육 조직으로부터 방출됩니다.방출된 미오글로빈은 신장에 의해 여과되지만 신관상피에는 독성이 있기 때문에 급성 신장 [25]손상을 일으킬 수 있습니다.독성이 있는 것은 미오글로빈 자체가 아니라 산성 환경(예: 산성 소변, 리소좀)에서 미오글로빈과 분리되는 철혈산 부위이다.
미오글로빈은 근육 손상에 대한 민감한 지표로, 흉통 [26]환자의 심장 마비에 대한 잠재적 지표가 됩니다.단, 미오글로빈 증가는 급성심근경색(AMI)에 대한 특이성이 낮기 때문에 CK-MB, 심트로포닌, 심전도 및 임상 징후를 고려해야 한다.[27]
구조 및 본딩
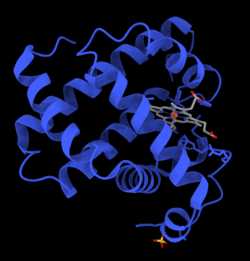
미오글로빈은 단백질의 글로빈 슈퍼패밀리에 속하며, 다른 글로빈과 마찬가지로 루프로 연결된 8개의 알파 헬리크로 구성됩니다.미오글로빈은 153개의 아미노산을 [28]함유하고 있습니다.
미오글로빈은 중심에 철이 있는 포르피린 고리를 포함하고 있다.근위 히스티딘기(His-93)가 철에 직접 부착되어 원위 히스티딘기(His-64)가 반대면 [28]부근을 맴돌고 있다.원위 이미다졸은 철에 결합되지 않지만 기질2 O와 상호작용할 수 있습니다.이러한 상호작용은 O의 결합을2 촉진하지만 일산화탄소(CO)의 결합은 촉진하지 않으며, 일산화탄소(CO)는 여전히 O보다2 약 240배 더 강하게 결합한다.
O의2 결합은 Fe 중심에서 상당한 구조적 변화를 일으키며, Fe 중심은 반지름으로 축소되어 N4 포켓의 중심으로 이동한다.O-결합은2 "스핀 쌍"을 유도합니다: 5좌표 철 디옥시 형태는 높은 스핀이고 6좌표 옥시 형태는 낮은 스핀과 [citation needed]반자성입니다.
미오글로빈의 [29]Fe-O2 상호작용에 대한 분자 궤도 설명.
합성유사체
미오글로빈의 많은 모델은 전이 금속 다이옥시젠 복합체에 대한 광범위한 관심의 일부로 합성되었다.잘 알려진 예는 테트라페닐포르피린의 [30]입체적으로 부피가 큰 유도체의 철 복합체로 이루어진 피켓펜스 포르피린이다.이미다졸 배위자의 존재 하에서 이 철 착체는 O를 가역적으로 결합시킨다2.O기판은2 굽은 형상을 채택하여 철의 중심 6번째 위치를 차지합니다.이 모델의 주요 특성은 비활성 디퍼릭 상태인 μ-oxo 이합체의 느린 형성입니다.본질적으로 이러한 비활성화 경로는 Fe-포르피린 [31]어셈블리의 근접 접근을 방해하는 단백질 매트릭스에 의해 억제된다.
 메틸미다졸(녹색)과 다이옥시겐이 차지하는 축배위 부위를 가진 Fe의 피켓-펜스 포르피린 착화체.R 그룹은 O-binding2 사이트에 측면으로 배치됩니다.
메틸미다졸(녹색)과 다이옥시겐이 차지하는 축배위 부위를 가진 Fe의 피켓-펜스 포르피린 착화체.R 그룹은 O-binding2 사이트에 측면으로 배치됩니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000198125 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000018893 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Ordway GA, Garry DJ (Sep 2004). "Myoglobin: an essential hemoprotein in striated muscle". The Journal of Experimental Biology. 207 (Pt 20): 3441–6. doi:10.1242/jeb.01172. PMID 15339940.
- ^ Wick MR, Hornick JL (2011). "Immunohistology of Soft Tissue and Osseous Neoplasms". Diagnostic Immunohistochemistry. Elsevier. pp. 83–136. doi:10.1016/b978-1-4160-5766-6.00008-x. ISBN 978-1-4160-5766-6.
Myoglobin is a 17.8-kD protein that is found in cardiac and skeletal muscle and that forms complexes with iron molecules.
- ^ Feher J (2017). "Oxygen and Carbon Dioxide Transport". Quantitative Human Physiology. Elsevier. pp. 656–664. doi:10.1016/b978-0-12-800883-6.00064-1. ISBN 978-0-12-800883-6.
Highly oxidative muscle fibers contain a lot of myoglobin. It has two functions in muscle: it stores oxygen for use during heavy exercise, and it enhances diffusion through the cytosol by carrying the oxygen. By binding O2, myoglobin (Mb) provides a second diffusive pathway for O2 through the cell cytosol.
- ^ a b Wilson MT, Reeder BJ (2006). "MYOGLOBIN". Encyclopedia of Respiratory Medicine. Elsevier. pp. 73–76. doi:10.1016/b0-12-370879-6/00250-7. ISBN 978-0-12-370879-3.
Myoglobin (Mb) is a heme-containing globular protein that is found in abundance in myocyte cells of heart and skeletal muscle.
- ^ Boncyk JC (2007). "Perioperative Hypoxia". Complications in Anesthesia. Elsevier. pp. 193–199. doi:10.1016/b978-1-4160-2215-2.50052-1. ISBN 978-1-4160-2215-2.
Myoglobin serves both as an O2 buffer and to store O2 in muscle. All known vertebrate myoglobins and β-hemoglobin subunits are similar in structure, but myoglobin binds O2 more avidly at low Po2 (Fig. 47-5) because it is a monomer (i.e., it does not undergo a significant conformational change with oxygenation). Thus, myoglobin remains fully saturated at O2 tensions between 15 and 30 mm Hg and unloads its O2 to the muscle mitochondria only at very low O2 tensions.
- ^ Hardison RC (Dec 2012). "Evolution of Hemoglobin and Its Genes". Cold Spring Harb Perspect Med. 2 (12): a011627. doi:10.1101/cshperspect.a011627. PMC 3543078. PMID 23209182.
- ^ Chung MJ, Brown DL (July 2018). "Diagnosis of acute myocardial infarction.". In Brown DL (ed.). Cardiac Intensive Care-E-Book. pp. 91–98.e3. doi:10.1016/B978-0-323-52993-8.00009-6. ISBN 9780323529938.
Myoglobin is not specific for myocardial necrosis, however, especially in the presence of skeletal muscle injury and renal insufficiency.
- ^ Sekhon N, Peacock WF (2019). "Biomarkers to Assist in the Evaluation of Chest Pain". Biomarkers in Cardiovascular Disease. Elsevier. pp. 115–128. doi:10.1016/b978-0-323-54835-9.00011-9. ISBN 978-0-323-54835-9. S2CID 59548142.
myoglobin is not specific for the death of cardiac myocytes, and levels can be elevated in renal disease as well as damage to skeletal muscle.
- ^ a b Nelson DL, Cox MM (2000). Lehninger Principles of Biochemistry (3rd ed.). New York: Worth Publishers. p. 206. ISBN 0-7167-6203-X. (Google books 링크는 2008년판)
- ^ 미국 국립과학재단: 단백질 데이터 뱅크 연표(2004년 1월 21일).3.17.2010 취득
- ^ Kendrew JC, Bodo G, Dintzis HM, Parrish RG, Wyckoff H, Phillips DC (Mar 1958). "A three-dimensional model of the myoglobin molecule obtained by x-ray analysis". Nature. 181 (4610): 662–6. Bibcode:1958Natur.181..662K. doi:10.1038/181662a0. PMID 13517261. S2CID 4162786.
- ^ Stoddart, Charlotte (1 March 2022). "Structural biology: How proteins got their close-up". Knowable Magazine. doi:10.1146/knowable-022822-1. Retrieved 25 March 2022.
- ^ 1962년 노벨 화학상
- ^ Garry DJ, Kanatous SB, Mammen PP (2007). "Molecular insights into the functional role of myoglobin". Advances in Experimental Medicine and Biology. 618: 181–93. doi:10.1007/978-0-387-75434-5_14. ISBN 978-0-387-75433-8. PMID 18269197.
- ^ Akaboshi E (1985). "Cloning of the human myoglobin gene". Gene. 33 (3): 241–9. doi:10.1016/0378-1119(85)90231-8. PMID 2989088.
- ^ Harvey JW (2008). "Iron Metabolism and Its Disorders". Clinical Biochemistry of Domestic Animals. Elsevier. pp. 259–285. doi:10.1016/b978-0-12-370491-7.00009-x. ISBN 978-0-12-370491-7.
Myoglobin is an oxygen-binding protein located primarily in muscles. Myoglobin serves as a local oxygen reservoir that can temporarily provide oxygen when blood oxygen delivery is insufficient during periods of intense muscular activity. Iron within the heme group must be in the Fe+2 state to bind oxygen. If iron is oxidized to the Fe+3 state, metmyoglobin is formed.
- ^ McGee H (2004). On Food and Cooking: The Science and Lore of the Kitchen. New York: Scribner. p. 148. ISBN 0-684-80001-2.
- ^ Fraqueza MJ, Barreto AS (Sep 2011). "Gas mixtures approach to improve turkey meat shelf life under modified atmosphere packaging: the effect of carbon monoxide". Poultry Science. 90 (9): 2076–84. doi:10.3382/ps.2011-01366. PMID 21844276.
- ^ "Meat companies defend use of carbon monoxide". Business. Minneapolis Star Tribune. Associated Press. 2007-10-30. Archived from the original on 2013-12-25. Retrieved 2013-02-11.
- ^ Berridge BR, Van Vleet JF, Herman E (2013). "Cardiac, Vascular, and Skeletal Muscle Systems". Haschek and Rousseaux's Handbook of Toxicologic Pathology. Elsevier. pp. 1567–1665. doi:10.1016/b978-0-12-415759-0.00046-7. ISBN 978-0-12-415759-0.
Myoglobin is a low molecular weight oxygen binding heme protein that is found exclusively in heart and skeletal muscle cells. In blood, myoglobin is bound primarily to plasma globulins, a complex which is filtered by the kidneys. If the plasma concentration exceeds the plasma binding capacity (1.5 mg/dl in humans), myoglobin begins to appear in the urine. High concentrations of myoglobin can change the color of the urine to a dark red-brown color.
- ^ Naka T, Jones D, Baldwin I, Fealy N, Bates S, Goehl H, Morgera S, Neumayer HH, Bellomo R (Apr 2005). "Myoglobin clearance by super high-flux hemofiltration in a case of severe rhabdomyolysis: a case report". Critical Care. 9 (2): R90-5. doi:10.1186/cc3034. PMC 1175920. PMID 15774055.
- ^ Weber M, Rau M, Madlener K, Elsaesser A, Bankovic D, Mitrovic V, Hamm C (Nov 2005). "Diagnostic utility of new immunoassays for the cardiac markers cTnI, myoglobin and CK-MB mass". Clinical Biochemistry. 38 (11): 1027–30. doi:10.1016/j.clinbiochem.2005.07.011. PMID 16125162.
- ^ Dasgupta A, Wahed A (2014). "Cardiac Markers". Clinical Chemistry, Immunology and Laboratory Quality Control. Elsevier. pp. 127–144. doi:10.1016/b978-0-12-407821-5.00008-5. ISBN 978-0-12-407821-5.
Myoglobin is a heme protein found in both skeletal and cardiac muscle. Myoglobin is typically released in the circulation as early as 1 h after myocardial infarction,... Myoglobin has poor clinical specificity due to the presence of large quantities of myoglobin in skeletal muscle. Some studies suggest adding the myoglobin test to the troponin I test in order to improve diagnostic value [4]. Myoglobin, being a small protein, is excreted in urine, and a high level of serum myoglobin is encountered in patients with acute renal failure (uremic syndrome). Acute renal failure is also a complication of rhabdomyolysis, ...
- ^ a b UniProt에서 범용 단백질 자원 등록 번호 P02144.
- ^ Drago RS (1980). "Free radical reactions of transition metal systems". Coordination Chemistry Reviews. 32 (2): 97–110. doi:10.1016/S0010-8545(00)80372-0.
- ^ Collman JP, Brauman JI, Halbert TR, Suslick KS (Oct 1976). "Nature of O2 and CO binding to metalloporphyrins and heme proteins". Proceedings of the National Academy of Sciences of the United States of America. 73 (10): 3333–7. Bibcode:1976PNAS...73.3333C. doi:10.1073/pnas.73.10.3333. PMC 431107. PMID 1068445.
- ^ Lippard SJ, Berg JM (1994). Principles of Bioinorganic Chemistry. Mill Valley, CA: University Science Books. ISBN 0-935702-73-3.
추가 정보
- Collman JP, Boulatov R, Sunderland CJ, Fu L (Feb 2004). "Functional analogues of cytochrome c oxidase, myoglobin, and hemoglobin". Chemical Reviews. 104 (2): 561–88. doi:10.1021/cr0206059. PMID 14871135.
- Reeder BJ, Svistunenko DA, Cooper CE, Wilson MT (Dec 2004). "The radical and redox chemistry of myoglobin and hemoglobin: from in vitro studies to human pathology". Antioxidants & Redox Signaling. 6 (6): 954–66. doi:10.1089/ars.2004.6.954. PMID 15548893.
- Schlieper G, Kim JH, Molojavyi A, Jacoby C, Laussmann T, Flögel U, Gödecke A, Schrader J (Apr 2004). "Adaptation of the myoglobin knockout mouse to hypoxic stress". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 286 (4): R786-92. doi:10.1152/ajpregu.00043.2003. PMID 14656764. S2CID 24831969.
- Takano T (Mar 1977). "Structure of myoglobin refined at 2-0 A resolution. II. Structure of deoxymyoglobin from sperm whale". Journal of Molecular Biology. 110 (3): 569–84. doi:10.1016/S0022-2836(77)80112-5. PMID 845960.
- Roy A, Sen S, Chakraborti AS (Feb 2004). "In vitro nonenzymatic glycation enhances the role of myoglobin as a source of oxidative stress". Free Radical Research. 38 (2): 139–46. doi:10.1080/10715160310001638038. PMID 15104207. S2CID 11631439.
- Stewart JM, Blakely JA, Karpowicz PA, Kalanxhi E, Thatcher BJ, Martin BM (Mar 2004). "Unusually weak oxygen binding, physical properties, partial sequence, autoxidation rate and a potential phosphorylation site of beluga whale (Delphinapterus leucas) myoglobin". Comparative Biochemistry and Physiology B. 137 (3): 401–12. doi:10.1016/j.cbpc.2004.01.007. PMID 15050527.
- Wu G, Wainwright LM, Poole RK (2003). Microbial globins. Advances in Microbial Physiology. Vol. 47. pp. 255–310. doi:10.1016/S0065-2911(03)47005-7. ISBN 9780120277476. PMID 14560666.
- 이 소견에 대한 Proteopedia 기사도 참조하십시오Mirceta S, Signore AV, Burns JM, Cossins AR, Campbell KL, Berenbrink M (Jun 2013). "Evolution of mammalian diving capacity traced by myoglobin net surface charge". Science. 340 (6138): 1234192. doi:10.1126/science.1234192. PMID 23766330. S2CID 9644255..
외부 링크
- 온라인 Mendelian In Man (OMIM) : 16만 인간유전학
- 미오글로빈 단백질
- RCSB PDB 특징 분자
- "어느 칼집이 오래되었는가?" 뉴욕 타임즈 2006년 2월 21일자, 육류 산업이 고기를 빨갛게 보이게 하기 위해 일산화탄소를 사용하는 것에 관한 기사.
- "고기 보고서에 반응하는 상점들", 뉴욕 타임즈, 2006년 3월 1일자, 고기를 신선하게 보이게 하기 위해 일산화탄소를 사용하는 것에 대한 기사.
- PDB for UniProt: P02144(인간 미오글로빈)에서 PDBe-KB에 제공되는 모든 구조 정보의 개요.





![Molecular orbital description of Fe-O2 interaction in myoglobin.[29]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/34/MbO2MO.png/200px-MbO2MO.png)