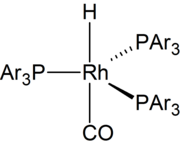하이드로폼화
Hydroformylation
| 하이드로폼화 | |
|---|---|
| 반응형 | 덧셈반응 |
| 식별자 | |
| RSC 온톨로지 ID | RXNO:0000272 |
옥소합성 또는 옥소공정이라고도 하는 수력포뮬레이션은 알케인으로부터 알데히드를 생산하기 위한 산업적인 과정이다.[1][2] 이 화학반응은 탄소-탄소 이중결합에 포밀 그룹(CHO)과 수소 원자의 순첨가를 수반한다. 이 과정은 1995년에 생산능력은 6.6×10톤에6 달했다. 알데히드는 많은 2차 제품으로 쉽게 전환되기 때문에 중요하다. 예를 들어, 결과 알데히드는 세제로 전환되는 알코올로 수소가 된다. 하이드로폼화는 향기와 약물의 유기적 합성과 관련된 특수 화학물질에도 사용된다. 하이드로폼화의 발전은 20세기 산업 화학의 가장 큰 업적 중 하나이다.
이 공정은 일반적으로 40~200°C의 온도에서 일산화탄소와 수소의 고압(10~100기압)이 있는 알켄의 처리를 수반한다.[3] 한 가지 변형에서 합성가스 대신 포름알데히드가 사용된다.[4] 전환 금속 촉매가 필요하다. 항상 촉매는 반응 매체에서 용해된다. 즉, 하이드로폼화는 균질 촉매의 한 예다.
역사
이 과정은 1938년 독일 화학자 오토 로엘렌에 의해 피셔-트로프슈 과정의 조사 과정에서 발견되었다. 에틸렌을 F-T 원자로에 첨가했을 때 알데히드와 디에틸케톤이 얻어졌다. 이러한 연구를 통해 로엘렌은 코발트 촉매의 효용을 발견했다. 로엘렌의 작업 몇 년 전만 해도 고립됐던 4HCo(CO)가 뛰어난 촉매로 나타났다.[5][6] 옥소합성이라는 용어는 루르케미 특허부에 의해 만들어졌는데, 그는 그 과정이 알데히드와 케톤 모두의 조제에 적용될 것으로 기대했다. 후속 연구는 리간드 트리뷰틸인산(PBU3)이 코발트-카탈리신 공정의 선택성을 개선했음을 입증했다. Co-catalized hydroformy의 메커니즘은 Richard F에 의해 설명되었다. Heck와 David Breslow는 1960년대.[7]
1968년에는 활동성이 높은 로듐 기반 촉매가 보고되었다.[8] 1970년대 이후 대부분의 하이드로폼화는 로듐에 기초한 촉매에 의존한다.[9] 수용성 촉매들이 개발되었다. 그것들은 촉매로부터 제품을 분리하는 것을 용이하게 한다.[10]
메커니즘

선택성
하이드로폼화의 주요 고려사항은 "정상" 대이다. "iso" 선택성. 예를 들어, 프로필렌의 하이드로폼화는 두 개의 이소메릭 제품인 부티랄데히드 또는 이소부티랄데히드를 제공할 수 있다.
- H2 + CO + CHC3=CH2 → CHCHCHO322("정상")
- 대
- H2 + CO + CHC3=CH2 → (CH3)2CHCHO ("iso")
이러한 이소머는 M-H 결합에 알켄을 삽입하는 역화학성을 반영한다. 두 제품 모두 동등하게 바람직하지는 않기 때문에(정상적인 것은 이소보다 더 안정적이다) 정상 이성질체를 선호하는 촉매 탐구에 많은 연구가 투입되었다.
스테릭 효과
마르코브니코프가 1차 연골에 하이드라이드를 첨가한 것은 코발트 중심과 2차 연골 리간드 사이의 강력한 방해에 의해 바람직하지 않다. 부피가 큰 리간드는 이 장기의 장애를 악화시킨다. 따라서 혼합 카보닐/인산 복합체는 마코브니코프 첨가 시 선택성이 높아 스트레이트 체인 제품(n-) 알데히드를 선호한다. 현대의 촉매들은 점점 더 킬레이트 리간드에 의존하고 있으며, 특히 디인산염에 의존하고 있다.[12]
전자 효과
또한 전자가 풍부한 하이드라이드 콤플렉스는 양성자 같지 않다. 따라서 그 결과 알켄에 마코브니코프를 추가하는 데 일반적으로 유리한 전자적 효과는 덜 적용된다. 따라서 전자가 풍부한 하이드라이드는 더 선택적이다.
아킬형성
알켄의 경쟁 이성질화를 억제하기 위해서는 알킬의 탄소금속 결합에 카보닐이 삽입되는 이동 속도가 비교적 빨라야 한다. 카보닐 탄소를 C-M 결합에 삽입하는 속도는 베타 수소 제거 속도보다 클 가능성이 높다.[13]
비대칭 하이드로폼화
프로치럴 알켄의 하이드로폼화는 새로운 스테레오센트를 만든다. 치랄인산 리간드를 사용하여, 하이드로폼화는 하나의 에난토머를 선호하도록 맞춤화할 수 있다.[14] 따라서 예를 들어 ibuprofen의 (+-s)-enantomer인 덱시부프로펜은 산화 방지제 하이드로폼화에 의해 생성될 수 있다.
과정
산업 공정은 하이드로폼할 올레핀의 체인 길이, 촉매 금속과 리간드, 촉매의 회수 등에 따라 달라진다. 원래 루르케미 공정은 코발트 사트라카르보닐 하이드라이드를 사용하여 에테네와 이승에서 프로판알을 생산했다. 오늘날 코발트 촉매를 기반으로 한 산업 공정은 주로 중·장체인 올레핀 생산에 이용되는 반면, 로듐 기반 촉매는 프로펜의 수성형화에 주로 사용된다. 로듐 촉매는 코발트 촉매보다 훨씬 비싸다. 높은 분자량 올레핀의 수력형성에서는 생성된 알데히드로부터 촉매의 분리가 어렵다.
BASF-oxo 공정
BASF-oxo 공정은 대부분 더 높은 올레핀으로 시작하고 코발트 카보닐 기반 촉매에 의존한다.[15] 저온에서 반응을 수행함으로써 선형 산출물에 유리한 선택성 증가를 관찰한다. 이 과정은 약 30 MPa의 압력과 150 - 170 °C의 온도 범위에서 수행된다. 코발트는 수용성 Co에2 + 산화하여 액체 제품에서 회수되며, 수성 포믹 또는 아세트산을 첨가한다. 이 과정은 코발트의 수용 단계를 제공하며, 그 다음 재활용될 수 있다. 손실은 코발트 염을 첨가하여 보상한다.[16]
엑손공정
Exxon 공정(Kuhlmann- 또는 PCUK – oxo 공정)은 C6–C12 올레핀의 수력 형성에 사용된다. 그 과정은 코발트 촉매에 의존한다. 촉매를 회복하기 위해 수산화나트륨 용액이나 탄산나트륨을 유기 단계에 첨가한다. 일산화탄소 압력 하에서 황산 용액을 첨가하여 올레핀으로 추출하고 중화함으로써 금속 카보닐 하이드라이드를 회수할 수 있다. 이것은 승아와 함께 벗겨져 올레핀에 흡수되어 원자로로 돌아온다. BASF 공정과 유사하게 Exxon 공정은 약 30 MPa의 압력과 약 160 180 °C의 온도에서 수행된다.[16]
셸 공정
Shell 공정은 C7–C14 올레핀의 하이드로폼화를 위해 인광 리간드로 수정된 코발트 복합체를 사용한다. 그 결과 알데히드는 지방성 알코올에 직접 수소를 공급하는데, 증류에 의해 분리되어 촉매가 재활용될 수 있다. 이 공정은 세제의 공급원료로 사용되는 선형제품에 대한 선택성이 좋다. 이 프로세스는 약 4~8 MPa의 압력과 약 150–190 °C의 온도 범위에서 수행된다.[16]
유니온 카바이드 공정
저압 옥소 공정(LPO)이라고도 알려진 유니온 카바이드(UCC) 공정은 프로펜의 수력포화를 위해 1차 알데히드의 분자량 응축물인 고부화 두툼한 기름에 용해된 로듐 촉매를 사용한다. 반응 혼합물은 휘발성 구성 요소로부터 떨어지는 필름 증발기에서 분리된다. 액상은 증류되고 부티랄알데히드는 헤드제품으로 제거되며 하단제품이 함유된 촉매는 이 공정에 재활용된다. 이 과정은 약 1.8 MPa와 95–100 °C에서 수행된다.[16]
루르케미/론-풀랑크 공정
RCRPP(Ruhrchemie/Rhone-Poulenc 공정)는 프로펜의 수성형 TPPTS를 리간드(Kuntz Cornils 촉매)로 하는 로듐 촉매에 의존한다.[19] 트리페닐인산 리간드의 삼황화합물은 유기농 복합체에 친수성 특성을 제공한다. 촉매복합체는 설폰산염 9개 군을 운반하며 물(약 1kg−1 L)에서 용해성이 높지만 신흥 제품 단계에서는 그렇지 않다.[20] 수용성 TPPTS는 약 50배 초과로 사용되며, 촉매의 침출은 효과적으로 억제된다. 반응제는 1.1:1의 비율로 수소와 일산화탄소로 구성된 프로펜과 승이다. 96:4 비율의 부티알데히드와 이소부티알데히드의 혼합물은 알코올, 에스테르, 끓는 분율과 같은 부산물이 거의 없이 생성된다.[20] 루르케미/론-풀랑크 공정은 촉매제가 수성 단계에 존재하는 최초의 상용 2상 시스템이다. 반응 진행 중에 유기 제품 단계가 형성되며, 위상 분리를 통해 연속적으로 분리되며, 수성 촉매 위상은 원자로에 남아 있다.[20]
이 과정은 원자로 바닥에서 올레핀과 승아가 집중[clarification needed] 교반된 상태에서 촉매 단계를 거쳐 교반되는 교반된 탱크 원자로에서 수행된다. 그 결과 발생하는 원유알데히드 위상은 수성 위상에서 분리된다. 수용성 촉매 함유 용액은 열교환기를 통해 다시 가열되어 원자로에 다시 주입된다.[20] 과잉 올레핀과 승라는 스트리퍼의 알데히드 단계로부터 분리되어 원자로로 다시 공급된다. 생성된 열은 프로세스 증기의 생성을 위해 사용되는데, 이는 유기상의 후속 증류를 위해 부티랄데히드와 이소부티랄데히드로 분리하는 데 사용된다.[20] 합성 가스에서 나오는 잠재적 촉매 독은 유기 단계로 이동하며 알데히드와의 반응으로부터 제거된다. 따라서 촉매독의 축적이 없으며, 승아의 정교한 미세정화를 생략할 수 있다.[20]
1984년 오버하우젠에 공장이 세워졌는데 1988년, 1998년 다시 부탄날 50만 t/a 생산능력까지 떨어졌다. 프로펜의 전환율은 98%이며 n-butanal으로의 선택성은 높다. 공정 내 촉매 배치의 수명 동안 1ppb 미만의 로듐이 손실된다.[21]
실험실 공정
시클로헥센과 같은 실험실 척도의 하이드로폼을 위한 레시피가 개발되었다.[3][14]
알케인이 아닌 기질
코발트 카보닐과 로듐 복합체는 포름알데히드와 산화 에틸렌의 하이드로포밀화를 촉매해 히드록시아세트알데히드와 3-히드록시프로판알데하이드와 에틸렌글리콜에 각각 수소화시킬 수 있다. 용제가 기본일 때(피리딘 등)[22][23] 반응이 가장 좋다.
촉매로 디코발트 옥타카르보닐이나 CO2(8CO)의 경우 수소가 없는 경우 에테네와 CO에서 펜탄-3-1이 발생할 수 있다. 제안된 매개체는 [CHCOCHCCo322(CO)]를 형성하기 위해 철새 삽입을 거치는 에틸렌-프로피오닐종[CHC3(O)Co(CO)(3ethene)]이다.3 필요한 수소는 물 이동 반응에서 발생한다. 자세한 내용은 을 참조하십시오[24].
물 이동 반응이 작용하지 않는 경우, 이 반응은 일산화탄소와 에틸렌 유닛을 교대로 포함하는 폴리머를 제공한다. 그러한 편평성 폴리케톤은 팔라듐 촉매를 사용하여 더 전통적인 방식으로 준비된다.[25]
아일알코올과 같은 기능화된 올레핀은 수산화될 수 있다. 대상 제품 1,4-부타네디올과 그 이소머는 로듐-트리페닐인산염 복합체와 같은 이소머화 프리 촉매로 획득한다. 코발트 복합체의 사용은 이중 결합을 n-propanal에 이소체화함으로써 이끈다.[26] 알케닐 에테르와 알케닐 에스테르의 하이드로폼화는 보통 에테르 또는 에스테르 함수에 대한 α 위치에서 발생한다.
로듐 제조 공정에서 아크릴산과 메타크릴산의 하이드로폼화는 첫 번째 단계에서 마르코브니코프 제품으로 이어진다.[27] 반응 조건의 변화에 따라 반응은 다른 제품으로 향할 수 있다. 높은 반응 온도와 낮은 일산화탄소 압력은 열역학적으로 보다 안정적인 β-이소머에 마르코브니코프 제품의 이소머화를 선호하며, 이는 n-알데히드로 이어진다. 낮은 온도와 높은 일산화탄소 압력과 자유로운 조정 부위를 차단하는 인산염의 과다는 에스테르 그룹에 대한 α 위치의 더 빠른 하이드로폼화(hydroformylation)로 이어지며 이소머화를 억제할 수 있다.[27]
사이드 리액션과 연속 리액션
알케네스
알케인의 부작용은 이중 결합의 이성질화와 수소화다. 이중 결합의 수소화에 기인하는 알칸은 반응에 더 이상 참여하지 않지만, 후속 n-alkyl 콤플렉스의 형성과 함께 이중 결합의 이소체화는 바람직한 반응이다. 수소는 보통 경미하지만, 코발트-인산염으로 변형된 촉매들은 수소화 활성이 증가하여 알켄의 최대 15%가 수소화된다.
알데히데스
일반적으로 원하는 연속 반응은 알코올에 대한 알데히드의 수소화다. 높은 온도와 수소 부분 압력은 알데히드가 알코올로 생성되는 수소를 선호한다. 반응 메커니즘의 경우, 알데히드는 초기에 촉매와 함께 CO-화합물을 형성한다고 여겨진다. 이것은 알카산화 복합체로 재배열되고 이후 수소가 산화되면서 알코올이 제거되고 출발 복합체가 형성된다.
알데하이드 탄소-산소 이중 결합은 또한 형산과 그것의 에스테르로 이어지는 하이드로폼화의 대상이 될 수 있다. 그 반응을 위해서는 일산화탄소를 알카산화 복합체의 산소-금속 결합에 삽입해야 한다. 그 결과로 생긴 포밀 콤플렉스는 수소를 산화 첨가하여 포말산 에스테르와 시동 콤플렉스로 변환할 수 있다. 초기에 생산된 알데히드는 2-ethylhexenal 또는 높은 분자량 응축 제품, 이른바 두꺼운 기름과 같은 표적 생산물 전구체에 알돌 응결에 의해 더욱 반응할 수 있다.
촉매 및 리간드
하이드로폼화 강직성 조건은 지원하는 유기인산성 리간드의 열화를 유발할 수 있다. 트리페닐인산염은 수소폴리시스의 영향을 받아 벤젠과 디페닐인산염을 방출한다. 중간 금속-페닐 결합에 일산화탄소를 삽입하면 벤즈알데히드가 형성되거나 벤질 알코올에 대한 후속 수소로 이어질 수 있다.[28] 리간드 페닐-군 중 하나는 프로펜으로 대체할 수 있으며, 그 결과 디페닐프로필인핀 리간드는 기본성이 높아져 하이드로폼화 반응을 억제할 수 있다.[28]
참조
- ^ Robert Franke, Detlef Selent, Armin Börner (2012). "Applied Hydroformylation". Chem. Rev. 112 (11): 5675–5732. doi:10.1021/cr3001803.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Ojima I., Tsai C.-Y., Tzamarioudaki M., Bonafoux D. (2000). "The Hydroformylation Reaction". Org. React. 56: 1. doi:10.1002/0471264180.or056.01.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ a b Pino, P.; Botteghi, C. (1977). "Aldehydes from olefins: cyclohexanecarboxaldehyde". Organic Syntheses. 57: 11. doi:10.15227/orgsyn.057.0011.
- ^ . doi:10.1002/adsc.200900713.
{{cite journal}}: Cite 저널은 (도움말)을 요구한다. 누락 또는 비어 있음(도움말) - ^ Boy Cornils; Wolfgang A. Herrmann; Manfred Rasch (1994). "Otto Roelen, Pioneer in Industrial Homogeneous Catalysis". Angewandte Chemie International Edition in English. 33 (21): 2144–2163. doi:10.1002/anie.199421441.
- ^ "Archived copy" (PDF). Archived from the original (PDF) on 28 September 2007. Retrieved 7 January 2007.
{{cite web}}: CS1 maint: 타이틀로 보관된 사본(링크) - ^ a b Richard F. Heck, David S. Breslow (1961). "The Reaction of Cobalt Hydrotetracarbonyl with Olefins". Journal of the American Chemical Society. 83 (19): 4023–4027. doi:10.1021/ja01480a017.
{{cite journal}}: CS1 maint: 작성자 매개변수(링크)를 사용한다. - ^ Evans, D., Osborn, J. A., Wilkinson, G. (1968). "Hydroformylation of Alkenes by Use of Rhodium Complex Catalyst". Journal of the Chemical Society. 33 (21): 3133–3142. doi:10.1039/J19680003133.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ J. F. Hartwig; 유기환산 금속 화학 - 결합에서 촉매에 이르기까지. 대학 과학 서적. 2009. 753, 757–578. ISBN 978-1-891389-53-5.
- ^ 코넬스, B.; 헤르만, W. A. (에드) VCH, Weinheim: 1998년 "Aqueous-Phase Organometalic Catalysis" VCH, Weinheim:
- ^ Jack Halpern (2001). "'Organometallic chemistry at the threshold of a new millennium. Retrospect and prospect". Pure and Applied Chemistry. 73 (2): 209–220. doi:10.1351/pac200173020209.
- ^ Gual, Aitor; Godard, Cyril; de la Fuente, Verónica; Castillón, Sergio (2012). "Design and Synthesis of Phosphite Ligands for Homogeneous Catalysis". Phosphorus(III) Ligands in Homogeneous Catalysis: Design and Synthesis. pp. 81–131. doi:10.1002/9781118299715.ch3. ISBN 9781118299715.
- ^ Kuil, M.; Soltner, T.; van Leeuwen, P. W. N. M.; Reek, J. N. H. (2006). "High-Precision Catalysts: Regioselective Hydroformylation of Internal Alkenes by Encapsulated Rhodium Complexes". Journal of the American Chemical Society. 128 (35): 11344–45. doi:10.1021/ja063294i.
- ^ a b Gene W. Wong, Tyler T. Adint, Clark R. Landis (2012). "Synthesis of (2R)-3-[[(1,1-Dimethylethyl)dimethylsilyl]oxy]-2-methylpropanal by Rhodium-Catalyzed Asymmetric Hydroformylation". Org. Synth. 89: 243. doi:10.15227/orgsyn.089.0243.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Duembgen G., Neubauer D. (1969). "Grosstechnische Herstellung von Oxo-Alkoholen aus Propylen in der BASF.". Chemie Ingenieur Technik. 41: 974–80. doi:10.1002/cite.330411708.
- ^ a b c d 보이 코닐스, 볼프강 A. 헤르만, 치후이 웡, 호르스트 베르너 잔토프: A에서 Z까지의 카탈루션: 간결한 백과사전, 2408 세이텐, Verlag Wiley-VCH Verlag GmbH & Co. KGA, (2012), ISBN 3-527-337-307-X.
- ^ Cuny, Gregory D.; Buchwald, Stephen L. (1993). "Practical, High-Yield, Regioselective, Rhodium-Catalyzed Hydroformylation of Functionalized α-olefins". Journal of the American Chemical Society. 115 (5): 2066–2068. doi:10.1021/ja00058a079.
- ^ Van Rooy, Annemiek; Kamer, Paul C. J.; Van Leeuwen, Piet W. N. M.; Goubitz, Kees; Fraanje, Jan; Veldman, Nora; Spek, Anthony L. (1996). "Bulky Diphosphite-Modified Rhodium Catalysts: Hydroformylation and Characterization". Organometallics. 15 (2): 835–847. doi:10.1021/OM950549K.
- ^ W. A. 헤르만, C. W. 콜파인너, 안젤프. 1993년, 105년, 1588년
- ^ a b c d e f Wiebus Ernst, Cornils Boy (1994). "Die großtechnische Oxosynthese mit immobilisiertem Katalysator.". Chemie Ingenieur Technik. 66: 916–923. doi:10.1002/cite.330660704.
- ^ 만프레드 배른스, 아르노 베흐르, 악셀 브렘, 위르겐 그흐링, 한스 호프만, 울페르트 온켄: 테크니쉬 케미 르르부흐 480 압빌둥엔 190 타벨렌 Wiley VCH Verlag GmbH, 2006년 9월 ISBN 3-527-31000-2.
- ^ Chan A.S.C.; Shieh H-S. (1994). "A mechanistic study of the homogeneous catalytic hydroformylation of formaldehyde: synthesis and characterization of model intermediates". Inorganica Chimica Acta. 218 (1–2): 89–95. doi:10.1016/0020-1693(94)03800-7.
- ^ A. Spencer (1980). "Hydroformylation of formaldehyde catalysed by rhodium complexes". Journal of Organometallic Chemistry. 194 (1–2): 113–123. doi:10.1016/S0022-328X(00)90343-7.
- ^ Murata K.; Matsuda A. (1981). "Application of Homogeneous Water-Gas Shift Reaction III Further Study of the Hydrocarbonylation – A highly Selective Formation of Diethyl Keton from Ethene, CO and H2O". Bulletin of the Chemical Society of Japan. 54 (7): 2089–2092. doi:10.1246/bcsj.54.2089.
- ^ J. Liu; B.T. Heaton; J.A. Iggo; R. Whyman (2004). "The Complete Delineation of the Initiation, Propagation, and Termination Steps of the Carbomethoxy Cycle for the Carboalkoxylation of Ethene by Pd–Diphosphane Catalysts". Angew. Chem. Int. Ed. 43: 90–94. doi:10.1002/anie.200352369.
- ^ Fell Bernhard, Rupilius Wolfgang, Asinger Friedrich (1968). "Zur Frage der Isomerenbildung bei der Hydroformylierung höhermolekularer Olefine mit komplexen Kobalt- und Rhodiumkatalysatoren". Tetrahedron Letters. 9: 3261–3266. doi:10.1016/S0040-4039(00)89542-8.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ a b 위르겐 팔베, 장 R. 아담스: 유기 합성에서의 일산화탄소, 스프링거 베를라크, 1970, ISBN 3-540-04814-6
- ^ a b 아르노 베흐르: 안젤완테 동종 카탈리스, 와일리-VCH. 웨인하임, ISBN 3-527-31666-3
추가 읽기
- "Organometalic Composites와 균질 촉매제 적용: 소년 코닐스(편집자), W. A. 헤르만(편집자)의 2권 종합편람(페이퍼백) ISBN 3-527-29594-1
- "로듐 촉매 하이드로폼화" P. W. N. M. 반 리우웬, C. Claver Eds.; 스프링거; (2002년). ISBN 1-4020-0421-4
- "동종 카탈루션: Piet W. N. M. Van Leeuwen Springer의 "예술 이해" 2005. ISBN 1-4020-3176-9
- 이마니토프 N.S./ 올레핀의 로듐 콤플렉스 // 로듐 익스프레스를 이용한 하이드로폼화 1995. No 10–11 (5월). 페이지 3–62 (Eng. ISSN [https://www.worldcat.org/search?fq=x0:jrnl&q=n2:0869-7876 0869-7876]