옥사프로진
Oxaprozin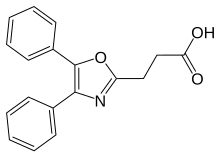 | |
| 임상자료 | |
|---|---|
| 상명 | 데이프로, 데이런, 듀라프록스 등 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a693002 |
| 임신 범주 |
|
| 경로: 행정 | 입으로 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 |
|
| 약동학 데이터 | |
| 생체이용가능성 | 95% |
| 단백질 결합 | 99% |
| 신진대사 | 간—65% 산화 및 35% 글루쿠론산 결합. 5%는 활성 페놀 대사물이다. |
| 제거 반감기 | 54.9시간 |
| 식별자 | |
| CAS 번호 | |
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.040.254 |
| 화학 및 물리적 데이터 | |
| 공식 | C18H15NO3 |
| 어금질량 | 293.322 g·1998−1 |
| 3D 모델(JSmol) | |
| | |
옥사프로진(Oxaprozin)은 비스테로이드성 항염증제(NSAID)[1]로 골관절염과 류마티스 관절염과 관련된 염증, 붓기, 뻣뻣함, 관절통 등을 완화하는데 쓰인다. 화학적으로 프로피온산 유도체다. 청소년 류마티스 관절염만으로 6년 이상 어린이에게 안전성과 효능이 확립됐고, 노인 인구에서 이상반응의 위험이 높아진다.
1967년에 특허를 받았으며 1983년에 의료용으로 승인되었다.[2]
의학적 용법
2015년, 옥사프로진(oxaprozin)은 엔사이드의 효능을 비교하기 위해 임상시험에 포함된 20개의 NSAID 중 하나였다. NSAIDs는 활성 AS 환자들의 NSAID의 무작위 제어 시험을 완료함으로써 비교되었다. 2-12주에 보고된 효능과 부작용을 검사했다. 통증 점수의 변화와 아침 뻣뻣함 지속시간의 변화에 의해 효능을 측정했다. 총 3410명이 참여한 가운데 총 26회의 재판이 완료되었다(시험의 58%가 50명 미만이었다). 위약보다 통증을 더 줄이는 것으로 밝혀진 20개의 NSAID는 모두 15개가 현저히 나은 것으로 밝혀졌다. 아침 강성의 감소와 부작용의 가능성에 관하여, NSAIDs 간에 유의미한 차이는 없었다. 에토릭시브가 AS의 고통을 줄이는 데 더 효과적이라고 결론내렸지만, 작은 연구와 불충분한 증거 때문에, 어느 누구도 AS의 가장 효과적인 치료법이라고 단정할 수 없었다. 에트로릭시브 이후, 옥사프로진을 복용한 환자들은 나프록센보다 부작용이 적은 최소한의 통증을 경험했다.[3]
역효과
미국 식품의약국(FDA)은 2020년 10월, 양수가 낮은 태아의 신장 질환 위험을 설명하기 위해 모든 비스테로이드성 항염증 약물에 대해 약물 라벨을 업데이트하도록 요구했다.[4][5] 그들은 임신 20주 혹은 그 이후에 임산부의 NSAIDs를 피하라고 권고한다.[4][5]
역사
옥사프로진은 Wyeth-Ayerst에 의해 개발되고 특허를 받았다.[6] 미국의 특허 3578671 옥사졸은 1967년 11월 6일에 출원되어 1971년 5월 11일에 출판되었다.[7] 특허 출원에 이어 항염증 성질을 보이는 옥사프로진의 첫 번째 설명이 '다일록사졸레'와 '디아릴시아졸레알카노시산'이라는 두 가지 새로운 비스테로이드성 항염증제 시리즈에 요약됐다. 이 기사는 1968년에 네이처지에 실렸다.[8][9] 1988년 12월, Wyeth-Ayerst는 Searle에게 미국, 캐나다, 푸에르토리코, 카리브해에 대한 마케팅 권한을 허가했다.[6]
데이프로는 1993년 1월 5일에 이용이 가능해졌다. '핑크시트'는 개봉과 동시에 서얼 데이프로의 평균 전체 판매가가 100(600mg) 태블릿에 112.30달러로 추정했다.[6] 그 가격은 다른 처방 NSAIDs와 견줄 만했다.
사회와 문화
FDA 승인
옥사프로진 신약 적용(NDA 18~841)은 1982년 8월 10일 FDA에 제출되었다. 이 약은 1992년 6월 15일부터 16일까지 "NDA의 날" 리뷰를 받았다. 서얼이 10월 22일 7개의 4단계 포스트마케팅 연구를 완료하기로 합의한 후, FDA는 1992년 10월 29일 데이프로를 승인했다.[6]
서글의 데이프로 승인 이후 다른 회사들은 약칭 신약 응용 프로그램(ANDAs)을 FDA에 제출했다. Daypro by Searle은 ADA의 생물학적 동등성을 증명하기 위해 참조 목록에 등재된 약물로 등록되어 있다. 아래 표에는 승인된 옥사프로진 제품이 모두 나열되어 있다.
회상하다
Advantage Dose LLC는 2008년 11월 26일에 옥사프로진 알약을 회수했다. 회사는 cGMP를 준수하지 않았다.[11] (Recall #D-837-2009)
참조
- ^ Greenblatt DJ, Matlis R, Scavone JM, Blyden GT, Harmatz JS, Shader RI (March 1985). "Oxaprozin pharmacokinetics in the elderly". British Journal of Clinical Pharmacology. 19 (3): 373–8. doi:10.1111/j.1365-2125.1985.tb02656.x. PMC 1463728. PMID 3986088.
- ^ Fischer, Jnos; Ganellin, C. Robin (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 520. ISBN 9783527607495.
- ^ Wang, Runsheng (6 Aug 2015). "Comparative efficacy of non-steroidal anti-inflammatory drugs in ankylosing spondylitis: a Bayesian network meta-analysis of clinical trials". Annals of the Rheumatic Diseases. 75 (6): 1152–1160. doi:10.1136/annrheumdis-2015-207677. PMID 26248636. S2CID 20375113.
- ^ Jump up to: a b "FDA Warns that Using a Type of Pain and Fever Medication in Second Half of Pregnancy Could Lead to Complications". U.S. Food and Drug Administration (FDA) (Press release). 15 October 2020. Retrieved 15 October 2020.
 이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다..
이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다.. - ^ Jump up to: a b "NSAIDs may cause rare kidney problems in unborn babies". U.S. Food and Drug Administration. 21 July 2017. Retrieved 15 October 2020.
 이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다..
이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다.. - ^ Jump up to: a b c d The NDA Pipeline 1992. Chevy Chase, MD: F-D-C Reports, Inc. 1992. pp. I-462.
- ^ Oxazoles, retrieved 2015-12-07
- ^ Brown, K. (July 13, 1968). "Diaryloxazole and Diarylthiazolealkanoic Acids: Two Novel Series of Non-steroidal Anti-inflammatory Agents". Nature. 219 (5150): 164. Bibcode:1968Natur.219..164B. doi:10.1038/219164a0. PMID 5301713. S2CID 4214027.
- ^ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. Whitehouse Station, NJ: Merck Research Laboratories. 2001.
- ^ Jump up to: a b "Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations". www.accessdata.fda.gov. Retrieved 2015-12-02.
- ^ "FDA Enforcement Report" (PDF). FDA.gov. June 24, 2009. Retrieved Dec 2, 2015.