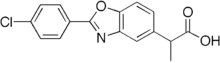
베녹사프로펜
Benoxaprofen베녹사펜으로도 알려진 베녹사프로펜은 CHCLNO라는16123 공식을 가진 화학 화합물로, 비스테로이드성 항염증제(NSAID)로 미국에서는 오라플렉스, 유럽에서는 엘리 릴리와 컴퍼니에 의해 오프렌이라는 상표명으로 시판되었다. 릴리는 1982년 영국 정부와 미국 식품의약국(FDA)의 마약 관련 부작용과 사망 소식이 전해지자 오라플렉스 판매를 중단했다.
역사
Benoxaprofen은 영국 연구소에서 Lilly 화학자 팀에 의해 발견되었다. 이 실험실은 1966년에 새로운 반관절 화합물을 탐사하기 위해 배정되었다. 릴리는 7년 후 베녹사프로펜에 대한 특허를 출원했고 FDA로부터 인간에 대한 약물 실험을 시작하라는 허가를 신청하기도 했다. 연방정부가 요구하는 3단계 임상시험 절차를 거쳐야 했다.[1]
릴리는 소수의 건강한 인간 자원 봉사자들을 시험함으로써 1단계 진행 과정을 시작했다. 이 테스트들은 그 약이 분명하고 즉각적인 안전 위험을 내포하지 않는다는 것을 증명해야 했다. 2단계에서는 경미한 질병을 가진 사람들을 포함하여 더 많은 수의 인간 대상자들이 실험되었다. 그 약의 효과와 안전성이 이 테스트의 주요 목표였다. 3단계는 가장 큰 시험이었고 1976년에 시작되었다. 100명 이상의 의사들이 2,000명 이상의 관절염 환자를 투여했다. 의사들은 그 결과를 릴리 회사에 보고했다.[1]
1980년 1월 FDA와 함께 정식으로 시판할 것을 요청했을 때 이 문서는 10만쪽이 넘는 검사 결과와 환자 기록으로 구성됐다. Benoxaprofen은 처음으로 해외에 팔렸다: 1980년에 그 약은 영국에서 마케팅을 위해 출시되었다. 1982년 5월 미국에서 시판되었다.[2]
베녹사프로펜이 미국에서 오라플렉스로서 시장에 나왔을 때 릴리 회사에 첫 번째 문제의 징후가 나타났다. 영국 의학저널은 1982년 5월 영국의 의사들이 이 약이 신장 및 간 기능 부전에 의해 주로 야기되는 최소 12명의 사망에 책임이 있다고 믿고 있다고 보도했다. 오라플렉스에게 시장에서 퇴출시켜 달라는 청원이 접수됐다.[1]
1982년 8월 4일, 영국 정부는 '안전을 이유로' 영국에서 이 약품의 판매를 잠정 중단했다. 영국 의약품안전위원회는 FDA에 보낸 전보를 통해 오라플렉스 사용 환자 가운데 부작용 신고가 3500건 이상 접수됐다고 선언했다. 사망자도 61명으로 대부분 노인이었다. FDA는 거의 동시에 오라플렉스 사용자 중 미국에서 11명의 사망자가 발생했으며, 이 중 대부분은 신장 손상과 간 손상으로 발생했다고 밝혔다.[1]
엘리 릴리 회사는 그날 오후 베녹사프로펜의 판매를 중단했다.[1]
구조 및 반응도
베녹사프로펜의 분자식은 CHClNO이며16123, 체계적(IUPAC) 명칭은 2-[2-(4-클로로페닐)-1,3-벤조사졸-5-yl)프로피온산이다. 분자는 분자 질량이 301.050568 g/mol이다.[3]
베녹사프로펜은 본질적으로 평면 분자다. 이는 벤조소아졸과 페닐링의 공동 평면성 때문이기도 하지만, 분자 역시 프로파노산 모이로 구성된 비 평면 사이드 체인을 가지고 있어 운반체 역할을 한다. 이 연구 결과는 릴리 연구 센터에서 실시한 X선 결정학적 측정에서 얻어졌다.[4]
Benoxaprofen은 광독성이 강하다. 그 약물의 자유 급진적 디카복실화 파생물질은 산소가 있는 곳에서 singlet 산소와 초산소 음이온을 생성하는 독성물질이다. 수용액에서 benoxaprofen의 조사는 급진적인 메커니즘을 통한 광화학 디카르복시화와 DNA의 단일 가닥 파괴를 유발한다. 이것은 베녹사프로펜보다 이 점에서 훨씬 더 활동적인 케토프로펜과 나프록센, 다른 NSAID에게도 일어난다.[4]
사용 가능한 양식
베녹사프로펜(Benoxaprofen)은 인종 혼합물[(RS)-2-(p-클로로페닐-a-메틸-5-벤조톡사졸레아세트산]이다. 두 개의 반물질은 R(-)과 S(+)[5]이다.
R(-) 엔안티머와 글루쿠로니드 결합의 역전은 베녹사프로펜을 대사시킨다. 그러나 benoxaprofen은 쉽게 산화대사를 겪지 않을 것이다.[4]
그러나 시토크롬 P4501이 촉매일 때 4-클로로필 링의 산소화가 발생할 가능성이 있다. S(+) 에나토머를 사용하면 2-페닐프로피온산 몰이성의 방향족 링의 산소화가 발생할 가능성이 더 높으며, 여기에 촉매 P4501이 있다.[4]
독성역동학
베녹사프로펜은 1~10mg/kg의 용량 경구 투여 후 잘 흡수된다. 혈장에서는 변하지 않는 약만 검출되는데, 대부분 혈장 단백질과 결합되어 있다.[6] 11개 과목의 베녹사프로펜의 플라스마 수준은 2개 구획의 오픈 모델에 기초하여 정확하게 예측되었다. 흡수의 평균 반감기는 0.4시간이었다. 이는 25분 이내에 선량의 절반이 시스템에 흡수된다는 것을 의미한다. 분배의 평균 반감기는 4.8시간이었다. 이는 5시간 이내에 선량의 절반이 전체 시스템에 분포한다는 것을 의미한다. 제거의 평균 반감기는 37.8시간이었다. 이는 40시간 이내에 선량의 절반이 시스템 밖으로 배출된다는 것을 의미한다.[6]
암컷 쥐의 경우 20mg/kg 경구 투여 후, 베녹사프로펜의 조직 농도는 간, 신장, 폐, 부신, 난소에서 가장 높았다. 임신한 여성의 분포는 동일하지만 태아에서 낮은 농도에서도 찾을 수 있다. 배설의 경로에 있어서 종간에는 큰 차이가 있다. 사람, 붉은털원숭이, 토끼는 대부분 오줌을 통해 배설되는 반면, 쥐와 개에서는 담도-대변 배설물을 통해 배설된다. 인간과 개에서는 이 화합물이 에스테르 글루쿠로니드로, 다른 종에서는 변하지 않는 화합물로 배설되었다. 이것은 베녹사프로펜의 대사변형이 일어나지 않는다는 것을 의미한다.[7]
독성역학
다른 NSAIDs와는 달리, benoxaprofen은 단핵 세포에 직접 작용한다. 그것은 Lipoxygenase 효소를 억제함으로써 그들의 화학적 반응을 억제한다.[8]
효능 및 부작용
효능
베녹사프로펜은 진통제, 항균제, 항염증제다.[9] 베녹사프로펜은 항염증 효과 때문에 류마티스 관절염과 골관절염 환자에게 투여되었다. 파게트병, 시뇨관절염, 안키로싱성 척추염, 아픈 어깨, 혼합결합성 질환, 다면체 류마티스, 요통, 베체병 환자들도 베녹사프로펜을 받았다. 하루 300~600mg의 복용량은 많은 환자에게 효과적이다.[10]
역효과
부작용의 종류는 다양하다. 대부분 피하나 위장이었다. 중추신경계에서는 부작용이 거의 나타나지 않고 잡다한 부작용도 자주 관찰되지 않았다. 류마티스 관절염[10] 환자에게서 대부분의 부작용이 나타난다는 연구결과가 나왔다.
피하 부작용
베녹사프로펜의 피하적인 부작용은 광감성, 온열분해, 발진, 밀리아, 손톱 성장 증가, 치욕증(치욕), 고삼투성이다.[10] 광감성은 환자들이 햇빛에 노출되었을 때 화끈거리거나 가려움, 빨개짐으로 이어진다.[11] 베녹사프로펜, 즉 다른 리포록시제네제 억제제가 피부에 염증세포(류세포)의 이동 억제를 하기 때문에 건선 치료에 도움이 될 수 있다는 연구결과가 나왔다.[12]
위장부작용
베녹사프로펜의 위장 부작용은 출혈, 설사, 복통, 거식증(증상), 구강궤양, 미각 변화 등이다.[10][13] 한 연구에 따르면 가장 많이 나타나는 위 부작용은 구토, 속쓰림, 경구통이다.[10]
중추신경계 부작용
소수의 사람들에게, 베녹사프로펜을 복용하는 것은 우울증, 무기력, 그리고 병을 유발할 수 있다.[10]
기타부작용
기절, 현기증, 두통, 두근거림, 경시, 시야 흐림, 비뇨기 급박함, 자일코마스티아는 베녹사프로펜을 복용하는 환자에게서 좀처럼 나타나지 않는다.[10] 베녹사프로펜은 또한 간독성을 유발하여 일부 노인 환자들을 사망에 이르게 한다.[14][15] 그것이 그 약이 시장에서 철수된 주된 이유였다.
독성
1982년 판매 중단 이후 베녹사프로펜이 인간에게 미칠 수 있는 독성 효과를 보다 깊이 연구하였다. 베녹사프로펜의 꽤 평면적인 화합물은 인체에 헤파(hepa-)와 광산화(photoxoxic)인 것 같다.[4]
베녹사프로펜은 인간의 반감기가 다소 길고(t1/2=20~30 h) 담도 배설과 장내혈순환을 겪으며 혈장 간극이 느린 것으로 알려져 있다(CL p=4.5ml/min). 반감기는 노인 환자(>80세)와 이미 신장 장애가 있는 환자의 경우 148시간까지 증가할 수 있다.[4]
베녹사프로펜의 태아 간독성은 반복 투여 후 약물이 축적되고 혈장 간극이 느려지는 것과도 관련이 있다. 약물의 간 축적은 아마도 베낙소프로펜을 산소로 만들고 반응하는 중간체를 생성하는 간상 시토크롬 P450I의 활성 증가의 원인일 것이다. 베녹사프로펜은 시토크롬 P450I와 그 효소 계열의 기질이자 약한 유도체일 가능성이 매우 높다. 일반적으로 산화 반응에 의해 대사되지 않지만, 베녹사프로펜의 S(+) 에노토머와 시토크롬 P450I를 촉매로 하여 4-클로로페닐 링과 2-페닐 프로피온산의 방향족 링의 산소화가 가능할 것으로 보인다. 따라서 경미한 대사 경로를 유도하면 상당한 양의 독성 대사물이 형성된다. 독성 대사물은 중요한 세포내 고분자에 결합할 수 있으며 키노네가 형성되면 리독스 사이클링으로 반응하는 옥시겐을 발생시킬 수 있다.[4] 이것은 또한 반응성 옥시겐의 해독을 담당하는 보호 글루타티온의 고갈로 이어질 수 있다.[16]
베녹사프로펜으로 치료된 환자의 관찰된 피부 광독성은 화합물의 구조를 보면 설명할 수 있다. 베녹사프로펜의 벤조사졸 링과 광독성으로 알려진 화합물인 시오렌의 벤조사후란 링 사이에는 상당한 구조적 유사성이 있다. 그 약물의 자유 디카복실화 유도체는 산소가 존재하는 곳에서 싱글렛 산소와 초옥시 음이온을 생성할 수 있다. 더욱이 광화학 디카복시화 및 산소급성 형성에 대한 가능한 설명은 반복 투여량의 축적, 시토크롬 P450I의 유도 및 공밸런트 결합을 가진 반응성 중간체의 출현일 수 있다. 화합물의 광화학 성질은 염증과 심각한 조직 손상을 일으킬 수 있다.[4]
동물들에서는 과산화지질 증식도 관찰되지만 인간에게는 중요하지 않은 것 같다.[4]
동물에 미치는 영향
베녹사프로펜이 동물에 미치는 영향은 일련의 실험에서 시험되었다.[7][17] Benoxaprofen은 상당한 항염증, 진통제를 가지고 있었고 또한 그 테스트에서 항피레틱 활성을 가지고 있었다.[7] 쥐, 개, 붉은털원숭이, 토끼, 기니피그, 쥐 등 6개 동물 실험에서 모두 구전으로 잘 흡수된 약이었다. 6종 중 3종에서 benoxaprofen은 위장관으로부터 효과적으로 흡수되었다(1~10mg/kg 경구 투여 후).[7] 혈장 반감기는 개, 토끼, 원숭이 등에서는 13시간이 채 안 될 정도로 차이가 있는 것으로 나타났고, 쥐에서는 더 긴 것이 눈에 띄었다. 게다가, 그 화합물의 배설 속도와 경로에서 종들의 차이가 발견되었다. 베녹사프로펜은 토끼와 기니피그에 의해 소변으로 배설된 반면 담도 배설은 쥐와 개에게서 발견되는 통과의 방법이었다. 모든 종에서 변하지 않은 베녹사프로펜만이 대부분 단백질에 광범위하게 결합된 혈장에서 발견되었다.[7]
변치 않는 화합물을 담즙으로 배설하는 것은 쥐에게서 더 느리게 일어났다. 이는 저자들이 장내순환이 일어나지 않는다는 증거로 해석된다.[7] 쥐에 대한 또 다른 연구는 간세포의 혈장 막이 베녹사프로펜 투여 후 표백 형성이 시작되었음을 보여주었다. 이는 미토콘드리아 기능에 영향을 미토콘드리아 기능에 영향을 미치고 따라서 칼슘 농도에 장애를 일으킬 수 있는 세포 리독스 상태의 결과일 가능성이 있는 칼슘 농도의 교란 때문인 것으로 생각된다.[17] 그 종들 중 어느 종에서도 베녹사프로펜의 상당한 수준의 신진대사가 일어난 것이 발견되지 않았다. 오직 개들에서만 글루쿠로니드가 담즙에서 발견될 수 있었는데, 이것은 그 종에서 신진대사의 확실한 징후다. 또한 정상 쥐와 임신 쥐의 화합물 분포에서도 차이가 발견되지 않았다. 그것은 쥐들에게 베녹사프로펜이 태아에 분배되었지만 모체 조직보다 두드러지게 낮은 농도로 나타났다.[7]
합성
2-(4-aminophenyl)propannitrile(1)의 diazotization에 의한 Sandmeyer 반응이 산 가수분해로 이어지면 페놀(2)이 나타나 질화 및 감소를 거쳐 아미노페놀(3)을 준다. 니틸을 가수분해하고 에스테르화하면 에스테르 4가 생성되는데, 에스테르 4는 염화 p-클로로벤조일(p-clorobenzoyl)을 아킬화하여 베녹사프로펜(5)으로 변환한 다음, 사이클화 후 에틸에스테르를 사포화한다.
참조
- ^ Jump up to: a b c d e Lueck TJ (15 August 1982). "At Lilly, the Side-Effects Of Oraflex". The New York Times.
- ^ Grahame R (November 1982). "The rise and fall of Benoxaprofen". Rheumatology and Rehabilitation. XXI (4).
- ^ "Benoxaprofen". ChemSpider.
- ^ Jump up to: a b c d e f g h i j Lewis DF, Ioannides C, Parke DV (December 1990). "A retrospective study of the molecular toxicology of benoxaprofen". Toxicology. 65 (1–2): 33–47. doi:10.1016/0300-483x(90)90077-t. PMID 2274968.
- ^ Bopp RJ, Nash JF, Ridolfo AS, Shepard ER (1979). "Stereoselective inversion of (R)-(-)-benoxaprofen to the (S)-(+)-enantiomer in humans". Drug Metabolism and Disposition: The Biological Fate of Chemicals. 7 (6): 356–9. PMID 43219.
- ^ Chatfield DH, Tarrant ME, Smith GL, Speirs CF (October 1977). "Pharmacokinetic studies with benoxaprofen in man: prediction of steady-state levels from single-dose data". British Journal of Clinical Pharmacology. 4 (5): 579–83. doi:10.1111/j.1365-2125.1977.tb00789.x. PMC 1429156. PMID 303114.
- ^ Jump up to: a b c d e f g Chatfield DH, Green JN (March 1978). "Disposition and metabolism of benoxaprofen in laboratory animals and man". Xenobiotica; the Fate of Foreign Compounds in Biological Systems. 8 (3): 133–44. doi:10.3109/00498257809060392. PMID 418580.
- ^ "Benoxaprofen". British Medical Journal (Clinical Research ed.). 285 (6340): 459–460. 14 August 1982. doi:10.1136/bmj.285.6340.459. PMC 1499290. PMID 6809122.
- ^ Dahl SL, Ward JR (1982). "Pharmacology, clinical efficacy, and adverse effects of the nonsteroidal anti-inflammatory agent benoxaprofen". Pharmacotherapy. 2 (6): 354–66. doi:10.1002/j.1875-9114.1982.tb03212.x. PMID 6762531.
- ^ Jump up to: a b c d e f g Halsey JP, Cardoe N (May 1982). "Benoxaprofen: side-effect profile in 300 patients". British Medical Journal (Clinical Research ed.). 284 (6326): 1365–8. doi:10.1136/bmj.284.6326.1365. PMC 1498268. PMID 6803978.
- ^ Hindson C, Daymond T, Diffey B, Lawlor F (May 1982). "Side effects of benoxaprofen". British Medical Journal (Clinical Research ed.). 284 (6326): 1368–9. doi:10.1136/bmj.284.6326.1368. PMC 1498237. PMID 6803979.
- ^ Allen BR, Littlewood SM (October 1982). "Benoxaprofen: effect on cutaneous lesions in psoriasis". British Medical Journal (Clinical Research ed.). 285 (6350): 1241. doi:10.1136/bmj.285.6350.1241. PMC 1499777. PMID 6812822.
- ^ Somerville KW, Hawkey CJ (January 1986). "Non-steroidal anti-inflammatory agents and the gastrointestinal tract". Postgraduate Medical Journal. 62 (723): 23–8. doi:10.1136/pgmj.62.723.23. PMC 2418576. PMID 3540919.
- ^ Doube A (July 1990). "Hepatitis and non-steroidal anti-inflammatory drugs". Annals of the Rheumatic Diseases. 49 (7): 489–90. doi:10.1136/ard.49.7.489. PMC 1004125. PMID 2200358.
- ^ Taggart HM, Alderdice JM (May 1982). "Fatal cholestatic jaundice in elderly patients taking benoxaprofen". British Medical Journal (Clinical Research ed.). 284 (6326): 1372. doi:10.1136/bmj.284.6326.1372. PMC 1498289. PMID 6462187.
- ^ Ayrton AD, Ioannides C, Parke DV (June 1991). "Induction of the cytochrome P450 I and IV families and peroxisomal proliferation in the liver of rats treated with benoxaprofen. Possible implications in its hepatotoxicity". Biochemical Pharmacology. 42 (1): 109–15. doi:10.1016/0006-2952(91)90688-2. PMID 2069584.
- ^ Jump up to: a b Knights KM, Cassidy MR, Drew R (September 1986). "Benoxaprofen induced toxicity in isolated rat hepatocytes". Toxicology. 40 (3): 327–39. doi:10.1016/0300-483x(86)90064-8. PMID 3750332.
- ^ Dunwell DW, Evans D, Hicks TA (January 1975). "2-aryl-5-benzoxazolealkanoic acid derivatives with notable antiinflammatory activity". Journal of Medicinal Chemistry. 18 (1): 53–8. doi:10.1021/jm00235a012. PMID 1109576.