알켄
Alkene
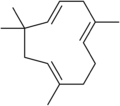
알켄(Alkene)은 유기 화학에서 탄소-탄소 이중 결합을 포함하는 탄화수소를 말합니다.[1]이중 결합은 내부 또는 종단 위치에 있을 수 있습니다.말단 알켄은 α-올레핀이라고도 합니다.
국제순수응용화학연합(IUPAC)은 이중결합이 1개뿐인 비환식 탄화수소에 대해서만 "알켄"이라는 명칭을 사용할 것을 권고하고 있으며, 이중결합이 2개 이상인 비환식 탄화수소에는 알카디엔, 알카트리엔 등 또는 폴리엔, 고리형인 경우 사이클로알켄, 사이클로알카디엔 등; 및 일반적인 부류에는 "올레핀" - 사이클로알킬 또는 AC하나 또는 그 이상의 이중 결합을 갖는, 순환형.[2][3][4]
하나의 이중 결합만 있고 다른 작용기(mono-enes라고도 함)가 없는 비순환 알켄이 일반적인 화학식을 가진 상동성 일련의 탄화수소를 형성합니다.n이 2 이상인 CHn2n(해당 알칸보다 2개 적은 수소).n이 4 이상이면 이중결합의 위치와 형태로 구별되는 이성질체가 가능합니다.
알켄은 일반적으로 무색의 비극성 화합물이며, 알켄과 약간 비슷하지만 반응성이 더 높습니다.이 시리즈의 처음 몇 멤버는 상온의 기체 또는 액체입니다.가장 단순한 알켄인 에틸렌(CH24)(또는 IUPAC 명명법에서 "에틸렌")은 산업적으로 가장 큰 규모로 생산되는 유기 화합물입니다.[5]
방향족 화합물은 종종 고리형 알켄으로 그려지지만, 그 구조와 성질은 알켄이나 올레핀으로 분류되지 않을 정도로 충분히 구별됩니다.[3]두 개의 이중 결합(C=C=C)을 갖는 탄화수소는 알렌이라고 불리고, 가장 간단한 이러한 화합물은 그 자체로 알렌이라고 불립니다. 그리고 세 개 이상의 중복 결합(C=C=C=C, C=C=C=C 등)을 갖는 탄화수소는 큐뮬렌이라고 불립니다.
구조이성질체론
4개 이상의 탄소 원자를 갖는 알켄은 다양한 구조적 이성질체를 형성할 수 있습니다.대부분의 알켄은 사이클로알칸의 이성질체이기도 합니다.단 하나의 이중 결합을 갖는 비환식 알켄 구조 이성질체는 다음과 같습니다.[6]
- CH24: 에틸렌 전용
- CH36: 프로필렌만
- CH48: 이성질체 3종: 1-부텐, 2-부텐 및 이소부틸렌
- CH510: 5 이성질체: 1-펜텐, 2-펜텐, 2-메틸-1-부텐, 3-메틸-1-부텐, 2-메틸-2-부텐
- CH612: 13개 이성질체: 1-헥센, 2-헥센, 3-헥센, 2-메틸-1-펜텐, 3-메틸-1-펜텐, 4-메틸-1-펜텐, 2-메틸-2-펜텐, 3-메틸-2-펜텐, 4-메틸-2-펜텐, 2,3-디메틸-1-부텐, 3,3-디메틸-1-부텐, 2,3-디메틸-2-부텐, 2-에틸-1-부텐
이러한 분자들 중 많은 것들이 시스-트랜스 이성질체를 보여줍니다.특히 더 큰 분자(C로부터5) 내에는 카이랄 탄소 원자가 있을 수도 있습니다.잠재적 이성질체의 수는 탄소 원자가 추가됨에 따라 빠르게 증가합니다.
구조 및 접합
본딩

탄소-탄소 이중 결합은 시그마 결합과 파이 결합으로 구성됩니다.이 이중 결합은 단일 공유 결합(C=C의 경우 611 kJ/mol 대 C-C의 경우 347 kJ/mol)보다 강하지만 두 배나 강하지는 않습니다.이중 결합은 일반적인 C-C 단일 결합의 경우 평균 결합 길이가 1.33 Å(133 pm) 대 1.53 Å인 단일 결합보다 짧습니다.[7]
이중 결합의 각 탄소 원자는 3개의 sp2 하이브리드 오비탈을 사용하여 3개의 원자(다른 탄소 원자와 2개의 수소 원자)와 시그마 결합을 형성합니다.3개의 sp2 혼성 궤도의 축들에 의해 생성된 평면에 수직으로 놓여있는 혼성화되지 않은 2p 원자 궤도들은 파이 결합을 형성합니다.이 결합은 주 C-C 축의 바깥쪽에 있으며, 결합의 반은 분자의 한쪽에, 반은 다른 쪽에 있습니다.65 kcal/mol의 강도로 파이 결합은 시그마 결합보다 상당히 약합니다.
탄소-탄소 이중 결합에 대한 회전은 두 탄소 원자의 p 오비탈 정렬을 깨는 에너지 비용을 발생시키기 때문에 제한됩니다.따라서 시스 또는 트랜스 이성질체는 매우 느리게 상호 변환되어 이성질화 없이 주변 조건에서 자유롭게 처리할 수 있습니다.더 복잡한 알켄은 치환기가 3개 또는 4개인 분자에 대한 E-Z 표기법으로 명명될 수 있습니다.예를 들어, 부텐의 이성질체 중 (Z)-부트-2-엔(일명 시스-2-부텐)의 두 메틸기는 이중 결합의 동일한 면에 나타나고 (E)-부트-2-엔(일명 트랜스-2-부텐)에서 메틸기는 반대쪽에 나타납니다.부텐의 이 두 이성질체는 뚜렷한 특성을 가지고 있습니다.
모양.
전자쌍 반발력의 VSEPR 모델에 의해 예측된 바와 같이 알켄의 분자 형상은 약 120°의 이중 결합에서 각 탄소 원자에 대한 결합 각도를 포함합니다.이중 결합의 탄소 원자에 부착된 작용기 사이의 비결합 상호작용에 의해 유입되는 입체 변형으로 인해 각도가 달라질 수 있습니다.예를 들어 프로필렌의 C-C-C 결합 각도는 123.9°입니다.
브리지드 알켄의 경우, 브리지드 알켄의 규칙은 고리가 충분히 크지 않으면 브리지드 고리 시스템의 교두보에서 이중 결합이 발생할 수 없다고 명시합니다.[8]포셋(Fawcett)에 따라 그리고 S를 링의 비-교두 원자의 총 개수로 정의하면, 바이사이클릭 시스템은 안정성을 위해 S ≥ 7을 필요로 하고 트라이사이클릭 시스템은 S ≥ 11을 필요로 합니다.
이성질체론
유기화학에서 cis-와 trans-라는 접두사는 이중 결합으로 결합된 탄소 원자에 부착된 작용기의 위치를 설명하는 데 사용됩니다.라틴어로 cis와 trans는 각각 "이쪽에"와 "반대쪽에"를 의미합니다.따라서 작용기가 탄소 사슬의 같은 쪽에 있으면 결합은 cis- 구성이라고 하고, 그렇지 않으면(즉 작용기가 탄소 사슬의 반대쪽에 있음) 결합은 trans- 구성이라고 합니다).
-
시스-2-부텐의 구조
-
트랜스-2-부텐의 구조
-
(E-그러나-2-엔
-
(Z-그러나-2-엔
시스- 및 트랜스- 구성이 존재하기 위해서는 탄소 사슬이 있어야 하며, 또는 각각의 탄소에 부착된 적어도 하나의 작용기는 양쪽에서 동일합니다.E- 및 Z- 구성은 이중 결합에서 탄소 원자에 부착된 4개의 작용기가 모두 다른 보다 일반적인 경우에 대신 사용될 수 있습니다.E-와 Z-는 독일어 단어 zusammen(함께)과 entgegen(반대)의 줄임말입니다.E- 및 Z 이성질체에서는 칸-잉골드-프리로그 우선 순위 규칙에 따라 각 기능 그룹에 우선 순위가 할당됩니다.우선 순위가 높은 두 그룹이 이중 결합의 같은 쪽에 있으면 결합에 Z- 구성이 할당되고, 그렇지 않으면(즉, 우선 순위가 높은 두 그룹이 이중 결합의 반대쪽에 있음) 결합에 E- 구성이 할당됩니다.Cis- 및 트랜스 구성은 E- 및 Z- 구성과 고정된 관계가 없습니다.
물리적 특성
알켄과 알칸의 많은 물리적 특성들은 유사합니다: 그것들은 무색, 무극성, 가연성입니다.물리적 상태는 분자 질량에 따라 다릅니다. 해당하는 포화 탄화수소와 마찬가지로 가장 간단한 알켄(에틸렌, 프로필렌 및 부텐)은 상온에서 가스입니다.약 5~16개의 탄소 원자의 선형 알켄은 액체이고, 더 높은 알켄은 왁스 고체입니다.고체의 녹는점은 분자량이 증가함에 따라 증가합니다.
알켄은 일반적으로 그에 상응하는 알켄보다 더 강한 냄새를 가집니다.에틸렌은 달콤하고 퀴퀴한 냄새가 납니다.특히 노르보르넨과 트랜스사이클로옥텐과 같은 긴장된 알켄은 강하고 불쾌한 냄새를 가지고 있는 것으로 알려져 있는데, 이는 구리를 포함한 금속 이온과 형성하는 더 강한 π 복합체와 일치합니다.
끓는점, 녹는점
아래는 다양한 알켄의 끓는점과 녹는점을 해당하는 알켄 및 알킨 유사체와 함께 나열한 것입니다.[12][13]
| 개수 탄소들 | 알케인 | 알켄 | 알킨 | |
|---|---|---|---|---|
| 2 | 이름. | 에탄 | 에틸렌 | 아세틸렌 |
| 융점 | −183 | −169 | −80.7 | |
| 비등점 | −89 | −104 | −84.7 | |
| 3 | 이름. | 프로판의 | 프로필렌 | 프로핀 |
| 융점 | −190 | −185 | −102.7 | |
| 비등점 | −42 | −47 | −23.2 | |
| 4 | 이름. | 부탄 | 1-부텐 | 1-부틴 |
| 융점 | −138 | −185.3 | −125.7 | |
| 비등점 | −0.5 | −6.2 | 8.0 | |
| 5 | 이름. | 펜탄 | 1-펜텐 | 1펜텐 |
| 융점 | −130 | −165.2 | −90.0 | |
| 비등점 | 36 | 29.9 | 40.1 |
적외선 분광법
C=C 결합의 신장은 1670– 1600 cm에서 IR 흡수 피크를 제공하고 C=C 결합의 굽힘은 1000-650 cm 파장을 흡수합니다.
NMR 분광법
HNMR 분광법에서 이중결합에 인접한 탄소에 결합된 수소는 4.5-6.5 ppm의 δ을 제공합니다.또한 이중 결합은 sp 탄소에 인접한 탄소에 부착된 수소를 차폐하며, 이로 인해 δ=1.6–2. ppm 피크가 발생합니다.시스/트랜지스터는 J-커플링 효과가 달라 구별할 수 있습니다.시스바이시널 수소는 6~14Hz 범위의 결합 상수를 갖는 반면 트랜스는 11~18Hz 범위의 결합 상수를 갖습니다.[15]
알켄의 CNMR 스펙트럼에서 이중 결합은 또한 탄소를 차폐하여 낮은 전계 이동을 만듭니다.C=C 이중 결합은 일반적으로 약 100–170 ppm의 화학적 이동을 갖습니다.
연소
대부분의 다른 탄화수소들처럼, 알켄들은 이산화탄소와 물을 주기 위해 연소합니다.
알켄의 연소는 동일한 수의 탄소로 포화된 알켄의 동일한 몰에서 연소하는 것보다 적은 에너지를 방출합니다.이러한 경향은 탄화수소 연소의 표준 엔탈피 목록에서 명확하게 확인할 수 있습니다.[16]
| 개수 탄소들 | 물질. | 유형 | 공식 | ㅇcø (kJ/mol) |
|---|---|---|---|---|
| 2 | 에탄 | 포화 상태의 | C2H6 | −1559.7 |
| 에틸렌 | 불포화의 | C2H4 | −1410.8 | |
| 아세틸렌 | 불포화의 | C2H2 | −1300.8 | |
| 3 | 프로판의 | 포화 상태의 | CH3CH2CH3 | −2219.2 |
| 프로펜의 | 불포화의 | CHCH=CH | −2058.1 | |
| 프로핀 | 불포화의 | CHC ≡CH | −1938.7 | |
| 4 | 부탄 | 포화 상태의 | CH3CH2CH2CH3 | −2876.5 |
| 1-부텐 | 불포화의 | CH=CH-CHCH | −2716.8 | |
| 1-부틴 | 불포화의 | CH ≡C-CHCH | −2596.6 |
반응
알켄은 비교적 안정적인 화합물이지만 알칸보다 반응성이 높습니다.알켄의 대부분의 반응은 이 파이 결합에 첨가되어 새로운 단일 결합을 형성합니다.알켄은 다양한 반응, 현저하게 중합 및 알킬화에 참여할 수 있기 때문에 석유 화학 산업의 공급 원료 역할을 합니다.에틸렌을 제외한 알켄은 탄소-탄소 파이-결합과 알릴 CH-중심의 존재라는 두 가지 반응성 부위를 가지고 있습니다.전자가 지배적이지만 동맹국 사이트도 중요합니다.
불포화 결합에 더해서

수소화는 알칸을 생성하는 H의2 첨가를 포함합니다.에틸렌이 메탄으로 수소화되는 방정식은 다음과 같습니다.
- HC=CH + H→HC-CH
수소화 반응은 일반적으로 반응 속도를 높이기 위해 촉매를 필요로 합니다.불포화 탄화수소에 첨가할 수 있는 수소의 총 개수는 그 불포화 정도에 따라 달라집니다.
수소와 유사하게 할로겐은 이중 결합에 추가됩니다.
- HC=CH + Br→H2CBr−CH2Br
할로늄 이온은 중간체입니다.이러한 반응은 촉매를 필요로 하지 않습니다.

브로민 테스트는 탄화수소의 포화도를 테스트하는 데 사용됩니다.[17]브롬 테스트는 불포화 탄화수소의 불포화 정도를 나타내는 데도 사용될 수 있습니다.브롬 수는 100g의 생성물과 반응할 수 있는 브롬 그램으로 정의됩니다.[18]수소화와 마찬가지로 브롬의 할로겐화도 π 결합의 수에 따라 달라집니다.브롬 수치가 높을수록 포화도가 높다는 것을 나타냅니다.
알켄 탄화수소의 π 결합 또한 수화에 취약합니다.그 반응은 보통 강한 산을 촉매로 사용합니다.[19]수화의 첫 단계는 종종 탄산염의 형성을 수반합니다.반응의 결과는 알코올이 될 것입니다.에틸렌 수화의 반응식은 다음과 같습니다.
- HC=CH + HO→H3C-CH2OH
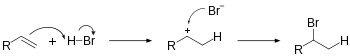
할로겐화 수소화는 불포화 탄화수소에 H-X를 첨가하는 것을 포함합니다.이 반응은 새로운 C-H 및 C-X σ 결합을 초래합니다.중간 탄화물의 형성은 선택적이고 마르코프니코프의 규칙을 따릅니다.알켄의 히드로할로겐화는 할로알칸을 생성할 것입니다.에틸렌에 HBr을 첨가하는 반응식은 다음과 같습니다.
- HC=CH + HBr → HC-CHBr
사이클로드 에디션
![Generation of singlet oxygen and its [4+2]-cycloaddition with cyclopentadiene](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)
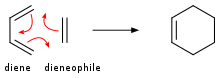
알켄은 다이엔에 첨가하여 사이클로헥센을 생산합니다.이 전환은 디엘스-알더 반응의 한 예입니다.이러한 반응은 입체화학의 유지와 함께 진행됩니다.요금은 전자 인출 또는 전자 기증 대체품에 민감합니다.자외선에 의해 조사되면, 알켄은 이량체화되어 사이클로부탄을 생성합니다.[20]또 다른 예로는 단일 산소가 알릴 구조와 반응하여 전치된 알릴 과산화물을 생성하는 솅켄 반응이 있습니다.

산화
알켄은 퍼카복실산과 심지어 과산화수소와도 반응하여 산화물을 생성합니다.
에틸렌의 경우, 은 기반 촉매가 있는 상태에서 산소를 사용하여 산업적으로 매우 큰 규모로 산화가 수행됩니다.
- CH + 1/ O → CHO
알켄은 오존과 반응하여 이중 결합을 제거합니다.그 과정은 오존 용해라고 불립니다.종종 반응 과정에는 디메틸설파이드(SME2)와 같은 경도의 환원제가 포함됩니다.
KMnO의4 뜨거운 농축된 산성화 용액으로 처리될 때, 알켄은 케톤 및/또는 카르복실산을 형성하기 위해 분해됩니다.반응의 화학양론은 조건에 민감합니다.이 반응과 오존 용해는 알려지지 않은 알켄에서 이중 결합의 위치를 결정하는 데 사용될 수 있습니다.
산화는 사산화 오스뮴이나 다른 산화제를 사용하여 알켄을 완전히 분해하는 것이 아니라 바이시날 디올에서 막을 수 있습니다.
이 반응은 디하이드록실화라고 불립니다.
메틸렌 블루(methylene blue) 및 라이트(light)와 같은 적절한 광감각제의 존재하에서, 알켄은 광감각제에 의해 생성된 활성 산소종, 예를 들어 하이드록실 라디칼, 싱글릿 산소 또는 슈퍼옥사이드 이온과 반응을 겪을 수 있습니다.여기된 증감체의 반응은 전자 또는 수소 전이를 수반할 수 있으며, 대개 환원 기질(Type I 반응) 또는 산소와의 상호 작용(Type II 반응)을 수반할 수 있습니다.[21]이러한 다양한 대체 공정과 반응은 특정 반응 조건의 선택에 의해 제어될 수 있으며, 이는 다양한 제품으로 이어집니다.일반적인 예는 사이클로펜타디엔과 같은 디엔과 함께 단일 산소를 [4+2]-사이클로딩하여 엔도폭사이드를 생성하는 것입니다.
중합
말단 알켄은 중합이라 불리는 과정을 통해 고분자의 전구체입니다.일부 중합은 플라스틱 폴리에틸렌 및 폴리프로필렌을 생성하기 때문에 경제적으로 매우 중요합니다.알켄에서 나오는 고분자는 올레핀이 없지만 보통 폴리올레핀이라고 불립니다.중합은 다양한 메커니즘을 통해 진행될 수 있습니다.부타-1,3-디엔 및 이소프렌(2-메틸부타-1,3-디엔)과 같은 공액 디엔은 또한 중합체를 생성하며, 한 예는 천연 고무입니다.
알릴릭 치환
불포화 탄화수소에 C=C π 결합이 존재하면 알릴 C-H 결합의 해리 에너지가 약화됩니다.따라서 이러한 그룹화는 C=C 부위의 부가 반응뿐만 아니라 이러한 C-H 부위의 자유 라디칼 치환에 취약합니다.라디칼 개시제가 존재하는 경우, 알릴 C-H 결합은 할로겐화될 수 있습니다.[22]하나의 메틸렌, 즉 이중 알릴릭을 측면에 배치하는 두 개의 C=C 결합의 존재는 특히 약한 HC-H 결합을 초래합니다.이러한 상황의 높은 반응성은 건조 오일의 화학에서 나타나는 특정한 자유 라디칼 반응의 기초가 됩니다.
메타테시스
알켄은 알켄의 치환기를 분해하고 교환하는 올레핀 대사작용을 거칩니다.이와 관련된 반응으로는 에틸렌 분해가 있습니다.[23]
금속 착화


금속-알켄 복합체인 비스(시클로옥타디엔)니켈(0)의 구조
전이금속 알켄 복합체에서 알켄은 금속의 리간드 역할을 합니다.[24]이 경우, π 전자 밀도는 금속 d 오비탈에 기부됩니다.도네이션이 강할수록 알켄의 금속 d 오비탈에서 π* 반결합 오비탈로의 백본딩이 강합니다.이 효과는 알켄의 결합 순서를 낮추고 C-C 결합 길이를 증가시킵니다.한 예로 복잡한3 PtCl(−CH24)]이 있습니다.이러한 복합체는 불포화 탄화수소의 금속 촉매 반응 메커니즘과 관련이 있습니다.[23]
반응개요
| 반응명 | 제품. | 댓글 |
|---|---|---|
| 수소화 | 알케인 | 수소첨가 |
| 하이드로알케닐화 | 알켄, 알케네스 | 금속 촉매에 의한 수소화/삽입/베타 제거 |
| 할로겐첨가반응 | 1,2-디할라이드 | 할로겐의 친전자성 첨가 |
| 할로겐화수소 (마르코프니코프) | 할로알칸 | 할로겐화수소산 첨가 |
| 반마르코프니코프 히드로할로겐화 | 할로알칸 | 활성산소가 수소할산을 매개로 첨가함 |
| 히드로아미네이션 | 마인즈 | C-C 이중 결합에 N-H 결합 추가 |
| 하이드로포름화 | 알데하이드류 | 산업 공정, CO 및 H 첨가2 |
| 탄화수소화 및 코흐 반응 | 카르복실산 | 산업 공정, CO 및 HO2 추가. |
| 카르보알콕시화 | 에스터 | 산업 공정, CO 및 알코올 첨가 |
| 알킬화 | 에스터 | 산업적 공정: 알켄 알킬화 카르복실산과 규텅스텐산 촉매. |
| 비쉬 하이드록실화 | 디올스 | 산화, 시약: 사산화 오스뮴, 카이랄 리간드 |
| 우드워드 시스-하이드록실화 | 디올스 | 산화, 시약: 요오드, 아세트산은 |
| 오존 용해 | 알데하이드류 또는 케톤류 | 시약 : 오존 |
| 올레핀 메타테시스 | 알켄, 알케네스 | 두 알켄이 두 알켄을 형성하기 위해 재배열합니다. |
| 디엘스-알데르 반응 | 사이클로헥센 | 디엔을 첨가한 사이클로딩 |
| 파우손-칸드 반응 | 사이클로펜테논 | 알킨과 CO를 사용한 사이클로딩 |
| 하이드로보레이션 – 산화 | 술, 술. | 시약: 붕산, 과산화물 |
| 산소 경화-환원 | 술, 술. | 초산 수은을 친자성으로 첨가한 후 환원. |
| 프린스 반응 | 1,3디올 | 알데히드 또는 케톤과의 친전자성 첨가 |
| 파테르노-뷔치 반응 | 옥세탄가 | 알데히드 또는 케톤과의 광화학 반응 |
| 산화 | 에폭시드 | 과산화물의 친자성 첨가 |
| 사이클로프로판화 | 사이클로프로판 | 카르베네 또는 카르베노이드 첨가 |
| 히드로아실화 | 케톤류 | 금속 촉매에 의한 산화적 첨가/환원 제거 |
| 친수화 | 포스핀 |
합성
공업용법
알켄은 탄화수소 분해에 의해 생성됩니다.미국과 중동에서는 천연가스 응축수 성분(주로 에탄과 프로판)이 원료이고, 유럽과 아시아에서는 나프타가 원료입니다.알케인은 주로 지방족 알켄과 저분자 알케인의 혼합물을 생성하기 위해 고온에서, 종종 제올라이트 촉매가 존재할 때 분해됩니다.혼합물은 공급 원료와 온도에 따라 다르며, 분급 증류를 통해 분리됩니다.이는 주로 소형 알켄(최대 6개의 탄소) 제조에 사용됩니다.[25]

이와 관련된 것이 촉매 탈수소화인데, 여기서 알칸은 고온에서 수소를 잃어서 상응하는 알켄을 생산합니다.[1]이것은 알켄의 촉매 수소화의 반대입니다.

이 과정을 개혁이라고도 합니다.두 과정 모두 흡열성이며 엔트로피에 의해 고온에서 알켄을 향해 진행됩니다.
(RCH=CH 유형의) 더 높은 α-알켄의 촉매 합성은 또한 니켈, 코발트 또는 백금의 존재하에서 에틸렌과 유기 금속 화합물 트리에틸알루미늄의 반응에 의해 달성될 수 있습니다.
탈락반응
실험실에서 알켄 합성을 위한 주요 방법 중 하나는 알킬 할라이드, 알코올 및 유사한 화합물의 제거 반응입니다.가장 일반적인 것은 E2 또는 E1 메커니즘을 통한 β 제거입니다.[26]상업적으로 중요한 예는 염화비닐의 생산입니다.
E2 메커니즘은 대부분의 알켄 합성에 대해 E1보다 더 신뢰할 수 있는 β-제거 방법을 제공합니다.대부분의 E2 제거는 알킬 할라이드 또는 알킬 술폰산 에스테르(토실레이트 또는 트리플레이트와 같은)로 시작합니다.알킬 할라이드가 사용될 때, 그 반응은 탈할로겐화라고 불립니다.비대칭 제품의 경우 치환된 알켄(C=C에 부착된 수소가 적은 알켄)이 우세한 경향이 있습니다(자이체프의 규칙 참조).제거 반응의 두 가지 일반적인 방법은 알킬 할라이드의 탈수소화와 알코올의 탈수소화입니다.일반적인 예는 아래에 나타나 있습니다. 가능한 경우 H는 이탈 그룹에 대해 반작용이지만 Z 이성질체의 안정성은 떨어집니다.[27]

알코올로부터 탈수를 통해 알켄을 합성할 수 있으며, 이 경우 물은 E1 메커니즘을 통해 손실됩니다.예를 들어 에탄올의 탈수로 에틸렌이 생성됩니다.
- CHCHOH → HC= CH + HO
알코올은 또한 츄가예프 제거 및 그리에코 제거와 같은 더 가벼운 신-제거를 허용하기 위해 더 나은 이탈 그룹(예: 잔산산염)으로 전환될 수 있습니다.관련 반응으로는 β-헤일로에테르(보드 올레핀 합성) 및 에스테르(에스테르 열분해)에 의한 제거가 있습니다.
알켄은 알킬아민으로부터 간접적으로 제조될 수 있습니다.아민 또는 암모니아는 적합한 이탈 그룹이 아니므로, 아민은 먼저 알킬화되거나(호프만 제거에서와 같이) 아민 산화물로 산화되어(코프 반응) 원활한 제거가 가능합니다.코프 반응은 150°C 이하에서 발생하는 합성 제거입니다. 예를 들어 다음과 같습니다.[28]

호프만 제거는 덜 치환된 (자이체프가 아닌) 알켄이 일반적으로 주요 생성물이라는 점에서 특이합니다.
알켄은 람베르그-배클룬드 반응에서 α-할로술폰으로부터 생성되며, 3원 고리의 술폰 중간체를 통해 생성됩니다.
카보닐 화합물로부터 합성
알켄 합성을 위한 또 다른 중요한 방법은 카르보닐 화합물(알데히드 또는 케톤 등)을 카르바니온 또는 그 등가물에 결합 또는 축합시켜 새로운 탄소-탄소 이중 결합을 구성하는 것입니다.알돌 축합은 전성적인 것입니다.노베나겔 축합은 카보닐을 알켄으로 바꾸는 반응의 관련 부류입니다.잘 알려진 방법을 올레피네이션이라고 합니다.위티그 반응은 예시적이지만 호너-와즈워스-에몬스 반응을 포함한 다른 관련 방법들이 알려져 있습니다.
위티그 반응은 알데히드 또는 케톤과 PhP= chr 유형의 위티그 시약(또는 인광)을 반응시켜 알켄 및 PhP=O를 생성합니다.위티그 시약 자체는 트리페닐포스핀과 알킬할라이드로부터 쉽게 제조됩니다.[29]

위티그 반응과 관련된 것으로는 페터슨 올레피네이션이 있는데, 이는 인광산 대신 실리콘 기반 시약을 사용합니다.이 반응을 통해 E- 또는 Z-제품을 선택할 수 있습니다.만약 E-제품이 필요하다면, 또 다른 대안은 페닐 술폰에서 생성된 카바니온을 사용하는 줄리아 올레피네이션입니다.유기크로뮴 중간체를 기반으로 한 타카이올피네이션도 E-제품을 공급합니다.테베의 시약인 티타늄 화합물은 메틸렌 화합물의 합성에 유용하며, 이 경우 에스터와 아미드도 반응합니다.
한 쌍의 케톤 또는 알데하이드는 알켄을 생성하기 위해 탈산소화될 수 있습니다.대칭적인 알켄은 티타늄 금속 환원(McMurry 반응)을 사용하여 단일 알데히드 또는 케톤 결합으로 제조될 수 있습니다.서로 다른 케톤을 결합하려면 바튼-켈로그 반응과 같이 더 복잡한 방법이 필요합니다.
단일 케톤은 메톡사이드 나트륨(밤포드-스티븐스 반응) 또는 알킬리튬(샤피로 반응)을 사용하여 토실히드라존을 통해 해당 알켄으로 전환될 수도 있습니다.
알켄으로 합성
에틸렌(가장 작은 알켄)은 저렴하고 쉽게 구할 수 있으며 연간 수억 톤이 생산되기 때문에 더 작은 알켄을 단계적으로 중합하여 더 긴 알켄을 형성하는 것이 매력적입니다.지글러-나타 공정은 폴리에틸렌에 사용되는 것과 같은 매우 긴 사슬의 형성을 가능하게 합니다.계면활성제를 생산하는 것과 같이 더 짧은 사슬이 필요한 경우, 셸 고등 올레핀 공정과 같은 올레핀 대사 단계를 통합하는 공정이 중요합니다.
올레핀 메타테시스는 또한 에틸렌과 2-부텐의 프로필렌으로의 상호 전환을 위해 상업적으로 사용됩니다.이 과정에서는 레늄과 몰리브덴이 함유된 이종 촉매가 사용됩니다.[30]
- CH=CH + CHCH=CHCH → 2 CH=CHCH
전이금속 촉매화된 수소화는 알켄 자체로부터 시작되는 또 다른 중요한 알켄 합성 과정입니다.[31]그것은 이중 결합에 수소와 비닐기(또는 알케닐기)의 추가를 포함합니다.
알킨에서
알킨의 환원은 치환된 알켄의 입체 선택적 합성에 유용한 방법입니다.시스-알켄이 필요한 경우, 린들라 촉매(탄산칼슘 위에 팔라듐을 증착하고 다양한 형태의 납으로 처리된 이종 촉매) 존재 하에서 수소화하는 것이 일반적으로 사용되지만, 하이드로보레이션 후 가수분해가 대안적인 접근법을 제공합니다.액체 암모니아에서 나트륨 금속에 의해 알킨이 환원되면 트랜스 알켄이 생성됩니다.[32]

제조 다중 치환된 알켄의 경우, 알킨의 카보메탈화는 다양한 알켄 유도체를 생성할 수 있습니다.
알켄은 재배열 반응을 통해 다른 알켄으로부터 합성될 수 있습니다.올레핀 메타테시스(위에서 설명한) 이외에도 엔 반응 및 코프 재배열과 같은 많은 주기적인 반응을 사용할 수 있습니다.

디엘-알더 반응에서, 사이클로헥센 유도체는 디엔과 반응성 또는 전자 결핍 알켄으로부터 제조됩니다.
어플
불포화 탄화수소는 플라스틱, 의약품 및 기타 유용한 재료를 생산하는 데 널리 사용됩니다.
| 이름. | 구조. | 사용하다 |
|---|---|---|
| 에틸렌 |  |
|
| 1,3-부타디엔 | 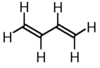 |
|
| 염화비닐 |
| |
| 스티렌 | 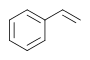 |
|
자연발생
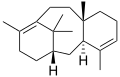
알켄은 자연에 널리 퍼져있습니다.식물은 테르펜의 형태로 알켄의 주요한 천연 공급원입니다.[citation needed]많은 가장 생생한 천연 색소는 테르펜입니다; 예를 들어, 리코펜 (토마토 속은 빨간색), 카로틴 (당근 속은 주황색), 그리고 잔토필 (난황 속은 노란색).모든 알켄 중에서 가장 간단한 것인 에틸렌은 식물의 숙성에 영향을 주는 신호 분자입니다.
- 선별된 자연계 불포화 화합물
IUPAC 명명법
비록 명명법이 광범위하게 지켜지지는 않지만, IUPAC에 따르면, 알켄은 탄소 원자들 사이에 단지 하나의 이중 결합을 가진 비순환적인 탄화수소입니다.[2]올레핀은 디엔 및 폴리엔뿐만 아니라 고리형 및 비고리형 알켄의 더 많은 컬렉션으로 구성됩니다.[3]
일자 체인 알켄에 대한 IUPAC 이름의 루트를 형성하려면 부모의 -an-인픽스를 -en-으로 변경합니다.예를 들어, CH-CH는33 알케인 에쓰입니다.Ane. 따라서 CH=CH의 이름은 ethENe입니다.
탄소수 4 이상의 직쇄 알켄의 경우, 그 이름이 화합물을 완전히 식별하지는 않습니다.그러한 경우 및 분기된 비순환 알켄의 경우 다음 규칙이 적용됩니다.
- 분자 내에서 가장 긴 탄소 사슬을 찾습니다.해당 사슬에 이중 결합이 포함되어 있지 않은 경우 알케인 명명 규칙에 따라 화합물의 이름을 지정합니다.그렇지 않은 경우:
- 이중 결합에 가장 가까운 끝에서부터 시작하여 사슬의 탄소 번호를 매깁니다.
- 이중 결합의 위치 k를 첫 번째 탄소의 수로 정의합니다.
- (수소 이외의) 사이드 그룹의 이름을 해당 규칙에 따라 지정합니다.
- 각 변 그룹의 위치를 연결된 체인 탄소의 개수로 정의합니다.
- 각 사이드 그룹의 위치와 이름을 적습니다.
- "-ane" 접미사를 "k-ene"으로 대체하여 알케인의 이름을 같은 사슬로 작성합니다.
이중 결합의 위치는 접미사("pent-2-ene")가 아닌 체인의 이름 앞에 삽입되는 경우가 많습니다(예: "2-pentene").
위치가 고유한 경우에는 표시할 필요가 없습니다.이중 결합은 해당 알케인에 사용되는 것과는 다른 사슬 번호를 의미할 수 있습니다. (HC)C-CH-CH는 "2,2-dimethyl 펜탄"인 반면 (HC)C-CH=CH는 "3,3-dimethyl 1-펜텐"입니다.
폴리엔과 사이클로알켄에는 더 복잡한 규칙이 적용됩니다.[4]

시스-트랜스 이성질체론
비환식 모노-엔의 이중 결합이 사슬의 첫 번째 결합이 아닌 경우, 위에서 구성된 이름은 여전히 시스-트랜스 이성질체 때문에 화합물을 완전히 식별하지 못합니다.그런 다음 이중 결합에 인접한 두 개의 단일 C-C 결합이 평면의 같은 면에 있는지 또는 반대 면에 있는지 지정해야 합니다.모노알켄의 경우, 시스-2-펜텐 또는 트랜스-2-부텐과 같이 구성은 종종 이름 앞에 cis-(라틴어 "이쪽"에서 유래) 또는 trans-("다른쪽"에서) 접두사로 표시됩니다.

일반적으로 시스-트랜스 이성질체론은 이중 결합에 있는 두 개의 탄소가 각각 서로 다른 두 개의 원자 또는 그룹을 가지고 있다면 존재할 것입니다.IUPAC은 이러한 경우를 고려하여 시스 접두사와 트랜스 접두사 대신 보다 일반적인 E-Z 표기법을 권장합니다.이 표기법은 두 탄소 각각에서 CIP 우선 순위가 가장 높은 그룹을 고려합니다.이 두 그룹이 이중 결합 평면의 반대쪽에 있는 경우 구성은 E(반대를 의미하는 독일어 entgegen에서 유래함)로 표시됩니다. 같은 쪽에 있는 경우 Z(독일어 주삼멘에서 유래함)로 표시됩니다.이 라벨링은 니모닉 "Z는 '온제 자메지드'를 의미합니다."[33]와 함께 교육할 수 있습니다.

C=C 이중결합을 포함하는 군
IUPAC은 탄소-탄소 이중 결합을 포함하는 탄화수소 그룹에 대해 비닐 그룹과 알릴 그룹의 두 가지 이름을 인정합니다.[4]

참고 항목
명명법 링크
- 규칙 A-3.불포화 화합물과 1가 라디칼 [1] IUPAC Blue Book
- 규칙 A-4.2가 및 다가 라디칼 [2] IUPAC Blue Book
- 규칙 A-11.3, A-11.4, A-11.5 불포화 단환 탄화수소 및 치환기 [3] IUPAC Blue Book.
- 규칙 A-23.융합 다환 탄화수소의 수소화 화합물 [4] IUPAC Blue Book
참고문헌
- ^ a b c Wade, L.G. (2006). Organic Chemistry (6th ed.). Pearson Prentice Hall. pp. 279. ISBN 978-1-4058-5345-3.
- ^ a b IUPAC, 화학 용어 해설서, 제2판("골드북") (1997).온라인 수정판: (2006–) "알켄", Doi:10.1351/goldbook.A00224
- ^ a b c IUPAC, 화학 용어 해설서, 제2판("골드북") (1997).온라인 수정 버전: (2006–) "olefins". doi:10.1351/goldbook.O04281
- ^ a b c Moss, G. P.; Smith, P. A. S.; Tavernier, D. (1995). "Glossary of Class Names of Organic Compounds and Reactive Intermediates Based on Structure (IUPAC Recommendations 1995)". Pure and Applied Chemistry. 67 (8–9): 1307–1375. doi:10.1351/pac199567081307. S2CID 95004254.
- ^ "Production: Growth is the Norm". Chemical and Engineering News. 84 (28): 59–236. 10 July 2006. doi:10.1021/cen-v084n034.p059.
- ^ Sloane, N. J. A. (ed.). "Sequence A000631 (Number of ethylene derivatives with n carbon atoms)". The On-Line Encyclopedia of Integer Sequences. OEIS Foundation.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, p. 23, ISBN 978-0-471-72091-1
- ^ a b Bansal, Raj K. (1998). "Bredt's Rule". Organic Reaction Mechanisms (3rd ed.). McGraw-Hill Education. pp. 14–16. ISBN 978-0-07-462083-0.
- ^ Fawcett, Frank S. (1950). "Bredt's Rule of Double Bonds in Atomic-Bridged-Ring Structures". Chem. Rev. 47 (2): 219–274. doi:10.1021/cr60147a003. PMID 24538877.
- ^ "Bredt's Rule". Comprehensive Organic Name Reactions and Reagents. Vol. 116. 2010. pp. 525–528. doi:10.1002/9780470638859.conrr116. ISBN 978-0-470-63885-9.
- ^ Duan, Xufang; Block, Eric; Li, Zhen; Connelly, Timothy; Zhang, Jian; Huang, Zhimin; Su, Xubo; Pan, Yi; Wu, Lifang (28 February 2012). "Crucial role of copper in detection of metal-coordinating odorants". Proceedings of the National Academy of Sciences of the United States of America. 109 (9): 3492–3497. Bibcode:2012PNAS..109.3492D. doi:10.1073/pnas.1111297109. ISSN 0027-8424. PMC 3295281. PMID 22328155.
- ^ Nguyen, Trung; Clark, Jim (23 April 2019). "Physical Properties of Alkenes". Chemistry LibreTexts. Retrieved 27 May 2019.
- ^ Ophardt, Charles (2003). "BOILING POINTS AND STRUCTURES OF HYDROCARBONS". Virtual Chembook. Retrieved 27 May 2019.
- ^ Hanson, John. "Overview of Chemical Shifts in H-NMR". ups.edu. Retrieved 5 May 2019.
- ^ a b "Nuclear Magnetic Resonance (NMR) of Alkenes". Chemistry LibreTexts. 23 April 2019. Retrieved 5 May 2019.
- ^ "Organic Compounds: Physical and Thermochemical Data". ucdsb.on.ca. Retrieved 5 May 2019.
- ^ R.L. Shriner, C.K.F. Hermann, T.C. Morrill, D.Y. Curtin, and R.C. Fuson (1997). The Systematic Identification of Organic Compounds. John Wiley & Sons. ISBN 0-471-59748-1.
{{cite book}}: CS1 유지 : 여러 이름 : 저자 목록 (링크) - ^ "Bromine Number". Hach company. Retrieved 5 May 2019.
- ^ Clark, Jim (November 2007). "The Mechanism for the Acid Catalysed Hydration of Ethene". Chemguide. Retrieved 6 May 2019.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Baptista, Maurício S.; Cadet, Jean; Mascio, Paolo Di; Ghogare, Ashwini A.; Greer, Alexander; Hamblin, Michael R.; Lorente, Carolina; Nunez, Silvia Cristina; Ribeiro, Martha Simões; Thomas, Andrés H.; Vignoni, Mariana; Yoshimura, Tania Mateus (2017). "Type I and Type II Photosensitized Oxidation Reactions: Guidelines and Mechanistic Pathways". Photochemistry and Photobiology. 93 (4): 912–919. doi:10.1111/php.12716. PMC 5500392. PMID 28084040.
- ^ Oda, Masaji; Kawase, Takeshi; Kurata, Hiroyuki (1996). "1,3,5-Cyclooctatriene". Organic Syntheses. 73: 240. doi:10.15227/orgsyn.073.0240.
- ^ a b Hartwig, John (2010). Organotransition Metal Chemistry: From Bonding to Catalysis. New York: University Science Books. p. 1160. ISBN 978-1-938787-15-7.
- ^ Toreki, Rob (31 March 2015). "Alkene Complexes". Organometallic HyperTextbook. Retrieved 29 May 2019.
- ^ Wade, L.G. (2006). Organic Chemistry (6th ed.). Pearson Prentice Hall. pp. 309. ISBN 978-1-4058-5345-3.
- ^ Saunders, W. H. (1964). "Elimination Reactions in Solution". In Patai, Saul (ed.). The Chemistry of Alkenes. PATAI'S Chemistry of Functional Groups. Wiley Interscience. pp. 149–201. doi:10.1002/9780470771044.
- ^ Cram, D.J.; Greene, Frederick D.; Depuy, C. H. (1956). "Studies in Stereochemistry. XXV. Eclipsing Effects in the E2 Reaction1". Journal of the American Chemical Society. 78 (4): 790–796. doi:10.1021/ja01585a024.
- ^ Bach, R.D.; Andrzejewski, Denis; Dusold, Laurence R. (1973). "Mechanism of the Cope elimination". J. Org. Chem. 38 (9): 1742–3. doi:10.1021/jo00949a029.
- ^ Crowell, Thomas I. (1964). "Alkene-Forming Condensation Reactions". In Patai, Saul (ed.). The Chemistry of Alkenes. PATAI'S Chemistry of Functional Groups. Wiley Interscience. pp. 241–270. doi:10.1002/9780470771044.ch4.
- ^ Lionel Delaude; Alfred F. Noels (2005). "Metathesis". Kirk-Othmer Encyclopedia of Chemical Technology. Weinheim: Wiley-VCH. pp. metanoel.a01. doi:10.1002/0471238961.metanoel.a01. ISBN 978-0-471-23896-6.
- ^ Vogt, D. (2010). "Cobalt-Catalyzed Asymmetric Hydrovinylation". Angew. Chem. Int. Ed. 49 (40): 7166–8. doi:10.1002/anie.201003133. PMID 20672269.
- ^ Zweifel, George S.; Nantz, Michael H. (2007). Modern Organic Synthesis: An Introduction. New York: W. H. Freeman & Co. pp. 366. ISBN 978-0-7167-7266-8.
- ^ 존 E. 맥머리 (2014):생물학적 응용을 이용한 유기화학; 제3판1224쪽.ISBN 9781285842912