수력화
Hydroamination수산화란 알켄, 알킨, 디엔 또는 알렌의 탄소-탄소 다중 결합에 걸쳐 아민의 N-H 결합을 추가하는 것이다.[1] 이상적인 경우, 수산화물은 원자가 경제적이고 녹색이다.[2] 아민은 정밀화학, 제약, 농업에서 흔히 볼 수 있다.[3][4][5][6] 수산화효소는 분자 내 또는 아민 및 불포화 화합물을 분리하여 분자 간을 생성하는데 사용될 수 있다. 수산화 촉매를 위한 촉매의 개발은 특히 알켄의 경우 활성 영역으로 남아 있다. 실용적인 수산화 반응은 디엔과 전기생성 연골에 영향을 미칠 수 있지만, 수산화라는 용어는 종종 금속을 분석하는 과정을 의미한다.
역사
수산화 기술은 myrcene에서 향기를 생성하기 위해 잘 확립된 기술이다. 이 변환에서 디에틸아민은 디엔 대체제에 첨가되며, 반응은 디에틸아미드에 의해 촉매된다.[7] 분자 내 수산화물은 1989년 토빈 J. 마크스가 란타넘, 루테튬, 사마륨 등 희토류 금속에서 유래한 야금성을 이용해 보고한 바 있다. 촉매 속도는 금속의 이온 반경과 반비례적으로 상관되며, 아마도 리간드의 강직성 간섭의 결과일 것이다.[8] 1992년 마크스는 치랄 보조장치를 사용하여 최초의 치랄 수산화 촉매를 개발했는데, 이것은 오직 하나의 특정한 스테레오이소머만을 선호하는 최초의 수산화 촉매였다. 메탈로케네 리간드에 있는 치랄 보조기구는 제품의 입체화학성을 지시하는 데 사용되었다.[9] 비금속성 치랄 촉매는 2003년에 처음 보고되었으며, 비사릴라미도와 아미노페놀레이트 리간드를 사용하여 항독성도를 높였다.[10]
반응범위
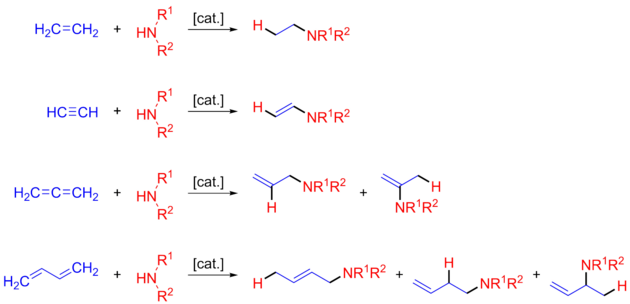
다양한 아민, 불포화 기판, 그리고 엄청나게 다른 촉매로 수산화 검사를 받았다. 조사된 아민은 일차, 이차, 주기, 주기, 주기 및 다양한 강직 및 전자 대체 물질을 포함하는 광범위한 범위에 걸쳐 있다. 조사된 불포화 기질에는 알케네, 디엔, 알케네, 알케네 등이 있다. 분자 내 수산화에는 다양한 아미노알케인이 검사되었다.[11]
상품들
불포화 탄소-탄소 결합에 걸친 추가는 촉매에 따라 마르코브니코프 또는 반 마르코브니코프일 수 있다.[12] R/S chirality의 가능성을 고려할 때, 다음 4가지 제품을 얻을 수 있다. R 또는 S를 포함한 마르코브니코프 및 R 또는 S를 포함한 반 마르코브니코프. 광범위한 금속으로 촉매 수산화(hydroammative hydroammatising)에 대한 보고가 많았지만, 가능한 4가지 제품 중 하나를 선택적으로 만들기 위한 항독성 촉매 촉매에 대한 설명은 훨씬 적다. 최근에는 선택적으로 열역학 또는 운동학적 제품을 만든다는 보고가 있어, 이것은 인종적 마르코브니코프나 안티 마르코브니코프 구조와 관련될 수 있다(아래 열역학 및 운동학적 제품 참조).
촉매 및 촉매 사이클
수산화 반응은 일반적으로 쉽게 구할 수 있고 값싼 시동 물질을 사용하는 원자 효율적인 공정이므로 일반적인 촉매 전략은 매우 바람직하다. 또한 직접 촉매 수산화 전략은 필요한 합성 단계 수 감소를 포함하여 화합물을 포함하는 아민(amine)을 준비하기 위한 더 많은 고전적인 방법에 비해 원칙적으로 상당한 편익을 가진다.
그러나 가수분해 반응은 촉매변환에 대해 몇 가지 어려운 문제를 제기한다. 질소 원자 단독 쌍과 전자 풍부한 탄소-탄소 복합 결합의 강한 전자 반발과 더불어 수산화 반응이 엔트로피적으로 탈피(특히 분자간 버전)되어 큰 반응 장벽을 초래한다.[14][15] 섭생성 문제는 또한 결과 제품의 합성 효용성을 저해하는데, 이는 덜 선호되는 마코브니코프 첨가(그림 참조)에 비해 마코브니코프의 아민 추가가 가장 일반적인 결과물이다. 그 결과, 이제 알켄, 알렌, 알킨 기판의 수산화에서 활용할 수 있는 수많은 촉매들이 존재하는데, 여기에는 다양한 금속 기반 이질 촉매, 초기 변환 금속 복합체(예: 티타늄과 지르코늄), 후기 변환 금속 복합체(예: 루테늄과 팔라듐), 란타늄 및 액티나이드 복합체(e) 등이 포함된다..g.g. 사마륨 및 란타늄, 브뢰네스트 산 및 베이스.[16][17][18]
촉매
리튬 등 알칼리 금속과 칼슘 등 그룹 2 금속,[11][19] 알루미늄, 인듐,[20][21] 비스무트 등 그룹 3 금속을 포함한 많은 금속-리간드 조합이 수산화 촉매를 위해 보고되었다.[22] 이러한 주요 그룹 사례 외에도 초·중·후기 금속뿐만 아니라 1열, 2열, 3열 원소에 대한 보고와 함께 전이 금속에 대한 광범위한 연구가 진행되어 왔다. 마침내 란타니드는 철저히 조사되었다. Zeolites는 또한 수력화에서 효용성을 보여주었다.[11]
촉매 사이클
금속으로 만들어진 수산화 메커니즘은 잘 연구되어 왔다.[11] 특히 잘 연구된 것은 알케인의 분자 내 수산화 오르골란탄산화물이다.[23] 첫째, 촉매는 아미드 교환에 의해 활성화되어 활성 촉매(i)를 발생시킨다. 다음으로 알켄이 Ln-N 본드(ii)에 삽입한다.[24] 마지막으로, 양성분석은 활성 촉매(iii)를 재생하는 동시에 사이클링된 제품을 생성한다. 이 메커니즘은 란타니드 촉매의 사용을 묘사하지만 희토류, 액티니드, 알칼리 금속 기반 촉매의 기초가 된다.
후기 전이 금속 수산화 촉매는 재열체 결정 단계에 기초한 여러 모델을 가지고 있다. 네 가지 주요 범주는 (1) 알켄 알킨 또는 아릴 리간드에 대한 핵포질 공격과 (2) 알켄을 금속-아미드 결합에 삽입하는 것이다.[11] 아래에 일반적인 촉매 사이클이 표시된다. 메커니즘은 속도 연구, 동위원소 라벨링 및 제안된 중간자 트래핑에 의해 지원된다.
열역학 및 운동학
수산화 반응은 대략 열화학적으로 중립적이다. 그러나 그 반응은 전자가 풍부한 기질과 아민핵의 반발 때문에 높은 활성화 장벽을 겪는다. 분자간 반응 또한 매우 부정적으로 변하는 엔트로피를 동반하여 높은 온도에서 불리하게 된다.
[14][15] 따라서 이 반응이 진행되려면 촉매가 필요하다.[3][11] 화학에서 늘 그렇듯이, 분자간 과정보다 분자간 과정이 더 빠른 속도로 일어난다.
열역학적 vs 운동학적 제품
일반적으로 대부분의 수산화 촉매는 효율적 기능을 발휘하기 위해 온도가 상승해야 하며, 따라서 열역학 제품만 관측된다. 희귀하고 보다 종합적으로 가치가 높은 운동 아일 아민 제품의 격리 및 특성화는 불포화 기질에서 알렌이 사용되었을 때 보고되었다. 한 시스템은 80 °C의 온도를 로듐 촉매와 아일린 유도체를 아민으로 사용하였다.[25] 보고된 다른 시스템은 광범위한 1차 및 2차 순환 아민과 1차 순환 아민의 상온에서 팔라듐 촉매를 이용했다.[26] 두 시스템 모두 전통적인 유기 반응을 통해 더욱 기능화할 수 있는 알켄을 함유한 높은 수율의 원하는 아릴 아민을 생산했다.
염기 촉매 수산화
강한 기초는 수산화 촉매를 촉진한다. 예로는 ethene을 이용한 piperidine의 에틸화 등이 있다.[27]
그러한 염기 촉매 반응들은 ethene과 함께 잘 진행되지만 더 높은 알케인은 덜 반응적이다.
그룹(IV) 콤플렉스에 의해 촉매화된 가수분해
특정 티타늄과 지르코늄 복합체는 알케인과 알렌의 분자간 수산화 촉매를 촉진한다.[3] 스토오치메트릭과 촉매변형 모두 처음에는 지르코노세 bis(amido) 콤플렉스로 검사했다. 타이타노세 아미도(Titanocene amido)와 설포나미도(Sulfonamido) 콤플렉스는 아래 그림에 나타낸 것과 같이 해당 아즈마메탈라시클로부탄(Azametalacyclobutane)을 형성하는 [2+2] 사이클로어데스를 통해 아미노펜의 분자 내 수산화 촉매를 촉진한다. 유입 기질에 의한 후속 양성분해는 α-비닐-피롤리딘(1) 또는 테트라히드롭키리딘(2) 제품을 제공한다. 실험적이고 이론적인 증거는 중성 그룹 IV 촉매로 제안된 이미도 중간 및 메커니즘을 뒷받침한다.
공식 수력화
아민 HNR2 이외의 시약을 사용하여 수소와 아미노 그룹(NR2)을 첨가하는 것을 "형식 수력화" 반응이라고 한다. 그 결과 원자 경제 및/또는 질소 선원의 사용 가능한 이점은 줄어들지만, 열역학적으로 더 큰 추진력과 아세트 시약 조절 능력이 잠재적으로 유용하다. 아민 대신 히드록시아민 에스테르와[28] 니트로아렌이[29] 질소 공급원으로 보고되었다.
적용들
수산화 작용은 결과 아민의 가치 있는 특성뿐만 아니라 프로세스의 녹색성 때문에 응용 프로그램을 찾을 수 있었다. 수력분해를 통해 생산될 수 있는 기능화된 아리아민은 현재 수력분해에 의해 준비되지 않았지만 광범위한 약제적용을 가지고 있다. 아릴리아민 씨나리진 합성에 수산화(hydroamination)가 양적 수율에서 활용되었다. 씨나리진은 현기증과 멀미 관련 메스꺼움을 모두 치료한다.[26]
수산화도 알칼로이드 합성에 유망하다. 예를 들면 (---pymyrtine)의 총합성에 사용된 수산화 단계가 있다.[30]

참고 항목
참조
![]() 이 글에는 CC BY 2.5 면허에 따라 이용할 수 있는 데이비드 마이클 바버의 텍스트가 포함되어 있다.
이 글에는 CC BY 2.5 면허에 따라 이용할 수 있는 데이비드 마이클 바버의 텍스트가 포함되어 있다.
- ^ Togni, Antionio; Grützmacher, Hansjörg (2001). Catalytic heterofunctionalization: from hydroanimation to hydrozirconation (1. ed.). Weinheim: Wiley-VCH. doi:10.1002/3527600159. ISBN 978-3527302345.
- ^ Beller, M.; Bolm, C. (2004). Transition metals for organic synthesis : building blocks and fine chemicals (2nd ed.). Weinheim: Wiley-VCH. doi:10.1002/9783527619405. ISBN 9783527306138.
- ^ a b c Reznichenko, A. L.; Hultszch, K. C. (2015). Hydroamination of Alkenes. Org. React. Vol. 88. p. 1. doi:10.1002/0471264180.or088.01. ISBN 978-0471264187.
- ^ Hultzsch, Kai C. (2005). "Catalytic asymmetric hydroamination of non-activated olefins". Org. Biomol. Chem. (Review). 3 (10): 1819–1824. doi:10.1039/b418521h. PMID 15889160.
- ^ Hartwig, J. F. (2004). "Development of catalysts for the hydroamination of olefins" (PDF). Pure Appl. Chem. 76 (3): 507–516. doi:10.1351/pac200476030507.
- ^ Pohlki, F.; Doye, S. (2003). "The catalytic hydroamination of alkynes". Chem. Soc. Rev. 32: 104–114. doi:10.1039/b200386b. PMID 12683107.
- ^ Takabe, K.; Katahiri, T.; Tanaka, J.; Fujita, T.; Watanabe, S.; Suga, K. (1989). "Addition Of Dialkylamines To Myrcene: N,N-diethylgeranylamine". Org. Synth. 67: 44. doi:10.15227/orgsyn.067.0044.
- ^ Gagné, M.R.; Marks, T.J. (1989). "Organolanthanide-catalyzed hydroamination. Facile, regiospecific cyclization of unprotected amino olefins". J. Am. Chem. Soc. 111: 4108. doi:10.1021/ja00193a056.
- ^ Gagné, M.R.; Brard, L.; Conticello, V.P.; Giardello, M.A.; Marks, T.J.; Stern, C.L. (1992). "Stereoselection effects in the catalytic hydroamination/cyclization of amino olefins at chiral organolanthanide centers". Organometallics. 11: 2003. doi:10.1021/om00042a012.
- ^ O'Shaughnessy, P.N.; Scott, P. (2003). "Biaryl amine ligands for lanthanide catalysed enantioselective hydroamination/cyclisation of aminoalkenes". Tetrahedron Asymmetry. 14: 1979. doi:10.1016/s0957-4166(03)00429-4.
- ^ a b c d e f Müller, Thomas E.; Beller, Matthias (1998). "Metal-Initiated Amination of Alkenes and Alkynes". Chem. Rev. 98: 675–704. doi:10.1021/cr960433d. PMID 11848912.
- ^ Beller, M.; Seayad, J.; Tillack, A.; Jiao, H. (2004). "Catalytic Markovnikov and anti-Markovnikov Functionalization of Alkenes and Alkynes: Recent Developments and Trends". Angew. Chem. Int. Ed. 43: 3368–3398. doi:10.1002/anie.200300616. PMID 15221826.
- ^ Salvatore, R.N.; Yoon, C.H.; Jung, K.W. (2001). "Synthesis of secondary amines". Tetrahedron. 57: 7785–7811. doi:10.1016/S0040-4020(01)00722-0.
- ^ a b Brunet, J.-J.; Neibecker, D.; Niedercorn, F. (1989). "Functionalisation of alkenes: catalytic amination of monoolefins". J. Mol. Catal. 49: 235–259. doi:10.1016/0304-5102(89)85015-1.
- ^ a b Johns, A.M.; Sakai, N.; Ridder, A.; Hartwig, J.F. (2006). "Direct Measurement of the Thermodynamics of Vinylarene Hydroamination". J. Am. Chem. Soc. 128: 9306–9307. doi:10.1021/ja062773e. PMID 16848446.
- ^ Müller, T.E.; Hultzsch, K.C.; Yus, M.; Foubelo, F.; Tada, M. (2008). "Hydroamination: Direct Addition of Amines to Alkenes and Alkynes". Chem. Rev. 108: 3795–3892. doi:10.1021/cr0306788. ISSN 0009-2665.
- ^ Alonso, F.; Beletskaya, I.P.; Yus, M. (2004). "Transition-Metal-Catalyzed Addition of Heteroatom−Hydrogen Bonds to Alkynes". Chem. Rev. 104: 3079–3160. doi:10.1021/cr0201068. ISSN 0009-2665.
- ^ Aillaud, I.; Collin, J.; Hannedouche, J.; Schulz, E. (2007). "Asymmetric hydroamination of non-activated carbon–carbon multiple bonds". Dalton Trans.: 5105. doi:10.1039/b711126f. ISSN 1477-9226.
- ^ Crimmin, M.R.; Casely, I.J.; Hill, M.S. (2005). "Calcium-Mediated Intramolecular Hydroamination Catalysis". J. Am. Chem. Soc. 127: 2042–2043. doi:10.1021/ja043576n. PMID 15713071.
- ^ Koller, J.; Bergman, R.G. (2010). "Highly Efficient Aluminum-Catalyzed Hydro-amination/-hydrazination of Carbodiimides". Organometallics. 29: 5946–5952. doi:10.1021/om100735q.
- ^ Sarma, R.; Prajapati, D. (2011). "Indium catalyzed tandem hydroamination/hydroalkylation of terminal alkynes". Chem. Commun. 47: 9525–7. doi:10.1039/c1cc13486h. PMID 21776504.
- ^ Komeyama, K.; Kouya, Y.; Ohama, Y.; Takaki, K. (2011). "Tandem ene-reaction/hydroamination of amino-olefin and -allene compounds catalyzed by Bi(OTf)3". Chem. Commun. 47: 5031–5033. doi:10.1039/c0cc05258b. PMID 21423974.
- ^ Hong, S.; Marks, T.J. (2004). "Organolanthanide-Catalyzed Hydroamination". Acc. Chem. Res. 37: 673–686. doi:10.1021/ar040051r. PMID 15379583.
- ^ Crabtree, Robert H. (2005). The organometallic chemistry of the transition metals (4th ed.). Hoboken, N.J.: John Wiley. ISBN 978-0-471-66256-3.
- ^ Cooke, M.L.; Xu, K.; Breit, B. (2012). "Enantioselective Rhodium-Catalyzed Synthesis of Branched Allylic Amines by Intermolecular Hydroamination of Terminal Allenes". Angew. Chem. Int. Ed. 51: 10876–10879. doi:10.1002/anie.201206594. PMID 23011801.
- ^ a b Beck, J.F.; Samblanet, D.C.; Schmidt, J.A.R. (2013). "Palladium catalyzed intermolecular hydroamination of 1-substituted allenes: an atom-economical method for the synthesis of N-allylamines". RSC Adv. 3: 20708–20718. doi:10.1039/c3ra43870h.
- ^ Wollensak, J.; Closson, R.D. (1963). "N-Ethylpiperidine". Org. Synth. 43: 45. doi:10.15227/orgsyn.043.0045.
- ^ Miki, Y.; Hirano, K.; Satoh, T.; Miura, M. (2013). "Copper-Catalyzed Intermolecular Regioselective Hydroamination of Styrenes with Polymethylhydrosiloxane and Hydroxylamines". Angew. Chem. Int. Ed. 52: 10830–10834. doi:10.1002/anie.201304365. ISSN 1521-3773. PMID 24038866.
- ^ Gui, J.; Pan, C.-M.; Jin, Y.; Qin, T.; Lo, J.C.; Lee, B.J.; Spergel, S.H.; Mertzman, M.E.; Pitts, W.J. (2015). "Practical olefin hydroamination with nitroarenes". Science. 348: 886–891. doi:10.1126/science.aab0245. ISSN 0036-8075. PMID 25999503.
- ^ a b Trinh, T.T.H.; Nguyen, K.H.; Amaral, P. de A.; Gouault, N. (2013). "Total synthesis of (−)-epimyrtine by a gold-catalyzed hydroamination approach". Beilstein J. Org. Chem. 9: 2042–2047. doi:10.3762/bjoc.9.242. PMC 3817515.