앨리글 그룹
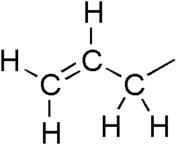
Allyl groupallil 그룹은 구조 공식 HC2=CH-CHR을 대체하는 그룹이며,2 여기서 R은 분자의 나머지 부분이다. 비닐그룹(-CH=CH2)에 부착된 메틸렌교(-CH-2)로 구성된다.[1][2] 그 이름은 라틴어로 마늘을 뜻하는 알리움 사티붐에서 유래되었다. 1844년 테오도르 베르테임은 마늘유에서 아일파생물을 분리하여 "슈베펠랄렐"[3][4]이라고 명명했다. allil이라는 용어는 HC2=CH-CH-CH와2 관련된 많은 화합물에 적용되며, 그 중 일부는 allil 염화물과 같이 실용적이거나 일상적으로 중요하다.
명명법

불포화 탄소 원자에 인접한 부지를 아군 위치 또는 아군 사이트라고 한다. 이 사이트에 첨부된 그룹은 때때로 동맹자로 묘사된다. 따라서 CH2=CHCHO는2 "동맹형 하이드록실 그룹"을 갖는다. Alilic C-H 본드는 일반 sp3 탄소 중심에서 C-H 본드보다 약 15% 약해 반응성이 더 높다. 이 고조된 반응성은 많은 실제적인 결과를 가져온다. 프로펜의 암산화물에 의한 아크릴로니트릴의 산업 생산은 아군 C-H 센터의 쉬운 산화를 이용한다.
불포화지방은 우방 C-H 센터에서의 공격을 수반하는 산욕화로 상한다.
벤질릭과 동맹은 구조, 결합 강도, 반응성의 측면에서 연관되어 있다. 아군 화합물들과 함께 발생하기 쉬운 다른 반응은 동맹 산화, 엔 반응, 츠지-트로스트 반응이다. 벤질릭 그룹은 동맹 그룹과 관련이 있다; 두 그룹 모두 반응성이 향상되었다.
펜타디닐
두 개의 비닐 그룹에 연결된 CH2 그룹은 이중 우방이라고 한다. 이중 우방인 C-H 채권의 채권 분리 에너지는 우방인 C-H 채권의 채권 분리 에너지보다 약 10% 적다. 약화된 C-H 결합은 결과적으로 발생하는 펜타디닐 활성산소의 높은 안정성을 반영한다. C=C-를 함유한 화합물CH-C2=C 링크(예: 리놀레산 유도체)는 자가산화되기 쉬워서 중합이나 반소체를 형성할 수 있다. 이 반응도 패턴은 유화 물감과 바리쉬의 성분인 "건조유"의 필름 형성 거동에 기초한다.
호모알릭
호모릴릭(homoalylic)이라는 용어는 동맹적 위치 옆에 있는 탄소 골격의 위치를 가리킨다. but-3-enyl 염화물 CH2=CHCHCCl에서22 염화물은 호모릴릭 부위와 결합되기 때문에 호모릴릭이다.
본딩
그 동맹군은 유기화학 분야에서 널리 접하고 있다.[1] 동맹산소, 음이온, 양이온이 반응의 매개체로 자주 논의된다. 모두 연속적인 sp²-하이브리드 탄소 중심 3개가 특징이며 모두 공명으로부터 안정성을 이끌어 낸다.[5] 각 종은 두 공진 구조물에 의해 두 개의 공진 구조물에 의해 제시될 수 있으며, 두 개의 공진 구조는 1,3개의 위치에 분산되어 있다.
 아릴 음이온의 공명구조
아릴 음이온의 공명구조
MO 이론의 관점에서, MO 다이어그램은 세 개의 분자 궤도를 가지고 있다: 첫 번째 결합, 두 번째 결합, 높은 에너지 궤도에는 항균이다.[2]
반응
카보닐 알라이제이션
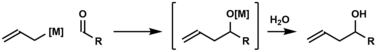
카보닐 아일레이션은 아일 그룹을 도입하는 데 사용되는 가장 일반적인 방법 중 하나이다. 카보닐 아일레이션(Carbonyl allilation)은 알데히드나 케톤에 아릴 음이온을 첨가하여 호모알코올을 생산하는 것을 말하는데, 이는 다음의 2단계 과정에서도 알 수 있다. 최초의 카보닐 동맹화는 1876년 알렉산더 자이체프에 의해 보고되었고 아릴진크 시약을 사용하였다.[6]
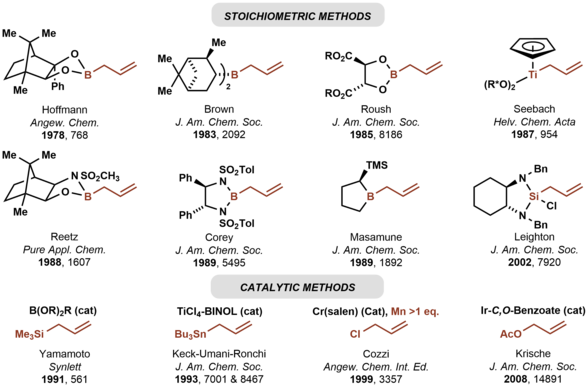
항정신성 카보닐 앨리플레이션을 위한 첫 번째 치랄 아일메탈 시약은 호프만에 의해 개발되었다.[7] 많은 치랄 동맹국 시약이 그 후에 개발되었다.[8][9][10][11][12][13] 이 중 '브라운 시약'인 allidiisopinocampheylborane이 광범위하게 사용되고 있다.[9] Keck allilation에서 예시한 바와 같이, 카보닐 화합물에 아치랄 allimetal 시약의 촉매적 항억제적 추가도 가능하다.[14][15] 앞서 언급한 비대칭 카보닐 동맹은 미리 형성된 아일메탈 시약에 의존하는 반면, 크리스체 아일레이션은 풍부한 화학 공급 원료인 아일 아세테이트를 이용해 항저항 카보닐 아일레이션을 얻는다.[16] 비대칭 카보닐 앨리플레이션을 위한 선택된 방법이 아래에 요약되어 있다.
카보닐 동맹화는 연속적인 배열의 스테레오센트로 폴리케티드 천연물과 다른 산소 분자를 구성하는 데 종종 사용된다. 예를 들어 스티븐 V. 레이와 동료들은 구조적으로 FK506과 라파마이신을 닮아 FKBP12의 강력한 바인더인 마크로리이드 안티아스코미신 B를 만들기 위해 세로로 파생된 알데히드의 아군lstannation을 사용했다.[17] 크리스체 얼리플레이션은 폴리케타이드 천연제품(+--SH 351448), 14개의 스테레오제닉 센터가 있는 매크로다이올리드 이오노포레(macrodiolide ionophore)를 준비하기 위해 사용되었다.[18]
결합 덧셈
공극 아일레이션은 에논의 베타 위치에 아일 그룹을 추가하는 것을 말한다. 호소미-사쿠라이 반응은 가장 일반적으로 공용으로 쓰이는 공법이다.[19]
앨릴 화합물
많은 대체물을 아일 그룹에 부착하여 안정적인 화합물을 제공할 수 있다. 상업적으로 중요한 아일 화합물에는 다음이 포함된다.
- 앨릴 알코올(HC2=CH-CHOH2)
- 염화 아릴(HC2=CH-CHCL2)
- 크로틸알코올(CHCH3=CH-CHOH2)
- 천연고무를 포함한 많은 천연물의 전구체인 테르펜의 생합성에서 중심인 디메틸알 파이로인산염.
- allipalladium 염화다이머와 같은 전이금속 아일 복합체
참고 항목
| Wikiquote는 다음과 관련된 인용구를 가지고 있다. 앨리글 그룹 |
참조
- ^ a b "Advanced Organic Chemistry" 제리 행진, 1992년 에드 J. Wiley and Sons: 뉴욕 ISBN0-471-60180-2.
- ^ a b 유기화학 4부. 모리슨 & 보이드 1988.
- ^ Theodor Wertheim (1844). "Untersuchung des Knoblauchöls". Annalen der Chemie und Pharmacie. 51 (3): 289–315. doi:10.1002/jlac.18440510302.
- ^ Eric Block (2010). Garlic and Other Alliums: The Lore and the Science. Royal Society of Chemistry. ISBN 978-0-85404-190-9.
- ^ 유기화학 존 맥머리 제2판 1988
- ^ Michael; Saytzeff, Alexander (1877). "Synthese des Allyldimethylcarbinols". Justus Liebigs Annalen der Chemie. 185 (2–3): 151–169. doi:10.1002/jlac.18771850204. ISSN 1099-0690.
- ^ Herold, Thomas; Hoffmann, Reinhard W. (October 1978). "Enantioselective Synthesis of Homoallyl Alcoholsvia Chiral Allylboronic Esters". Angewandte Chemie International Edition in English. 17 (10): 768–769. doi:10.1002/anie.197807682. ISSN 0570-0833.
- ^ Hayashi, Tamio; Konishi, Mitsuo; Kumada, Makoto (September 1982). "Optically active allylsilanes. 2. High stereoselectivity in asymmetric reaction with aldehydes producing homoallylic alcohols". Journal of the American Chemical Society. 104 (18): 4963–4965. doi:10.1021/ja00382a046. ISSN 0002-7863.
- ^ a b Brown, Herbert C.; Jadhav, Prabhakar K. (April 1983). "Asymmetric carbon-carbon bond formation via .beta.-allyldiisopinocampheylborane. Simple synthesis of secondary homoallylic alcohols with excellent enantiomeric purities". Journal of the American Chemical Society. 105 (7): 2092–2093. doi:10.1021/ja00345a085. ISSN 0002-7863.
- ^ Roush, William R.; Walts, Alan E.; Hoong, Lee K. (December 1985). "Diastereo- and enantioselective aldehyde addition reactions of 2-allyl-1,3,2-dioxaborolane-4,5-dicarboxylic esters, a useful class of tartrate ester modified allylboronates". Journal of the American Chemical Society. 107 (26): 8186–8190. doi:10.1021/ja00312a062. ISSN 0002-7863.
- ^ Kinnaird, James W. A.; Ng, Pui Yee; Kubota, Katsumi; Wang, Xiaolun; Leighton, James L. (2002-07-01). "Strained Silacycles in Organic Synthesis: A New Reagent for the Enantioselective Allylation of Aldehydes". Journal of the American Chemical Society. 124 (27): 7920–7921. doi:10.1021/ja0264908. ISSN 0002-7863. PMID 12095334.
- ^ Short, Robert P.; Masamune, Satoru (March 1989). "Asymmetric allylboration with B-allyl-2-(trimethylsilyl)borolane". Journal of the American Chemical Society. 111 (5): 1892–1894. doi:10.1021/ja00187a061. ISSN 0002-7863.
- ^ Corey, E. J.; Yu, Chan Mo; Kim, Sung Soo (July 1989). "A practical and efficient method for enantioselective allylation of aldehydes". Journal of the American Chemical Society. 111 (14): 5495–5496. doi:10.1021/ja00196a082. ISSN 0002-7863.
- ^ Keck, Gary E.; Tarbet, Kenneth H.; Geraci, Leo S. (September 1993). "Catalytic asymmetric allylation of aldehydes". Journal of the American Chemical Society. 115 (18): 8467–8468. doi:10.1021/ja00071a074. ISSN 0002-7863.
- ^ Denmark, Scott E.; Fu, Jiping (2003-08-01). "Catalytic Enantioselective Addition of Allylic Organometallic Reagents to Aldehydes and Ketones". Chemical Reviews. 103 (8): 2763–2794. doi:10.1021/cr020050h. ISSN 0009-2665. PMID 12914480.
- ^ Kim, In Su; Ngai, Ming-Yu; Krische, Michael J. (2008-11-05). "Enantioselective Iridium-Catalyzed Carbonyl Allylation from the Alcohol or Aldehyde Oxidation Level via Transfer Hydrogenative Coupling of Allyl Acetate: Departure from Chirally Modified Allyl Metal Reagents in Carbonyl Addition". Journal of the American Chemical Society. 130 (44): 14891–14899. doi:10.1021/ja805722e. ISSN 0002-7863. PMC 2890235. PMID 18841896.
- ^ Brittain, Dominic E. A.; Griffiths-Jones, Charlotte M.; Linder, Michael R.; Smith, Martin D.; McCusker, Catherine; Barlow, Jaqueline S.; Akiyama, Ryo; Yasuda, Kosuke; Ley, Steven V. (2005). "Total Synthesis of Antascomicin B". Angewandte Chemie International Edition. 44 (18): 2732–2737. doi:10.1002/anie.200500174. ISSN 1521-3773. PMID 15806607.
- ^ Wang, Gang; Krische, Michael J. (2016-07-06). "Total Synthesis of (+)-SCH 351448: Efficiency via Chemoselectivity and Redox-Economy Powered by Metal Catalysis". Journal of the American Chemical Society. 138 (26): 8088–8091. doi:10.1021/jacs.6b04917. ISSN 0002-7863. PMC 4935581. PMID 27337561.
- ^ Hosomi, Akira; Sakurai, Hideki (March 1977). "Chemistry of organosilicon compounds. 99. Conjugate addition of allylsilanes to .alpha.,.beta.-enones. A New method of stereoselective introduction of the angular allyl group in fused cyclic .alpha.,.beta.-enones". Journal of the American Chemical Society. 99 (5): 1673–1675. doi:10.1021/ja00447a080. ISSN 0002-7863.