카르복시미다이트
Carboximidate카르복시미드산(또는 보다 일반적인 이미드산)은 카르복시미드산(R-C(=C)) 사이에 형성된 에스테르로 생각할 수 있는 유기 화합물이다.OH) 및 일반식 R-C(=CH')OR"인 알코올.
탄소 원자에 산소 원자가 연결된 이민(>C=N-)을 닮았기 때문에 이미노 에테르라고도 합니다.
합성
이미데이트는 다수의 합성 [1]루트에 의해 생성될 수 있지만 일반적으로 피너 반응에 의해 형성됩니다.이것은 알코올에 의한 아질화물의 산성 촉매 공격을 통해 진행됩니다.

이러한 방식으로 생성된 이미다이트는 염산염으로 형성되며, 피너염이라고도 합니다.카르복시미드산염은 맘 전위 및 오버맨 전위에서도 중간체로서 형성된다.
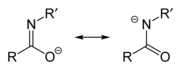
이미다이트/아미다이트 음이온
아미드 또는 이미드산의 탈양성자에 의해 아미드/이미드 음이온이 형성된다.아미드와 이미드산은 호변이체이기 때문에 탈양성자 시 동일한 음이온을 형성한다.따라서 두 이름은 동일한 음이온을 설명하는 동의어이지만, 이미데이트는 왼쪽에 있는 공명 기여자를, 아미데이트는 오른쪽에 있는 공명 기여자를 의미합니다.그러나 전이 금속의 리간드 역할을 하는 경우에는 O-결합종을 이미다트, N-결합종을 아미다트라고 한다.식 R-N=C(O−)R의 에놀레이트의 aza 치환 유사체로 간주할 수 있다.
반응
카르복시미드산염은 좋은 전자 친화체이고 다양한 부가 반응을 거친다; 지방족 이미드산은 일반적으로 방향족 [1]이미드산염보다 더 빠르게 반응한다.이들은 에스테르를 생성하기 위해 가수분해될 수 있으며 유사한 과정을 통해 아민(암모니아 포함)과 반응하여 아미딘을 형성할 수 있다.지방족 이미다이트는 산촉매 하에서 과도한 알코올과 반응하여 오르토에스터 RC(OR)3를 형성하며 방향족 이미다이트는 변환될 수 있지만 훨씬 덜 쉽게 변환됩니다.
채프먼 재배열
채프먼 전위는 아릴기의 분자 내 이동을 통해 아릴 N nitrogenarylbenzimidates를 산소에서 [3]질소로 열 변환하는 것이다.이것은 처음 그것을 [4]기술한 Arthur William Chapman의 이름을 따서 지어졌으며 개념적으로 Newman-Kwart 편성과 유사하다.
보호 그룹으로서
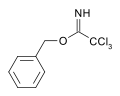
카르복시미데이트는 [5]알코올을 보호하는 역할을 할 수 있다.예를 들어 트리클로로아세토니트릴에 대한 벤질알코올의 염기촉매반응은 트리클로로아세트이미데이트를 생성한다.이 종은 아세테이트 및 TBS 보호와 직교 안정성을 가지며 산 [6]가수분해로 분해될 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Roger, Robert; Neilson, Douglas G. (1961). "The Chemistry of Imidates". Chemical Reviews. 61 (2): 179–211. doi:10.1021/cr60210a003.
- ^ B. P. Mundy, M. G. Ellerd, F. G. Favaloro: 유기 합성에서의 반응 및 시약 이름, 2.Auflage, Wiley-Intercience, Hoboken, NJ 2005, ISBN 978-0-471-22854-7, S. 516.
- ^ Schulenberg, J. W.; Archer, S. (1965). "The Chapman Rearrangement". Organic Reactions. 14: 1–51. doi:10.1002/0471264180.or014.01. ISBN 0471264180.
- ^ Chapman, Arthur William (1925). "CCLXIX.—Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether". J. Chem. Soc., Trans. 127: 1992–1998. doi:10.1039/CT9252701992.
- ^ Wuts, Peter G. M.; Greene, Theodora W. (2006). Protective groups in organic synthesis (4th ed.). Hoboken, N.J.: WILEY. p. 244. ISBN 978-0-471-69754-1.
- ^ Yu, Biao; Yu, Hai; Hui, Yongzheng; Han, Xiuwen (June 1999). "Trichloroacetimidate as an Efficient Protective Group for Alcohols". Synlett. 1999 (6): 753–755. doi:10.1055/s-1999-2736.