아미딘
Amidine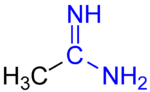
아미딘은 관능기 RC(NR)NR을 2가진 유기화합물로, R기는 같거나 다를 수 있다.아미드(RC(O)NR)2의 이미 유도체이다.가장 단순한 아미딘은 포름아미딘, HC(=NH)NH이다2.
아미딘의 예는 다음과 같습니다.
준비
1차 아미딘으로 가는 일반적인 경로는 피너 반응이다.산의 존재 하에서 니트릴과 알코올의 반응으로 이미노에테르를 얻을 수 있다.생성된 화합물을 암모니아로 처리하면 [1]아미딘으로의 변환이 완료된다.브론스테드산 대신 삼염화알루미늄과 같은 루이스산은 질화물의 직접적인 [2]아민화를 촉진합니다.그들은 또한 [3]염화 이미도일의 아미노화에 의해 생성된다.또한 다이민에 유기석소 시약을 첨가한 후 양성자화 또는 알킬화를 통해 제조됩니다.
디메틸포름아미드 아세탈은 1차 아민과 반응하여 아미딘을 생성합니다.[4]
- MeNC2(H)(OME)2 + RNH2 → MeNC2(O) NHR + 2 Me오호
속성 및 응용 프로그램
아미드는 아미드보다 훨씬 더 기본적이며 가장 강력한 충전되지 않은/[5][6]연합 기지 중 하나입니다.
양성자화는 sp2 혼성질소에서 일어난다.이것은 양전하가 양쪽 질소 원자에 비국재화될 수 있기 때문에 발생합니다.생성된 양이온 종은 아미디늄[7] 이온으로 알려져 있으며 동일한 C-N 결합 길이를 가집니다.
몇몇 약물 또는 약물 후보들은 아미딘 치환기를 특징으로 한다.예를 들어 항원충 이미도카르브, 살충제 아미트라즈, 구충제 트리벤디미딘, 5HT2A [8]수용체 길항제 자일라미딘 등이 있다.
포름아미디늄(아래 참조)을 금속 할로겐화물과 반응시켜 페로브스카이트 태양전지 내에서 광흡수 반도체 재료를 형성할 수 있다.포름아미디늄(FA) 양이온 또는 할로겐화물은 태양광 발전장치에서 페로브스카이트 흡수체층을 형성할 때 할로겐화메틸암모늄을 부분적으로 또는 완전히 대체할 수 있다.
명명법
형식적으로 아미딘은 옥소산의 한 종류이다.아미딘이 유도되는 옥소산은 RE(=O) 형태여야n 한다.아, 여기서 R은 대체수입니다.-OH기는 -NH기로2 치환되고 =O기는 =NH기로 치환되어 일반구조n RE(=NR)2[9][10][11]NR이 된다.부모 옥소산이 카르본산일 때 생성되는 아미딘은 카르복사미딘 또는 카르복시미다미드(IUPAC 이름)이다.카르복사미딘은 유기 화학에서 가장 흔히 볼 수 있는 아미딘의 한 종류이기 때문에 종종 간단히 아미딘이라고 언급된다.
파생상품
포름아미디늄 양이온
아미디늄 이온의 주목할 만한 하위 분류는 포름아미듐 양이온이며 화학식 [RN-CH
2=CHN
2]+
으로 나타낼 수 있다.이들의 탈양성자는 화학식 RN-C
2:-NR로
2[12][13]나타낼 수 있는 안정적인 카르벤을 제공한다.
아미딘산염

아미드화염은 일반구조+ M[RNRCNR]−을 가지며 카르보디이미드와 메틸리튬 [15]등의 유기금속화합물을 반응시켜 접근할 수 있다.그것들은 유기 금속 복합체에서 리간드로 널리 사용된다.
「 」를 참조해 주세요.
레퍼런스
- ^ A. W. Dox (1928). "Acetamidine Hydrochloride". Organic Syntheses. 8: 1. doi:10.15227/orgsyn.008.0001.
- ^ "N-Phenylbenzamidine". Organic Syntheses. 36: 64. 1956. doi:10.15227/orgsyn.036.0064.
- ^ Arthur C. Hontz, E. C. Wagner (1951). "N,N-Diphenylbenzamidine". Organic Syntheses. 31: 48. doi:10.15227/orgsyn.031.0048.
- ^ Daniel A. Dickman; Michael Boes; Albert I. Meyers (1989). "(S)-N,N-Dimethyl-N'-(1-tert-Butoxy-3-Methyl-2-Butyl)formamidine". Organic Syntheses. 67: 52. doi:10.15227/orgsyn.067.0052.
- ^ 로체 VF약학과 학생들의 산염기 화학에 대한 이해와 장기 보존을 향상시킨다.미국 약학 교육 저널2007;71(6):122.
- ^ Clayden; Greeves; Warren (2001). Organic chemistry. Oxford university press. p. 202. ISBN 978-0-19-850346-0.
- ^ Schrader, Thomas; Hamilton, Andrew D., eds. (2005). Functional synthetic receptors. Wiley-VCH. p. 132. ISBN 3-527-30655-2.
- ^ Greenhill, John V.; Lue, Ping (1993). 5 Amidines and Guanidines in Medicinal Chemistry. Progress in Medicinal Chemistry. Vol. 30. pp. 203–326. doi:10.1016/S0079-6468(08)70378-3. ISBN 9780444899897. PMID 7905649.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "amidines" . doi : 10.1351 / goldbook . A00267
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "carboxamidines.".doi:10.1351/goldbook.C00851
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "술피나미딘".doi:10.1351/goldbook.S06107
- ^ Alder, Roger W.; Blake, Michael E.; Bufali, Simone; Butts, Craig P.; Orpen, A. Guy; Schütz, Jan; Williams, Stuart J. (2001). "Preparation of tetraalkylformamidinium salts and related species as precursors to stable carbenes". Journal of the Chemical Society, Perkin Transactions 1 (14): 1586–1593. doi:10.1039/B104110J.
- ^ Edward C. Taylor; Wendell A. Ehrhart; M. Kawanisi (1966). "Formamidine Acetate". Organic Syntheses. 46: 39. doi:10.15227/orgsyn.046.0039.
- ^ Keaton, Richard J.; Jayaratne, Kumudini C.; Henningsen, David A.; Koterwas, Lisa A.; Sita, Lawrence R. (2001). "Dramatic Enhancement of Activities for Living Ziegler−Natta Polymerizations Mediated by "Exposed" Zirconium Acetamidinate Initiators: The Isospecific Living Polymerization of Vinylcyclohexane". Journal of the American Chemical Society. 123 (25): 6197–6198. doi:10.1021/ja0057326. PMID 11414862.
- ^ Ulrich, Henri (2007). Chemistry and technology of carbodiimides. Chichester, England: John Wiley & Sons. ISBN 9780470065105.




