황산
Sulfenic acid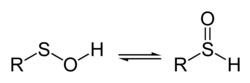
황산은 유기황 화합물과 일반 공식 RSOH를 가진 옥소산이다. 오가르노황산소산화물 계열의 첫 번째 멤버로 설핀산과 설폰산, RSOH2, RSOH도3 각각 포함된다. R = H를 가진 황산 시리즈의 기본 부재는 수소 티오페록사이드다.
특성.
설피닌산이나 설폰산과 대조적으로 메탄세황산, CHSOH와3 같은 단순 황산은 반응성이 높아 용액에서 격리할 수 없다. 가스 단계에서 메탄세황산의 수명은 약 1분이다. 메탄세황산의 기체상 구조는 마이크로파 분광법(회전 분광법)에 의해3 CH-S-O-H로 확인되었으며,[1] 황산은 황산이 자체적으로 응결되어 마늘의 알리신(Alicin)과 같은 RS(O)SR을 형성하는 것을 방지하는 스테렉트 효과를 통해 안정화될 수 있다. X선 결정학을 이용하여, 그러한 안정화된 황산의 구조는 R–S–O–H로 나타났다.[2][3] The stable, sterically hindered sulfenic acid 1-triptycenesulfenic acid has been found to have a pKa of 12.5 and an O–H bond-dissociation energy (bde) of 71.9 ± 0.3 kcal/mol, which can be compared to a pKa of ≥14 and O–H BDE of ~88 kcal/mol for the (valence) isoelectronic hydroperoxides, ROOH.[4]
형성 및 발생
자연에서
Sulfenic 산 alliin과 관련 화합물, 양파 마늘에 조직 손상을 따르는 효소적 분해 과정에서, 그리고 로사 종명.1-Propenesulfenic 산성, 양파 삭감된 형성의 다른 식물들이 급속하게 두번째 효소, 눈물을 흘리게 하는 인자 합성 효소, syn-propanethial-S-oxide을 줌으로써 다시 조정돼 생성되어 있다.[5]2-Propenesulfenic 알리신으로부터 형성된 산은 마늘의 강력한 항산화 작용의 원인이 되는 것으로 생각된다.[6] DART 이온원을 이용한 질량분석법은 마늘을 자르거나 으스러뜨릴 때 생기는 2-프로페네황산(propenesulfenic)을 식별하고 이 황산의 수명이 1초 미만임을 입증하기 위해 사용되었다.[7] 오메프라졸, 에솜프라졸, 티클로피딘, 클로피도그렐, 프라수그렐과 같은 특정 약물의 약리학적 활성도를 황산중간체를 포함하는 것으로 제안한다.[8] 단백질 내 시스틴 잔류물을 해당 황산 단백질에 산화시키는 것은 재독성 매개 신호 전달에 중요한 것으로 제안된다.[9][10]
황산염에 기초한 리간드는 니트리올 하이드라타제의 활성 부위에서 발견된다. S-O 그룹은 니트리올을 공격하는 핵물질로 제안된다.[11]
요리할 때
황산은 양파를 자를 때 일어나는 일련의 화학 반응의 일부를 형성한다. 눈물샘은 반응의 최종 산물인 syn-propanetial-S-oxide에 의해 자극되어 눈물을 유발한다.[12]
유기 화학
Sulfoxide는 알케인과 황산을 산출하기i 위해 E 메커니즘을 통해 열제거를 수행할 수 있다.[13][14]
- RS(O)CHR22′ → RSOH + CH2=CHR′
기타 설페닐 화합물
유기 명명법에서 설페닐 접두사는 RS그룹(R ≠ H)을 나타낸다. 한 예로 염화메타네술페닐, CHSCl이3 있다.[15]
Sulfenate 에스테르에는 RSOR′라는 공식이 있다. 그것들은 알코올에 대한 설페닐 염소화물의 반응에 의해 발생한다.[16] Sulfenate 에스테르는 Allil sulfoxide의 Mislow-Evans 재배열에서 매개체다.[13] Sulfenamides는 RSNR′2라는 공식을 가지고 있다.
참조
- ^ Penn RE, Block E, Revelle LK (1978). "Methanesulfenic Acid". Journal of the American Chemical Society. 100 (11): 3622–3624. doi:10.1021/ja00479a068.
- ^ Goto K, Holler M, Okazaki R (1997). "Synthesis, Structure, and Reactions of a Sulfenic Acid Bearing a Novel Bowl-Type Substituent: The First Synthesis of a Stable Sulfenic Acid by Direct Oxidation of a Thiol". Journal of the American Chemical Society. 119 (6): 1460–1461. doi:10.1021/ja962994s.
- ^ Ishii A, Komiya K, Nakayama J (1996). "Synthesis of a Stable Sulfenic Acid by Oxidation of a Sterically Hindered Thiol (Thiophenetriptycene-8-thiol)1 and Its Characterization". Journal of the American Chemical Society. 118 (50): 12836–12837. doi:10.1021/ja962995k.
- ^ McGrath AJ, Garrett GE, Valgimigli L, Pratt DA (2010). "The redox chemistry of sulfenic acids". Journal of the American Chemical Society. 132 (47): 16759–16761. doi:10.1021/ja1083046. PMID 21049943.
- ^ Block, E. (2010). Garlic and Other Alliums: The Lore and the Science. Royal Society of Chemistry. ISBN 978-0-85404-190-9.
- ^ Vaidya V, Ingold KU, Pratt DA (2009). "Garlic: Source of the Ultimate Antioxidants – Sulfenic Acids". Angewandte Chemie International Edition. 48 (1): 157–60. doi:10.1002/anie.200804560. PMID 19040240.
- ^ Block E, Dane AJ, Thomas S, Cody RB (2010). "Applications of Direct Analysis in Real Time–Mass Spectrometry (DART-MS) in Allium Chemistry. 2-Propenesulfenic and 2-Propenesulfinic Acids, Diallyl Trisulfane S-Oxide and Other Reactive Sulfur Compounds from Crushed Garlic and Other Alliums". Journal of Agricultural and Food Chemistry. 58 (8): 4617–4625. doi:10.1021/jf1000106. PMID 20225897.
- ^ Mansuy D, Dansette PM (2011). "Sulfenic acids as reactive intermediates in xenobiotic metabolism". Archives of Biochemistry and Biophysics. 507 (1): 174–185. doi:10.1016/j.abb.2010.09.015. PMID 20869346.
- ^ Kettenhofen, NJ, Wood, MJ (2010). "Formation, Reactivity, and Detection of Protein Sulfenic Acids". Chem. Res. Toxicol. 23 (11): 1633–1646. doi:10.1021/tx100237w. PMC 2990351. PMID 20845928.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Gupta, Vinayak; Kate S. Carroll (February 2014). "Sulfenic acid chemistry, detection and cellular lifetime". Biochimica et Biophysica Acta (BBA) - General Subjects. 1840 (2): 847–875. doi:10.1016/j.bbagen.2013.05.040. PMC 4184475. PMID 23748139.
- ^ Harrop, Todd C.; Mascharak, Pradip K. (2004). "Fe(III) and Co(III) Centers with Carboxamido Nitrogen and Modified Sulfur Coordination: Lessons Learned from Nitrile Hydratase". Accounts of Chemical Research. 37 (4): 253–260. doi:10.1021/ar0301532. PMID 15096062.
- ^ "Why does chopping an onion make you cry?". Everyday Mysteries. The Library of Congress. Retrieved 1 April 2019.
- ^ a b Braverman, S, Sulfenic Acids and Emproducts, 1990, John Wiley & Sons. doi:10.1002/9780470772287.ch8.
- ^ Michael Carrasco, Robert J. Jones, Scott Kamel, H. Rapoport, Thien Truong (1992). "N-(Benzyloxycarbonyl)-L-Vinylglycine Methyl Ester". Organic Syntheses. 70: 29. doi:10.15227/orgsyn.070.0029.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "설페닐 그룹". doi:10.1351/골드북.S06098
- ^ Petrovic, Goran; Saicic, Radomir N.; Cekovic, Zivorad (2005). "Phenylsulfenylation of Nonactivated Carbon Atom by Photolysiis of Alkyl Benzenesulfenated: Preparation of 2-Phenylthio-5-heptanol". Organic Syntheses. 81: 244. doi:10.15227/orgsyn.081.0244.



