테베 시약
Tebbe's reagent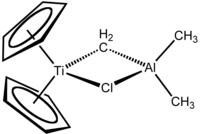 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 μ-클로로[di(cyclopenta-2,4-dien-1-yl)]디메틸(μ-메틸렌)티타늄알루미늄 | |
| 기타이름 테베 시약 | |
| 식별자 | |
3D 모델(Jsmol) | |
| 켐스파이더 | |
| ECHA 인포카드 | 100.157.162 |
펍켐 CID | |
| 유니아이 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| CHALClTi1318 | |
| 어금니 질량 | 284.60 g/mol |
| 기타 용매에 대한 용해도 | 톨루엔, 벤젠, 디클로로메탄, THF(저온만 해당) |
달리 명시된 경우를 제외하고는 표준 상태(25°C [77°F], 100kPa)에 있는 재료에 대한 데이터가 제공됩니다. | |
테베의 시약은 화학식이 (CH55)2TiCHClAl2(CH3)인 유기금속 화합물입니다.2 카르보닐 화합물의 메틸화에 사용되며, 즉 RC=O기를 포함하는 유기 화합물을 관련 RC=CH 유도체로 전환시키는 것입니다. 공기 중에서 발열성인 빨간색 고체이므로 일반적으로 공기가 없는 기술로 처리됩니다. 이것은 원래 듀폰 중앙 연구소의 프레드 테베에 의해 합성되었습니다.
테베의 시약은 한 쌍의 가교 리간드에 의해 연결된 두 개의 사면체 금속 중심을 포함합니다. 티타늄은 두 개의 사이클로펜타디엔일([CH
5
5] 또는 −
Cp) 고리를 가지고 있고 알루미늄은 두 개의 메틸기를 가지고 있습니다. 티타늄과 알루미늄 원자는 거의 정방형(Ti–CH2–Al–Cl) 기하학에서 메틸렌 다리(-CH-2)와 염화물 원자로 연결되어 있습니다.[2] 테베 시약은 메틸렌 브릿지가 전이금속(Ti)과 주족금속(Al)을 연결하는 최초의 보고된 화합물이었습니다.[3]
준비
테베 시약은 톨루엔 용액에서 티타노세 디클로라이드와 트리메틸알루미늄으로부터 합성됩니다.[3][4]
- Cp2TiCl2 + 2 Al(CH3)3 → CH4 + Cp2TiCH2AlCl(CH3)2 + Al(CH3)2Cl
약 3일 후 Al(CH3)2Cl 제거를 위해 재결정 후 생성물을 얻습니다.[3] 분리된 테베 시약을 사용한 합성은 더 깨끗한 제품을 제공하지만 "in situ" 시약을 사용한 성공적인 절차가 보고되었습니다.[5][6] 테베 시약을 분리하는 대신 시작 물질을 첨가하기 전에 용액을 얼음 욕조 또는 드라이 아이스 배스에서 냉각하는 것이 좋습니다.
다른 방법이지만 덜 편리한 합성에는 디메틸티타노센(Petasis reagent)의 사용이 수반됩니다.[7]
- Cp2Ti(CH3)2 + Al(CH3)2Cl → Cp2TiCH2AlCl(CH3)2 + CH4
이 방법의2 한 가지 단점은 CpTi(CH3)를 필요로 하는 것 외에도 미반응 개시 시약으로부터 제품을 분리하기 어렵다는 2것입니다.
반응 메커니즘
테베의 시약 자체는 카르보닐 화합물과 반응하지 않고 먼저 활성 슈록 카벤을 생성하는 피리딘과 같은 가벼운 루이스 염기로 처리해야 합니다.
또한 위티그 시약과 유사하게 반응성은 Ti(IV)의 높은 산소친화성에 의해 유도되는 것으로 보입니다. 슈록 카벤(1)은 카르보닐 화합물(2)과 반응하여 가정된 옥사티타나시클로부탄 중간체(3)를 생성하는 것을 특징으로 하는 화합물. 이 고리형 중간체는 원하는 알켄(5)을 생성하기 위해 즉시 분해되기 때문에 직접적으로 분리된 적이 없습니다.
범위
테베 시약은 카르보닐 메틸 식별을 위한 유기 합성에 사용됩니다.[8] [9][10] 테베 시약이 특히 입체 장애 카르보닐에 더 효율적이지만, 이러한 전환은 위티그 반응을 사용하여 효과적일 수도 있습니다. 또한 테베 시약은 위티그 시약에 비해 덜 기본적이며 β-제거 제품을 제공하지 않습니다.
메틸화 반응은 알데히드 뿐만 아니라 에스테르, 락톤 및 아미드에 대해서도 발생합니다. 테베 시약은 에스테르와 락톤을 에놀 에테르로, 아미드를 에나민으로 전환합니다. 케톤과 에스테르기를 모두 포함하는 화합물에서 케톤은 테베 시약의 1 당량 존재하에서 선택적으로 반응합니다.
테베 시약은 카이랄 α 탄소를 라세미화하지 않고 카보닐을 식별합니다. 이러한 이유로, 테베 시약은 입체화학의 유지가 중요할 수 있는 당의 반응에 적용되는 것을 발견했습니다.[11]
테베 시약은 산성 염화물과 반응하여 Cl을− 대체하여 티타늄 에놀레이트를 형성합니다.
수정사항
서로 다른 리간드를 사용하여 테베의 시약을 수정하는 것이 가능합니다. 이것은 복합체의 반응성을 변경하여 더 넓은 범위의 반응을 허용할 수 있습니다. 예를 들어, 사이클로프로판화는 염소화된 유사체를 사용하여 달성할 수 있습니다.[12]
참고 항목
관련 유기 티타늄 시약 및 반응
관련 메틸화(methylidenation) 반응
참고문헌
- ^ F. N. Tebbe, G. W. Parshall and G. S. Reddy (1978). "Olefin homologation with titanium methylene compounds". J. Am. Chem. Soc. 100 (11): 3611–3613. doi:10.1021/ja00479a061.
- ^ Thompson, Rick; Nakamaru-Ogiso, Eiko; Chen, Chun-Hsing; Pink, Maren; Mindiola, Daniel J. (2014). "Structural Elucidation of the Illustrious Tebbe Reagent". Organometallics. 33 (1): 429–432. doi:10.1021/om401108b.
- ^ a b c 허만, W.A., "메틸렌 다리" 유기금속 화학의 발전 1982, 20, 195–197.
- ^ 스트라우스, D. A. "μ-클로로비스(시클로펜타디엔일)(디메틸알루미늄)-μ-메틸렌티타늄": 유기 합성을 위한 시약 백과사전. 존 와일리, 런던, 2000.
- ^ Pine, S. H.; Kim, V.; Lee, V. (1990). "Enol ethers by methylenation of esters: 1-Phenoxy-1-phenylethene and 3,4-dihydro-2-methylene-2H-1-benzopyran". Org. Synth. 69: 72. doi:10.15227/orgsyn.069.0072.
- ^ L. F. Cannizzo & R. H. Grubbs (1985). "In situ preparation of (μ-chloro)(μ-methylene)bis(cyclopentadienyl)(dimethylaluminum)titanium (Tebbe's reagent)". J. Org. Chem. 50 (13): 2386–2387. doi:10.1021/jo00213a040.
- ^ Payack, J. F.; Hughes, D. L.; Cai, D.; Cottrell, I. F.; Verhoeven, T. R. (2004). "Dimethyltitanocene". Organic Syntheses.Payack, J. F.; Hughes, D. L.; Cai, D.; Cottrell, I. F.; Verhoeven, T. R. (2004). "Dimethyltitanocene". Organic Syntheses.
{{cite journal}}CS1 maint: 다중 이름: 저자 목록(링크); - ^ Hartley, Richard C.; Li, Jianfeng; Main, Calver A.; McKiernan, Gordon J. (2007). "Titanium carbenoid reagents for converting carbonyl groups into alkenes". Tetrahedron. 63 (23): 4825–4864. doi:10.1016/j.tet.2007.03.015.
- ^ 파인, S.H. 오르그. 반응 1993, 43, 1. (검토)
- ^ 비덤, I, 믹필드, J. 커 Org. Synth. 2005, 2, 231–250. (리뷰)
- ^ A. Marra, J. Esnault, A. Veyrieres and P. Sinay (1992). "Isopropenyl glycosides and congeners as novel classes of glycosyl donors: theme and variations". J. Am. Chem. Soc. 114 (16): 6354–6360. doi:10.1021/ja00042a010.
{{cite journal}}: CS1 maint: 다중 이름: 저자 목록 (링크) - ^ 아미드 사이클로프로판화 쿠오웨이 린, 시안 옌, 아이린 셰 및 투신 옌 오르그의 특이한 양친성 카르베노이드 등가물. 레트.; 2006; 8(11) pp 2265 - 2267; 초록
- ^ Luciano Lombardo (1987). "Methylenation of Carbonyl Compounds: (+)-3-Methylene-cis-p-menthane". Organic Syntheses. 65: 81. doi:10.15227/orgsyn.065.0081..